Пути улучшения результатов эндохирургического лечения ахалазии кардии
Автор: Галимов О.В., Ханов В.О., Бакиров М.Р., Сайфуллин Р.Р., Галимов Д.О.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 2 (42), 2020 года.
Бесплатный доступ
Цель исследования: проанализировать общепринятые методики лечения ранних стадий ахалазии кардии, и усовершенствовать методику классической органосохраняющей кардиопластической операции - кардиомиотомии по Heller.Материалы и методы. В рамках клинического исследования изучены результаты хирургического лечения 280 пациентов с ахалазией кардии, находившихся на лечении в период с 2000 по 2019 г. на клинических базах кафедры хирургических болезней и новых технологий Башкирского государственного медицинского университета (г. Уфа) и отделения хирургии и желудка Республиканского клинического онкологического диспансера (г. Казань). Нами проведено когортное ретроспективное исследование в 2 группах (лапароскопическая эзофагокардиомиотомия по Heller, дополненная передней модифицированной гемифундопликацией по Dor (n = 74), и традиционные лапароскопические вмешательства (n = 206)). Все пациенты групп были сопоставимы по половому, возрастному признаку, по отличиям в стадии и проявлениях заболевания.Результаты. В клинике разработан оригинальный способ лапароскопической эзофагокардиомиотомии, включающий использование устройств, облегчающих мобилизацию кардии и формирование фундопликационной манжеты. Для дифференциальной диагностики заболевания и оценки результатов лечения в послеоперационном периоде проводились обследование, подразумевающее эзофагогастродуоденоскопию, R-скопию пищевода и желудка с контрастированием жидким барием, эзофагоманометрию, рН-метрию. Отслежены отдаленные результаты до 2 лет. На основании данных инструментального обследования оценивалась безопасность и эффективность предложенной хирургической техники. Анкетирование оперированных пациентов по специальным опросникам показало восстановление качества жизни у большинства обследуемых.Заключение. Разработанная методика лапароскопической эзофагокардиомиотомии, включающая использование внутрипищеводной трансиллюминации и устройства для измерения пищеводного отверстия, позволяет предупредить повреждение стенки пищевода и послеоперационные осложнения, связанные с недостаточным либо чрезмерным сужением пищеводного отверстия. Из 74 пациентов 66 (89,2 %) оценили результат как отличный и хороший, 6 (8,1 %) как удовлетворительный, 2 (2,7 %) как неудовлетворительный.
Ахалазия кардии, лапароскопическая кардиомиотомия, трансиллюминационный зонд, фундопликация, инструменты для лапароскопии
Короткий адрес: https://sciup.org/142226488
IDR: 142226488 | УДК: 616.333-009.12 | DOI: 10.38181/2223-2427-2020-2-5-9
Текст научной статьи Пути улучшения результатов эндохирургического лечения ахалазии кардии
Ахалазия кардии (АК) – идиопатическое нервно-мышечное заболевание, проявляющееся функциональным нарушением проходимости кардии вследствие дискоордина-ции между глотком, рефлекторным раскрытием нижнего пищеводного сфинктера (НПС), двигательной и тонической активностью гладкой мускулатуры пищевода [1]. Частота встречаемости АК по отношению к другим заболеваниям пищевода составляет от 3 до 20 %. [1, 2]. АК чаще всего встречается в трудоспособном возрасте в период от 20 до 50 лет и часто приводит к тяжелой алиментарной дистрофии, иногда к инвалидности пациента [3, 4].
В настоящее время продолжается поиск новых методов лечения ахалазии кардии. Общепринятые методы лечения АК имеют ряд недостатков и осложнений. Так, консервативное лечение эффективно только на ранних (I-II) стадиях заболевания [5, 6]. Простым и достаточно эффективным методом является эндоскопическое интерсфинктерное введение ботулотоксина, но его эффект еще менее продолжительный [7, 8]. На сегодняшний день, альтернативным способом лечения ахалазии кардии является пероральная эндоскопическая миотомия (ПОЭМ) с использованием подслизистого тунел-лирования [9].
При обзоре зарубежной литературы ряд авторов указывают о 96-100 % положительных результатов при лечении пациентов с АК методом ПОЭМ, однако эта процедура довольно сложна, что ограничивает ее применение. Наблюдение за пациентами, перенесшими данные вмешательства ведутся непродолжительный период времени, поэтому объективно оценить результаты методики пока не предоставляется возможным [10]. По единодушному мнению большинства современных авторов, при неэффективном консервативном лечении показана органосохраняющая кардиопластическая операция – кардиомиотомия по Heller с неполной фундопликацией [11, 12].
Материалы и методы
Были отслежены отдаленные результаты до 2 лет. На основании данных инструментального обследования оценивалась безопасность и эффективность предложенной хирургической техники. Оценку качества жизни больных с АК после выполненного хирургического вмешательства проводили анкетированием оперированных пациентов по специальным опросникам GERD-HRQL и общему опроснику SF-36 характеризующим физический (Physical Component Summary) и психологический (Mental Component Summary) компоненты здоровья одновременно с применением инструментальных методов исследования функции кардии.

Рис. 1. Трансиллюминационный фототензометрический зонд

Рис. 2. Устройство для измерения пищеводного отверстия диафрагмы
Обсуждение полученных результатов
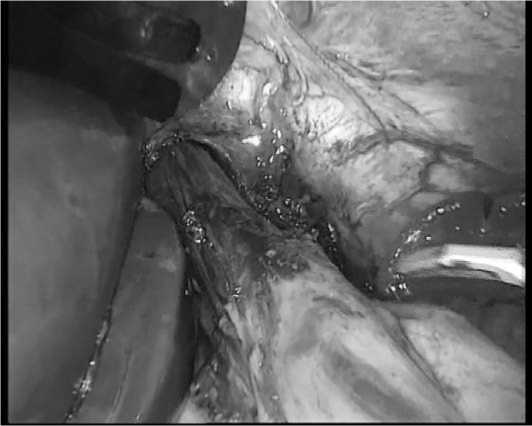
Рис. 3. Пищевод с введенным в абдоминальный отдел зондом
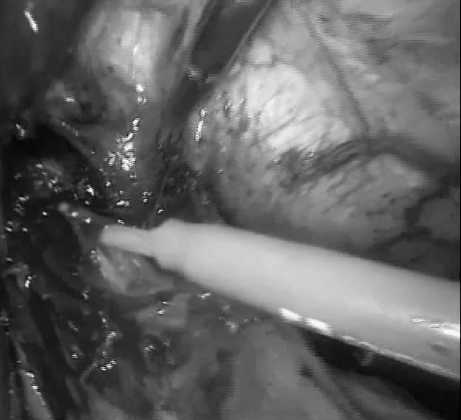
Рис. 4. Лапароскопическая продольная эзофагокардиомиотомия

Рис. 5. Операция в законченном виде (передняя модифицированной гемифундопликация)
Как свидетельствуют наши наблюдения, многие осложнения операций по коррекции АК связаны с недостаточным или избыточным сужением пищеводного отверстия. В эндохирургии важное значение имеет точное определение размера анатомических структур, что позволяет верно подбирать необходимые размеры инструментов, протезирующих материалов, выбирать дальнейшую тактику оперативного вмешательства [6]. Например, определение размера пищеводного отверстия диафрагмы имеет значение для выбора метода крурорафии или определения необходимого размера импланта для закрытия дефекта. Так, по мнению ряда авторов, применение сетчатого протеза при устранении ГПОД должно быть лимитировано и целесообразно только при наличии морфофункциональных изменений ножек (фиброз, гипотрофия), а также при размерах хиатального окна более 5 см [13, 14]. Для проведения анти-рефлюксного этапа операции нами предложено устройство для измерения пищеводного отверстия диафрагмы (Патент Российской Федерации на изобретение № 2088158). Использование устройства хорошо зарекомендовало себя в клинической практике.
Применение у 74 пациентов с АК указанного оригинального способа лапароскопической эзофагокардиомиотомии, включающего использование устройств, облегчающих мобилизацию кардии и формирование фундопликационной манжеты позволяет улучшить результаты лечения. Каких-либо интраоперационных осложнений в основной группе, а также ранних послеоперационных осложнений не выявлено. Продолжительность оперативного вмешательства составляла в среднем 65,0 [52,5–95,5] мин. Данные длительности операции представлены в Таблице 1. Существенных различий в продолжительности операции обеих исследуемых групп в стационаре не было выявлено.
Таблица 1
Показатели длительности проведения эзофагокардиомио-томии
|
Группы |
время операции (мин.) |
Уровень значимости |
|
Группа основная |
65,0±10,2 |
р1 <0,05 |
|
Группа сравнения |
68,6±12,6 |
При гладком течении послеоперационного периода больных выписывали на 4-5 сутки после лапароскопической операции. Средний койко-день в основной группе составил 4,26±2,16 дней, в контрольной - 8,1±3,6 дней (р > 0,05). Увеличение сроков госпитализации было связано с терапией выявленных осложнений. В контрольной группе (n = 206) в 4 наблюдениях (1,9 %) во время мобилизации кардии был вскрыт просвет пищевода, потребовавший ушивание дефекта. В раннем послеоперационном периоде у 29 пациентов группы контроля (14,1 %) наблюдалась дисфагия, связанная с чрезмерным сужением пищеводного отверстия диафрагмы. Изучение отдаленных результатов проводили методом анкетирования, 34 пациентам удалось провести контрольное инструментальное обследование, при этом были отслежены отдаленные результаты до 2 лет.
Данные опроса удалось получить у 74 (45 пациентов основной группы и 29 группы контроля). При общей оценке самочувствия по 4-бальной шкале отличные результаты отметили 17 (22,9 %), из них 7 пациентов основной группы и 10 группы контроля; хорошие – 49 (66,3 %), из них 35 пациентов основной группы и 14 группы контроля; удовлетворительные – 6 (8,1 %), из них 3 пациента основной груп- пы и 3 группы контроля; неудовлетворительные – 2 (2,7 %). Все пациенты с неудовлетворительными результатами (рецидив заболевания) из группы контроля. При самооценке больными состояния своего здоровья по опроснику GERD-HRQL отмечено статистически значимое восстановление показателей замыкательной функции кардии по манометрическим данным и показателя DeMeester. Вместе с тем у части больных с отличными и хорошими результатами выявлено наличие нарушения пищеводной моторики и рефлюкс-эзофагита в нижней трети пищевода по данным суточной внутрипищеводной рН-метрии и ФЭГДС (23,81 ± 4,65 %). Оценка качества жизни пациентами, согласно опроснику SF-36, увеличилась по всем шкалам в течение 1-го и 2-го года после операции в сравнении с предоперационными значениями. Причем все пациенты, которым коррекция АК выполнялась по разработанной методике оказались в группе удовлетворенных результатами хирургии. 34 пациентам обеих групп удалось провести контрольное инструментальное обследование. При этом у большинства (22) не выявлено отклонений от нормы, лишь у 11 пациентов при фиброгастроскопии диагностирован эзофагит, а у 1 больного из группы контроля после кардиомиотомии с фундопликацией по Дор с крурорафией определены рентгенологические признаки рецидива АК.
Выводы
Разработанная методика лапароскопической эзофаго-кардиомиотомии, включающая использование внутрипи-щеводной трансиллюминации и устройства для измерения пищеводного отверстия позволяет предупредить повреждение стенки пищевода и послеоперационные осложнения, связанные с недостаточным либо чрезмерным сужением пищеводного отверстия. Из 74 пациентов 66 (89,2 %) оценили результат как отличный и хороший, 6 (8,1 %) как удовлетворительный, 2 (2,7 %) как неудовлетворительный.
Список литературы Пути улучшения результатов эндохирургического лечения ахалазии кардии
- Аллахвердян А.С. Выбор метода лапароскопической фундопликации при скомпрометированной моторике пищевода. Вестник последипломного медицинского образования 2016; 2; 72-75.
- Черноусов А.Ф., Хоробрых Т.В., Ветшев Ф.П., Мелентьев А.А., Осминин С.В. Ахалазия кардии и кардиоспазм - современные принципы лечения. Анналы хирургии 2012; 3; 5-10.
- Чикинев Ю.В., Дробязгин Е.А. Медиастиноскопия в хирургии доброкачественных заболеваний пищевода и кардии. Вестник хирургии им. И.И. Грекова 2016; 5; 53-57.
- Оскретков В.И., Балацкий Д.В., Гурьянов А.А. Функциональное состояние кардии после различных методов лечения ахалазии пищевода. Хирург 2016; 3; 13-18.
- Анищенко В.В., Ковган Ю.М., Налбандян А.Г., Ким Д.А., Платонов П.А. Эзофагокардиофундопластика как метод лечения ахалазии кардии. Вопросы реконструктивной и пластической хирургии 2017; 1(60); 40-45.
- Галимов О.В., Ханов В.О., Зиангиров Р.А., Сайфуллин Р.Р. Критерии выбора способа коррекции грыж пищеводного отверстия диафрагмы. Материалы XII съезда хирургов России, Ростов-на-Дону - 2015. Альманах института хирургии им. А.В.Вишневского 2015; 2; 211-212.
- Карпов О.Э., Ветшев П.С., Васильев И.В., Маады А.С., Алексеев К.И., Осипов А.С. Эндоскопические технологии в диагностике и лечении ахалазии кардии. Вестник Национального медико-хирургического центра им. Н.И. Пирогова 2016; (1); 11; 30-36.
- Akintoye E., Kumar N., Obaitan I. et al. Peroral endoscopic myotomy: a metaanalysis. Endoscopy 2016; E-pub ahead of print.
- DOI: 10.1055/s-0042-114426
- Ren Z., Zhong Y., Zhou Р. et al. Perioperative management and treatment for complications during and after peroral endoscopic myotomy (POEM) for esophageal achalasia (EA) (data from 119 cases). Surg Endosc 2012; 26; 3267-3272.
- Zhang W.G., Linghu E.Q., Chai N.L., Li H.K. Ling classification describes endoscopic progressive process of achalasia and successful peroral endoscopy myotomy prevents endoscopic progression of achalasia. World J Gastroenterol 2017; 23(18); 309-314. http://dx.doi.org/0.3748/wjg.v23.i18.3309
- Rawlings A., Soper N., Oelschlager B. et al. Laparoscopic Dor versus Toupet Fundoplication following Heller Myotomy for Achalasia: Results of a Multicenter, Prospective Randomized-Controlled Trial. Surg Endosc 2012; Jan; 26(1); 18-26.
- Yano F., Omura N., Tsuboi K., et al. Learning curve for laparoscopic Heller myotomy and Dor fundoplication for Achalasia. PLoS One 2017; 12(7); 1023-1026.
- DOI: 10.1371/journal.pone.0180515
- Galljamov E., Agapov M., Erin S., Galljamov E., Gololobov G., Lutsevich O., and Presnov K. Experience of laparoscopic refundoplication. Surgical Endoscopy (2018), 51-52.
- DOI: 10.1007/s00464018-6179-z
- Галлямов Э.А., Агапов М.А., Луцевич О.Э., Кубышкин В.А., Ерин С.А., Преснов К.С., Бусырев Ю.Б., Какоткин В.В., Торосян О.Г. Лапароскопический подход в коррекции рецидивов гастроэзофагеальной рефлюксной болезни и грыж пищеводного отверстия диафрагмы. Хирургическая практика. 2019;(3):33-40.
- DOI: 10.38181/issn2223-2427.2019.3.33-40


