Рациональные подходы к терапии нозокомиальных инфекций, вызванных грамположительными микроорганизмами, у онкологических больных
Автор: Агинова В.В., Дмитриева Н.В., Григорьевская З.В., Петухова И.Н., Багирова Н.С., Терещенко И.В., Ключникова И.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.16, 2017 года.
Бесплатный доступ
Частота нозокомиальных инфекций, вызванных грамположительными микроорганизмами, включая золотистые стафилококки ( Staphylococcus aureus ) и энтерококки ( Enterococcus faecium и Enterococcus faecalis ), неуклонно возрастает практически во всех клиниках мира. Особое беспокойство вызывают эти инфекции в клиниках онкологического профиля. Угнетение иммунной системы, хирургические вмешательства, химио- и лучевая терапия, множественные инвазивные манипуляции и проч. оказывают негативное воздействие на процессы, обеспечивающие устойчивость макроорганизма к инфекционным агентам. В данной статье представлен анализ резистентности грамположительных микроорганизмов, вызывающих инфекционные осложнения у онкологических больных, к антибактериальным препаратам для определения стратегии их дальнейшего использования в клинике.
Нозокомиальные инфекции, грамположительные инфекции, золотистые стафилококки, энтерококки, таксономическая структура, устойчивость к антибиотикам
Короткий адрес: https://sciup.org/140253998
IDR: 140253998 | УДК: 616-006:616.9-02-08 | DOI: 10.21294/1814-4861-2017-16-5-12-17
Текст научной статьи Рациональные подходы к терапии нозокомиальных инфекций, вызванных грамположительными микроорганизмами, у онкологических больных
Нозокомиальные инфекции, вызванные грам-положительными микроорганизмами, включая золотистые стафилококки (Staphylococcus aureus) и энтерококки (Enterococcus faecium и Enterococcus faecalis), неуклонно возрастают практически во всех клиниках мира [1–3]. Стафилококки являются возбудителями значительной части внебольничных и нозокомиальных бактериемий, пневмоний, инфекций кожи, мягких тканей и др. Особое значение имеет распространение стафилококков, резистентных к метициллину или к оксациллину (MRSA), и стафилококков со сниженной чувствительностью к ванкомицину (VRSA/VISA) [4–7]. Данные особенности стафилококков служат причиной существенного ограничения выбора антибактериальных препаратов для лечения инфекций, вызванных этими штаммами микроорганизмов [8]. Среди энтерококков реальную проблему представляют ванкомицин-резистентные штаммы (VRE) и, что особенно беспокоит мировую общественность, появление линезолид-резистентных штаммов (LRE) [1–3, 9, 10].
Целью исследования явился анализ резистентности грамположительных микроорганизмов, вызывающих инфекционные осложнения у онкологических больных, к антибиотикам для определения стратегии их дальнейшего использования в клинике.
Материал и методы
Исследованию подлежали 2114 штаммов микроорганизмов, выделенных от онкологических больных, имеющих различные инфекционные осложнения. В 38 % случаев микроорганизмы были представлены ассоциациями грамположительных и грамотрицательных микроорганизмов или анаэ-
робами. Повторное выделение одного и того же микроорганизма от больного не учитывалось.
Идентификация микроорганизмов и оценка их чувствительности к антибактериальным препаратам производились с помощью современных автоматизированных систем: Vitek-2 System, MicroScan, WalkAway. Статистическая обработка данных осуществлялась с помощью программ Excel (Microsoft, США). Достоверность различий сравниваемых величин проводилась с помощью параметрического t-критерия Стьюдента.
Результаты и обсуждение
При анализе динамики устойчивости S. aureus к антибиотикам установлено, что частота выделения золотистых стафилококков увеличилась в 2 раза (табл. 1). Так, если в 2014 г. их количество составляло 160 штаммов, то в 2016 г. уже 341 штамм (повторные изоляты здесь и далее исключены). Высокое количество продуцентов бета-лактамаз способствовало тому, что почти все штаммы золотистого стафилококка были устойчивы к ампициллину (около 100 %) в течение всего исследуемого периода и в большинстве случаев сохраняли чувствительность к пенициллинам в комбинации с бета-лактамными ингибиторами (ампициллин/сульбактам и амоксициллин/кла-вуланат). Отмечено нарастание устойчивости золотистых стафилококков в период 2014–2016 гг. к амоксициллину/клавуланату с 11,8 % до 20,8 % (p<0,01), в то время как количество устойчивых к ампициллину/сульбактаму штаммов за исследуемый период не изменялось, оставаясь на низком уровне (11,7–12,9 %), количество резистентных штаммов к нему в 2016 г. было значимо ниже (p<0,02), чем к амоксициллину/клавуланату. Наибольшие проблемы при лечении нозокомиальных инфекций, вызванных золотистыми стафилококками, представляют штаммы, резистентные к мети- циллину/оксациллину – MRSA (рис. 1). Количество MRSA достоверно увеличилось к 2016 г. – с 10,6 % до 21,1 % (p<0,02), оставаясь на невысоком уровне. MRSA резистентен практически ко всем группам бета-лактамных антибиотиков, включая цефалоспорины. Так, количество резистентных штаммов к цефтриаксону также составило 21,1 % в 2016 г., и оно значимо увеличилось (в 2 раза) по сравнению с предыдущими годами.
Среди фторхинолонов самая низкая резистентность выявлена к моксифлоксацину (4-е поколение) по сравнению с препаратами 2-го и 3-го поколений этой группы (ципрофлоксацин и левофлоксацин) – 5,8 % резистентных штаммов против 14,9 % и 9,1 % соответственно (p<0,05–0,001), при этом левофлоксацин был более активен, чем ципрофлоксацин (различия между группами значимы). Эти данные закономерны, так как фторхиноло-ны 4-го поколения более активны в отношении золотистых стафилококков по сравнению с предыдущими поколениями. Резистентность к фторхинолонам за последние годы существенно не изменилась, оставаясь в целом на невысоком уровне – 5,8–14,9 %.
В отношении аминогликозидов (гентамицин) и тетрациклинов количество резистентных штаммов было невысоким и существенно не менялось за последние годы (8,7–12,0 %). Увеличилось (p<0,02) количество штаммов золотистых стафилококков, резистентных к бисептолу (триметоприм-сульфаметоксазолу), – от 3,1 % до 8,8 %. Однако настораживает тенденция к увеличению (p>0,05) относительного количества ванкомицин-резистентных и даптомицин-резистентных штаммов золотистых стафилококков, хотя их абсолютное количество составляло в 2016 г. 10–11 штаммов и увеличилось почти в 3 раза по сравнению с предыдущим периодом (рис. 1). Стали выявляться линезолид-резистентные золотистые
Таблица 1
Динамика выделения штаммов S. aureus , устойчивых к антибиотикам в период 2014–2016 гг.
|
Препараты |
Годы/количество штаммов |
||
|
2014 г. (n=160) |
2015 г. (n=194) |
2016 г. (n=341) |
|
|
Амоксициллин/клавулановая кислота |
19 (11,8 %) |
23 (12,4 %) |
71 (20,8 %) |
|
Ампициллин |
158 (98,7 %) |
194 (100,0 %) |
341 (100,0 %) |
|
Ампициллин/сульбактам |
19 (11,8 %) |
25 (12,9 %) |
40 (11,7 %) |
|
Оксациллин |
17 (10,6 %) |
21 (10,8 %) |
72 (21,1 %) |
|
Цефтриаксон |
18 (11,2 %) |
22 (11,3 %) |
72 (21,1 %) |
|
Ципрофлоксацин |
21 (13,1 %) |
26 (13,4 %) |
51 (14,9 %) |
|
Левофлоксацин |
20 (12,5 %) |
19 (9,7 %) |
31 (9,1 %) |
|
Моксифлоксацин |
16 (10,0 %) |
15 (7,7 %) |
20 (5,8 %) |
|
Гентамицин |
14 (8,7 %) |
19 (9,7 %) |
41 (12,0 %) |
|
Линезолид |
3 (1,8 %) |
2 (1,0 %) |
0 |
|
Ванкомицин |
3 (1,8 %) |
4 (2,0 %) |
10 (2,9 %) |
|
Тетрациклин |
19 (11,8 %) |
17 (8,8 %) |
40 (11,7 %) |
|
Триметоприм/сульфаметоксозол |
5 (3,1 %) |
2 (1,0 %) |
30 (8,8 %) |
|
Даптомицин |
3 (1,8 %) |
4 (2,0 %) |
11 (3,2 %) |
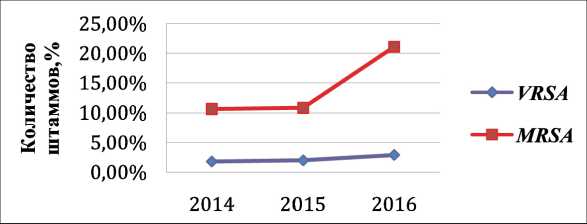
Рис. 1. Частота выделений MRSA и VRSA штаммов в период 2014–2016 гг.
стафилококки: в течение 2014–2015 гг. было выделено 5 штаммов, в 2016 г. таковых не было.
Анализ устойчивости E. faecalis и E. faecium за период 2014–2016 гг представлен в табл. 2. Общее количество энтерококков снизилось с 489 штаммов в 2014 г. до 417 штаммов в 2016 г. (p<0,001), при этом снизилось количество как E. faecalis, так и E. faecium.
Число ампициллин-резистентных штаммов в течение всего периода наблюдения было минимальным для E. faecalis и составило около 8 %, что позволяет рассматривать аминопенициллины, в том числе и «защищенные» (ампициллин/сульбак-там и амоксициллин/клавуланат), как препараты выбора для лечения инфекций, вызванных этим возбудителем, включая эмпирическую терапию. Напротив, почти все штаммы E. faecium были резистентны к ампициллину, за исключением 2016 г., когда их количество снизилось до 51,9 %, оставаясь в целом высоким, что не позволяет использовать ампициллин, включая его «защищенные» формы, в качестве препарата выбора для лечения инфекций, вызванных E. faecium.
Количество штаммов E. faecalis , резистентных к фторхинолонам (ципрофлоксацин и левофлоксацин), было значительным, составляя в 2014–2015 гг. 40–50 %, в 2016 г. оно снизилось почти в 2 раза (p<0,0001), в то время как к мок-сифлоксацину, напротив, увеличилось в 5 раз (p<0,0001). Это могло быть связано со значительным сокращением использования фторхинолонов
2-го и 3-го поколений в пользу препарата 4-го поколения – моксифлоксацина, обладающего более высокой активностью в отношении грам-положительных микроорганизмов. Штаммы E. faecium были высокорезистентны практически ко всем поколения фторхинолонов (63–89 %), за исключением 2015 г., когда было выявлено 18,4 % устойчивых штаммов к моксифлоксацину, однако в следующем году их количество составило уже 74 % (p<0,0001). Поэтому в настоящее время вся группа фторхинолонов не должна использоваться в клинике для лечения грамположительных инфекций, включая эмпирическое назначение.
Количество штаммов энтерококков, устойчивых к тетрациклинам, было достаточно велико в течение последних 3 лет и в разные годы колебалось от 45 до 78 %, с наибольшим количеством резистентных штаммов со стороны E. faecalis (p<0,0001). В целом высокое количество тетрациклин-устойчивых штаммов энтерококков не позволяет рекомендовать эту группу антибиотиков для широкого использования в клинике.
В отношении сравнительно нового антибиотика из группы липопептидов – даптомицина – сохраняется высокая чувствительность штаммов E. fecalis – 2–5 %, однако настораживает рост резистентности E. faecium c 10 до 36 % (p<0,0001). Поэтому назначение даптомицина должно быть строго ограничено результатами антибиотикограммы.
Ванкомицин и линезолид являются препаратами выбора для лечения не только инфекций, вызванных MRSA , но и для лечения резистентных энтерококковых инфекций, в частности, к полу-синтетическим пенициллинам. Нерациональное применение ванкомицина индуцирует появление в клинике ванкомицин-резистентных штаммов (рис. 2). Количество энтерококков, резистентных к ванкомицину, колебалось от 3 до 8 % (p>0,05). Препаратом выбора для лечения VRE является линезолид. В 2014 г. появились первые линезолид-резистентные энтерококки, а в 2016 г. их было уже 15. Крайне низкое количество VRE позволяет про-
Таблица 2
Динамика выявления штаммов E. faecalis и E. faecium, устойчивых к антибиотикам в период 2014–2016 гг.
|
Препараты |
Годы/количество штаммов 2014 г. 2015 г. 2016 г. E. faecalis E. faecium E. faecalis E. faecium E. faecalis E. faecium (n=283) (n=206) (n=242) (n=271) (n=236) (n=181) |
|
Ампициллин Ципрофлоксацин Левофлоксацин Моксифлоксацин Линезолид Ванкомицин Тетрациклин Даптомицин |
25 (8,8 %) 170 (82,5 %) 21 (8,7 %) 235 (86,7 %) 19 (8,0 %) 94 (51,9 %) 144 (50,8 %) 171 (83,0 %) 101 (41,7 %) 254 (93,7 %) 52 (22,0 %) 161 (88,9 %) 135 (47,7 %) 168 (81,5 %) 97 (40,1 %) 241 (88,9 %) 49 (20,7 %) 115 (63,5 %) 0 0 20 (7,1 %) 52 (18,4 %) 86 (36,4 %) 133 (73,5 %) 0 6 (2,9 %) 0 0 9 (3,8 %) 6 (3,3 %) 11 (3,8 %) 16 (7,7 %) 9 (3,7 %) 13 (4,8 %) 6 (2,54 %) 12 (6,6 %) 217 (76,6 %) 92 (44,6 %) 188 (77,6 %) 108 (39,8 %) 186 (78,1 %) 81 (44,7 %) 6 (2,1 %) 20 (9,7 %) 7 (2,9 %) 32 (11,8 %) 12 (5,1 %) 65 (35,9 %) |
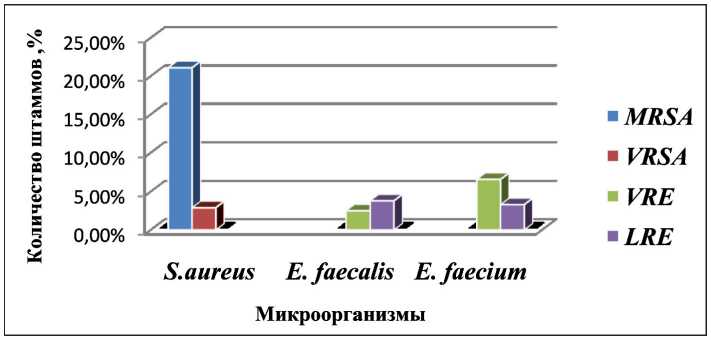
Рис. 2. Количество резистентных к антибиотикам золотистых стафилококков и энтерококков в период 2014–2016 гг.
должать использовать ванкомицин в клинике как для целенаправленной, так и для эмпирической терапии энтерококковых инфекций или инфекций с высокой долей вероятности обнаружения энтерококков. Неоправданно широкое использование линезолида приводит к появлению линезолид-резистентных штаммов. Лечение этих инфекций может представлять большую проблему. Поэтому следует строго ограничить назначение линезолида только для инфекций, вызванных VRE.
Таким образом, нарастание резистентности к антибиотикам со стороны как грамотрицатель-ных, так и грамположительных микроорганизмов и грибов вызывает большое беспокойство врачей практически всех стран мира. Грамположительные антибиотикорезистентные бактерии, вызывающие серьезные и трудно поддающиеся терапии инфекции, включают резистентные к метициллину, ванкомицину и линезолиду стафилококки, ванко- и линезолид-резистентные энтерококки. В течение последних 3 лет (2014–2016 гг.) нами был проведен анализ динамики резистентности 2114 штаммов золотистых стафилококков и энтерококков, выделенных из различных патологических материалов от онкологических больных в клинике «РОНЦ им. Н.Н. Блохина» МЗ РФ. Была выявлена значимо доказанная тенденция к нарастанию MRSA штаммов: их количество к 2016 г. увеличилось в 2 раза и составило 21,1 % от общего числа золотистых стафилококков. Отмечена тенденция к нарастанию ванкомицин-резистентных штаммов. Так, к 2016 г. их количество увеличилось более чем в 2 раза, а за весь период наблюдения было выявлено 17 ванкомицин-резистентных штаммов (повторно выделенные изоляты были исключены). В целом, относительное количество ванкомицин-резистентных стафилококков крайне низко (1,8–2,9 %), что позволяет использовать ванкомицин для лечения инфекций, вызванных MRSA. Среди энтерококков не отмечено нарастания ванкомицин- и линезолид-резистентных штаммов, однако их общее количество за весь период наблюдения составило 67 штаммов, резистентных к ванкомицину, и 21 штамм, резистентный к линезолиду, хотя относительное количество VRE было невелико (2–7 %), что позволяет использовать ванкомицин для эмпирической терапии при соответствующих показаниях. Использование линезолида должно быть строго ограничено, как антибиотика резерва для лечения инфекций, вызванных ванкомицин-резистентными грамположительными бактериями. Ампициллин/сульбактам показал хорошую активность и отсутствие нарастания резистентности в отношении как золотистых стафилококков, так и E. faecalis (представлены данные по ампициллину), поэтому препарат может быть использован в первой линии терапии инфекций, вызванных этими возбудителями. Большинство штаммов золотистых стафилококков было чувствительно к фторхинолонам, в то время как для лечения инфекций, вызванных энтерококками, эти препараты должны быть полностью исключены: количество резистентных к моксифлоксацину энтерококков составило 36 и 73 % и отмечена тенденция к нарастанию резистентности. Использование даптомицина (препарат резерва для лечения грамположительных инфекций) также должно быть ограничено инфекциями, вызванными ванкомицин-резистентными штаммами. Число резистентных грамположи-тельных микроорганизмов к даптомицину среди золотистых стафилококков не превышало 3,2 %, среди энтерококков – 5–12 %, за исключением выявления высокого количества (36 %) даптомицин-резистентных E. faecium в 2016 г.
Список литературы Рациональные подходы к терапии нозокомиальных инфекций, вызванных грамположительными микроорганизмами, у онкологических больных
- Петухова И.Н., Дмитриева Н.В., Григорьевская З.В., Багирова Н.С., Терещенко И.В., Дьякова С.А. Частота выделения MRSA и других резистентных грамположительных микроорганизмов в различных отделениях онкологического стационара. Клиническая лабораторная диагностика. 2016; 9: 125-126
- Дмитриева Н.В., Петухова И.Н., Багирова Н.С., Григорьевская З.В., Дьякова С.А., Терещенко И.В., Соколова Е.Н. Распространенность нозокомиальных микроорганизмов в онкологической клинике. Клиническая лабораторная диагностика. 2016; 9; 109-110.
- Дмитриева Н.В., Петухова И.Н. Антимикробная химиотерапия внутрибольничных инфекций. М.: Издательский дом «АБВ-пресс», 2015; 210-222
- Antimicrobial resistance surveillance in Europe 2015. URL: http:// www.ecdc.europa.eu (дата обращения 01.11.2016)
- Rice L.B. Antimicrobial resistance in gram-positive bacteria. Am J Infect Control. 2006 Jun; 34 (5 Suppl 1): S11-9
- Antimicrobial Agent Use. Infectious Diseases Society of American (IDSA). URL: http://www.idsociety.org/Antimicrobial_Agents (дата обращения 01.11.2016)
- World Health Organization. WHO Global Strategy for Containment of Antimicrobial Resistance. Geneva, 2001; 90
- Loomba P.S., Taneja J., Mishra B. Methicillin and Vancomycin Resistant S. aureus in Hospitalized Patients. J Glob Infect Dis. 2010 Sep; 2 (3): 275-83. DOI: 10.4103/0974-777X.68535
- Arias C.A., Murray B.E. The rise of the Enterococcus: beyond vancomicin resistance. Nat Rev Microbiol. 2012 Mar 16; 10 (4): 266-78. DOI: 10.1038/nrmicro2761
- Krull M., Klare I., Ross B., Trenschel R., Beelen D.W., Todt D., Steinmann E., Buer J., Rath P.M., Steinmann J. Emergence of linezolid- and vancomycin-resistant Enterococcus faecium in a department for hematologic stem cell transplantation. Antimicrob Resist Infect Control. 2016 Sep 22; 5: 31. DOI: 10.1186/s13756-016-0131-6


