Радиационный риск эмбриональной гибели в различных стадиях развития половых клеток мышей-самцов после низкодозного радиационного облучения
Бесплатный доступ
Гонады обладают высокой радиочувствительностью и относятся к 1 группе критических органов облучения, а сперматогенный эпителий, обладая способностью к непрерывному обновлению клеток, является уникальной моделью для исследования радиационных эффектов и оценки их последствий. Нарушения, возникающие в органах репродуктивной системы, могут привести к снижению фертильности и эмбриональным потерям. С целью выявления радиационного риска малых доз гамма-облучения для сперматогенеза проведена комплексная оценка количественных и функциональных показателей сперматогенных клеток и сперматозоидов у мышей линии BALB/c, подвергнутых облучению в дозах 0,1; 0,25; 0,5 и 1,0 Гр (137Cs, мощность дозы 0,85 Гр/мин). Количественный анализ сперматогенных клеток в клеточной суспензии семенника и эпидидимальных сперматозоидов проводили с помощью камеры Горяева. Впервые для оценки функционального состояния половых клеток использован метод определения их жизнеспособности. При дозах 0,1 и 0,25 Гр отмечается стимуляция пролиферативной активности сперматогенных клеток (гормезис) - компенсаторно-защитная реакция, способствующая сохранению числа клеток. Выявлена негативная реакция половых клеток на облучение, реализующаяся в снижении фертильности и антенатальной гибели плодов. Представлены данные по эмбриональным потерям на разных стадиях сперматогенеза. Установлено снижение внутриутробной выживаемости эмбрионов при дозе 0,1 Гр на премейотической стадии сперматогенеза, при дозе 1,0 Гр - на постмейотической. Эмбриональная смертность происходит за счёт гибели плодов до имплантации. Постимплантационная гибель плодов достоверно превышает контрольные значения только при воздействии облучения в дозе 1,0 Гр. Повреждающей дозой однократного общего гамма-облучения мужских гонад в экспериментальных условиях является доза 0,1 Гр.
Облучение, доза, сперматогенез, сперматогенные клетки, сперматозоиды, коэффициент жизнеспособности, апоптоз, фертильность, предимплантационная гибель плодов, гибель плодов после имплантации, эмбриональные потери
Короткий адрес: https://sciup.org/170171497
IDR: 170171497 | УДК: 539.1.047:591.463.12 | DOI: 10.21870/0131-3878-2019-28-3-54-62
Текст научной статьи Радиационный риск эмбриональной гибели в различных стадиях развития половых клеток мышей-самцов после низкодозного радиационного облучения
На сегодняшний день при стремительном развитии атомной промышленности возможно радионуклидное загрязнение окружающей среды, которое негативно отразится на репродуктивном здоровье населения. Гонады обладают высокой радиочувствительностью и относятся к 1-й группе критических органов облучения, нарушения в половых клетках могут привести к снижению фертильности и гибели плодов на разных стадиях эмбриогенеза [1-3]. Сперматогенный эпителий является уникальной моделью для изучения эффектов и последствий облучения [4-6].
К настоящему времени накоплено достаточно данных по действию низкодозового облучения на сперматогенный эпителий, которые в основном касаются либо морфологических изменений в ткани семенника, либо цитогенетических и онтогенетических эффектов [7-9]. Известно, что при облучении в небольших дозах наблюдаются репаративные процессы в клетках, элиминация повреждённых клеток и модификация клеточных структур. В настоящее время наиболее актуальным является комплексный подход к изучению радиационного воздействия в малых дозах на репродуктивную функцию: установление взаимосвязи между состоянием спер-
Мамина В.П. – ст. научн. сотр., к.б.н. ФГБУ ИЭРиЖ УрО РАН.
матогенеза, фертильностью и доминантно-летальными мутациями. Комплексная оценка состояния репродуктивной функции мышей-самцов, подвергшихся низкодозовому облучению, необходима для прогнозирования отдалённых эффектов и выявления риска для репродукции.
Для оценки риска влияния облучения в малых дозах на сперматогенез мышей подвергали острому облучению в малых дозах и определяли выход доминантно-летальных мутаций. Выявлены наиболее информативные показатели. Цель данного исследования – оценить функциональное состояние половых клеток и провести сравнительный анализ эмбриональных потерь на пре и постмейотических стадиях сперматогенеза.
Материал и методики
Исследования проводили на мышах линии BALB/c (возраст 2,5 мес.), которых содержали в стандартных условиях вивария. Животных подвергали однократному облучению на установке «ИГУР» в дозах 0,1; 0,25; 0,5 и 1,0 Гр (137Cs, мощность дозы 0,85 Гр/мин). Животных декапити-ровали на 8-е, 16-е, 24-е, 32-е и 48-е сутки после облучения, извлекали семенники и придатки (эпидидимисы). Количественный анализ сперматогенных клеток проводили в клеточной суспензии семенника с помощью камеры Горяева. Для получения суспензии семенник помещали в 5% раствор уксусной кислоты с генцианвиолетом [10]. Определение живых и мёртвых сперматоген-ных клеток проводили в клеточной суспензии семенника с прижизненным окрашиванием: использовали среду, состоящую из сахарозы, ЭДТА, трис-НС и 0,5% нейтрального красного на физиологическом растворе [11]. Коэффициент жизнеспособности сперматогенных клеток (К ж ) рассматривается как отношение живых клеток к мёртвым. Для цитологического анализа использовано 170 самцов. Количество сперматозоидов, выделенных из эпидидимиса, определяли в камере Горяева, жизнеспособность – на мазках с помощью окрашивания эозин-нигрозином [12]. Для определения эмбриональных потерь на разных стадиях сперматогенеза интактных половозрелых самок подсаживали к облучённым самцам через 1-7, 11-21, 22-24, 28-35 и после 35 суток (зрелые сперматозоиды, сперматиды, сперматоциты, сперматогонии и стволовые клетки соответственно). На каждой стадии сперматогенеза учитывали гибель эмбрионов до имплантации, после имплантации, показатель внутриутробной выживаемости и число живых плодов на самку [13]. Для спаривания использовано 200 самцов и 400 самок. Полученные данные подвергали статистической обработке с использованием методов вариационной статистики ( t -критерия Стьюдента) при 95%-м уровне значимости различий между показателями подопытных и контрольных групп.
Результаты исследования и их обсуждение
Количественные и функциональные показатели сперматогенных клеток представлены в табл. 1. Анализ результатов показал снижение числа сперматогенных клеток и их жизнеспособности, степень выраженности которых зависит от величины дозы облучения. На 8-е сутки после облучения в дозах 0,1 и 0,25 Гр наблюдается статистически значимое увеличение количества сперматогенных клеток и коэффициента их жизнеспособности (радиационный гормезис) [14], благодаря которому численность клеток удерживается на уровне контрольных значений до 32 суток. При облучении в дозе 0,5 Гр снижение числа сперматогенных клеток происходит на 24-е сутки, при дозе 1,0 Гр – на 16-е сутки после облучения. Падение коэффициента жизнеспособности сперматогенных клеток (К ж ) отмечается при дозах 0,1 и 0,25 Гр – на 24 сутки, при дозе 0,5 Гр – на 16 сутки, при дозе 1,0 Гр – на 8 сутки.
Таблица 1
Изменение количества сперматогенных клеток и их жизнеспособности (К ж ) у мышей линии BALB/c после низкодозового гамма-облучения
|
Показатели |
Интактный контроль |
Сроки, сут |
Доза, Гр |
|||
|
0,1 |
0,25 |
0,5 |
1,0 |
|||
|
Число сперматогенных |
25,6 ± 3,4 |
8 |
30,5 ± 3,0* |
30,7± 2,8* |
22,9 ± 2,5 |
20,6 ± 1,8 |
|
клеток, х10 6 |
16 |
25,2 ± 2,5 |
24,8 ± 3,0 |
18,0 ± 1,9* |
18,5 ± 1,9* |
|
|
24 |
23,3 ± 2,8 |
21,4 ± 2,7 |
18,2 ± 0,9* |
17,1 ± 0,8* |
||
|
32 |
20,0 ± 2,0* |
17,5 ± 1,5* |
16,4 ± 0,7* |
15,6 ± 0,6* |
||
|
Коэффициент жизнеспо- |
16,5 ± 1,8 |
8 |
22,0 ± 2,5* |
21,0 ± 1,8* |
7,4 ± 0,8 |
6,5 ± 0,8* |
|
собности сперматогенных |
16 |
15,5 ± 1,8 |
14,8 ± 1,2 |
7,2 ± 0,8* |
8,0 ± 0,9* |
|
|
клеток (К ж ) |
24 |
9,6 ± 1,1* |
8,1 ± 1,0* |
7,3 ± 0,9* |
8,0 ± 1,1* |
|
|
32 |
7,6 ± 0,8* |
7,5 ± 0,9* |
9,0 ± 1,2* |
9,2 ± 1,2* |
||
Примечание: знаком (*) обозначены значения, достоверно (p<0,05) отличающиеся от интактного контроля, в каждой группе по 8-10 самцов.
Увеличение числа сперматогенных клеток происходит за счёт стимуляции пролиферативной активности сперматогоний, которая обусловлена нейрогуморальной регуляцией сперматогенеза: увеличением концентрации тестостерона [15]. Падение числа сперматогенных клеток связано с увеличением апоптической гибели клеток на разных стадиях их развития [16]. Инициация апоптического сигнала клеток опосредуется через экзогенные (рецепторы на мембране) и эндогенные (митохондрии) факторы [17]. Мишенью ионизирующего излучения в малых дозах являются морфологические и функциональные нарушения клеточных мембран, которые приводят к возрастанию проапоптических белков, вызывающих гибель клеток. Снижение числа спер- матогенных клеток вызывает статистически значимое падение числа сперматозоидов на 16 и
24 сутки после облучения в дозах 0,5 и 1,0 Гр, а на 32 и 48 сутки – при всех исследованных дозах (рис. 1а).
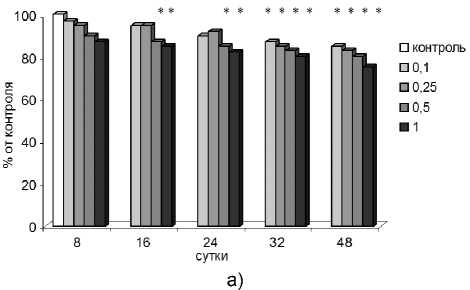
Рис. 1. Изменение числа сперматозоидов (а) и их жизнеспособности (б) у мышей в разные сроки после облучения в дозах 0,1; 0,25; 0,5 и 1,0 Гр.
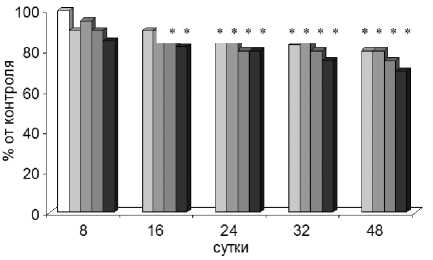
Жизнеспособность сперматозоидов изменяется соответственно изменению их числа (рис. 1б). Предимплантационная гибель, отражающая раннюю доминантную летальность, достоверно превышает значения контроля после радиационного воздействия в дозе 0,1 Гр, когда половые клетки самцов в момент облучения находились на стадиях сперматоцитов, спермато-гониев и стволовых клеток, в дозе 0,25 Гр – на стадиях сперматогониев и стволовых клеток. При облучении мышей в дозе 1,0 Гр доимплантационные потери статистически значимо возрастают на всех стадиях сперматогенеза, при дозе 0,5 Гр – почти на всех стадиях кроме сперматоцитов (табл. 2). Анализ предимплантационной гибели эмбрионов показал, что при всех исследован- ных дозах нарушения происходят в стволовых клетках и сперматогониях, а с увеличением дозы облучения отмечается достаточно высокая поражаемость сперматид и сперматозоидов. Постимплантационная гибель плодов, отражающая уровень доминантных леталей в более поздние сроки, достоверно превышает контрольные значения при воздействии облучения в дозе 1,0 Гр на стадиях сперматозоидов, сперматид и сперматоцитов (табл. 2).
Таблица 2
Эмбриональные потери у мышей линии BALB/c, половые клетки которых в момент облучения находились на разных стадиях сперматогенеза
|
Стадии сперматогенеза |
Гибель эмбрионов до имплантации, % |
Гибель эмбрионов после имплантации, % |
Число живых плодов на самку, % |
|
Контроль |
23,1 ± 2,8 |
18,9 ± 1,8 |
6,7 ± 0,7 |
|
0,1 Гр |
|||
|
Сперматозоиды |
26,4 ± 4,5 |
13,6 ± 1,8 |
5,8 ± 0,7 |
|
Сперматиды |
29,2 ± 4,5 |
14,9 ± 1,6 |
5,4 ± 0,8 |
|
Сперматоциты |
46,0 ± 5,8* |
13,0 ± 1,5 |
4,1 ± 0,4* |
|
Сперматогонии |
44,1 ± 6,0* |
17,3 ± 2,5 |
4,4 ± 0,5* |
|
Стволовые клетки |
43,3 ± 4,8* |
16,2 ± 2,0 |
3,2 ± 0,4* |
|
0,25 Гр |
|||
|
Сперматозоиды |
31,0 ± 5,7 |
21,6 ± 3,0 |
4,5 ± 0,7 |
|
Сперматиды |
29,8 ± 6,0 |
16,6 ± 2,1 |
5,3 ± 0,8 |
|
Сперматоциты |
41,0 ± 4,0 * |
19,0 ± 2,5 |
5,3 ± 0,9 |
|
Сперматогонии |
38,5 ± 5,0* |
13,5 ± 1,9 |
4,5 ± 0,5 |
|
Стволовые клетки |
40,0 ± 5,8* |
14,2 ± 1,7 |
5,0 ± 0,5 |
|
0,5 Гр |
|||
|
Сперматозоиды |
36,5 ± 4,8* |
20,0 ± 3,5 |
4,4 ± 0,4* |
|
Сперматиды |
37,7 ± 5,4* |
22,9 ± 7,0 |
4,0 ± 0,5* |
|
Сперматоциты |
36,0 ± 9,0 |
13,5 ± 2,0 |
5,3 ± 1,1 |
|
Сперматогонии |
50,0 ± 7,0* |
20,5 ± 3,4 |
4,4 ± 0,5* |
|
Стволовые клетки |
55,0± 6,4* |
13,8 ± 2,5 |
3,8 ± 0,4* |
|
1,0 Гр |
|||
|
Сперматозоиды |
49,0 ± 3,8* |
28,9 ± 3,0* |
3,8 ± 0,3* |
|
Сперматиды |
47,8 ± 7,8* |
27,1 ± 2,9* |
4,5 ± 0,6* |
|
Сперматоциты |
46,7 ± 6,3* |
38,4 ± 8,0* |
3,7 ± 0,4* |
|
Сперматогонии |
33,1 ± 6,0 |
25,6 ± 4,8 |
5,0 ± 0,7 |
|
Стволовые клетки |
43,0 ± 7,8* |
12,7 ± 1,8 |
5,0 ± 0,8 |
Примечание : знаком* обозначены значения, достоверно (p<0,05) отличающиеся от контроля, в каждой группе находилось 13-15 беременных самок.
Снижение числа сперматогенных клеток приводит к статистически значимому падению числа сперматозоидов на 16-е и 24-е сутки после воздействия радиации в дозах 0,5 и 1,0 Гр, а на 32-е и 48-е сутки – при всех исследованных дозах (рис. 1а). Жизнеспособность сперматозоидов изменяется соответственно изменению их числа (рис. 1б). Анализируя предимплантацион-ную гибель, отражающую раннюю доминантную летальность, следует отметить, что она достоверно превышает значения контроля после радиационного воздействия в дозе 0,1 Гр, когда половые клетки самцов подвергались облучению на стадиях сперматоцитов, сперматогониев и стволовых клеток, в дозе 0,25 Гр – на стадиях сперматогониев и стволовых клеток. При облучении мышей в дозе 1,0 Гр доимплантационные потери статистически значимо возрастают на всех стадиях сперматогенеза, при дозе 0,5 Гр – почти на всех стадиях кроме сперматоцитов (табл. 2). При сравнении последствий облучения половых клеток самцов на разных стадиях сперматогенеза по предимплантационной гибели эмбрионов установлено, что при всех исследованных дозах нарушения происходят в стволовых клетках и сперматогониях, с увеличением дозы облучения отмечается достаточно высокая поражаемость сперматид и сперматозоидов.
Постимплантационная гибель плодов, отражающая уровень доминантных леталей в более поздние сроки, достоверно превышает контрольные значения при воздействии облучения в дозе 1,0 Гр на стадиях сперматозоидов, сперматид и сперматоцитов (табл. 2).
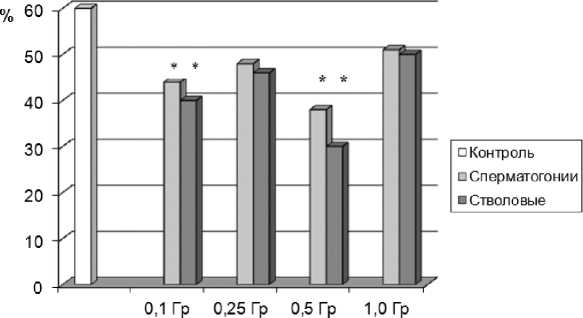
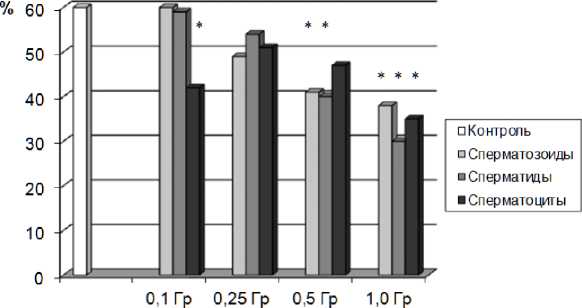
Интегральным показателем доминантных леталей в потомстве облучённых самцов служит число живых плодов, которое достоверно снижается после облучения самцов в дозе 0,1 Гр, половые клетки которых в момент облучения находились на стадиях сперматоцитов, спермато-гониев и стволовых клеток, что соответствует высокой преимплантационной гибели (табл. 2). Число плодов у облучённых самцов в дозах 0,5 и 1,0 Гр в основном повторяло закономерности, характеризующие последствия облучения половых клеток на разных стадиях сперматогенеза по показателям эмбриональной смертности. Следует отметить, что облучение сперматогониев и сперматоцитов в дозе 0,25 Гр, сперматоцитов в дозе 0,5 Гр и сперматогониев в дозе 1,0 Гр не влияет на число плодов. Данный факт, возможно, обусловлен селективной гибелью наиболее радиочувствительных и мутабильных клеток в гетерогенной популяции сперматогониев. Что касается сперматоцитов, то на разных стадиях мейоза они обладают неодинаковой мутабиль-ностью и по частоте возникновения хромосомных нарушений наиболее радиочувствительными являются стадии диплотены и диакинеза [18]. В нашем случае, возможно, облучению подвергались сперматоциты, находящиеся на менее радиочувствительных стадиях, – прелептонемы и лептонемы. Показатель внутриутробной выживаемости плодов потомства 1 поколения соответствует данным, полученным в результате анализа эмбриональных потерь у облучённых самцов на разных стадиях сперматогенеза (рис. 2, 3).
Доза
Рис. 2. Показатель внутриутробной выживаемости плодов потомства I поколения самцов, облучённых на стадиях сперматогониев и стволовых клеток в разных дозах.
Доза
Рис. 3. Показатель внутриутробной выживаемости плодов потомства I-го поколения самцов, облучённых на стадиях сперматозоидов, сперматид и сперматоцитов в разных дозах.
Таким образом, основной вклад в общую эмбриональную смертность вносит доимплан-тационная гибель эмбрионов. Ранние доминантные летали могут возникать за счёт снижения оплодотворяющей способности сперматозоидов, которое может быть обусловлено как генетическими нарушениями, например, аномальной организацией хроматина ядер сперматозоидов, так и изменением морфологических показателей негенетического характера. Снижение жизнеспособности сперматогенных клеток может быть следствием фрагментации ДНК. В дифференцирующихся половых клетках семенников при незавершённом процессе апоптоза нередко отмечается фрагментация ДНК [19]. В связи с этим снижение жизнеспособности сперматозоидов вполне возможно является следствием повышенного уровня фрагментации ДНК в сперматозоидах, который негативно отражаются на мужской фертильности и процессах оплодотворения. Поздние летали – результат мутагенного эффекта на сперматогенный эпителий. Изучение влияния мутагенных воздействий на половые клетки у мыши даёт возможность экстраполяции данных на человека [20]. Выявленный нами высокий уровень доимпллантационных потерь связан с количеством и жизнеспособностью как сперматогенных клеток, так и сперматозоидов. По результатам наших исследований минимальной повреждающей дозой однократного общего гамма-облучения с мощностью дозы 0,85 Гр/мин для семенников является уже доза 0,1 Гр.
Заключение
Выявлена негативная реакция половых клеток на облучение в малых дозах. Показано, что облучение в дозах 0,1 и 0,25 Гр вызывает компенсаторно-защитную реакцию, способствующую поддержанию численности сперматогенных клеток и их жизнеспособности. Наиболее выраженный повреждающий эффект нарушения в половых клетках отмечается при дозах 0,5 и 1,0 Гр. Установлено снижение внутриутробной выживаемости эмбрионов при дозе 0,1 Гр на премейотической стадии сперматогенеза, при дозе 1,0 Гр – на постмейотической. Эмбриональная смертность происходит за счёт гибели плодов до имплантации. Постимплантационная гибель плодов достоверно превышает контрольные значения только при воздействии облучения в дозе 1,0 Гр. Полученные данные свидетельствуют о снижении оплодотворяющей способности сперматозоидов, которое обусловлено генетическими нарушениями. Снижение жизнеспособности половых клеток является следствием фрагментации ДНК. Полученные экспериментальные данные позволяют прогнозировать отдалённые последствия лучевого воздействия в малых дозах на мужскую репродуктивную функцию. Повреждающей дозой однократного общего гамма-облучения мужских гонад в экспериментальных условиях является доза 0,1 Гр.
Список литературы Радиационный риск эмбриональной гибели в различных стадиях развития половых клеток мышей-самцов после низкодозного радиационного облучения
- Никитин А.И. Вредные факторы среды и репродуктивная система человека (ответственность перед будущими поколениями). 2-е издание. СПб: ЭЛБИ-СПб, 2008. 240 с.
- Цыб А.Ф., Каплан М.А., Лепёхин Н.П. Оценка состояния репродуктивной функции участников аварии на ЧАЭС через 13-14 лет после радиационной катастрофы //Радиация и риск. 2002. № 13. С. 42-44.
- Grafström G., Jönsson B.A., El Hassan A.M., Tennvall J., Strand S.E. Rat testis as a radiobiological in vivo model for radionuclides //Radiat. Prot. Dosim. 2006. V. 118, N 1. P. 32-42.
- Monesi V. Relation between x-ray sensitivity and stages of the cell cycle in spermatogonia of the mouse //Radiat. Res. 1962. V. 17, N 6. P. 809-838.
- Hacker U., Schumann J., Gohde W. Mammalian spermatogenesis as a new system for biology dosimetry of ionizing irradiation //Acta Radiol. Oncol. 1982. V. 21, N 5. P. 349-351.
- Krausz C., Escamilla A.R., Chianese C. Genetics of male infertility: from research to clinic //Reproduction. 2015. V. 150, N 5. P. 159-174.
- Russell W.L. The genetic effects of radiation //Peaceful Uses of Atomic Energy. New York, Vienna: IAEA, 1972. V. 13. P. 487-500.
- Alvantic D., Searle F.G. Effects of post-irradiation interval on translocation frequency in male mice //Mutat. Res. 1985. V. 142, N 1-2. P. 65-68.
- Van Alphen M.M.A., Davids J.A.G., Warmer C.J., van de Kant H.J.G., Bootsma A.L., de Rooij D.G. Dose-response studies of monkey spermatogonia stem cells after X-irradiation //Int. J. Radiat. Biol. 1988. V. 54, N 5. P. 851-852.
- Мамина В.П., Семенов Д.И. Метод определения количества сперматогенных клеток семенника в клеточной суспензии //Цитология. 1976. Т. 18, № 3. С. 913-915.
- Мамина В.П. Содержание циклических нуклеотидов в ткани семенника у мышей в зависимости от дозы ионизирующей радиации //Действие малых доз ионизирующих излучений на гонады и плод: сб. докладов Всесоюзной конференции, 22-26 октября 1988 г. Обнинск: НИИМР АМН СССР, 1988. С. 44-45.
- Молнар Е. Общая сперматология: пер. с немецкого Марио Сиза /под ред. И.М. Порудоминского. Будапешт: Академия наук Венгрии, 1969. 294 с.
- Методические указания по изучению эмбриотоксического действия химических веществ при гигиеническом обосновании их ПДК в воде водных объектов. МУ 2926-83. М., 1984.
- Mossman J.L. Deconstructing radiation hormesis //Health Phys. 2001. V. 80, N 2. P. 263-269.
- McLachlan R.I., Wreford N.G., Meachem S.J., De Kretser D.M., Robertson D.M. Effects of testosterone on spermatogenic cell populations in the adult rat //Biol. Reprod. 1994. V. 51, N 5. P. 945-955.
- Liu G., Gong P., Bernstein L.R., Bi Y., Gong S., Cai L. Apoptotic cell death induced by low-dose radiation in male germ cells: hormesis and adaptation //Crit. Rev. Toxicol. 2007. V. 37, N 7. P. 587-605.
- Jaiswal D., Trivedi S., Agrawal N.K., Singh K. Dysregulation of apoptotic pathway candidate genes and proteins in infertile azoospermia patients //Fertil. Steril. 2015. V. 104, N 3. P. 736-743.
- Tsuchida W.S.,•Uchida I.A. Radiation-induced chromosome aberrations in mouse spermatocytes and oocytes //Cytogenet. Cell Genet. 1975, V. 14, N 1. P. 1-8.
- Agarwal A., Said T.M. Role of sperm chromatin abnormalities and DNA damage in male infertility //Hum. Reprod. Update. 2003. V. 9, N 4. P. 331-345.
- Adler I.D. Spermatogenesis and mutagenicity of environmental hazards: extrapolation of genetic risk from mouse to man //Andrologia. 2000. V. 32, N 4-5. P. 233-237.


