Radical prostatectomy and robotic radiosurgery as treatment options for localized prostate cancer
Автор: Kipriyanov Evgeny A., Karnaukh Peter A., Vazhenin Ilya A., Vazhenin Andrey V.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.19, 2020 года.
Бесплатный доступ
Purpose: to compare immediate, short-term and long-term treatment outcomes after radical prostatectomy and robotic radiosurgery in patients with localized prostate cancer. Material and Methods. The study included 2 groups of patients. Group I patients (n=80) underwent radical surgery (nerve-sparing prostatectomy). Group II patients (n=102) underwent KiberKnife stereotactic robotic radiotherapy. Results. Immediate treatment outcomes after both radical prostatectomy and robotic radiosurgery did not demonstrate increased number of postoperative complications and severe radiation-induced injuries. The PSA level decreased and reached a nadir PSA level immediately after radical prostatectomy. After stereotactic radiation therapy, the PSA level decreased gradually every three months, reaching a nadir within a year. In the group of patients receiving CyberKnife treatment, changes in the prostate volume affected the quality of urination, which was confirmed by the assessment of the volume of residual urine. When comparing the quality of urination in treatment groups using the IPSS scale, the values were comparable. No differences in the 1-year disease-free survival rates between groups were found. However, 60 months later, disease free survival rate was higher by 8.2 % in patients treated with radiosurgery than in patients who underwent radical prostatectomy (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Prostate cancer, radical prostatectomy, robotic radiosurgery, kiberknife
Короткий адрес: https://sciup.org/140254052
IDR: 140254052 | УДК: 616.65-006.6-085.849.114-037 | DOI: 10.21294/1814-4861-2020-19-1-50-56
Текст научной статьи Radical prostatectomy and robotic radiosurgery as treatment options for localized prostate cancer
Ежегодно в мире выявляют около 1 млн новых случаев рака предстательной железы (РПЖ) [1, 2]. В структуре заболеваемости злокачественными новообразованиями мужского населения РПЖ занимает второе место [1–3]. Сегодня доступно большое количество лечебных методик, демонстрирующих схожие показатели эффективности у пациентов с локализованным РПЖ [4, 5]. Среди них радикальная простатэктомия, дистанционная лучевая терапия, брахитерапия, роботизированная радиохирургия [3, 6]. Развитие техники и технологии радикальной простатэктомии направлено на повышение выживаемости пациентов, а также на улучшение функциональных результатов, в первую очередь удержания мочи и, что немаловажно, сохранения эректильной функции [3, 5].
В последнее десятилетие отмечается значительный рост числа пациентов, подвергающихся лучевой терапии по поводу РПЖ. С одной стороны, это объясняется созданием нового оборудования для проведения лучевой терапии, способного значительно повысить эффективность облучения при уменьшении частоты и выраженности побочных явлений. Это можно объяснить такими преимуществами ДЛТ, как отсутствие необходи- мости госпитализации в стационар, нахождения в реанимации, изменения обычного уклада жизни пациентов. Интерес представляет и тот факт, что в последнее время все больше пациентов самостоятельно делают выбор в пользу лучевой терапии по сравнению с другими методами. Так, в Японии доля больных РПЖ, которые предпочли лучевую терапию другим видам лечения, в период с 1996 по 1998 г. составляла 5,9 %, с 1999 по 2001 г. – 26,5 %, с 2003 по 2005 г. – 41,4 % (р<0,0001) [2, 4, 5].
На протяжении последних лет идет активное изучение различных режимов фракционирования лучевой терапии. Это стало возможным как благодаря появлению новых данных о радиобиологии опухолевых тканей, так и в связи с совершенствованием методов доставки излучения к органу-мишени с минимальным риском для окружающих структур. Результаты экспериментальных исследований свидетельствуют о том, что клетки РПЖ обладают уникальными радиобиологическими характеристиками [2, 4]. Высказывается предположение о том, что индекс для предстательной железы значительно ниже, чем для прямой кишки и мочевого пузыря, что должно способствовать усилению терапевтического эффекта при использовании меньшего количества фракций с большей дозой излучения [5, 7]. Одним из подтверждений данной гипотезы является эффективность высо-кодозной брахитерапии, при которой применяют такие схемы облучения, как 6 фракций по 7 Гр, 9 фракций по 6 Гр и др., что соответствует дозе в 100 Гр и более, подведенной в режиме стандартного фракционирования.
Подведение столь высоких доз излучения возможно не только методом высокодозной брахитерапии, но и с помощью стереотаксической дистанционной лучевой терапии (СтЛТ). Такая технология подразумевает использование систем постоянного визуального контроля за опухолью с применением рентгенографии с возможностью коррекции в случае смещения опухоли в процессе сеанса облучения, доставку конформных пучков излучения, полностью повторяющих контур опухоли, а также возможность создания значительного градиента снижения дозы по мере удаления от опухоли и приближения к критическим структурам [5, 7].
В мире насчитывается 176 установок «КиберНож», из них 115 находятся в клиниках и центрах США, второе место в этом списке занимает Япония – 19 аппаратов, по 6 установок имеют Китай и Южная Корея, в РФ – 4 установки, во Франции и Италии – по 3 установки. На территории РФ лечение локализованного РПЖ методом стереотаксической лучевой терапии, кроме ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины», проводится в МНИОИ им. П.А. Герцена, клиниках ГБОУ ВПО «Башкирский государственный медицинский университет». Также опубликованы результаты лечения с помощью СтЛТ в «Лечебно-диагностическом центре Международного института биологических систем им. С. Березина» (г. Санкт-Петербург). При медиане наблюдения 24 мес 4-летняя безрецидив-ная выживаемость по уровню простатического специфического антигена (ПСА) составила 95,8 %, медиана надира по уровню ПСА – 0,48 нг/мл. Ранних и поздних нежелательных явлений III–IV степеней не отмечено.
Цель исследования – сравнить непосредственные, ближайшие и отдаленные результаты лечения после радикальной простатэктомии и роботизированной радиохирургии у пациентов с локализованным раком предстательной железы.
Материал и методы
Пациенты, вошедшие в исследование с локализованным верифицированным РПЖ, были разделены на две группы:
– I группа – 80 пациентов после проведенного хирургического лечения (радикальная позадилон-ная нервосберегающая простатэктомия);
– II группа – 102 пациента, которым проведена роботизированная стереотаксическая лучевая терапия на аппарате «КиберНож».
Группы были сопоставимы по основным характеристикам: возрасту, уровню общего ПСА, стадии заболевания, дифференцировке опухоли, объему предстательной железы, критериям шкале IPSS. Средний возраст в I группе – 62,6 ± 4,5 года, во II группе – 67 ± 1,5 года. Распределение по стадиям: в I группе Т2аN0М0 стадия установлена у 53,5 % пациентов, во II группе – у 52 %, Т2вN0М0 стадия – у 46,5 и 48 % больных соответственно. В I группе аденокарцинома предстательной железы с индексом Глисона 6 (3+3) выявлена у 62,5 %, во II группе – у 79 % пациентов, с индексом Глисона 7 (3+4) – у 38,5 и 21 % соответственно.
Результаты
Непосредственные результаты лечения после радикального хирургического лечения: интраоперационный объем кровопотери –340–740 мл, кровотечение в ближайшем послеоперационном периоде – в 1,25 % случаев, осложнения со стороны сердечно-сосудистой системы – в 1,25 %, гнойносептические осложнения – в 1,25 %, частичная несостоятельность уретрального анастомоза – в 3,7 % наблюдениях. Продолжительность послеоперационного периода, в среднем, составила 11 койко-дней. Уретральный катетер удалялся у всех пациентов на 10-е сут после операции. Эффективность удержания мочи после удаления уретрального катетера: полное удержание мочи наблюдалось в 92,5 % случаев, частичное неудержание – в 6,25 %, неудержание мочи – в 1,25 %.
Стереотаксическая лучевая терапия проводилась на аппарате «КиберНож», мощность 6 Мэв. Перед предварительным планированием под ультразвуковым контролем трансректально в ткань предстательной железы устанавливали три рент-генконтрастных маркера. Необходимое расстояние между соседними метками – 20 мм, угол – 15о. После этого создавалась 3D-модель и топометрия органов малого таза: предстательной железы, мочевого пузыря, прямой кишки. Лучевое лечение проводили в режиме гипофракционирования, РОД составляла 7 Гр до СОД 35 Гр.
При оценке непосредственных результатов стереотаксической лучевой терапии отмечены следующие нежелательные явления: лучевой цистит I ст. – в 9,8 %, лучевой цистит II ст. – в 2,9 %, лучевой ректит I ст. – в 2,9 %, лучевой ректит II ст. – в 2,9 % случаев.
Ближайшие результаты в группах оценены по следующим характеристикам: динамике изменения уровня общего ПСА, объему предстательной железы (в группе пациентов после лучевой терапии), оценке качества мочеиспускания (количеству остаточной мочи, шкалы IPSS), исследовано качество эректильной функции по шкале МИЭФ-5. В I группе исходный уровень ПСА составил 8,8 нг/мл, после операции значение онкомаркера не превышало 0,003 нг/мл. Во II группе уровень ПСА до лечения в среднем составлял 10 нг/мл. Через 3 мес после СтЛТ этот показатель снизился до 4,3 нг/мл; через 6 мес – до 2,1 нг/мл, через 9 мес – до 1,5 нг/мл, через год после лечения значение ПСА составило 0,8 нг/мл (рис. 1).
Перед проведением хирургического лечения (I группа) объем предстательной железы не превышал в среднем 35 см3. До начала радиохирургии (II группа), объем предстательной железы в среднем составлял 45 см3. Через 3 мес после СтЛТ объем железы не изменился, через 6 и 9 мес объем предстательной железы уменьшился до 34 см3. Через 12 мес объем простаты составлял 37 см3 (рис. 2).
Перед проведением стереотаксической лучевой терапии объем остаточной мочи не превышал
40 мл. Через 3 мес количество остаточной мочи составило 50 мл, через 6 мес – 48 мл, через 9 мес – 50 мл. Через год после проведенного лечения объем остаточной мочи составил 36 мл (рис. 3). Всем пациентам II группы после лучевого лечения для уменьшения инфравезиальной обструкции назначались альфа-блокаторы.
В I группе у пациентов до операции сумма баллов по шкале IPSS в среднем составляла 9,2. Через 3 мес после операции этот показатель равнялся 13 баллам; через 6 мес – 12 баллам; через 9 и 12 мес количество баллов по шкале IPSS не превышало 11.
До стереотаксической лучевой терапии у пациентов II группы сумма баллов по шкале IPSS
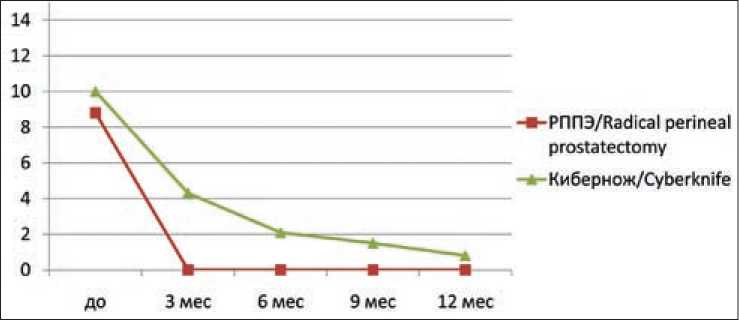
Рис.1. Динамика изменения показателя общего ПСА Fig. 1. Changes in the total PSA level
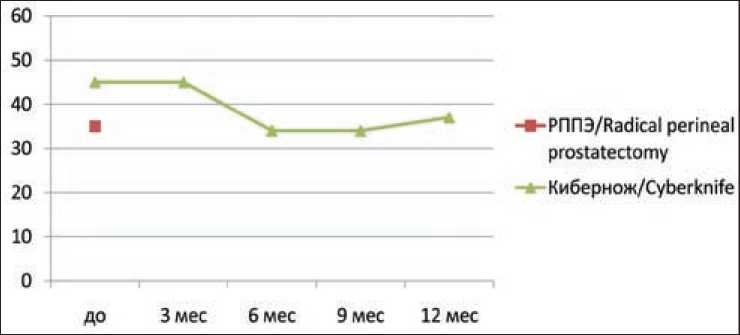
Рис. 2. Динамика изменения объема предстательной железы
Fig. 2. Changes in prostate volume
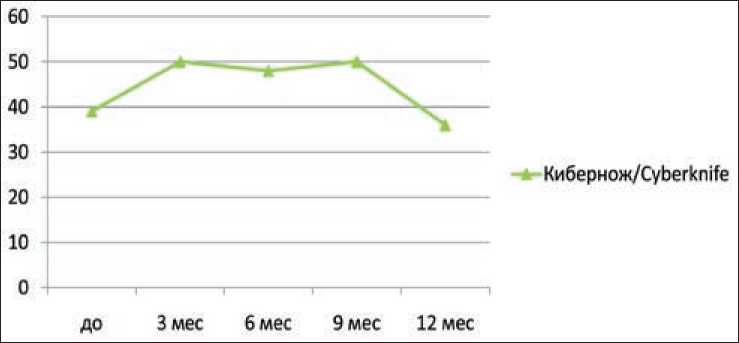
Рис. 3. Динамика изменения объема остаточной мочи после стереотаксической лучевой терапии
Fig. 3. Changes in residual urine volume after stereotactic radiation therapy
составляла 8,5. Через 3 мес после СтЛТ этот показатель увеличился до 12. Через 6 мес значение IPSS – 8,1 балла. Через 9 мес количество баллов по шкале IPSS уменьшилось до 7,5. Через год уровень IPSS не превышал 8 баллов (рис. 4).
Качество эректильной функции оценивалось по шкале МИЭФ-5. В I группе до лечения пациентов со значительной эректильной дисфункцией (5–10 баллов) было 19,5 %, без эректильной дисфункции (21–25 баллов) – 51,2 %. Во II группе до радиохирургии доля пациентов без нарушений эректильной функции составляла 23 %, со значительной эректильной дисфункцией – 37,1 %. У остальных пациентов наблюдалось нарушение эректильной функции различной степени выраженности.
После хирургического лечения (I группа) количество пациентов без эректильной дисфункции снизилось до 4,8 %, тогда как с выраженной дисфункцией увеличилось до 60,9 %. Во II группе эти показатели составили 14 и 51,4 % соответственно.
Отдаленные результаты после лечения оценены сравнением пятилетней безрецидивной (ПСА-рецидив), а также онкоспецифической выживаемости пациентов. В I группе после радикальной простатэктомии безрецидивная одногодичная выживаемость составила 97,5 %, 5-летняя – 80 %. Во II группе после СтЛТ – 100 и 88,2 % соответственно (рис. 5). Онкоспецифическая одногодичная выживаемость в обеих группах равнялась 100 %,
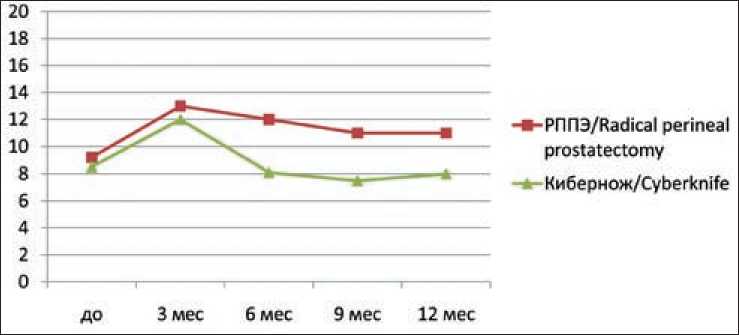
Рис. 4. Оценка по шкале IPSS Fig. 4. IPSS score
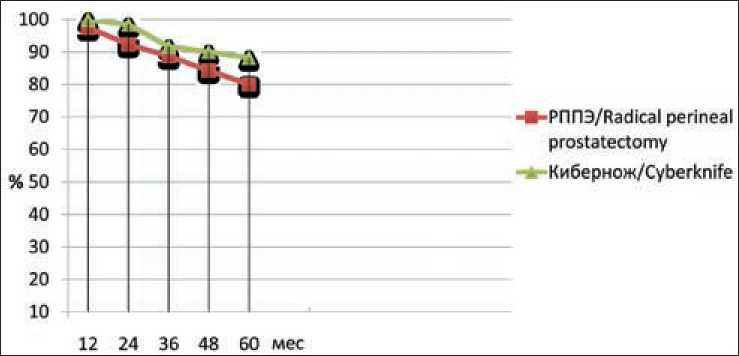
Рис. 5. Показатели 5-летней безрецидивной выживаемости в группах (ПСА-рецидив) Fig. 5. Disease-free survival rates in patient groups (PSA recurrence)
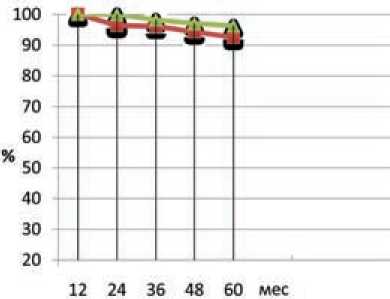
-•-РППЭ/Radical perineal prostatectomy
Кибернож/Cyberknife
Рис. 6. Показатели онкоспецифической выживаемости Fig. 6. Cancer-specific survival rates
5-летняя онкоспецифическая выживаемость после простатэктомии составила 92,5 %, после лечения на аппарате «КиберНож» – 96,3 % (рис. 6).
Обсуждение
Представленные методы радикального лечения являются безопасными и эффективными. Непосредственные результаты лечения как после оперативного вмешательства, так и после радиохирургии не сопровождаются значительным количеством побочных послеоперационных или лучевых реакций. При планировании лечения у пациентов с низким и средним риском прогрессирования, при отсутствии выраженной симптоматики со стороны нижних мочевых путей и объеме предстательной железы не более 40–50 см3, данные методики могут быть альтернативой друг другу. При этом радикальное хирургическое лечение выполняется только в условиях круглосуточного стационара, тогда как стереотаксическую лучевую терапию можно проводить и амбулаторно.
После радикальной простатэктомии уровень ПСА уменьшается, достигая надира сразу после лечения. После стереотаксической лучевой терапии уровень ПСА уменьшается постепенно, достигая
Список литературы Radical prostatectomy and robotic radiosurgery as treatment options for localized prostate cancer
- Важенин А.В., Карнаух П.А. Эпидемиология рака предстательной железы в Челябинской области. Паллиативная медицина и реабилитация. 2008; 2: 26-28.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). М., 2017. 250 с.
- Гришина Ю.А., Хмелевский Е.В. Лучевая терапия локальных рецидивов рака предстательной железы после радикальной простатэктомии. Вопросы онкологии. 2015; 61(1): 7-13.
- Hegemann N.S., Guckenberger M., Belka C., Ganswindt U., Manapov F., Li M. Hypopofractionated radiotherapy for prostate cancer. Radiat Oncol. 2014 Dec 6; 9: 275. DOI: 10.1186/s13014-014-0275-6
- Pedicini H., Strigari L., Benassi M. Estimation of a self of radio-biological parameters from hypofractionated versus standartd radiation therapy of prostate cancer. Int J Radiat Oncol Biol Phys. 2013 Apr 1; 85(5): e231-7. DOI: 10.1016/j.ijrobp.2012.11.033
- Sanfilippo N.J., Cooper B.T. Hypofractionated radiation therapy for prostate cancer: biologic and technical considerations. Am J Clin Exp Urol. 2014 Dec 25; 2(4): 286-93.
- Katz A.J., Kang J. Stereotactic body radiotherapy as treatment for organ confined low- and intermediate-risk prostate carcinoma, a 7-year study. Front Oncol. 2014 Sep 2; 4: 240. DOI: 10.3389/fonc.2014.00240


