Радиомодифицирующие свойства бутилгидрокситолуола на примере Drosophila melanogaster
Автор: Е.А. Юшкова
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Статья в выпуске: 7 (83), 2025 года.
Бесплатный доступ
В экспериментах на Drosophila melanogaster проведена оценка радиомодифицирующего действия бутилгидрокситолуола (БГТ) путем исследования уровня повреждений ДНК и выживаемости у линии дикого типа Canton-S и мутантов по sod-генам. Установлено, что введение в диету дрозофил БГТ может вызвать снижение чувствительности к хроническому γ-излучению разной интенсивности (0,42 и 40,3 мГр/ч). У особей с нормальным функционированием генов (Canton-S), развивающихся в условиях хронического облучения, БГТ в концентрациях выше 1 мкМ благоприятно влияет на цитогенетический показатель (снижая его уровень при мощностях дозы 0,42 и 40,3 мГр/ч) и продолжительность жизни (увеличивая ее параметры при мощности дозы 0,42 мГр/ч). Обнаружено специфическое влияние БГТ на генотипы с низкой активностью цитоплазматической (sod[n1]/+) и митохондриальной (sod[delta02]/+) супероксиддисмутазы. По показателям “повреждения ДНК” и “выживаемость” наиболее выраженный радиопротекторный эффект БГТ был отмечен у животных линии sod[n1]/+. Этот эффект зафиксирован при концентрациях вещества, превышающих 10 мкМ, и всех мощностях облучения. У особей линии sod[delta02]/+ противолучевое действие БГТ выявлено в концентрациях 10-20 мкМ (на уровень повреждений ДНК) и 100 мкМ (на продолжительность жизни). Комбинация БГТ и хронического облучения имеет преимущественно антагонистический (у всех генотипов), реже синергический/аддитивный (у sod-мутантов) характер. Данный препарат в зависимости от концентрации способен уменьшать повреждения ДНК и увеличивать продолжительность жизни у особей определенного генотипа, что указывает на его способность замедлять процессы старения. Таким образом, экспериментальные данные указывают на то, что введение БГТ в диету дрозофил может оказывать радиопротекторное действие, адаптируя организм к хроническому γ-излучению, и влияние этого эффекта зависит от генетического фона животных, особенно уровня активности соответствующих sod-генов.
Дрозофила, γ-излучение, бутилгидрокситолуол, ДНК-разрывы, продолжительность жизни, антиоксидантная система, мутации в sod-генах
Короткий адрес: https://sciup.org/149149444
IDR: 149149444 | УДК: 575.167:57.04/57.017.3 | DOI: 10.19110/1994-5655-2025-7-25-34
Текст научной статьи Радиомодифицирующие свойства бутилгидрокситолуола на примере Drosophila melanogaster
Большое число популяций организмов, а также человек испытывают постоянное повышенное радиационное воздействие благодаря естественному и техногенному (вследствие развития ядерной энергетики, испытания ядерного оружия, аварий на объектах радиационной промышленности, растущего количества радиоактивных отходов) радиационному фону. Для человека риск радиационного поражения возрастает при применении ионизирующих излучений в лучевой диагностике и радиотерапии злокачественных опухолей. Накоплено много данных, свидетельствующих о том, что облучение индуцирует нестабильность генома, на фоне которого возникают различные типы повреждений ДНК, мутации, хромосомные аберрации и др. [1]. На сегодняшний день отсутствуют универсальные противолучевые средства, способные уменьшить поражающее действие облучения во всех диапазонах доз. Данный факт связан с различными биохимическими и молекулярно-генетическими механизмами, которые участвуют в формировании последствий воздействия ионизирующей радиации на организм [2, 3]. Важную роль в радиозащите клеток играет активация антиоксидантной системы, направленная на подавление свободных радикалов и последующего окислительного стресса [3].
Известно, что синтетические соединения обладают ра-диопротекторными свойствами по отношению к влиянию ионизирующего излучения в сублетальных и летальных дозах. В то время как вещества природного происхождения оказывают противолучевой эффект при низкоинтенсивном облучении [там же]. Поиск химических средств, повышающих радиорезистентность организма в условиях хронического облучения в малых дозах, в настоящее время становится все более актуальным в связи с широким использованием радиационных источников в клинической практике и повседневной деятельности человека. С этой целью активно ведутся разработка и апробация новых полусинтетических и синтетических антиоксидантов с низкой токсичностью, потенциально обладающих радиозащитным действием.
Бутилгидрокситолуол (БГТ, Butylhydroxytoluene (BHT)), одобренный FDA (Food and Drug Administration, США) широко используется в качестве консерванта в пищевой промышленности [4]. Это синтетическое вещество хорошо известно в клинических и биологических исследованиях как сильный антиоксидант, агент с противоканцерогенными, антинекротическими, противовирусными и антимикробными свойствами [5-7]. Данные свойства БГТ проявляются только при его воздействии на организм в небольших концентрациях [8]. Бутилгидрокситолуол в высоких концентрациях может вызвать выраженный цитотоксический эффект, нарушения эндокринной системы, гемолиз, репродуктивную токсичность и рак [5, 7]. Есть сведения, демонстрирующие его радиопротекторный потенциал у разных модельных животных, подвергшихся острому облучению [9, 10]. Роль БГТ в модификации эффектов хронического облучения разной интенсивности не изучена. Кроме того, неясно, способен ли БГТ компенсировать дефицит есте- ственных антиоксидантов организма в заданных условиях облучения.
Цель работы – оценить радиомодифицирующие свойства бутилгидрокситолуола путем исследования интегральных показателей выживаемости хронически облученных особей Drosophila melanogaster с низким уровнем ферментов антиоксидантной системы.
Материалы и методы
Линии Drosophila melanogaster . В качестве экспериментального материала были использованы линия дикого типа Canton-S и линии, характеризующиеся низким уровнем синтеза цитоплазматической Cu/Zn - (#4015, sod[n1]/+ , генотип: Sod[n1]red[1]/TM3,Sb[1]Ser[1]) и митохондриальной Mn- ( #27643, sod[delta02]/+ , генотип: y[1]w[*];Sod2[Delta02]/ CyO ) супероксиддисмутазы [11]. Данные линии получены из крупного зарубежного коллекционного центра (Блумингтон, США).
Методы. Биологическая эффективность бутилгидрокситолуола (2,6-ди-трет-бутил-4-метилфенол, ООО «БиоМир», Россия) была оценена критериями, определяющими продолжительность жизни и уровень повреждений ДНК (методом «ДНК-комет» в нейтральной версии рН). Анализ средней, медианной и максимальной продолжительности жизни был проведен на имаго самцов (не более 20 особей на пробирку, 300 особей на вариант), отобранных в течение суток после вылета и помещенных на обедненную сахароагаровую среду [12]. Самцы были пересажены на свежий корм дважды в неделю. Подсчет числа умерших особей был произведен ежедневно (кроме субботы и воскресенья). Полученные результаты были оформлены в виде кривых выживания и статистически обработаны с помощью лог-рангового теста. Значимость различий в средней, медианной и максимальной продолжительности жизни была рассчитана с использованием тестов Флеминга-Харингтона и Ванга-Аллисона с поправкой Бонферрони в онлайн-приложении OASIS 2 (https://sbi. [13].
Уровень повреждений ДНК был исследован в клетках нервных ганглиев (нейробластах) личинок третьего возраста [14]. Получение препаратов с нуклеоидами и их визуальная обработка подробно описаны в работе [15]. Статистическая значимость различий в значениях ОТМ (Olive tail moment – момент «хвоста кометы» по П. Л. Оливе) была определена по t-критерию Стьюдента.
Обработка БГТ. Бутилгидрокситолуол, растворенный в 96%-ном этаноле, в разных концентрациях (1, 10, 20 и 100 мкМ) был добавлен (по 30 мкл) на питательную (дрожжевую, сахарно-манковую) среду. В каждую пробирку со средой с БГТ и без (контроль, включающий только 96%-ный этанол) были помещены родительские формы исследуемых линий дрозофилы для получения кладок с эмбрионами. Обработка БГТ была проведена на чувствительных к различным воздействиям стадиях предимагинального развития дрозофил, когда происходит интенсивная пролиферация и дифференциация клеток организма. Для оценки цитогенетического показателя время экспозиции БГТ для всех концентраций составило 5 сут (стадии «эмбрион» – «личинка третьего возраста»), для анализа выживаемости – 12 сут (стадии «эмбрион» – «имаго»). Все экспериментальные культуры дрозофилы содержали в стандартных условиях: при температуре +23° С ± 0,1 и 12-часовом режиме освещения.
Условия облучения. Особи на предимагинальных стадиях были подвергнуты хроническому облучению в разных мощностях экспозиционной дозы (0,42 и 40,3 мГр/ч). Накопленные дозы составили 0,05, 0,12 и 4,8 Гр. Источником γ -излучения служил 226Ra (56 мГр/ч).
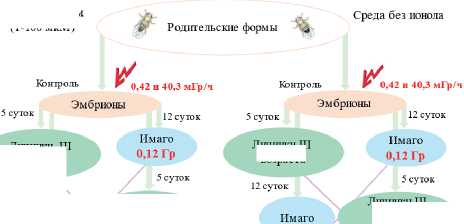
Дизайн эксперимента, включающий подробное описание особенностей обработки БГТ и условий облучения с указанием исследуемых стадий животных и показателей, представлен на рис. 1. Эксперимент был проведен в трех независимых биологических повторностях.
Среда с ионолом (1-100 мкМ)
возраста
Личинки 111
возраста
12 суток
Личинки III
Личинки 111
Имаго
Выживаемость
Выживаемость возраста 0,05 и 4,8 Гр возраста 0,05 и 4,8 Гр
Повреждения ДНК
Повреждения ДНК
Рисунок 1. Дизайн эксперимента, включающий подробное описание особенностей обработки БГТ и условий облучения с указанием исследуемых стадий животных и показателей.
Figure 1. Experimental design including a detailed description of BHT treatment and irradiation conditions, indicating the development stages of animals and parameters studied.
Личинки Ш
Коэффициенты взаимодействия БГТ и облучения. Оценка реакций животных на совместное действие ионизирующего излучения и БГТ в разных концентрациях была проведена с использованием коэффициентов взаимодействия (Kw), которые были рассчитаны по формуле: Kw = ДА(Х; У)/ Д Л(0; У) + А(Х;0), где ДЛ(Х;У) = Л(Х;У)-Л(0;0) – превышение совместного влияния факторов X (препарат) и Y (облучение) по сравнению с контролем; ДЛ(0;У) + А(Х;0) – сумма превышения эффектов при раздельном воздействии исследуемых факторов [16].
Результаты и их обсуждение
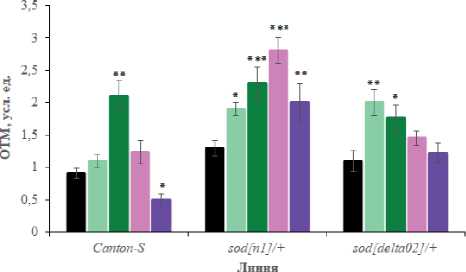
Оценка уровня повреждений ДНК. Показано, что раствор БГТ без облучения оказывает генотоксическое действие в концентрациях 1-10 мкМ (у линии sod[delta02]/+ ), 10 мкМ (у линии Canton-S ) и 1-100 мкМ (у линии sod[n1]/+ ) (рис. 2). У линий Canton-S и sod[delta02]/+ препарат в более высоких концентрациях (выше 20 мкМ) либо не влиял на цитогенетический параметр, либо значимо (р<0,05) снижал его уровень (у особей Canton-S ). Это свидетельствует о положительной эффективности БГТ в концентрациях, превышающих 20 мкМ при фоновых значениях радиации.
В отсутствии влияния БГТ хроническое облучение мощностью 40,3 мГр/ч приводит к увеличению (р<0,05)
повреждений ДНК у особей с дисфункцией sod -генов (рис. 3). У линии дикого типа Canton-S не обнаружено цитогенетического эффекта облучения, но при включении в диету БГТ характер реакции особей в ответ на облучение зависел от концентрации внесенного вещества и накопленной дозы γ -излучения (в единственном случае). У данного генотипа БГТ проявил радиопротекторные свойства при концентрациях 10-20 мкМ (р<0,01), снижая количество клеток с поврежденной ДНК. В то время как при концентрации 100 мкМ препарат усиливал (р<0,01) только действие хронического облучения мощностью 40,3 мГр/ч. Значимость наблюдаемых эффектов была получена при сравнении средних значений ОТМ между облученными особями, в чью диету входил БГТ, и особями, развивающимися в условиях раздельного действия изучаемых факторов («Контроль+облучение» или «Концентрация»). У линии sod[n1]/+ с низким синтезом цитоплазматической супероксиддисмутазы БГТ повлиял на формирование ра-диорезистентных признаков у облученных животных при воздействии всех концентраций вещества и накопленных доз γ-излучения (р<0,05-0,001). Так, уровень повреждений ДНК в клетках нервных ганглиев особей, испытывающих одновременное действие БГТ и облучения, оказался ниже уровня разрывов ДНК в нейробластах личинок, подвергавшихся либо действию БГТ, либо ионизирующему излучению. Напротив, у особей линии sod[delta02]/+ противолучевой эффект (р<0,05 и р<0,001) БГТ был обнаружен в концентрациях 1-20 мкМ и при хроническом низкоинтенсивном облучении (0,42 мГр/ч). У этого же генотипа БГТ в концентрациях 20-100 мкМ способен повышать (р<0,05) радиочувствительность особей, содержащихся при воздействии хронического облучения более высокой интенсивности (40,3 мГр/ч).
Оценка влияния БГТ на радиационно-индуцированные генетические нарушения у дрозофилы была изучена в работе [9], в которой описаны и проанализированы противоречивые результаты воздействия БГТ на половые клетки дрозофил мужского пола, подвергшиеся острому облучению. Показано, что радиозащитные эффекты БГТ наблюдались только на уровне рецессивных сцепленных
■Контроль И1мкМ ВЮмкМ ЯЗОмкМ ЦООмШ
Рисунок 2. Влияние БГТ в разной концентрации на уровень повреждений ДНК в клетках нервных ганглиев D. melanogaster .
Условные обозначения. *р<0,05; **р<0,01; ***р<0,001 – по сравнению с контролем.
Figure 2. Effect of BHT in different concentrations on the level of DNA damage in D. melanogaster nerve ganglion cells.
Keys. *p<0.05; **p<0.01; ***p<0.001 – compared to the control.
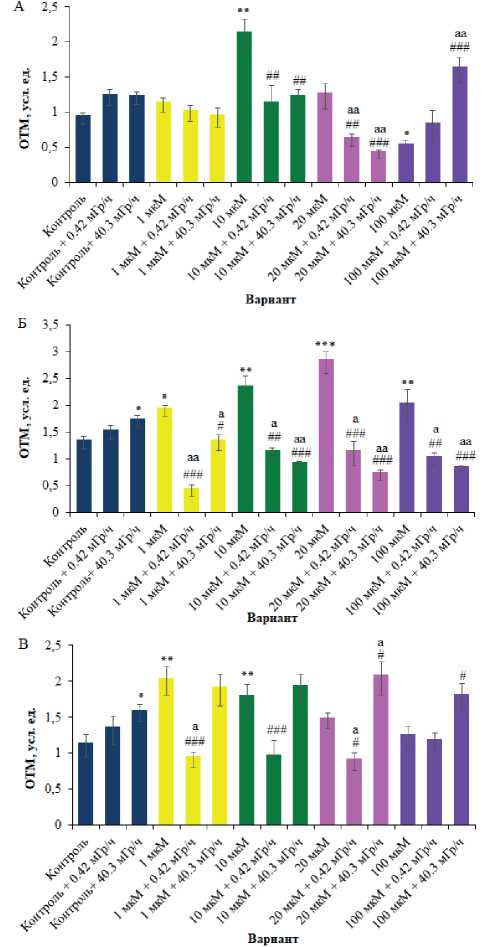
Рисунок 3. Уровень повреждений ДНК в клетках нервных ганглиев линий Canton-S (А), sod[n1]/+ (Б) и sod[delta02]/+ (В) после лечения БГТ и хронического облучения.
Условные обозначения. *р<0,05; **р<0,01; ***р<0,001 – по сравнению с контролем; #р<0,05; ##р<0,01; ###р<0,001 – между необлученными и облученными вариантами в соответствующих концентрации и мощности облучения; а р<0,05; аа р<0,01 – между облученным вариантом без БГТ («Контроль+0,42 мГр/ч» или «Контроль+40,3 мГр/ч») и облученным вариантом в соответствующей концентрации и мощности облучения.
Figure 3. The level of DNA damage in the nerve ganglion cells of the Canton-S (A), sod[n1]/+ (Б) and sod[delta02]/+ (В) strains after treatment with BHT and chronic irradiation.
Keys. *p<0.05; **p<0.01; ***p<0.001 – compared with the control; #p<0.05; ##p<0.01; ###p<0.001 – between non-irradiated and irradiated variants at the corresponding concentration and irradiation power; a p<0.05; aa p<0.01 – between the irradiated variant without BHT ("Control+0.42 mGy/h" or "Control+40.3 mGy/h") and the irradiated variant at the corresponding concentration and irradiation power.
с полом мутаций и транслокаций. По другим нарушениям генетического материала, включающим доминантные летальные мутации, аутосомно-рецессивные летали и потерю Х-хромосомы, препарат оказывал радиосенсибилизирующее действие. Настоящее исследование рассматривает цитогенетические эффекты БГТ на уровне соматического генома, что позволило более целостно оценить влияние препарата и интерпретировать полученные сведения относительно организма в целом. В большинстве случаев данные продемонстрировали снижение частоты повреждений ДНК в соматических клетках облученных животных, коррелирующее с повышенной их выживаемостью.
Оценка продолжительности жизни. У Canton-S по сравнению с контролем БГТ либо снижает параметры выживаемости, либо не влияет на них (рис. 4 А). Сравнение
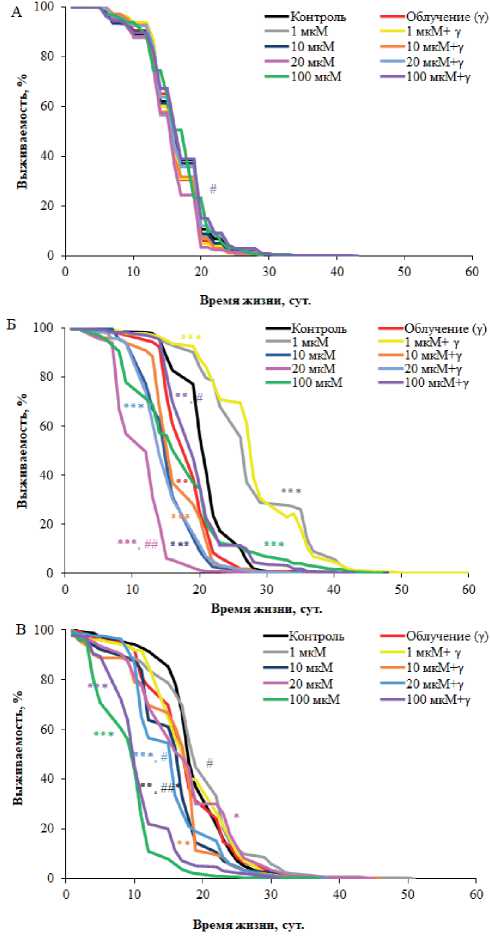
Рисунок 4. Кривые выживания самцов линий Canton-S (А), sod[n1] /+ (Б) и sod[delta02]/+ (В) после лечения БГТ и хронического низкоинтенсивного облучения (0,42 мГр/ч).
Условные обозначения. *р<0,05; **р<0,01; ***р<0,001 – по сравнению с контролем; #р<0,05; ##р<0,01 – между необлученными и облученными вариантами в соответствующей концентрации.
Figure 4. Survival curves of males of the Canton-S (A), sod[n1]/+ (Б) and sod[delta02]/+ (В) strains after treatment with BHT and chronic low-intensity irradiation (0.42 mGy/h).
Keys. *p<0.05; **p<0.01; ***p<0.001 – compared with the control; #p<0.05;
##p<0.01 – between non-irradiated and irradiated variants at the corresponding concentration.
Таблица 1
Продолжительность жизни самцов D. melanogaster после воздействия БГТ и хронического облучения мощностью 0,42 мГр/ч
Table 1
Lifespan of D. melanogaster males after exposure to BHT and chronic irradiation at a rate of 0.42 mGy/h
|
Линия |
УЭ |
Параметры продолжительности жизни |
|||||
|
М±SE |
∆М |
50 % |
∆50 % |
90 % |
∆90 % |
||
|
Контроль |
16,6 ± 0,3 |
Н |
16 |
Н |
22 |
Н |
|
|
Облучение (γ) |
16,2 ± 0,2 |
-2,4 |
16 |
0 |
21 |
-4,5 |
|
|
1 мкМ |
16,4 ± 0,2 |
-1,2 |
16 |
0 |
21 |
-4,5 |
|
|
1 мкМ + γ |
16,3 ± 0,2 |
-1,8 |
16 |
0 |
21 |
-4,5 |
|
|
Canton-S |
10 мкМ 10 мкМ + γ |
16,5 ± 0,3 16,2 ± 0,2 |
-0,6 -2,4 |
17 16 |
+6,2 0 |
21 21 |
-4,5 -4,5 |
|
20 мкМ |
15,7 ± 0,3 |
-5,4 |
16 |
0 |
20 |
-9,1* |
|
|
20 мкМ + γ |
16,8 ± 0,2 |
+1,2 |
16 |
0 |
22# |
0 |
|
|
100 мкМ |
17,1 ± 0,3 |
+3,0 |
19 |
+18,7* |
21 |
-4,5 |
|
|
100 мкМ + γ |
17,0 ± 0,3 |
+2,4 |
17# |
-6,2 |
22 |
0 |
|
|
Контроль |
22,8 ± 0,4 |
Н |
25 |
Н |
31 |
Н |
|
|
Облучение (γ) |
20,2 ± 0,4 |
-11,4* |
22 |
-12,0 |
25 |
-24,0* |
|
|
1 мкМ |
20.9 ± 0,7 |
-8,3 |
30 |
+20,0* |
36 |
+16,1* |
|
|
1 мкМ + γ |
27,6 ± 0,5# |
+20,0* |
21# |
-16,0* |
31# |
0 |
|
|
sod[n1]/+ |
10 мкМ |
19,3 ± 0,4 |
-15,3* |
17 |
-32,0* |
30 |
-3,2 |
|
10 мкМ + γ |
18,9 ± 0,5 |
-17,1* |
18 |
-28,0* |
30 |
-3,2 |
|
|
20 мкМ |
16,4 ± 0,2 |
-28,1* |
16 |
-36,0* |
21 |
-32,2* |
|
|
20 мкМ + γ |
18,9 ± 0,5# |
-17,1* |
17 |
-32,0* |
30# |
-3,2 |
|
|
100 мкМ |
21,6 ± 0,5 |
-5,2 |
21 |
-16,0* |
31 |
0 |
|
|
100 мкМ + γ |
23,8 ± 0,5 |
+4,4 |
25# |
0 |
35 |
+12,9 |
|
|
Контроль |
24,5 ± 0,3 |
Н |
25 |
Н |
31 |
Н |
|
|
Облучение (γ) |
23,8 ± 0,4 |
-2,8 |
24 |
-4,0 |
31 |
0 |
|
|
1 мкМ |
24,2 ± 0,4 |
-1,2 |
25 |
0 |
30 |
-3,2 |
|
|
1 мкМ + γ |
23,4 ± 0,4 |
-4,5 |
25 |
0 |
30 |
-3,2 |
|
|
sod[delta02]/+ |
10 мкМ 10 мкМ + γ |
21,2 ± 0,4 22,9 ± 0,3 |
-13,4 -6,5 |
24 24 |
-4,0 -4,0 |
30 30 |
-3,2 -3,2 |
|
20 мкМ |
22,4 ± 0,4 |
-8,6 |
23 |
-8,0 |
30 |
-3,2 |
|
|
20 мкМ + γ |
20,8 ± 0,3 |
-15,1* |
23 |
-8,0* |
30 |
-3,2 |
|
|
100 мкМ |
18,3 ± 0,5 |
-25,3* |
18 |
-28,0* |
29 |
-6,4 |
|
|
100 мкМ + γ |
20,5 ± 0,3# |
-16,3* |
23# |
-8,0* |
29 |
-6,4 |
|
Условные обозначения. УЭ – условия эксперимента; М ± SE – средняя продолжительность жизни (дни) ± стандартная ошибка (SE); 50 % – медианная продолжительность жизни; 90 % – возраст 90 % смертности (дни); ∆М и ∆50 % – различия в средней и медианной продолжительности жизни по сравнению с контролем; ∆90 % – различия в возрасте наступления 90 % смертности по сравнению с контролем; *р<0,05–0,0001 – по сравнению с контролем; #р<0,05–0,0001 – между необлученными и облученными вариантами в соответствующей концентрации; Н – не применимо.
Keys. УЭ – experimental conditions; M ± SE – mean lifespan (days) ± standard error (SE); 50 % – median lifespan; 90 % – age at 90 % mortality (days); ∆M and ∆50 % – differences in mean and median lifespan compared to the control; ∆90 % – differences in age at 90 % mortality compared to the control; *p<0.05–0.0001 – compared to the control; #p<0.05–0.0001 – between non-irradiated and irradiated variants at the corresponding concentration; H – not applicable.
симальной ПЖ на 6,2 и 42,8 % (при 20 мкМ), 19 и 12,9 (при 100 мкМ) % соответственно. У sod[delta02]/ + БГТ снижает ПЖ по сравнению с контролем (р<0,05–0,0001). При облучении БГТ способен повысить среднюю и медианную ПЖ особей этого генотипа на 12 и 27,8 % (р<0,05–0,0001).
Следует отметить, что БГТ способен увеличивать продолжительность жизни у линий Canton-S и sod[n1]/ + на 18,7 % (медианная, в концентрации 100 мкМ) и 16,1 % (максимальная, в концентрации 1 мкМ) соответственно. Это указывает на его потенциальные геропротекторные свойства, что согласуется с некоторыми данными исследований, демонстрирующими увеличение продолжительности жизни мышей и дрозофил [17, 18].
На сегодняшний день известны противоречивые факты действия БГТ относительно острого облучения. С одной стороны, БГТ оказывает радиосенсибилизирующее действие, вызывая высокую смертность мышей, подвергшихся воздействию рентгеновских лучей в острой дозе 7,25 Гр [19]. С другой – действует как радиопротектор у дрожжей при γ-излуче-нии в повреждающих дозах 100 и 400 Гр [10]. Как показали представленные в этой статье результаты, БГТ способен влиять на формирование радиорезистентных признаков у хронически облученных дрозофил, но данное его свойство сильно зависит от концентрации вещества и исходного уровня ферментов антиоксидантной системы восстановления в организме. Предположительно, такое радиопротекторное действие БГТ является следствием его способности к детоксикации свободных радикалов, особенно в случаях, когда наблюдается дефицит естественных ферментных систем необлученных и облученных вариантов этого генотипа после обработки БГТ в концентрации 20 мкМ показало увеличение средней и максимальной ПЖ на 10 и 7 % соответственно (р<0,05-0,0001). Обратная реакция наблюдается при концентрации 100 мкМ, при которой БГТ снижает медианную ПЖ на 10,5 % (р<0,01). У sod[n1]/+ БГТ вызвал в основном отрицательный эффект на выживаемость по сравнению с контролем (р<0,05–0,0001) (табл. 1, рис. 4). Исключение составляет его действие при концентрации 1 мкМ, увеличивающее медианную и максимальную ПЖ на 20 и 16 % соответственно (р<0,001). Хроническое низкоинтенсивное облучение (0,42 мГр/ч) негативно повлияло на ПЖ самцов, снижая их ПЖ на 11,4 (средняя), 12 (медианная) и 24 (максимальная) %. В условиях облучения БГТ проявил себя как радиопротектор, увеличивая параметры средней ПЖ на 32 (при 1 мкМ), 15,2 (при 20 мкМ) и 10,2 (при 100 мкМ) % (р<0,05–0,0001), параметры медианной и мак- антиоксидантной защиты. В пользу данного утверждения имеются сведения литературы, указывающие на то, что БГТ выступает в роли поглотителя свободных радикалов и может выполнять защитные функции, предотвращая химически индуцированные повреждения печени и замедляя процессы старения у животных. Однако БГТ может вызвать токсичность, обусловленную окислительным стрессом, возникающим вследствие селективной потери антиоксидантов, таких как глутатион-S-трансфераза (GSTP1), пероксиредоксин-2 (PRDX2), супероксиддисмута-за1 (Sod1), карбонилредуктаза (NADPH) и бутилированный гидрокситолуолхинонметид (BHT-QM) [7].
Считают, что основной механизм действия БГТ – это предотвращение свободнорадикального окисления [7]. Но есть и другое предположение, в основе которого БГТ рассматривается как ингибитор некоторых форм цитохрома P-450, связываясь с его феррихромом P-450 и вызывая связывание типа I [20]. Существует также мнение, что наблюдаемые эффекты связаны не столько с самим БГТ, сколько с продуктами его метаболизма [9]. Например, после приема БГТ у крыс формируются метаболиты в виде кислоты БГТ, образующейся при окислении кольцевой метильной группы, которая выделяется как в свободном виде, так и в составе, связанном с глюкуроновой кислотой, и производного меркаптуровой кислоты (S-(3,5-ди-трет-бу-тил-4-гидроксибензил)-N-ацетилцистеин) [21]. У человека БГТ метабилизируется в 5-кар-бокси-7-(1-карбокси-1-метилэтил)-3,3-ди-метил-2-гидрокси-2,3-дигидробензофуран и второстепенный компонент 3,5-ди-[1-13C]ме-тил-1-метилэтил-4-гидроксибензойную кислоту [21, 22]. Метаболическая судьба БГТ у дрозофилы неизвестна. Поэтому нельзя исключать, что эффекты, наблюдаемые в настоящем исследовании, обусловлены продуктами метаболизма БГТ и не только его исходной неизмененной структурой.
Таким образом, можно предположить механизмы действия БГТ при действии облучения и без него. Радио- и геропротекторный эффекты БГТ, скорее всего, происходят посредством его влияния (или метаболитов) на поддер жание антиоксидантного статуса животных (Kw>1). (в условиях окислительного стресса или сниженного уровня естественных антиоксидантов) и подавления цитохрома Р-450. Возможно, эффект БГТ обусловлен не только его прямым антиоксидантным действием, но и модуляцией сигналов о регуляции экспрессии антиоксидантных генов, что требует дополнительного изучения. Степень защиты БГТ при облучении зависит от множества факторов, включая дозу облучения, тип и режим облучения (рентгеновское или γ-излучение, кратковременное или хроническое), концентрации вещества и состояния антиоксидантной системы организма. Особенности таких динамических процессов требуют дальнейших детальных исследований, чтобы полностью понять, каким образом взаимодействуют эти факторы и как можно оптимально использовать потенциальные защитные свойства БГТ при различных формах окислительного стресса.
Оценка коэффициентов взаимодействия БГТ и облучения. При тестировании химических веществ в комбинации с другими факторами (физическими или биологическими) необходимо учитывать характер их взаимодействия (антагонизм, синергизм, аддитивность). Совместное их действие обуславливает принципиально различные типы ответной реакции организма [23]. Особенно это важно при поиске новых радиомодифицирующих средств [24, 25].
Биологический эффект совместного действия БГТ и облучения, оцениваемый на основании расчетов коэффициента взаимодействия (Kw), носит преимущественно антагонистический характер (табл. 2), когда сочетанный эффект двух исследуемых факторов меньше, чем раздельное действие каждого из них, или один фактор ос-
Таблица 2
Значения коэффициентов взаимодействия (Kw) при совместном действии БГТ и облучения
Table 2
Values of interaction coefficients (Kw) under the combined action of BHT and irradiation
|
Линия |
КБГТ, мкМ |
Показатель/накопленная доза облучения |
||||
|
Повреждения ДНК |
СрПЖ |
МедПЖ |
МаксПЖ |
|||
|
0,42 мГр/ч |
40,3 мГр/ч |
0,42 мГр/ч |
||||
|
Canton-S |
1 10 20 100 |
-0,64 0,21 -15,5 0,15 |
-0,10 0,32 -17,0 -0,98 |
-1,50 -1,33 -0,40 0,44 |
0 0 0 0,33 |
0 0 0 0 |
|
sod[n1]/+ |
1 10 20 100 |
-2,25 -0,25 -0,15 -0,60 |
0 -0,70 -0,54 -1,67 |
6,86 4,33 1,02 0,71 |
-0,50 1,40 1,33 0 |
0 -0,20 0,25 0,66 |
|
sod[delta02]/+ |
1 10 20 100 |
-0,28 -0,36 -1,69 -0,50 |
1,77 4,05 -8,54 -2,00 |
-2,75 0,61 2,64 0,73 |
0 0 2,00 0,33 |
1 1 1 1 |
Условные обозначения. КБГТ – концентрация БГТ (мкМ), СрПЖ – средняя продолжительность жизни, МедПЖ – медианная продолжительность жизни, МаксПЖ – максимальная продолжительность жизни.
Примечание. Значения Kw рассчитаны относительно контрольных значений. Типы взаимодействия исследуемых факторов (БГТ и облучения): антагонистическое (Kw<1), аддитивное (Kw=1) и синергическое (Kw>1).
Keys. КБГТ – BHT concentration (μM); СрПЖ – average lifespan; МедПЖ – median lifespan;
МаксПЖ – maximum lifespan.
Note. Kw values are calculated relatively to control values. The interaction types of the studied factors (BHT and irradiation): antagonistic (Kw<1), additive (Kw=1) and synergistic
лабляет влияние другого. У линии дикого типа Canton-S БГТ и облучение (независимо от времени экспозиции) в бóльшей мере проявляют антагонистическое действие на биологические показатели. У особей линии sod[n1]/+ также наблюдается антагонистический характер воздействия изучаемых агентов на уровень повреждений ДНК и выживаемость. Однако влияние их комбинации на среднюю и медианную продолжительность жизни (но не на максимальную ПЖ) может быть синергическим при концентрациях ниже 100 мкМ. У особей линии sod[delta02]/+, помимо антагонистических эффектов, встречаются случаи синергизма, когда комбинация воздействующих факторов выше, чем их раздельное действие. По показателю «повреждения ДНК» синергический эффект выявлен при концентрации вещества 1-10 мкМ и облучении мощностью 40,3 мГр/ч. В то время как влияние компонентов на среднюю и медианную продолжительность жизни является синергическим при концентрации БГТ 20 мкМ и хроническом облучении мощностью 0,42 мГр/ч. Для максимальной продолжительности жизни характерно аддитивное действие БГТ во всех концентрациях и ионизирующего излучения (0,42 мГр/ч), поскольку коэффициент взаимодействия равен единице. Это означает, что эффект совместно действующих факторов такой же, как и эффект суммарного действия каждого из них. Из вышеизложенного можно заключить, что характер взаимодействия двух факторов зависит от концентрации одного из них и генетических особенностей организма, где наличие нарушений в системе антиоксидантной защиты может смещать баланс в сторону усиления эффекта воздействия.
Заключение
Исходя из представленных данных, БГТ можно отнести к препаратам, способным в зависимости от концентрации модифицировать эффекты хронического облучения разной интенсивности (0,42 и 40,3 мГр/ч). Бутилгидрокситолуол как эффективный антиоксидант проявляет радио-протекторное действие не только на уровне повреждений ДНК, но и на организменном уровне (по показателю выживаемости). У облученных особей с нормальным генотипом Canton-S БГТ в концентрациях, превышающих 1 мкМ, благоприятно влияет на цитогенетический показатель (снижая его уровень при мощностях дозы 0,42 и 40,3 мГр/ч) и продолжительность жизни (увеличивая ее параметры при мощности дозы 0,42 мГр/ч). Бутилгидрокситолуол обладает более выраженным протекторным действием по отношению к облучению и бóльшей эффективностью (в концентрациях вещества выше 1 мкМ и во всех накопленных дозах облучения) у животных с дисфункцией гена sod[n1] , отвечающего за синтез цитоплазматической Cu/Zn-супероксиддисмутазы. В то время как у особей линии sod[delta02]/+ , отличающихся низким уровнем активности митохондриальной Mn-супероксиддисмутазы, противолучевая защита наблюдается при концентрациях 10-20 (по цитогенетическому показателю) и 100 (по продолжительности жизни) мкМ и только в условиях хронического облучения мощностью 0,42 мГр/ч. Это указывает на специфичность действия БГТ у генотипов с нарушенной активностью супероксиддисмутазы в разных структурах клетки. Анализ коэффициентов взаимодействия демонстрирует, что совместный вклад БГТ и хронического облучения в изменения биологических показателей вызывает в основном антагонистический эффект у всех генотипов. Однако есть случаи синергического и аддитивного действия комбинации БГТ (в концентрациях ниже 100 мкМ) и радиационного фактора на продолжительность жизни (реже на уровень ДНК-разрывов) у особей с нарушенной антиоксидантной системой защиты. Предполагается, что генетические особенности, связанные с антиоксидантной защитой, играют важную роль в определении конечного результата воздействия комбинации факторов. Более того, обнаружен геропротекторный потенциал действия БГТ, заключающийся в его способности снижать уровень повреждений ДНК и повышать продолжительность жизни в зависимости от концентрации препарата и генотипического статуса животных. В целом, экспериментальные данные демонстрируют, что БГТ является препаратом, обладающим концентрационно-зависимой эффективностью, специфичной для различных генотипов, что позволяет говорить о его потенциале в геропротекции и защите от хронического облучения.
Автор заявляет об отсутствии конфликта интересов.


