Радионуклидная диагностика при легочной гипертензии
Автор: Сергиенко Владимир Борисович, Валеева Эльвира Газинуровна
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Обзор
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
В обзоре рассмотрены современные возможности методов радионуклидной диагностики при различных вариантах легочной гипертензии (ЛГ): вентиляционно-перфузионной сцинтиграфии и однофотонной эмиссионной компьютерной томографии (ОЭКТ) легких, радионуклидной вентрикулографии и ангиопульмонография, а также предложены новые возможности использования перфузионной ОЭКТ миокарда для оценки состояния правого желудочка при ЛГ.
Легочная гипертензия, радионуклидная диагностика
Короткий адрес: https://sciup.org/14343108
IDR: 14343108
Текст научной статьи Радионуклидная диагностика при легочной гипертензии
Современные методы радионуклидной диагностики играют важную роль в алгоритмах обследования пациентов с ЛГ. Эти методы позволяют оценивать легочную перфузию и вентиляцию, проходимость мелких бронхиол, функцию мукоцилиарного аппарата и альвеолярно-капиллярных мембран [1]. Учитывая тесную причинно-следственную связь легочной гипертензии с состоянием сердца, особенно его правых отделов, а также с такими патологическими состояниями, как врожденные пороки сердца и тромбоэмболии легочной артерии (ТЭЛА), особую важность приобретает комплексное радионуклидное обследование с оценкой перфузии и сократимости миокарда. В диагностике и оценке течения состояний, связанных с легочной гипертензией, наиболее ценными являются следующие методы: перфузионная и вентиляционная сцинтиграфия легких, равновесная томовентрикуло-графия (РТВГ), в том числе с ангиопульмонографией [2, 3]. В то же время, с учетом развития гибридных технологий и новых алгоритмов обработки, приводящих к существенному улучшению качества изображений, особую роль приобретают методы однофотонной эмиссионной томографии, совмещенной с компьютерной томографией (ОЭКТ/КТ), в том числе перфузионные исследования миокарда.
Перфузионная сцинтиграфия легких
В основе этого классического диагностического метода лежит временная эмболизация артериолярно-капиллярного русла легких после внутривенного введения радиофармпрепарата (РФП) на основе меченых макроагрегатов или микросфер, чаще всего альбумина человеческой сыворотки, меченных технецием-99m (99mTc-МАА). Чем больше капилляров подвергается эмболизации, тем интенсивнее визуализируемое включение РФП в этой области легких. Наличие зон отсутствия или снижения накопления РФП свидетельствует о нарушении в них кровотока (перфузии). Исследование абсолютно безопасно, поскольку при его выполнении эмболи-зируется не более 0,1-0,3% объема капилляров, что, однако, достаточно для получения качественных диагностических изображений. Абсолютных противопоказаний для проведения перфузионной сцинтиграфии легких нет. РФП вводят внутривенно в положении пациента лежа на спине, что приводит к более равномерному его распределению по зонам, исследование выполняют через 1-10 минут после инъекции. Как правило, выполняется статическое исследование в 4 или 6 стандартных проекциях: передней и задней прямых, правой и левой латеральных, а также правой и левой передних косых. При необходимости более детальной визуализации, а также для совмещения с компьютерной томографией, выполняют исследование в томографическом режиме (ОЭКТ) при расположении детекторов под углом 180 º друг к другу. Эффективная эквивалентная доза при этом не превышает 2 мЗв.
При визуальном анализе сцинтиграмм определяются границы легочных полей, оценивается равномерность распределения РФП в легких, отмечается локализация и размер дефектов накопления РФП. Передние и задние проекции по форме и положению напоминают рентгенологические изображения. Визуальная оценка сцинтиграмм основана на особенностях распределения РФП в легких, которое обусловлено физиологическим распределением кровотока. При исследовании в положении стоя получают наиболее естественную картину, обусловленную гравитацией. Оценка изображений в различных проекциях необходима для исследования тех зон легких, которые экранируются сердцем, сосудистым пучком, диафрагмой или печенью. Количественный анализ перфузии легких включает в себя вычисление относительного распределения РФП по шести стандартным зонам Веста, с учетом нормального соотношения перфузии правого и левого легкого (около 55% и 45%).
Вентиляционная сцинтиграфия легких
Вентиляционная (ингаляционная) сцинтиграфия легких выполняется для определения структурно-функционального состояния бронхиального дерева. В настоящее время наиболее удобным РФП для вентиляционной сцинтиграфии легких является тонкодисперсный аэрозоль 99mТс-диэтилен-триамино-пентаацетата (ДТПА). При 5-8-минутной ингаляции происходит его временное оседание на поверхности бронхиального дерева и альвеолярных протоков. Последующее проведение сцинтиграфии позволяет оценить распределение РФП по воздухоносным путям легких. Перспективным для этой цели является использование радиоаэрозольных наборов с небулайзером, в которых образуются частицы размером менее 2 мкм, что при ламинарном воздушном потоке обеспечивает их оседание именно в респираторных отделах легких.
Сцинтиграфия выполняется непосредственно после ингаляции и может состоять из нескольких этапов, в зависимости от клинических задач. Сначала обычно выполняется динамическая сцинтиграфия легких в течение 30 минут, что позволяет построить динамические кривые альвеолярно-капиллярной проницаемости. Перенос РФП из легочных альвеол в кровеносное русло осуществляется через альвеолярно-капиллярную мембрану путем пассивной диффузии. Скорость этого процесса может оказаться перспективным диагностическим показателем при интерстициальных заболеваниях легких, которые сопровождаются отеком, фиброзом и деструкцией капилляров с последующим увеличением диффузионного расстояния (толщины мембраны). Быстрое выведение микрочастиц аэрозоля объясняется, по-видимому, увеличением альвеолярно-капиллярной проницаемости. У здоровых людей период полувыведения (Т1/2) составляет в среднем 53 мин, у здоровых курильщиков – 28 мин, при некоторых легочных инфекциях – до 5 мин, а при обструктивных и рестриктивных процессах может удлиняться. При легочной гипертензии Т1/2 варьирует в зависимости от тяжести состояния. Данная количественная оценка позволяет выявлять степень нарушения структурно-функционального состояния легких при легочной гипертензии, позволяя объективно оценивать характер развития патологического процесса. На втором этапе записывают статические сцинтиграммы легких в четырех стандартных проекциях, что позволяет изучить особенности регионарной вентиляции. При патологии бронхолегочной системы обнаруживаются различной степени зоны гипо- или гиперфиксации аэрозоля локального или диффузного характера, а также неоднородность изображения легочного рисунка вплоть до выявления дефектов накопления РФП. Для частичной непроходимости бронхов характерна гиперфиксация аэрозолей в местах обструкции. Соответственно, дистальнее этого участка на периферии обычно выявляется зона гипофиксации препарата. Количественный анализ вентиляционных сцинтиграмм аналогичен таковому при перфузионном исследовании, при этом возможен расчет апикально-базального градиента вентиляции, отражающего нарушения перераспределения легочной вентиляции в верхних и нижних отделах легких.
Сопоставление перфузионной и вентиляционной сцинтиграфии легких
В норме вентиляционные и перфузионные сцинтиграммы легких соответствуют друг другу по форме и топографии. Любое нарушение капиллярного кровотока сопровождается изменением соотношений накопления РФП по полям и отделам легких, а также появлением визуальных дефектов перфузии. У больных с легочной гипертензией можно обнаружить как абсолютно неизмененную картину, так и небольшие периферические субсегментарные дефекты перфузии без нарушенной вентиляции (рис. 1). Вентиляционная и перфузионная сцинтиграфия легких являются методом установления клинического класса легочной гипертензии и методом выявления (исключения) ТЭЛА [4-6]. Высокая чувствительность метода, позволяющая визуализировать нарушения перфузии до развития клинических и рентгенологических признаков инфильтративных изменений легочной ткани, облегчает принятие решения о дальнейших лечебных мероприятиях.
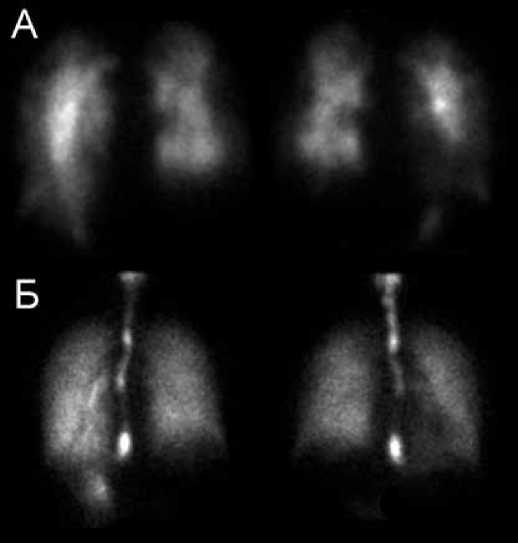
Рисунок 1. Сцинтиграфические признаки ХТЭЛА у пациента с ЛГ. Множественные дефекты перфузии (А) при отсутствии дефектов вентиляции (Б) легких
Наиболее информативно выполнение сцинтиграфии в первые минуты клинических проявлений заболевания. При ТЭЛА дефекты перфузии, как правило, краевые, треугольной (клиновидной) формы, с четкими контурами, они соответствуют дихотомии легочных артерий и могут быть достаточно крупными: субсегментарными, сегментарными или долевыми. В дифференциальной диагностике идиопатической легочной гипертензии и хронической тромбоэмболии чувствительность вентиляционно-перфузионной сцинтиграфии легких составляет 90-100%, специфичность – 94-100% [7]. Нормальная картина легочной перфузии исключает ТЭЛА из дальнейшего клинического поиска. В пользу высокой вероятности ТЭЛА свидетельствуют дефекты перфузии больших размеров, а также единичные или множественные несовпадающие дефекты перфузии и вентиляции [8]. О среднем риске ТЭЛА свидетельствует небольшое несовпадение вентиляционных и перфузионных дефектов, а также небольшое количество зон аномального включения индикатора в легочную ткань. нор- мальной вентиляции, чувствительность метода повышается до 100%. Острая ТЭЛА более вероятна, если дефекты перфузии выявляются при неизмененных данных рентгенографии, поскольку при рентгенографии дефекты перфузии визуализируются лишь в виде интерстициального отека, который развивается через сутки с начала клинической симптоматики.
Гибридные методы визуализации легких
Компьютерная томография (КТ) играет важную роль в дифференциальной диагностике легочной гипертензии. Обеспечивая детальное изображение легочной паренхимы, метод позволяет диагностировать интерстициальные заболевания легких, эмфизему, оценить состояние легочных полей, а также сердца и сосудов с помощью контрастирования полостей сердца и просвета сосудов при внутривенном введении контрастного вещества. КТ-картина хронической тромбоэмболии – полная окклюзия легочной артерии или ее ветвей, наличие эксцентрических дефектов вследствие тромбозов, реканализованные тромбы. В течение последнего десятилетия развитие новых визуализирующих технологий позволило объединить анатомические и функциональные методы в совмещенные системы визуализации, такие как однофотонная эмиссионная и компьютерная (ОЭКТ/КТ), позитронно-эмиссионная и компьютерная (ПЭТ/КТ), позитронно-эмиссионная и магнитно-резонансная (ПЭТ/МРТ) томографии. Наиболее доступная технология ОЭКТ/КТ может играть важную роль в решении клинических задач пульмонологии, поскольку позволяет соотносить функциональные, перфузионные и вентиляционные нарушения с тонкими анатомическими объектами (рис. 2). В настоящее время имеется возможность в некоторых случаях заменять вентиляционный этап радионуклидного исследования компьютерной томографией, однако этот подход пока требует валидации, поскольку при этих двух методах визуализируются различные морфофункциональные субстраты [4]. Важно, что КТ-подсистема также позволяет выполнять коррекцию поглощения гамма-излучения от РФП тканями человека, что существенно улучшает качество сцинтиграфических изображений.
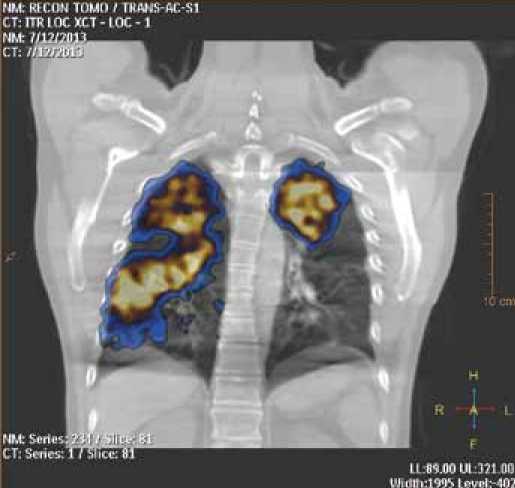
Рисунок 2. ОЭКТ/КТ у пациента с ХТЭЛА.
Объем перфузируемой ткани составляет всего 20% от общего объема легких, при этом по данным КТ грубых структурных нарушений не визуализируется
Радионуклидная вентрикулография и ангиопульмонография
Функция правого желудочка (ПЖ) является одним из главных прогностических факторов при легочной гипертензии. Предикторами неблагоприятного прогноза у этих больных являются значительная дисфункция и признаки недостаточности правого желудочка, высокое давление в правом предсердии, сниженный сердечный индекс. Однако, поскольку правый желудочек имеет более тонкие стенки и сложную форму, чем левый желудочек, его визуализация и количественные расчеты представляют собой непростую задачу. Метод радионуклидной вентрикулографии (наряду с коронаро-вентрикулографией) остается “золотым стандартом” в оценке объемов и функции желудочков сердца [9, 10]. К сожалению, в настоящее время метод не упоминается в рекомендациях по ЛГ, что, по-видимому, связано с качественно новым уровнем возможностей современных эхокардиографических и магнитно-резонансных методик [11]. Однако в таком случае метод радионуклидной вентрикулографии можно рекомендовать как дополнительный метод визуализации и оценки функции желудочков сердца, поскольку он обладает рядом уникальных преимуществ.
Существует две основных методики радионуклидной вентрикулографии. При первой – радионуклидной вентрикулографии по первому прохождению, или радионуклидной ангиопульмонографии – осуществляется запись короткой последовательности сердечных циклов во время быстрого транзита болюса РПФ (используется 99mTc-ДТПА или элюат 99mTc-пертехнетата) через камеры сердца, в течение двух минут со скоростью два кадра в секунду. Это обеспечивает высокое разрешение для разделения желудочков, позволяя проводить исследование объемов и фракции выброса, показателей систолы и диастолы, а также проводить непосредственную диагностику наличия регургитации крови при недостаточности трикуспидального или аортального клапанов и внутрисердечных шунтах. Построение кривых время-активность для каждой камеры сердца и легочных сосудов позволяет не только визуализировать, но и количественно охарактеризовать состояние легочного кровотока на микроциркуляторном уровне. Метод позволяет измерить периоды прохождения РФП через правые и левые отделы сердца, время циркуляции крови в малом круге, в том числе в мелких легочных артериях, периоды опорожнения правого желудочка и легочной артерии, показатели внутрисердечного шунтирования крови.
Вторая методика – равновесная радионуклидная вентрикулография с меткой эритроцитов, доступная в планарном или томографическом режиме. Пациенту вводят раствор пирофосфата или ДТПА, в котором содержится значительное количество олова, тропного к эритроцитам. Через 20 мин вводят радиоактивный элюат технеция (99mТс-пертехнетат), который, связываясь с оловом, обеспечивает радионуклидную метку пула крови in vivo. Меченые эритроциты, проходя через камеры сердца, отражают движение крови в различные фазы сердечного цикла. В настоящее время планарная радионуклидная вентрикулография практически вытеснена более современной томовентрикулографией (РТВГ), синхронизированной с ЭКГ, позволяющей получить исчерпывающую информацию о фракции выброса, объемных, скоростных и временных показателях, как левого, так и правого желудочка, включая параметры их диастолической функции. Важнейшим свойством РТВГ является возможность получения объемных пиковых скоростей – изгнания крови из желудочков и их наполнения. Эти скорости характеризуют общее состояние систолической и диастолической функции миокарда, соответственно. Такие параметры, как средняя скорость наполнения желудочка в первую треть диастолы, максимальная скорость наполнения во время второго пика, время максимального наполнения желудочков от момента начала диастолы характеризуют более тонкие фазы диастолы. При РТВГ возможна всесторонняя оценка нарушений локальной сократимости левого и правого желудочка. Программы обработки позволяют строить фазовые полярные карты и гистограммы, на которых отражается последовательность сокращения сегментов желудочков (рис. 3). Это позволяет визуализировать участки асин-хронии различных отделов желудочков и межжелудочковой перегородки. Метод является высоко воспроизводимым и не зависимым от квалификации оператора, что позволяет многократно применять его в динамике, в том числе у пациентов с пороками сердца, легочной гипертензией разного генеза, ХОБЛ и хронической ТЭЛА [12].
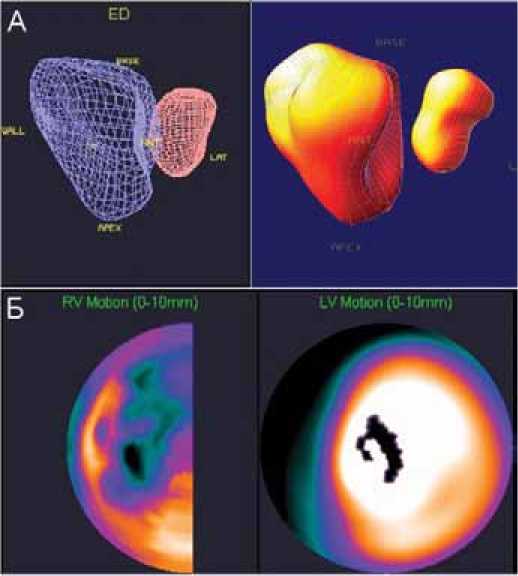
Рисунок 3. РТВГ у пациента с ЛГ. В 3D-режиме (А) демонстрируется геометрия желудочков сердца: дилатация и деформация, ПЖ, компрессия ЛЖ.
На полярных картах сократимости (Б) визуализируется акинез и парадоксальное движение МЖП, диссинхрония ПЖ
Использование РТВГ и радионуклидной ангиопульмоногра-фии позволяет идентифицировать проявления как легочновенозной (замедление времени транзита РФП по легочным венам), так и легочно-артериальной (замедленное поступление РФП в правый желудочек и низкая скорость его прохождения по легочным артериям) вариантов гипертензии. Например, сужение артериол легких в ответ на увеличение давления в левом предсердии и легочных венах (при митральном пороке сердца) и обусловленное этим развитие легочно-артериальной гипертензии (рефлекс Китаева) имеет отражение при РТВГ в виде замедления пассажа РФП по легочным артериям, а также замедления его выведения из легочного ствола. Дисфункция правого желудочка, связанная с легочной гипертензией, проявляется при радионуклидной ангиопульмонографии увеличе- нием времени опорожнения правого желудочка [13]. При пороках митрального клапана по данным РТВГ снижены фракция выброса, скорости изгнания, ударный объем, увеличен конечно-систолический объем правого желудочка, что объясняется увеличенной постнагрузкой на правый желудочек за счет гипертензии в малом круге кровообращения.
Перфузионная сцинтиграфия и ОЭКТ миокарда
В последние годы появился ряд исследований, посвященных роли радионуклидных методов оценки состояния миокарда в оценке прогноза у больных ЛГ. В частности, нейротропная сцинтиграфия и ОЭКТ миокарда с 123I-мета-йод-бензил-гуанидином (МИБГ) позволяет выявлять у пациентов с ЛГ нарушения симпатической активности миокарда, которые являются предиктором жизнеугрожающих нарушений ритма сердца и связаны с риском внезапной смерти [14, 15]. Нарушения метаболизма глюкозы и жирных кислот в миокарде, выявляемые с помощью ПЭТ с 18F-ФДГ и ОЭКТ с 123I-BMIPP, соответственно, являются, с одной стороны, наиболее ранними маркерами нарушения состояния миокарда, а с другой – важным прогностическим фактором и критерием оценки эффективности терапии [16, 17]. В этой связи, ОЭКТ миокарда с оценкой клеточной перфузии представляется еще одним перспективным направлением диагностики состояния миокарда у больных с ЛГ [18]. Одной из клинических задач у этой категории больных является исключение сопутствующей ишемической болезни сердца (ИБС), которая может развиться на фоне нарастания несоответствия между доставкой и потребностью в кислороде гипертрофированного миокарда ПЖ [19-23]. При этом именно у пациентов с ЛГ перфузионная ОЭКТ миокарда может оказаться особенно ценным диагностическим методом оценки состояния ПЖ. Это связано с тем, что при значительном повышении давления в легочных артериях, гипертрофированный ПЖ начинает визуализироваться на томосцинтиграммах, хотя в норме он не виден (в силу небольшого объема миокарда ПЖ относительно ЛЖ). Визуализация ПЖ дает возможность выявления стабильных и преходящих (стресс-индуцированных) дефектов его перфузии, а также степени его дилатации [24]. При выполнении методики ОЭКТ, синхронизированной с ЭКГ (С-ОЭКТ), возможна оценка сократительной способности ПЖ, с измерением того же самого набора параметров, что и при радионуклидной вентрикулографии [25, 26]. Наиболее характерным изменением конфигурации миокарда при ЛГ является сдавление левого желудочка гипертрофированным правым. При этом возникают феномены “D-образного” ЛЖ и парадоксального движения МЖП, хорошо видимые как при Эхо-КГ, так и при С-ОЭКТ [27]. Дополнительной возможностью является измерение соотношения интенсивности накопления РФП правым и левым желудочком (коэффициент RV/LV). Имеются данные, что увеличение этого показателя является достоверным признаком гипертрофии ПЖ [28].
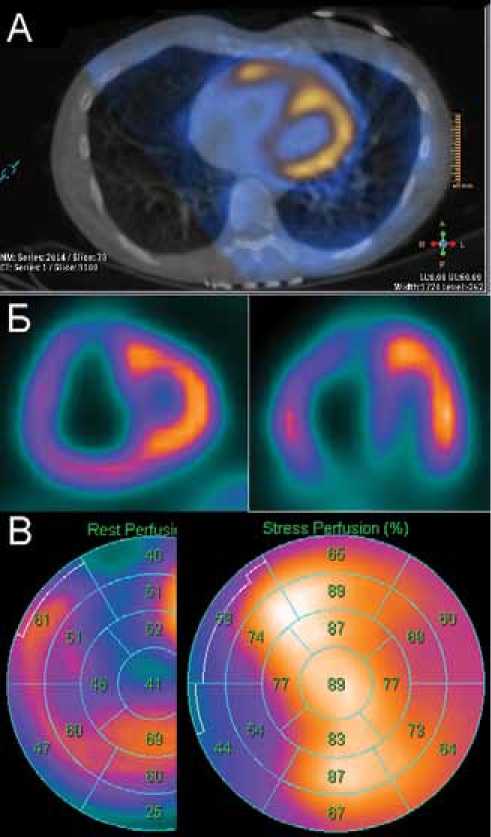
Рисунок 4. Перфузионная ОЭКТ/КТ миокарда у больного с ИЛГ. На аксиальных срезах ОЭКТ/КТ(А), косых срезах по короткой и длинным осям сердца (Б) визуализируется дилатация ПЖ. Перфузия ПЖ неоднородна, отмечается дефект перфузии в МЖП, возможно, вследствие компрессии (В)
В собственном исследовании на группе пациентов с ЛГ нами было показано наличие характерных нарушения перфузии у пациентов с ИЛГ, локализованных в базальных сегментах МЖП (рис. 4). Механизм появления этих дефектов является не до конца изученным [29], однако зарубежными авторами на модели собак было высказано мнение, что перегрузка ПЖ приводит к существенному снижению кровотока в МЖП [30]. На основании этих данных можно предположить, что источником стенокардии у пациентов ЛГ с интактными КА может быть ишемия, возникающей в результате компрессии МЖП. Кроме того, в исследовании Oikawa et al. было продемонстрировано восстановление метаболизма глюкозы в данной зоне на фоне терапии ЛГ [31]. Таким образом, эти дефекты перфузии, по-видимому, являются обратимыми, и, следовательно, не должны трактоваться как стойкие дефекты вследствие предполагаемых очагов фиброза. С учетом того, что пациенты с ЛГ имеют низкую толерантность к нагрузке, и, как правило, не достигают диагностических критериев преходящей ишемии миокарда, аналогичным образом следует трактовать и случаи дальнейшего ухудшения перфузии миокарда МЖП на фоне нагрузки. Такое преходящее ухудшение кровоснабжения, связано, скорее всего, с дальнейшим нарушением геометрии ПЖ вследствие повышения давления в ЛА при нагрузочной пробе.
ЗАКЛЮЧЕНИЕ
Суммируя вышесказанное, необходимо подчеркнуть высокую клиническую ценность методов радионуклидной диагностики у больных ЛГ. Эти методы были внедрены в клиническую практику более 30 лет назад [32], они постоянно развиваются, увеличивается их разрешающая способность и безопасность [33]. Новые гибридные ОЭКТ/КТ системы обеспечивают более высокое качество изображений с сохранением беспрецедентной чувствительности, что позволило значительно снизить число ложноположительных заключений [34]. Радионуклидная диагностика является важным этапом обследования пациентов с ЛГ, и позволяет ответить на важные клинические вопросы, касающиеся не только собственно диагностики заболевания, но и тактики дальнейшего ведения пациента и его прогноза.
Список литературы Радионуклидная диагностика при легочной гипертензии
- Сергиенко В.Б., Аншелес А.А. Радионуклидная диагностика в кардиологии/Ред. Е.И. Чазов. М.: Практика, 2014. C. 571-612
- Bossone E., Dellegrottaglie S., Patel S., et al. Multimodality imaging in pulmonary hypertension. Can J Cardiol. 2015. Vol. 31. N. 4. P. 440-459
- Лишманов Ю.Б., Ефимова И.Ю., Чернов В.И. и соавт. Сцинтиграфия как инструмент диагностики, прогнозирования и мониторинга лечения болезней сердца. Сибирский медицинский журнал. 2007.22(3): 74-77
- Galie N., Humbert M., Vachiery J.L., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Respir J. 2015. Vol. 46. N. 4. P. 903-975
- Чазова И.Е., Мартынюк Т.В. Клинические рекомендации по диагностике и лечению хронической тромбоэмболической легочной гипертензии (I часть). Терапевтический архив. 2016. 88(9): 90-101
- Чазова И.Е., Мартынюк Т.В. Клинические рекомендации по диагностике и лечению хронической тромбоэмболической легочной гипертензии (II часть). Терапевтический архив. 2016. 88(10): 63-73
- Torbicki A, Perrier A, Konstantinides S., et al. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Eur Heart J. 2008. Vol. 29. N. 18. P. 2276-2315
- Лишманов Ю.Б., Кривоногов Н.Г., Илюшенкова Ю.Н. и соавт. Сцинтиграфическая оценка структурно-фунциональных изменений миокарда и альвеолярно-капиллярной проницаемости легких у больных внебольничной пневмонией. Сибирский медицинский журнал. 2011. 26(1): 106109
- Gargiulo P., Cuocolo A, Dellegrottaglie S., et al. Nuclear assessment of right ventricle. Echocardiography. 2015. Vol. 32 Suppl 1. N. P. S69-74.
- Corbett J.R., Akinboboye O.O., Bacharach S.L., et al. Equilibrium radionuclide angiocardiography. J Nucl Cardiol. 2006. Vol. 13. N. 6. P. 56-79.
- Чазова И.Е., Авдеев С.Н., Царева Н.А. и соавт. Клинические рекомендации по диагностике и лечению легочной гипертонии. Терапевтический архив. 2014.86(9): 4-23.
- Hesse B., Lindhardt T.B., Acampa W. et al. EANM/ESC guidelines for radionuclide imaging of cardiac function. Eur J Nucl Med Mol Imaging. 2008. Vol. 35. N. 4. P. 851-885.
- Завадовский К.В., Панькова А.Н. Сцинтиграфическая оценка дисфункции правого желудочка сердца у пациентов с тромбоэмболией легочной артерии. Медицинская визуализация. 2009. 3: 24-30.
- Verrier R.L., Antzelevitch C. Autonomic aspects of arrhythmogenesis: the enduring and the new. Curr Opin Cardiol. 2004. Vol. 19. N. 1. P. 2-11.
- Аншелес А.А., Щиголева Я.В., Сергиенко И.В. и соавт. Особенности перфузии и симпатической иннервации миокарда по данным однофотонной эмиссионной компьютерной томографии у пациентов с гипертрофической кардиомиопатией. Кардиологический вестник. 2016. XI(1): 24-33.
- Matsushita T., Ikeda S., Miyahara Y., et al. Use of -BMIPP myocardial scintigraphy for the clinical evaluation of a fatty-acid metabolism disorder of the right ventricle in chronic respiratory and pulmonary vascular disease. J Int Med Res. 2000. Vol. 28. N. 3. P. 111-123.
- Bokhari S., Raina A, Rosenweig E.B., et al. PET imaging may provide a novel biomarker and understanding of right ventricular dysfunction in patients with idiopathic pulmonary arterial hypertension. Circ Cardiovasc Imaging. 2011. Vol. 4. N. 6. P. 641-647.
- Архипова О.А., Мартынюк Т.В., Валеева Э.Г. и соавт. Ишемия миокарда у пациентов с легочной артериальной гипертензией. Системные гипертензии. 2015. 4: 52-56
- Vogel-Claussen J., Skrok J., Shehata M.L., et al. Right and left ventricular myocardial perfusion reserves correlate with right ventricular function and pulmonary hemodynamics in patients with pulmonary arterial hypertension. Radiology. 2011. Vol. 258. N. 1. P. 119-127.
- Сергиенко В.Б., Аншелес А.А. Томографические методы в оценке перфузии миокарда. Вестник рентгенологии и радиологии. 2010. 3: 10-14
- Аншелес А.А, Шульгин Д.Н., Соломяный В.В. и соавт. Сопоставление результатов нагрузочных проб, данных однофотонной эмиссионной компьютерной томографии миокарда и коронарографии у больных ишемической болезнью сердца. Кардиологический вестник. 2012. 2: 10-17
- Аншелес А.А, Шульгин Д.Н., Соломяный В.В. и соавт. Клиническая значимость радионуклидной диагностики при решении вопросов направления больных ИБС на коронароангиографию. Терапевт. 2012. 9: 34-41
- Аншелес А.А, Сергиенко В.Б. Современные возможности радионуклидной диагностики при артериальной гипертензии. Системные гипертензии. 2016. 13 (1): 22-28
- Gomez A, Bialostozky D., Zajarias A, et al. Right ventricular ischemia in patients with primary pulmonary hypertension. J Am Coll Cardiol. 2001. Vol. 38. N. 4. P. 1137-1142.
- Сергиенко В.Б., Аншелес А.А, Шульгин Д.Н. и соавт. Методические рекомендации: перфузионная сцинтиграфия и ОЭКТ миокарда. Кардиологический вестник. 2015. 2: 6-21.
- Аншелес А.А, Халикова Э.И., Рыжикова О.А. Способ количественной оценки нарушений перфузии миокарда по данным однофотонной эмиссионной компьютерной томографии. Медицинская физика. 2016. 69(1):46-53
- Ohira H., Beanlands R.S., Davies R.A., et al. The role of nuclear imaging in pulmonary hypertension. J Nucl Cardiol. 2015. Vol. 22. N. 1. P. 141-157
- Mazraeshahi R.M., Striet J., Oeltgen R.C., et al. Myocardial SPECT images for diagnosis of pulmonary hypertension and right ventricular hypertrophy. J Nucl Med Technol. 2010. Vol. 38. N. 4. P. 175-180.
- Maedera M.T., Stöcklib M., Zellweger M.J. Myocardial perfusion SPECT features of severe pulmonary artery hypertension. Kardiovaskuläre Medizin. 2007. Vol. 10. N. P. 113-114.
- Gibbons Kroeker C.A., Adeeb S., Shrive N.G., et al. Compression induced by RV pressure overload decreases regional coronary blood flow in anesthetized dogs. Am J Physiol Heart Circ Physiol. 2006. Vol. 290. N. 6. P. H2432-2438.
- Oikawa M., Kagaya Y., Otani H., et al. Increased fluorodeoxyglucose accumulation in right ventricular free wall in patients with pulmonary hypertension and the effect of epoprostenol. J Am Coll Cardiol. 2005. Vol. 45. N. 11. P. 1849-1855.
- Сергиенко В.Б., Ноников В.Е. Эмиссионная компьютерная томография в пульмонологии. Терапевтический архив. 1984. 3: 122-125.
- Аншелес А.А., Сергиенко В.Б. Томографические методы диагностики при оценке перфузии миокарда у больных с ишемической болезнью сердца. Медицинская радиология и радиационная безопасность. 2011. 3: 74-79
- Аншелес А.А. Особенности интерпретации перфузионной однофотонной эмиссионной компьютерной томографии миокарда с компьютерно-томографической коррекцией поглощения. Вестник рентгенологии и радиологии. 2014. 2: 5-20


