Радиозащитный эффект креатина при повреждении ДНК мононуклеарных клеток периферической крови и адаптационные возможности креатин-креатинкиназной системы мозга и печени крыс
Автор: Нерсесова Л.С., Петросян М.С., Бабаян Н.С., Тадевосян Г.Л., Хондкарян Л.Г., Акопян Ж.И.
Рубрика: Научные статьи
Статья в выпуске: 3 т.28, 2019 года.
Бесплатный доступ
Известно, что антиоксидантные и антиапоптические свойства креатина (Кр) определяют его протекторное действие при нейродегенеративных и миопатических заболеваниях, старении и действии ультрафиолетового излучения, в основе патогенеза которых находятся аналогичные механизмы окислительного стресса. Учитывая, что в основе этиопатогенеза радиационного поражения лежит окислительный стресс, первичными мишенями которого являются ДНК и ферментные белки, целью данной работы было оценить радиозащитное действие Кр на повреждения ДНК мононуклеарных клеток периферической крови и адаптационные возможности креатин-креатинкиназной (Кр-КК) системы мозга и печени крыс, подвергнутых однократному общему рентгеновскому облучению в дозе 4,5 Гр. Показано, что Кр, как биодобавка, оказывает защитное действие на Кр-КК-систему исследованных органов, уменьшая повреждающее действие радиации и стимулируя её адаптационные свойства; при этом Кр-КК-система мозга, который отличается более высоким содержанием КК и Кр, чем печень, проявляет большую радиочувствительность, но и большую гибкость в адаптации к радиострессу. В первые пострадиационные сутки Кр снижает уровень индуцированных облучением повреждений ДНК почти в 2 раза по сравнению с соответствующим облучённым контролем; к 7 суткам этот уровень достигает контрольного уровня в интактных клетках и сохраняется до 15 суток. Полученные данные свидетельствует о противолучевой эффективности Кр, оказавшегося способным повышать резистентность и адаптабельность крыс к рентгеновскому облучению.
Рентгеновское облучение, радиозащитный эффект, креатин, креатинкиназа, повреждения днк, мононуклеарные клетки периферической крови, мозг, печень, адаптация, крысы
Короткий адрес: https://sciup.org/170171492
IDR: 170171492 | УДК: 615.849.015.25:547.495.9 | DOI: 10.21870/0131-3878-2019-28-3-119-131
Текст научной статьи Радиозащитный эффект креатина при повреждении ДНК мононуклеарных клеток периферической крови и адаптационные возможности креатин-креатинкиназной системы мозга и печени крыс
Технологические достижения современного мира значительно повысили риски воздействия на человека ионизирующего излучения (ИИ) вследствие его широкого применения в различных областях, и, особенно, в радиотерапии рака, при хранении продуктов питания, в сельском хозяйстве, а также в оборонном, индустриальном и энергетическом производствах. Это ставит на повестку дня вопрос разработки эффективных радиопротекторов. Использование предложенных на сегодня химических агентов, и, в первую очередь, аминотиолов, в определённой степени защищает организм от патологических эффектов радиации, но высокая токсичность оптимальных радиозащитных доз большинства из них ограничивает их применение [1]. В связи с этим становится актуальным поиск новых природных радиозащитных агентов среди антиоксидантных нутриентов и фитопроизводных препаратов, лишённых токсичности.
ИИ оказывает на клетки как прямое действие, вызывая разрывы химических связей в макромолекулах, так и опосредованное, обусловленное образованием свободных радикалов, которые агрессивно взаимодействуют с макромолекулами. Биологические эффекты этого воздействия зависят от интенсивности и степени проникновения ионизирующей радиации и могут быть
Нерсесова Л.С.* - вед. научн. сотр., к.б.н.; Петросян М.С. - соискатель, м.н.с., вед. специалист Комитета по регулированию ядерной безопасности РА; Бабаян Н.С. - научн. сотр., к.б.н.; Тадевосян Г.Л. - м.н.с.; Хондкарян Л.Г. - м.н.с.; Акопян Ж.И. - зав. лаб., д.б.н., чл.-корр. НАН РА, проф., заслуженный деятель науки НАН РА. ИМБ НАН РА.
острыми или хроническими. Хронический эффект сопряжён с окислительным стрессом и изменением геномной стабильности, которые, в свою очередь, действуют на метаболические функции клетки. Перекисное окисление липидов является характерной особенностью оксидативного стресса, который разрушает структурную целостность клеточной мембраны и может привести к образованию альдегидов, которые, в свою очередь, вызывают повреждения ДНК и окисление липидов и белков. В результате имеют место изменения как в уровнях активности, так и в биосинтезе ферментов, что служит основанием для оценки активности ферментов после действия ионизирующего излучения и изучения эффективности различных радиопротекторов [2].
Креатин (метил-гуанидиноуксусная кислота, Кр) является азотсодержащей карбоновой кислотой, которую организм человека получает, в основном, через пищу, а оставшаяся часть синтезируется в самом организме. Сначала в почках и поджелудочной железе из глицина и аргинина синтезируется гуанидиноацетат, который уже в печени метилируется с помощью метионина в Кр, экспортируемый затем через кровь в ткани, клетки которых поглощают его с помощью специфического Кр-транспортёра [3]. Кр в качестве биодобавки повышает энергетический статус организма, усиливает его активность и выносливость, способствует увеличению мышечной массы, предотвращает атрофию мышц, в том числе возрастную. Он безопасен в относительно высоких дозах (2-5 г/день), поэтому широко применяется как эргогоническая добавка в спортивной индустрии, при реабилитационных упражнениях, а также пожилыми людьми для повышения физической активности [3]. Более того, в последние два десятилетия было показано благотворное действие Кр-биодобавки в качестве адъювантной терапии в случаях предотвращения и/или лечения нейродегенеративных заболеваний, амиотрофического латерального склероза, артритов, мышечной дистрофии, последствий воздействия ультрафиолетового излучения и др. [3, 4]. Кр проявляет значительную антиоксидантную активность как в клеточных, так и бесклеточных системах. Так, например, показана эффективность Кр в прямом перехвате ряда радикалов, включая ABTS+ (2,2'-азинобис3-этилбензотиазолин-6-сульфонат), супероксидный анион и пероксинитрит [5]. Позже, в работе [6], был показан цитопротекторный эффект Кр против нескольких оксидантов на ряде клеточных линий млекопитающих. В этом контексте представляют интерес данные о том, что у пациентов с синдромом Кр-недостаточности выявляются повышенные окислительный стресс и апоптоз, индуцированные реакционоспособными формами кислорода [7]. Kреатинкиназа (КК; НФ 2.7.3.2.) с Кр и вторым своим субстратом, креатинфосфатом (КФ), образует Кр-КФ-КК-систему, которая, как показали исследования последних лет, выполняет в энергетическом обмене клетки не только буферную и транспортную роли, но и функцию поддержания стабильности митохондриальных мембран. Кроме того, митохондриальная КК оказывает протекторное действие на открытие митохондриальных временных проницаемых пор, а, следовательно, влияет на процессы апоптоза и некроза [3]. Именно антиоксидантные и антиапоптические свойства Кр лежат в основе его протекторного действия при ней-родегенеративных и миопатических заболеваниях, старении и действии ультрафиолетового излучения, в основе патогенеза которых находятся аналогичные молекулярные механизмы окислительного стресса [3, 4].
Ранее нами было исследовано влияние сублетальных доз рентгеновского излучения на активность ряда ключевых ферментов клеточного метаболизма в различных органах и сыворотке крови и на ядерно-ядрышковый аппарат. Наиболее радиочувствительным и адаптабель-ным ферментом оказалась КК; изменения морфометрических показателей ядерно-ядрышкового аппарата и распределения гепатоцитов по плоидности указывали на наличие выраженных деструктивных процессов и, в частности, апоптоз [8]. Учитывая то, что в основе этиопатогенеза радиационного поражения лежит окислительный стресс, среди первичных мишеней которого находятся ДНК и ферментные белки, а также отмеченные выше антиапоптотические и антиоксидантные свойства Кр, целью данной работы была оценка радиозащитного действия Кр на повреждения ДНК и адаптационные возможности Кр-КК-системы мозга и печени крыс в условиях радиопатологии.
Материалы и методы
В опытах использовано 60 белых беспородных крыс-самцов весом 180-210 г, которые содержались в стандартных условиях. Однократное общее облучение крыс в дозе 4,5 Гр проводили в изолированном помещении, предназначенном для подобных опытов, на рентгеновской установке «РУМ-17» (напряжение 200 киловольт, сила тока 20 миллиампер, Cu-Al фильтр; кожно-фокусное расстояние 50 см, мощность дозы облучения 1,78 Гр/мин). Животные были разделены на 1 опытную и 2 контрольные группы по 15 особей в каждой. Опытной группе за 2 недели до и 2 недели после облучения давали per os креатин-моногидрат в 0,9% растворе глюкозы в дозе 1 г/кг веса животного, а двум контрольным группам 0,9% раствор глюкозы и воду соответственно. Кроме того, в качестве исходного контроля была использована равноценная по числу крыс группа интактных животных. Пострадиационные эффекты оценивались на 1, 7, 15 сутки после лучевого воздействия (по 5 крыс из каждой группы).
Для определения активности КК и содержания креатина в печени, мозге и сыворотке крови проводили декапитацию животных после эфирного наркоза. Кровь собирали в пробирки без антикоагулянта, после её свертывания центрифугировали в рефрижераторной центрифуге при 800 g в течение 20 мин; сыворотку крови использовали в тот же день для определения ферментной активности. Печень и мозг отмывали от крови охлаждённым физиологическим раствором и гомогенизировали в экстрагирующем буферном растворе с pH 7,2 (0,1 моль/л трис-HCl, 5 ммоль/л дитиотреитола и 1 ммоль/л этилендиаминтетраацетата). Экстракты, полученные после центрифугирования гомогенатов при 23000 g в течение 30 мин, использовали для определения ферментной активности. КК-активность определяли спектрофотометрически по накоплению продукта реакции креатина [9]. Ферментную активность выражали в мкмоль/г влажной ткани в минуту для мозга и печени и мкмоль/л в минуту для сыворотки крови. Содержание креатина в мкг/г влажного веса печени и в мкг/мл сыворотки определяли спектрофотометрически согласно оптимизированному методу Эннора и Розенберга [9]. Для наглядного изображения рассчитанные средние и их стандартные отклонения для уровней активности КК и содержания Кр на графиках выражены в % по отношению к контрольному уровню, которым служили соответствующие данные, полученные для интактных животных (результаты 3 независимых экспериментов). Использованные реагенты: креатин моногидрат, креатинфосфат динатриевая соль (тетрагидрат), АДФ натриевая соль, 1-нафтол, диацетил (2,3 бутандиол), дитиотрейтол, ЭДТА фирмы Sigma Aldrich (Германия), а также 40% глюкоза (ОАО Ереванская ХФФ). Для статистической обработки данных использован пакет SPSS (Statistical Package for Social Science) [10]. Характер распределения полученных данных определён методом Колмогорова-Смирнова [10]. Сравнительный анализ проведён с использованием непараметрического теста Манна-Уитни [10]. Различия считались достоверными при р<0,05. Корреляционный анализ проведён с использованием непараметрического теста Спирмена [10].
Повреждения ДНК в мононуклеарных клетках периферической крови крыс оценивали с помощью метода ДНК-комет в щелочных условиях согласно протоколу, описанному в [11]. Очищенные обычные предметные стёкла погружали в 1,5% раствор нормальной расплавленной агарозы, осторожно вынимали, нижние края протирали для удаления излишка агарозы и хранили при комнатной температуре (25 °C) до их использования. Верхний слой слайдов готовили, обычно за день до использования. Суспензию клеток (20 мкл) смешивали с 80 мкл низкоплавкой агарозы (0,5%) и распределяли поверх верхнего слоя предметного стекла. Предметные стёкла выдерживали при 0 °С в течение 5 мин для затвердевания, затем осторожно погружали в свежеприготовленный [(2,5 М NaCl, 100 мМ Na 2 EDTA, 10 мМ Трис, pH 10) с добавлением 1% Triton X-100 и 10% ДМСО непосредственно перед использованием] охлаждаемый лизирующий раствор и оставляли на ночь при 4 °С. Далее предметные стёкла вынимали из лизирующего раствора, погружали в свежеприготовленный буфер для электрофореза (300 мМ NaOH и 1 мМ ЭДТА, pH 13) и оставляли на 20 мин для разматывания ДНК и выявления щелочно-лабильных участков. Электрофорез проводили в течение 30 мин при 300 мА и 25 В. После электрофореза предметные стёкла нейтрализовали путём трёхкратной промывки буфером для нейтрализации (400 мМ Трис, рН 7,5) в течение 5 мин, затем окрашивали бромидом этидия и смотрели под флуоресцентным микроскопом Zeiss III RS (Германия). Для каждой экспериментальной точки были исследованы как минимум 100 клеток. Кометы анализировали с использованием программного обеспечения для анализа CASP. Уровень повреждения ДНК определяли как степень миграции ДНК с использованием “Olive Tail Moment” (OTM), который представляет собой относительное количество ДНК в хвосте кометы, умноженное на медиану расстояния миграции. Для статистической обработки данных использован метод two way ANOVA программного пакета Graphpad prisma 5.1.
Результаты и обсуждение
Резистентность организмов к воздействию экстремальных факторов, в основе которых окислительный стресс, определяется в значительной степени эффективностью регуляторных механизмов поддержания энергетики клетки [3, 4]. КК, как ключевой фермент энергетического метаболизма клетки, проявляет высокую чувствительность к окислительному стрессу как на посттранскрипционном, так и на генном уровнях [12, 13]. Она вовлечена в немедленную ответную реакцию клетки на воздействие стресса, приводящего её к энергетическому истощению. В связи с этим уровень активности этого фермента, а также уровни отношений КФ/АТФ и КФ/Кр принято рассматривать как показатели энергетического статуса клетки [3, 4]. На рис. 1 представлены данные по влиянию Кр-добавки на динамику изменений активности КК (А) и содержания креатина (Б) в печени и сыворотке крови крыс после их однократного общего облучения в дозе 4,5 Гр. Поскольку в контрольной интактной группе животных во все исследованные пострадиационные сроки в уровнях КК-активности не было обнаружено значимых отклонений, рассчитано среднее значение контрольного уровня активности фермента, принятое за 100% (представлено на рис. 1 в виде пунктирной линии). Как следует из этих данных, в первые пострадиационные сутки в печени крыс только контрольной группы, получавшей воду, имеет место статистически недостоверное повышение активности КК примерно на 50%, тогда как в опытной группе крыс, получавших Кр в растворе глюкозы, и в группе, получавшей 0,9% раствор глюкозы, активность фермента сохраняется на контрольном уровне (рис. 1А, а, 1 и 3). Развитие пострадиационных эффектов во времени приводит к постепенному повышению КК-ой активности как в печени крыс контрольных групп, так и опытной группы: в последней до 2,5 раз на 15 сутки, что может быть обусловлено сменой механизмов адаптации с краткосрочной, основанной на постсинтетической регуляции, активности фермента, на долгосрочную, связанную с экспрессией КК, стимулированной, возможно, не только облучением, но и Кр-добавкой [14]. В отличие от опытной группы 1, компенсаторное повышение активности КК в контрольных группах 2 и 3 сменяется к 15 суткам определённым снижением активности фермента, связанным, по-видимому, с истощением нативных адаптационных свойств Кр-КК системы. В то же время в контрольных группах во все сроки содержание креатина в печени достоверно не отличается от контрольного уровня, тогда как в опытной группе во все пострадиационные сроки определяется 15-30% повышение содержания Кр, обусловленное, по-видимому, обогащением этой группы креатиновой добавкой (рис. 1Б). При этом, в первые пострадиационные сутки корреляционный анализ выявил достоверную связь между указанным повышением содержания Кр в печени и стабильностью уровня активности печёночной КК (r=0,972; р=0,028). Наблюдаемые небольшие колебания в уровнях активности КК и в содержании Кр в сыворотке крови животных всех групп во все пострадиационные сроки статистически недостоверны (рис. 1). Таким образом, приведённые данные свидетельствуют о радиомодифицирующем действии Кр на Кр-КК-систему, способствующую адаптации энергетического обмена печени к воздействию ИИ.
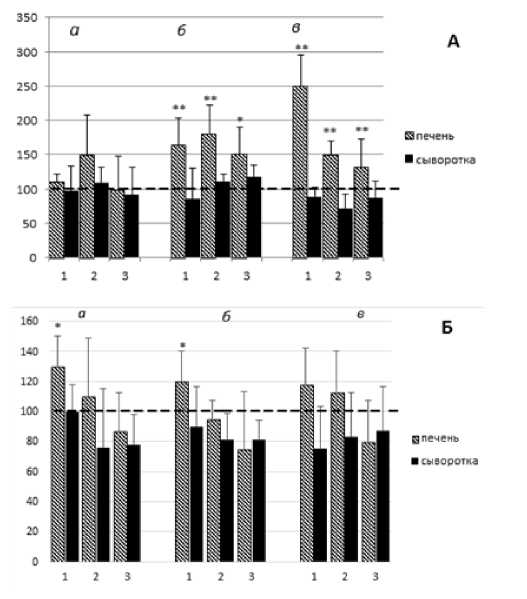
Рис. 1. Динамика изменений уровней активности КК (А, %) и содержания креатина (Б, %) в печени и сыворотке крови крыс после их однократного общего облучения в дозе 4,5 Гр в присутствии и отсутствии креатина.
1 – опытная группа, получавшая креатин/0,9% глюкоза в дозе 1г/кг веса; 2 и 3 – контрольные группы, получавшие соответственно воду и 0,9% раствор глюкозы. Пострадиационные сроки: а – 1, б – 7, в – 15 сутки. Пунктирная линия – контрольный уровень (интактные крысы), принятый за 100%. * – отличие от контроля достоверно при р<0,05-0,001; n=5 для каждой группы животных.
Одновременно с исследованием Кр-КК системы печени было изучено влияние Кр-добавки на динамику пострадиационных изменений активности КК и содержание креатина в мозге и сыворотке крови крыс. Как следует из данных, представленных на рис. 2, в мозге крыс контрольных групп 2 и 3, получавших воду и раствор глюкозы, в первые пострадиационные сутки, имеет место статистически достоверное падение активности КК на 40-50%, тогда как в опытной группе крыс, получавших Кр в растворе глюкозы, активность фермента падает только на 20% (рис. 2А, 1, а). Одновременно с этим в указанных контрольных группах наблюдается статистически недостоверное небольшое повышение содержания эндогенного Кр в мозге (примерно на 15%); достоверное повышение содержания Кр в мозге крыс опытной группы 1 на 27%, очевидно, связано с обогащением организма этих животных креатиновой добавкой (рис. 2Б, 1), поскольку корреляционный анализ не выявил возможную взаимосвязь между этим повышением и указанным выше падением уровня активности мозговой КК этих животных (r1=0,017, p=0,983). В связи с этим следует отметить, что согласно опубликованным данным при длительном использовании креатина в качестве эргогенического средства содержание креатина и его производных может повышаться в клетке вплоть до 30% [3]. Наблюдаемые в 1 пострадиационные сутки небольшие колебания в уровнях активности КК и в содержании Кр в сыворотке крови животных всех 3 групп статистически недостоверны (рис. 2А и 2Б, а).
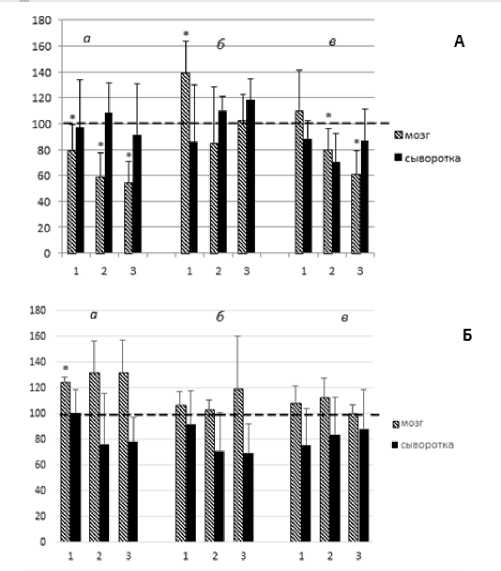
Рис. 2. Динамика изменений уровней активности КК (А, %) и содержания креатина (Б, %) в мозге и сыворотке крови крыс после общего облучения их в дозе 4,5 Гр в присутствии и отсутствии креатина. Обозначения как к рис. 1.
На 7 пострадиационные сутки, на которые приходится разгар лучевой болезни у крыс после облучения их в дозах 4-7 Гр [15], отмеченное в первые сутки падение активности мозговой КК в опытной группе животных сменяется статистически достоверным повышением активности фермента, которое носит, скорее всего, компенсаторный характер; к 15 суткам отмечается стабилизация КК-активности на контрольном уровне как в мозге, так и в сыворотке крови. Содержа- ние Кр в мозге этих крыс в указанные сутки держится на уровне контроля. В то же время в контрольных группах 2 и 3 на 7 пострадиационные сутки обнаруживается тенденция к восстановлению уровня активности мозговой КК до контрольного уровня, которая, однако, на 15 пострадиационные сутки сменяется новым достоверным падением уровня активности фермента (на 20-40%), по-видимому, из-за исчерпания нативных адаптационных возможностей Кр-КК-системы мозга этих животных. Уровни содержания Кр в мозге и сыворотке крови крыс этих групп в указанные сроки колеблются вокруг контрольного уровня. Итак, из приведённых данных следует, что Кр оказывает достоверное противолучевое действие на Кр-КК-систему мозга, обеспечивая, таким образом, адаптацию энергетического обмена ткани к лучевому воздействию.
При облучении крыс в сублетальных и летальных дозах у животных в первую очередь развиваются костномозговая и гастроинтестинальная формы острой лучевой болезни, выздоровление после которой затягивается на месяцы. Как было отмечено выше, разгар болезни начинается с 5-7 дня и длится примерно 2-4 недели [15]. Анализ динамики пострадиационных изменений уровней активности мозговой и печёночной КК в присутствии и отсутствии Кр (рис. 1 и 2) свидетельствует о совпадении характера этих изменений с развитием этой болезни во времени. При этом, указанные изменения во времени разнонаправленны и носят колебательный характер, что, по-видимому, связано с включением в разные пострадиационные сроки разных механизмов адаптации. Кр, как биодобавка, оказывает защитное действие на Кр-КК-систему исследованных органов, особенно очевидное для мозговой КК, в случае которой Кр уменьшает повреждающее действие радиации в первые пострадиационные сутки и стимулирует адаптационные свойства Кр-КК-системы в последующие сроки, обеспечивая, таким образом, полное восстановление энергетического метаболизма мозга к конечному сроку исследования. При этом, необходимо отметить, что есть определённые различия в динамике ответной реакции Кр-КК-системы мозга и печени на облучение как в присутствии, так и в отсутствии Кр. Кр-КК-система мозга, который отличается высоким уровнем энергетического обмена и значительно более высоким содержанием КК и Кр, чем печень [3], проявляет большую радиочувствительность и большую гибкость в адаптации к радиострессу, чем Кр-КК-система печени, которая во временном аспекте позднее реагирует на радиостресс. В связи с этим следует отметить, что в ряде работ обнаружены необычно высокие уровни активности КК в печени человека и животных, подвергшихся стрессу, как, например, обширная гепатоэктомия или воздействие эндотоксина, что многие авторы считают результатом компенсаторного повышения экспрессии КК для стабилизации энергетического обмена [16, 17]. О нативной способности печёночной КК к компенсаторной сверхэкспрессии фермента свидетельствуют и данные, полученные нами для контрольных крыс групп 2 и 3, не получавших Кр-добавку.
Двунитевые разрывы ДНК являются цитотоксической формой ДНК повреждений и в случае некорректной репарации могут инициировать геномную нестабильность, хромосомные аберрации, мутации или апоптоз. Разрывы ДНК, индуцированные радиацией, подвергаются репарации в течение нескольких часов после облучения, хотя этот процесс с меньшей силой может растянуться и на несколько суток. Однако, в случае тяжёлых повреждений ДНК может наступить апоптоз [18]. Известно, что определённый уровень нитевых разрывов ДНК всегда присутствует в клетках млекопитающих вследствие нормального метаболизма: разрывы, вызванные свободными радикалами, продуцируемыми в ходе метаболизма кислорода, и разрывы, как результат репликации, репарации, транскрипции ДНК, а также конденсации и деконденсации хроматина. Для определения степени повреждения ДНК и кинетики репарации на уровне отдельной клетки в радиационной биологии, токсикологии, микродозиметрической технике широко применяется метод ДНК-комет [11, 18]. На рис. 3 представлены комет-изображения мононук-леарных клеток периферической крови интактных контрольных животных (А), а также облучённых крыс, получавших креатиновую добавку (Б) и облучённых контрольных крыс (В). В интактном контроле (А) видны нормальные округлые клетки без хвоста; в облучённом контроле (В) выявляются комет-клетки, содержащие хвост и головку в виде кометы; в опытной группе (Б), крысы которой испытывали радиозащитное действие Кр, клетки по своей форме близки к интактному контролю.
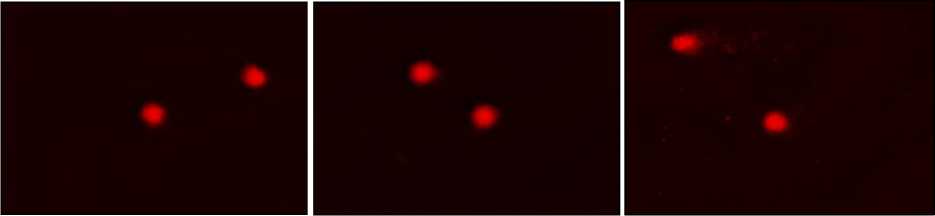
Интактный контроль (А) 1 г креатина/глюкоза+облучение (Б) Облучение (В)
Рис. 3. Комет-изображения мононуклеарных клеток периферической крови после общего рентгеновского облучения крыс в дозе 4,5 Гр в отсутствии и в присутствии Кр как биологической добавки в дозе 1 г/кг веса в течение 2 недель до и после облучения.
Уровень повреждения ДНК определялся как степень миграции ДНК с использованием OTM (olive tail moment), который представляет собой относительное количество ДНК в хвосте кометы, умноженное на медиану расстояния миграции. На рис. 4 в виде диаграммы представлена динамика изменений значений ОТМ, рассчитанных на основе анализа комет с помощью программного обеспечения CASP. Как следует из этих данных, облучение индуцирует значительное повышение величин ОТМ в облучённых группах по сравнению с интактным контролем, свидетельствующее о повреждениях ДНК в мононуклеарных клетках периферической крови животных этих групп. При этом обогащение рациона крыс Кр-добавкой приводит к существенно более низким значениям ОТМ в группе этих животных в сравнении с облучённым контролем, не получавшем Кр (в 1,8 раз), что однозначно указывает на радиозащитный эффект Кр на повреждения ДНК. Спустя 7 дней после облучения в этой же опытной группе падение значений ОТМ достигает уровня повреждений ДНК в интактном контроле, тогда как в облучённом контроле уровень повреждений ДНК резко падает и оказывается достоверно ниже по сравнению с соответствующим уровнем интактного контроля. На 15 день после облучения уровень повреждений ДНК в опытной группе не изменяется, оставаясь на уровне интактного контроля, в то время как в облучённом контроле выявляется статистически достоверное повышение значений ОТМ, как в сравнении с интактной группой, так и в сравнении с опытной группой, получавшей Кр, свидетельствующее о появлении новых повреждений ДНК. Поскольку исследуемые клетки крови являются полностью дифференцированными клетками, которые обладают низкой ДНК-репари-рующей активностью [19], можно предположить, что резкое уменьшение количества клеток с сильно повреждённой ДНК в облучённом контроле на 7 пострадиационные сутки может быть объяснено скорее их элиминацией, чем репарацией, в то время как компенсаторная репопуляция, запущенная активной пролиферацией выживших стволовых клеток, может привести к появ- лению неповреждённых клеток, т.е. обновлению клеточной популяции [18] и, в результате, к уменьшению значений ОТМ. Однако, в этой же группе крыс через 15 дней после облучения выявляется увеличение числа клеток с повреждённой ДНК, которое в этом случае может быть обусловлено системным воздействием облучения, такими как индуцированные радиацией кластогенные факторы плазмы, пертурбации окислительного метаболизма и хронические воспалительные реакции, приводящим к отдалённым эффектам ИО на геномную стабильность и др. [18]. В этом контексте, очевидный радиозащитный эффект Кр, наблюдаемый в первые пострадиационные сутки, а также проявляющийся в одинаковых с интактным контролем значениях уровней повреждений ДНК на 7 и 15 пострадиационные сутки, имеет, по-видимому, системный характер, поскольку изменения значений ОТМ, отмеченные выше для облучённого контроля, в данном случае не наблюдаются. В связи с вышеперечисленным, представляют интерес данные о цитопротекторном действии Кр на повреждения, индуцированные окислительными агентами в лимфоцитах и эритроцитах, выделенных из крови человека [14]. Авторы связывают последнее с прямой антиоксидантной активностью Кр, обусловленной его способностью обезвреживать свободные радикалы и активные формы кислорода, а также его способностью предотвращать подавление клеточной энзиматической и неэнзиматической систем антиоксидантной защиты (предотвращение падения уровня глютатиона, а также инактивации антиоксидантных ферментов и др.). Отдельно следует отметить выявленное этими же авторами методом комет-анализа протекторное действие Кр на повреждения ДНК лимфоцитов, индуцированные окислительным стрессом, вызванным добавлением к клеткам Н2О2, что однозначно поддерживает наш вывод о протекторном действии Кр на генотоксичность, индуцированную ИИ.
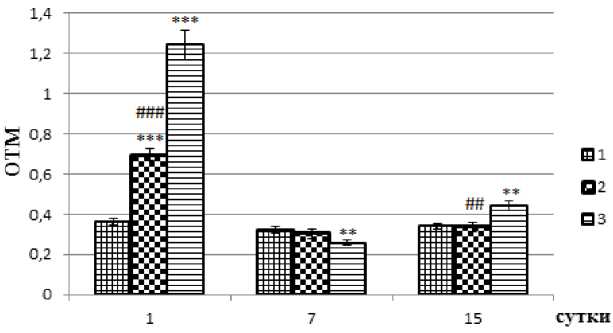
Рис. 4. Уровни повреждений ДНК в мононуклеарных клетках периферической крови крыс через 1, 7 и 15 дней после общего однократного рентгеновского облучения в дозе 4,5 Гр.
1 – интактный контроль; 2 – опытная группа, получавшая креатин в дозе 1г/кг веса за 2 недели до и 2 недели после облучения; 3 – облучённый контроль; *** - p<0,001 по сравнению с интактным контролем, ### - p<0,001 по сравнению с облучённым контролем.
Ранее нами было показано радиопротекторное действие Кр на выживаемость крыс, подвергнутых рентгеновскому облучению в дозе ЛД70/30, равной 6,5 Гр. Радиозащитный эффект Кр, рассчитанный согласно статистической модели выживаемости Каплана-Мейера, составил для группы, получавшей раствор Кр в 0,9% глюкозе, по отношению к контрольной группе, получавшей вместо Кр воду – 38,6%, а по отношению к контрольной группе, получавшей 0,9% раствор глюкозы – 30,3%. Средняя продолжительность жизни для крыс, получавших Кр+глюкоза, составила 21,7 дней, что значительно выше этой величины в 14,7 дней для соответствующей им кон- трольной группы, получавшей раствор глюкозы [20]. Таким образом, приведённые выше данные однозначно поддерживают сделанный нами ранее вывод о противолучевой эффективности Кр, оказавшегося способным повышать резистентность и адаптабельность крыс к ионизирующему облучению.
Выводы
-
1. Показано, что Кр как биодобавка оказывает защитное действие на Кр-КК-систему мозга и печени облучённых крыс, уменьшая повреждающее действие радиации и стимулируя её адаптационные свойства.
-
2. При этом Кр-КК-система мозга, который отличается более интенсивным энергетическим обменом и более высоким содержанием КК и Кр, чем печень, проявляет большую радиочувствительность, но и большую гибкость в адаптации к радиострессу.
-
3. Кр оказывает радиозащитное действие на повреждения ДНК мононуклеарных клеток периферической крови крыс , снижая уровень индуцированных облучением повреждений ДНК в первые пострадиационные сутки почти в 2 раза по сравнению с соответствующим облучённым контролем; к 7 суткам этот уровень достигает контрольного значения, рассчитанного для интактных клеток, и сохраняется на нём и на 15 пострадиационные сутки.
-
4. Полученные данные свидетельствуют о противолучевой эффективности природного адаптогена Кр, оказавшегося способным повышать резистентность и адаптабельность крыс к рентгеновскому облучению.
Список литературы Радиозащитный эффект креатина при повреждении ДНК мононуклеарных клеток периферической крови и адаптационные возможности креатин-креатинкиназной системы мозга и печени крыс
- Sweeney T.R. A survey of compounds from the antiradiation drug development program of the U.S. Army Medical Research and development command. Washington: Government Printing office, 1979. P. 308-318.
- Little J.B. Cellular, molecular and carcinogenic effects of radiation //Hematol. Oncol. Clin. 1993. V. 7, N 2. P. 337-352.
- Wallimann T., Tokarska-Schlattner M., Schlattner U. The creatine kinase system and pleiotropic effects of creatine //Amino Acids. 2011. V. 40, N 5. P. 1271-1296.
- Nersesova L.S. Role of creatine kinase and its substrates in the central nervous system in norm and in various pathologies //J. Evol. Biochem. Physiol. 2011. V. 47, N 2, P. 140-150.
- Lawler J.M., Barnes W.S., Wu G., Song W., Demaree S. Direct antioxidant properties of creatine //Biochem. Biophys. Res. Commun. 2002. V. 290, N 2. P. 47-52.
- Sestili P., Martinelli C., Bravi G., Picolli G., Curci R. Creatine supplementation affords cytoprotection in oxidatively injured cultured mammalian cells via direct antioxidiant activity //Free Radic. Biol. Med. 2006. V. 40, N 5. P. 837-849.
- Alcaide P., Merinero B., Ruiz-Sala P. Defining the pathogenicity of creatine deficiency syndrome //Hum. Mutat. 2011. V 32, N 3. P. 282-291.
- Нерсесова Л.^, Газарянц М.Г., Мкртчян З^. Влияние ионизирующей радиации на ферментные активности и состояние ядерно-ядрышкового аппарата гепатоцитов крыс //Радиационная. биология. Радиоэкология. 2013. T. 53, № 1. С. 55-62.
- Петрова Т.А., Лызлова С.Н. Оптимизация условий определения активности креатинкиназы колориметрическим методом //Вестник ЛГУ. 1985. № 24. С. 88-90.
- Field A. Discovering statistics using IBM SPSS statistics. Los Angeles: SAGE Publications Ltd., 2013. 2617 p.
- Tice R.R., Andrews P., Hirai O., Singh N.P. The single cell gel (SCG) assay: an electrophoretic technique for the detection of DNA damage in individual cells //Adv. Exp. Med. Biol. 1991. V. 283. P. 157-164.
- Malone J., Ullrich R. Novel radiation response genes identified in gene trapped MCF10A mammary epithelial cells //Radiat. Res. 2007. V. 167, N 2. Р. 176-184.
- Aksenov M., Aksenova M., Butterfield D.A., Markesbery W.R. Protein oxidation in the brain in Alzheimer's disease //Neuroscience. 2001. V. 103, N 2. P. 373-383.
- Qasim N., Mahmood R. Diminution of oxidative damage to human erythrocytes and lymphocytes by creatine: possible role of creatine in blood //Plos One. 2015. V. 10, N 15. P. 1-21.
- Шевцов В.И., Ирьянов Ю.М., Петровская Н.В., Ирьянова Т.Ю., Мигалкин Н.С., Очеретина Р.Ю. Методика моделирования острой лучевой болезни у крыс линии Август //Современные наукоемкие технологии. 2004. № 1. С. 95.
- Hatano E., Tanaka A., Iwata S., Satoh S., Kitai T., Tsunekawa S., Inomoto T., Shinohara H., Chance B., Yamaoka Y. Induction of endotoxin tolerance in transgenic mouse liver expressing creatine kinase //Hepatology. 1996. V. 24, N 3. P. 663-669.
- Satoh S., Tanaka A., Hatano E., Inomoto T., Iwata S., Kitai T., Shinohara H., Tsunekawa S., Chance B., Yamaoka Y. Energy metabolism and regeneration in transgenic mouse liver expressing creatine kinase after major hepatectomy //Gastroenterology. 1996. V. 110, N 4. P. 1166-1174.
- Garau M.M., Calduch A.L., Lopez E.C. Radiobiology of the acute radiation syndrome //Rep. Pract. Oncol. Radiother., 2011, V. 16, N 4, P. 123-130.
- Nouspikel T. DNA repair in differentiated cells: some new answers to old questions //Neuroscience. 2007. V. 145, N 4. P. 1213-1221.
- Petrosyan M.S., Nersesova L.S., Gazaryants M.G., Malakyan M.H., Akopian J.I. Creatine kinase effects of ionizing radiation and radioprotective potential of creatine //The BRITE (Biomarkers of Radiation In The Environment): Robust tools for risk assessment. Advanced Research Workshop: Proceedings. Yerevan, 2017. P. 37.


