Рак яичников, первичный рак брюшины и рак маточных труб
Автор: Покатаев И.А., Дудина И.А., Коломиец Л.А., Морхов К.Ю., Нечушкина В.М., Румянцев А.А., Тюляндин С.А., Урманчеева А.Ф., Хохлова С.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-2 т.14, 2024 года.
Бесплатный доступ
В данном разделе указаны критерии оценки клинической значимости применения дорогостоящей противоопухолевой лекарственной терапии в соответствии со шкалой, разработанной экспертной группой (стр. 6). В тексте они обозначены, как магнитуда клинической значимости (МКЗ).
Рак яичников, афп, β-хгч, циторедукция, мутации генов brca1/2, химиотерапия, рецидив
Короткий адрес: https://sciup.org/140307424
IDR: 140307424 | DOI: 10.18027/2224-5057-2024-14-3s2-1.2-02
Текст научной статьи Рак яичников, первичный рак брюшины и рак маточных труб
BRCA1/2, химиотерапия, рецидив
Клиническое течение и методы лечения первичного рака брюшины и рака маточных труб аналогичны таковым при раке яичников (РЯ), в связи с этим все три нозологические формы рассматриваются совместно в одном разделе.
1. ОПРЕДЕЛЕНИЕ СТАДИИ
Клиническое, радиологическое и хирургическое стадирование производится в соответствии с классификацией TNM (8-е издание, 2016 г.) и FIGO (2014 г., табл. 1).
Таблица 1. Система стадирования рака яичников по TNM (8-е издание, 2016 г.) и FIGO (2014 г.)
|
TNM |
FIGO |
|
|
Т1 |
I |
Опухоль ограничена яичниками |
|
Т1а |
IA |
Опухоль ограничена одним яичником, капсула не повреждена, нет опухолевых разрастаний на поверхности яичника, нет злокачественных клеток в асцитической жидкости или смывах из брюшной полости |
|
Т1b |
IB |
Опухоль ограничена двумя яичниками, их капсулы не повреждены, нет опухолевых разрастаний на поверхности яичников, нет злокачественных клеток в асцитической жидкости или смывах из брюшной полости |
|
T1c |
IC |
Опухоль ограничена одним или двумя яичниками и сопровождается любым из следующих факторов |
|
T1c1 |
IC1 |
Повреждение капсулы во время операции |
|
T1c2 |
IC2 |
Повреждение капсулы до операции или опухоль на поверхности яичника /маточной трубы |
|
T1c3 |
IC3 |
Злокачественные клетки в асцитической жидкости или смывах с брюшины |
|
TNM |
FIGO |
|
|
T2 |
II |
Опухоль поражает один или два яичника с распространением на малый таз |
|
T2a |
IIA |
Врастание и/или метастазирование в матку и/или в одну или обе маточные трубы |
|
T2b |
IIB |
Распространение на другие ткани таза |
|
T3 и/или N1 |
III |
Опухоль поражает один или оба яичника с гистологически подтвержденными внутрибрюшинными метастазами за пределами таза и/или метастазами в регионарных лимфатических узлах (внутренних, наружных и общих подвздошных, запирательных, крестцовых или поясничных лимфоузлах) |
|
N1 |
IIIA1 |
Метастазы только в забрюшинных лимфатических узлах |
|
IIIA1 (i) |
Метастазы в лимфатических узлах размерами до 10 мм |
|
|
IIIA1 (ii) |
Метастазы в лимфатических узлах размерами более 10 мм |
|
|
T3a |
IIIA2 |
Микроскопические гистологически подтвержденные внутрибрюшинные метастазы за пределами таза ± метастазы в забрюшинных лимфатических узлах |
|
T3b |
IIIB |
Макроскопические внутрибрюшинные метастазы за пределами таза до 2 см включительно в наибольшем измерении ± метастазы в забрюшинных лимфатических узлах |
|
T3с |
IIIC |
Внутрибрюшинные метастазы за пределами таза более 2 см в наибольшем измерении ± метастазы в забрюшинных лимфатических узлах (включая распространение опухоли на капсулу печени и селезенки без поражения паренхимы органов) |
|
M1 |
IV |
Отдаленные метастазы (исключая внутрибрюшинные метастазы) |
|
IVA |
Плевральный выпот со злокачественными клетками |
|
|
IVB |
Метастазы в паренхиматозных органах и других органах вне брюшной полости (в том числе паховых лимфатических узлах и лимфатических узлах за пределами брюшной полости) |
2. ДИАГНОСТИКА
Диагноз РЯ устанавливается на основании гистологического исследования материала, полученного во время операции или при биопсии на дооперационном этапе. При невозможности выполнения на первом этапе оперативного вмешательства или биопсии лечение начинается с предоперационной ХТ, в этом случае диагноз может быть установлен на основании данных цитологического исследования, уровня СА125, клинической картины и отсутствия данных за первичную опухоль других локализаций. Рекомендуемый алгоритм диагностики при РЯ представлен на рис. 1.
К злокачественным эпителиальным опухолям яичников относят следующие гистологические типы (классификация ВОЗ, 5-е издание, 2020 г.):
-
• серозная карцинома;
– низкой степени злокачественности ( low grade );
– высокой степени злокачественности ( high grade );
-
• эндометриоидная карцинома;
– серо-муцинозная карцинома;
-
• муцинозная карцинома;
-
• светлоклеточная карцинома;
-
• злокачественная опухоль Бреннера;
-
• недифференцированная карцинома;
-
• смешанная эпителиальная карцинома;
-
• мезонефроподобная карцинома;
-
• карциносаркома.
Классификацией ВОЗ предусматривается разделение серозного гистологического подтипа на две степени злокачественности — низкую ( low grade ) и высокую ( high grade ), в то время как для оценки эндометриоидных и муцинозных опухолей следует использовать трехуровневую морфологическую систему оценки степени злокачественности (опухоли низкой, умеренной и высокой степени злокачественности). Степень злокачественности опухоли обязательно должна быть отражена в патоморфологическом заключении, так как это может иметь значение для определения тактики лечения.
Объем обследования для установки диагноза:
• осмотр, сбор анамнеза болезни, семейного анамнеза;
• клинический анализ крови;
• биохимический анализ крови с показателями функции печени, почек;
• коагулограмма;
• общий анализ мочи;
• определение концентрации СА125 в плазме крови;
• для женщин моложе 40 лет: определение концентрации в плазме крови АФП, β-ХГЧ и ЛДГ для исключения герминогенных опухолей, а также ингибина — для исключения стромальных опухолей;
• УЗИ органов брюшной полости и малого таза, шейно-надключичных, паховых областей и забрюшинного пространства, вен нижних конечностей по показаниям;
• КТ органов грудной клетки с в/в контрастированием;
• ЭГДС;
• колоноскопия;
• КТ брюшной полости и малого таза с в/ в контрастированием и/ или МРТ брюшной полости и малого таза с в/в контрастированием и/или ПЭТ-КТ (данный метод не следует использовать для оценки эффективности ХТ и в процессе наблюдения, рекомендуется только для оценки степени распространенности опухолевого процесса при решения и вопроса о его резектабельности);
• для женщин старше 40 лет: маммография для исключения рака молочной железы с метастазами в яичниках;
• определение концентрации НЕ4 в плазме крови и определение индекса ROMA при отсутствии морфологической верификации диагноза;
• определение РЭА и CA19-9 в крови при подозрении на муцинозную карциному;
• диагностическая лапароскопия может выполняться для оценки резектабельности опухолевого процесса в сомнительных случаях.
3. ЛЕЧЕНИЕ ПЕРВИЧНОГО РАКА ЯИЧНИКОВ, РАКА БРЮШИНЫ И РАКА МАТОЧНЫХ ТРУБ
3.1. Хирургическое лечение и хирургическое стадирование
При многоцикловом лечении необходимые показатели для мониторинга определяются перед каждым курсом ХТ, перечень и сроки их выполнения подробно описаны в главе по общим принципам проведения противоопухолевой терапии.
Всем пациенткам с серозными и эндометриоидными карциномами высокой степени злокачественности показано определение патогенных мутаций генов BRCA1/2 в образце крови и/или опухоли методом ПЦР для поиска типичных наследственных мутаций. При отрицательном результате данного метода рекомендуется выполнение полного геномного секвенирования опухолевого образца для выявления редких герминальных и соматических мутаций в генах BRCA1/2. У пациентов с герминальными мутациями желательно проведение последующего генетического консультирования для определения необходимости ДНК-диагностики кровных родственников.
При возможности тестирования на выявление дефицита системы репарации путем гомологичной репарации ДНК (HRD), который включает в себя определение патогенных мутаций в генах BRCА1/2 и геномной нестабильности, отдельный анализ на определение мутаций в генах BRCA проводить нецелесообразно. Определение HRD статуса проводится на образце опухолевой ткани.
При эндометриоидных, муцинозных и светлоклеточных карциномах яичников целесообразно определение в опухолевом образце MSI/MMR методом ИГХ для определения показаний к иммунотерапии.
Выполнение комплексного геномного профилирования не рекомендуется в связи с крайне низкой вероятностью обнаружения терапевтически значимых мутаций. Окончательное стадирование по TNM и FIGO осуществляется после лапаротомии (табл. 1).
Выполнение лимфаденэктомии у пациенток с III–IV стадиями целесообразно при полной или оптимальной циторедукции в случае подозрения на метастатическое поражение лимфоузлов по данным предоперационного обследования или интраоперационной ревизии. Удалению подлежат внутренние, наружные, общие подвздошные, запиратель- ные, преаортальные, парааортальные, аортокавальные, прекавальные и паракавальные, крестцовые лимфоузлы до уровня почечных сосудов (рис. 2, 3).
Протокол операции должен содержать информацию об остаточной опухоли (размеры, количество очагов, локализация).
При визуальной картине I–II стадий обязательно выполнение процедур хирургического стадирования, которое включает следующее:
Органосохраняющее хирургическое вмешательство (односторонняя аднексэктомия с резекцией второго яичника, оментэктомия, тазовая и поясничная лимфаденэктомия и выполнение процедур стадирования) в виде исключения возможно у молодых пациенток, желающих сохранить фертильность, при высокодифференцированных серозной, эндометриоидной или муцинозной карциномах IA и IC1 (при поражении одного яичника) стадий при наличии возможности тщательного диспансерного наблюдения и доказанном отсутствии наследственного характера заболевания. При эндометриоидном гистологическом варианте в этих случаях следует выполнить биопсию эндометрия для исключения синхронного рака эндометрия. Лекарственное лечение после органосохраняющего лечения проводится по тем же показаниям, как и после стандартного объема хирургического вмешательства (рис. 2).
При I–II стадии в случае невыполнения процедур стадирования во время первой операции рекомендуется выполнение повторной операции с целью стадирования (рис. 4).
Малоинвазивные хирургические вмешательства, в частности лапароскопические, могут быть использованы только для верификации диагноза, определения стадии или для прогнозирования объема циторедуктивной операции.
Решение вопроса о проведении ХТ после операции основано на информации о стадии процесса, морфологическом варианте опухоли и степени злокачественности (табл. 2). ХТ желательно начинать не позднее 25 дня после операции, поскольку отсрочка начала ХТ позднее 25 дня приводит к ухудшению прогноза заболевания.
Таблица 2. Алгоритм назначения химиотерапии в зависимости от стадии и морфологических особенностей опухоли
|
Морфологические особенности опухоли |
Стадия |
Вариант лечения |
|
Серозная карцинома low grade Муцинозная карцинома Эндометриоидная карцинома G1 или G2 Светлоклеточная карцинома |
IA-IB |
Адъювантная ХТ не показана |
|
Серозная карцинома high grade Эндометриоидная карцинома G3 Карциносаркома |
IA-IB |
4–6 циклов адъювантной платиносодержащей ХТ |
|
Любой гистологический тип при отсутствии процедур полного хирургического стадирования |
IA-IB |
6 циклов адъювантной платиносодержащей ХТ или повторное оперативное вмешательство с полным хирургическим стадировани-ем с последующей ХТ по показаниям |
|
Любой гистологический тип |
IC–IV |
6 циклов лечебной платиносодержащей ХТ 1 |
1 Оптимальная длительность неоадъювантной ХТ (III–IV стадии при невозможности оптимальной первичной циторедукции) — 2–3 курса.
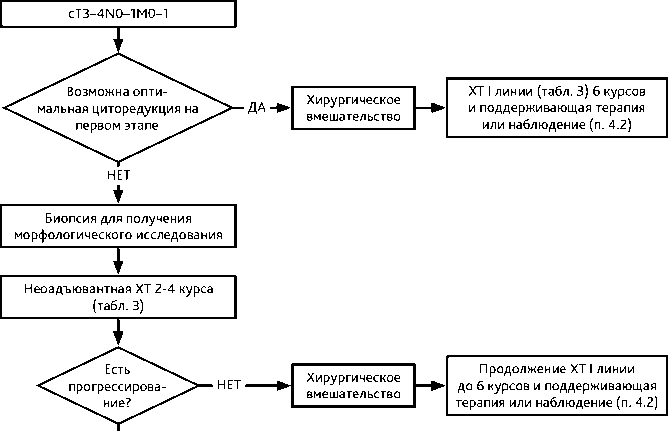
При невозможности выполнения на первом этапе хирургического вмешательства (неудовлетворительное общее состояние вследствие значительного распространения опухолевого процесса, серьезная сопутствующая патология) следует начинать лечение с ХТ с последующей промежуточной циторедуктивной операцией в максимально короткие сроки (после 2–3 циклов ХТ). После операции проводятся дополнительно 3–4 цикла ХТ по той же схеме вне зависимости от выраженности лечебного патоморфоза. В случае прогрессирования в процессе предоперационной ХТ возможен отказ от выполнения интервальной циторедукции и назначение ХТ II линии (рис. 3).
Использование внутрибрюшинной гипертермической химиоперфузии (HIPEC) не рекомендуется в рутинной клинической практике.
В табл. 3 представлены рекомендуемые режимы адъювантной и лечебной (I линии) ХТ.
При прогрессировании на фоне ХТ I линии (платинорефрактерный рак) возможна попытка монохимиотерапии одним из неплатиновых препаратов (табл. 4). Во всех других случаях, в том числе при неполном эффекте и наличии остаточной опухоли, целесообразно завершить лечение после 6 (максимум — 8) циклов ХТ и перейти к динамическому наблюдению или поддерживающей терапии до появления признаков прогрессирования заболевания.
Таблица 3. Рекомендуемые режимы химиотерапии первичного рака яичников
|
Показания |
Режим химиотерапии |
|
Паклитаксел 175 мг/м 2 в/в в 1-й день + карбоплатин AUC6 в/в в 1-й день каждые 3 нед. 1 Паклитаксел 175 мг/м 2 в/в в 1-й день + цисплатин 75 мг/м 2 в/в в 1-й день каждые 3 нед. 1 Доцетаксел 75 мг/м 2 в/в в 1-й день + цисплатин 75 мг/м 2 в/в в 1-й день каждые 3 нед. 1 Паклитаксел 60 мг/м 2 в/в еженедельно + карбоплатин AUC2 в/в еженедельно (18 введений) 1,2 Паклитаксел 80 мг/м 2 1, 8 и 15 дни в/в + карбоплатин AUC5–6 в/в 1 день каждые 3 нед. 1 |
1 У пациенток с III–IV стадиями и отсутствием мутаций BRCA1 /2 к ХТ может быть добавлен беваци-зумаб в следующих случаях: 1) при наличии резидуальных опухолевых узлов > 10 мм; 2) при невозможности выполнения циторедуктивной операции (в данный момент и в перспективе); 3) при IV стадии. Не следует использовать бевацизумаб при проведении предоперационной ХТ. Введение бевацизумаба (7,5 или 15 мг/кг в / в 1 раз в 3 нед.) может быть начато с первого или второго курса ХТ и продолжено после ее завершения до общего количества 18–22 введения (или до прогрессирования, если оно наступит раньше).
-
2 Предпочтительный режим для пациенток в возрасте ≥ 70 лет.
-
3.2.2. Поддерживающая терапия после химиотерапии первой линии
-
3.2.2.1. Бевацизумаб
-
3.2.2.2. Олапариб
Назначение поддерживающей терапии основывается на данных о мутации BRCA1/2 и/или HRD статусе. Выбор поддерживающей терапии в зависимости от вышеуказанных характеристик представлен в табл. 4.
При назначении бевацизумаба в сочетании с ХТ возможно его продолжение в качестве поддерживающего лечения в дозах 7,5 или 15 мг/кг в/в 1 раз в 3 нед. до общего количества 18–22 введений (или до прогрессирования, если оно наступит раньше). Если в процессе ХТ I линии в сочетании с бевацизумабом у пациентки была выявлена мутация генов BRCA 1/2, рекомендовано перевести пациентку на поддерживающее лечение олапарибом в сочетании или без бевацизумаба.
При выявлении позитивного HRD статуса за счет наличия признаков геномной нестабильности при отсутствии патогенных мутаций в генах BRCA 1/2 возможно продолжение поддерживающей терапии бевацизумабом 18–22 введения в сочетании с олапарибом
| том /vol. 14(3s2) 2024 ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors в течении 2 лет. Однако целесообразность применения бевацизумаба в данном контексте неизвестна, но может приводить к повышению частоты развития нежелательных явлений. Режим дозирования олапариба — см. пункт 3.2.2.2.
Пациенткам с серозным/эндометриоидным РЯ высокой степени злокачественности III–IV cтадий рекомендовано назначение поддерживающей монотерапии олапарибом при соблюдении следующих условий:
-
• наличие герминальной или соматической мутаций в генах BRCA 1/2;
-
• противоопухолевый ответ (полный или частичный) на комбинированное лечение, включающее циторедуктивную операцию любого объема и/или платиносодержащей ХТ I линии;
-
• при HRD-позитивном статусе, обусловленном признаками геномной нестабильности без наличия мутации BRCA1/2, в комбинации с поддерживающей терапией бевацизумабом.
-
3.2.2.3. Гормонотерапия
-
3.3. Наблюдение после первичного лечения
Поддерживающая терапия олапарибом (в таблетках) проводится в дозе 300 мг × 2 раза в сутки внутрь в течение 2 лет или до прогрессирования (если последнее наступит раньше) или непереносимой токсичности. Желательно начать поддерживающую терапию олапарибом в течение 8 нед. после окончания ХТ.
Таблица 4. Варианты поддерживающего лечения после химиотерапии I линии для пациенток с РЯ III–IV стадии в зависимости от результатов молекулярногенетического тестирования
|
Тип молекулярного нарушения |
Вариант поддерживающего лечения |
|
HRD позитивный, BRCA1/2 мутация есть |
|
|
HRD позитивный, BRCA1/2 мутации нет |
|
|
HRD негативный, BRCA1/2 мутации нет |
|
В случае серозного рака низкой степени злокачественности и эндометриоидного рака G1G2 II–IV стадий после окончания ХТ возможна поддерживающая эндокринная терапия ингибиторами ароматазы (в стандартных дозах) в течение 3 лет или до прогрессирования. Необходимость определения экспрессии РЭ и РП в опухоли для оценки предполагаемой чувствительности к эндокринной терапии при РЯ не доказана и не является обязательной.
Рекомендуемый алгоритм лечения РЯ в зависимости от стадии представлен на рис. 2, 3, 4.
Принципы наблюдения за пациентками с РЯ после первичного лечения до конца не определены. Результаты крупного международного исследования MRC OV-05 продемонстрировали отсутствие необходимости тщательного инструментального обследования с целью максимально раннего выявления рецидива. ХТ II линии целесообразно начинать при появлении клинических симптомов. Раннее начало ХТ II линии, например, при маркерном рецидиве, не увеличивает продолжительность жизни, но ухудшает ее качество за счет побочных эффектов лечения.
По этой причине члены рабочей группы предлагают следующий алгоритм наблюдения за пациентками:
• определение концентрации СА125 в плазме крови, осмотр гинеколога и УЗИ брюшной полости и малого таза, забрюшинного пространства 1 раз в 3 мес. — в течение первых 2 лет, 1 раз в 4 мес. — в течение 3-го года, далее — каждые 6 мес.;
• углубленное обследование (КТ брюшной полости и малого таза, рентгенография/КТ грудной клетки, ПЭТ-КТ в случае планирования хирургического лечения) показано при росте СА125, появлении жалоб или выявлении патологии при гинекологическом осмотре или УЗИ.
4. ЛЕЧЕНИЕ РЕЦИДИВОВ РАКА ЯИЧНИКОВ, РАКА БРЮШИНЫ И РАКА МАТОЧНЫХ ТРУБ
4.1. Критерии прогрессирования и показания к началу лекарственной терапии
Прогрессированием РЯ является наличие любого из перечисленных ниже критериев:
-
• клинические (осмотр, пальпация) или радиологические (данные инструментального обследования) признаки прогрессирования;
-
• повышение уровня СА125, подтвержденное двумя последовательными анализами, выполненными с интервалом не менее 1 недели, с соблюдением следующих условий: – повышение концентрации СА125 в 2 раза выше ВГН при нормальных предшествующих значениях;
– повышение уровня СА125 в 2 раза выше своего наименьшего значения, зарегистрированного во время лечения и наблюдения (при отсутствии нормализации маркера).
-
4.2. Повторные циторедуктивные вмешательства
Признаки прогрессирования не являются абсолютным показанием для начала новой линии ХТ, а служат для оценки эффективности предыдущего лечения, в т. ч. определения длительности бесплатинового интервала. Показанием для ХТ II и последующих линий является рост опухолевых очагов и/или наличие жалоб, связанных с опухолевым ростом.
У некоторых пациенток с рецидивами РЯ могут выполняться повторные циторедуктивные вмешательства. После ранее выполненной циторедукции с достижением полного ответа после первичного лечения может обсуждаться хирургическое лечение рецидивов РЯ при соблюдении следующих условий:
-
• длительность бесплатинового интервала > 6 мес.;
-
• отсутствие клинически значимого асцита;
-
• удовлетворительное общее состояние пациентки (по шкале ECOG 0 баллов).
-
4.3. Выбор режима химиотерапии
Повторная циторедуктивная операция целесообразна только в том случае, если хирург считает возможным выполнение полной циторедукции (без макроскопически определяемой остаточной опухоли). Хирургическое вмешательство следует планировать до начала ХТ по поводу рецидива. Показания к выполнению хирургических вмешательств по поводу рецидивов «редких» гистотипов рака яичников (low-grade опухоли, светлоклеточный рак, муцинозная аденокарцинома) определяются индивидуально (рис. 5).
В соответствии с общепринятой традицией выделяют следующие типы рецидивов рака яичников:
-
• платиночувствительный: длительность бесплатинового интервала > 6 мес.;
-
• платинорезистентный: длительность бесплатинового интервала < 6 мес.;
-
• платинорефрактерный: прогрессирование во время платиносодержащей ХТ I линии либо в течение 1 мес. после ее завершения.
При выборе варианта противоопухолевой терапии следует учитывать общее состояние пациентки, длительность бесплатинового интервала, эффективность предшествующей платиносодержащей ХТ, мутационный статус генов BRCA1/2, нежелательные эффекты ранее проведенной терапии и выраженность симптомов опухолевого процесса. При платиночувствительном рецидиве показано назначение комбинации цисплатина или карбоплатина с другим противоопухолевым препаратом, не использовавшимся ранее (табл. 5). При длительности бесплатинового интервала > 24 мес. возможно повторное назначение комбинации производного платины и таксанов. При меньшей длительности бесплати-нового интервала предпочтение следует отдавать использованию другой схемы платиносодержащей химиотерапии. Использование неплатиновых дуплетов (то есть схем лечения, включающих два неплатиновых агента), не рекомендуется.
При длительности бесплатинового интервала менее 6 мес. целесообразно рассмотреть назначение монохимиотерапии неплатиновыми агентами. При дальнейшем прогрессировании опухоли повторное применение платиносодержащей ХТ является предпочтительным, если ранее не было зарегистрировано прогрессирования опухоли во время ХТ производными платины. При наличии мутации в генах BRCA целесообразно сразу проводить платиносодержащую ХТ, если ранее не было зарегистрировано прогрессирования опухоли во время ХТ производными платины (табл. 5).
В случае прогрессирования заболевания в процессе двух последовательных линий ХТ целесообразность продолжения лечения сомнительна. В этом случае рекомендуется рассмотреть возможность проведения симптоматической терапии или включения пациентки в клинические исследования.
При использовании в I линии ХТ бестаксановой комбинации включение такса-нов в режим II линии является предпочтительным (в комбинации с производными платины — при платиночувствительном рецидиве и монохимиотерапия таксанами — при платинорезистентном рецидиве). Рекомендуемое количество циклов ХТ II линии составляет 4–6 при наличии эффекта и удовлетворительной переносимости. Метроном-ная терапия проводится до прогрессирования или непереносимой токсичности (рис. 5).
Алгоритм терапии последующих рецидивов аналогичен описанному выше.
Таблица 5. Рекомендуемые режимы химиотерапии рецидивов рака яичников
|
Режим химиотерапии |
|
|
Комбинированная химиотерапия |
Карбоплатин AUC5–6 в/в в 1-й день 21-дневного цикла в сочетании с одним из следующих препаратов:
Цисплатин 60–75 мг/м 2 в/в в 1-й день 21-дневного цикла в сочетании с одним из следующих препаратов:
|
|
Режим химиотерапии |
|
|
Оксалиплатин 100–130 мг/м 2 в/в в 1-й день в сочетании с одним из следующих препаратов:
Оксалиплатин 85 мг/м 2 в/в в 1-й день + фолинат кальция 400 мг/м 2 в/в в 1-й день + фторурацил 400 мг/м 2 в/в болюс в 1-й день + фторурацил 2400 мг/м 2 в/в инфузия в течение 46 часов, интервал между циклами 14 дней (приоритетный режим для муцинозного рака после таксан-содержащей ХТ) |
|
|
Монохимиотерапия, метрономная химиотерапия, иммунотерапия |
Этопозид 100 мг внутрь в 1-й — 10-й дни 21-дневного цикла или 50 мг внутрь в 1-й — 21-й дни 28-дневного цикла; Доксорубицин 50–60 мг/м 2 в/в в 1-й день 21-дневного цикла; Винорелбин 25 мг/м 2 в/в в 1-й, 8-й дни 21-дневного цикла; Пегилированный липосомальный доксорубицин 40–50 мг/м 2 в 1-й день 28-дневного цикла; Гемцитабин 1000 мг/м 2 1-й, 8-й, 15-й дни 28-дневного цикла; Паклитаксел 60–80 мг/м 2 в/в в еженедельно (день 1-й, 8-й, 15-й 21-дневного или 28-дневного цикла); Доцетаксел 75 мг/м 2 в/в в 1-й день 21-дневного цикла; Пеметрексед 500 мг/м 2 в/в в в 1-й день 21-дневного цикла; Метрономная ХТ: циклофосфамид 50 мг внутрь ежедневно без перерыва ± метотрексат по 2,5 мг внутрь 2 раза в день 2 дня в неделю; Пембролизумаб 200 мг в/в в 1-й день 21-дневного цикла или 400 мг в/в в 1-день 42-дневного цикла (при наличии в опухоли MSI-H) (МКЗ III-A) |
|
Эндокрино-терапия |
Летрозол 2,5 мг в сутки внутрь ежедневно; Анастрозол 1 мг в сутки внутрь ежедневно; Мегестрол 160 мг в сутки внутрь ежедневно; Фулвестрант 500 мг в/м в 1-й день 28-дневного цикла (в первый месяц вводится по 500 мг 1 раз в 14 дней) |
|
МEK ингибиторы |
Кобиметиниб 60 мг внутрь ежедневно (МКЗ II-A) Траметиниб 2 мг внутрь ежедневно (МКЗ II-A) |
-
4.4. Поддерживающая терапия при рецидивах рака яичников
-
4.4.1. Бевацизумаб
-
-
4.4.2. PARP-ингибитор олапариб
Добавление бевацизумаба (7,5 или 15 мг/кг в/в 1 раз в 3 нед.; 5 или 10 мг/кг 1 раз в 2 нед. в зависимости от режима ХТ) показано пациенткам с рецидивами заболевания, если препарат не был использован ранее (МКЗ III-A) . Назначение поддерживающей терапии бевацизумабом у пациенток с мутацией BRCA1/2 рекомендовано после получения PARP-ингибитора в предыдущих линиях в поддерживающем режиме. Терапию бевацизумабом следует начинать с 1–2 цикла ХТ. После окончания ХТ введение бевацизумаба следует продолжить до прогрессирования заболевания или неприемлемой токсичности. Возможно повторное назначение бевацизумаба совместно с ХТ и затем в поддерживающем режиме в последующих линиях лечения.
Назначение PARP-ингибитора олапариба в качестве поддерживающей терапии рекомендуется при наличии всех следующих критериев (МКЗ II-B) :
-
• карцинома высокой степени злокачественности при патогенной мутации (герминальной или соматической) в генах BRCA 1/2;
-
• объективный эффект после проведения последней платиносодержащей ХТ, назначенной по поводу платиночувствительного рецидива или отсутствие признаков болезни после полной повторной циторедукции с последующей ХТ.
-
4.5. Лекарственное лечение рецидивов редких гистологических типов
-
4.5.1. Серозный рак низкой степени злокачественности
-
-
4.5.2. Светлоклеточный рак
-
4.5.3. Муцинозный рак
Прием олапариба (300 мг 2 раза в сутки внутрь в лекарственной форме «таблетки для приема внутрь») желательно начать в течение 8 нед. после окончания платиносодержащей ХТ. При рецидивах РЯ, в отличие от I линии терапии лечение препаратом следует продолжать до прогрессирования или непереносимой токсичности.
У пациенток с аденокарциномой low-grade возможно назначение ГТ в качестве самостоятельной линии лечения после повторной циторедуктивной операции по поводу рецидива или при прогрессировании заболевания. Определение РЭ и РП не является обязательным для назначения ГТ, поскольку рецепторный статус при РЯ не коррелирует с ответом на данный вид терапии. Лечение проводится до прогрессирования или непереносимой токсичности.
Для пациенток с low grade серозной аденокарциномой возможно назначение MEK ингибитора траметиниба и кобиметиниба до прогрессирования или непереносимой токсичности.
Целесообразно тестирование на MSI/dMMR методом ИГХ при планировании лечения рецидива. При MSI-H/dMMR целесообразна либо комбинация ипилимумаба 1 мг/кг 1 раз в 6 недель и ниволумаба 3 мг/кг 1 раз в 3 недели, либо монотерапия ниволумабом или пембролизумабом до 2 лет (МКЗ III-A) .
При MSS/pMMR назначение комбинации ипилимумаба 1 мг/кг1 раз в 6 недель и ниво-лумаба 3 мг/кг 1 раз в 3 недели в/в до 2 лет предпочтительнее назначения ХТ (МКЗ III-A) .
Режимы ХТ в сочетании или без бевацизумаба аналогичны таковым для серозного рака высокой степени злокачественности (табл. 5).
При метастатическом муцинозном РЯ целесообразно выполнить ИГХ для дифференциальной диагностики с метастазами карцином ЖКТ, печени или легкого (CK7, CK20
и CDX2), а также тестирование на MSI/dMMR методом ИГХ. При MSI-H целесообразна либо комбинация ипилимумаба (1 мг/кг) и ниволумаба (3 мг/кг), либо монотерапия ниволумабом или пембролизумабом до 2 лет (МКЗ III-A) .
При MSS целесообразны режимы ХТ с включением оксалиплатина с фторпири-мидинами или иринотекана с фторпиримидинами ; целесообразно добавление бевацизумаба к ХТ при наличии макроскопических опухолевых очагов.
-
4.5.4. Карциносаркома
-
4.5.5. Мезонефроподобная карцинома (mesonephric-like carcinoma)
-
4.6. Лучевая терапия
Режимы ХТ в сочетании или без бевацизумаба аналогичны таковым для серозного рака высокой степени злокачественности (табл. 5).
Подбор лекарственных препаратов, эффективных для лечения сарком, не целесообразен.
Мезонефроподобная карцинома — редкая опухоль; собранная информация не позволяет обобщить данные по биологии опухоли и ее прогнозу. Лечение включает в себя хирургический этап как основной; данных по безопасности органосохраняющего лечения недостаточно.
Адъювантная и лечебная ХТ проводятся в соответствии с лечением серозной карциномы high grade (табл. 3, 5).
Часто встречается мутация KRAS или NRAS. Описана эффективность MEK-ингибитора при лечении рецидива с наличием данных мутаций.
Некоторые несерозные гистологические типы, например, светлоклеточный, муцинозный или эндометриоидный, во многих случаях локализованы в тазу, а метастазирование может быть ограничено регионарными лимфатическими узлами. При развитии резистентности несерозных гистотипов к лекарственной терапии возможно применение ЛТ рецидивных очагов и метастазов.
Рекомендуемый алгоритм лечения рецидивов РЯ представлен на рис. 5.
-
4.7. Профилактика реакций гиперчувствительности
При лечении пациенток с анамнезом аллергических реакций (реакций гиперчувствительности) на платиновые агенты рекомендуется оценить возможность продолжения терапии платиновыми препаратами, используя следующий алгоритм.
-
2) При выборе протокола десенсибилизации следует руководствоваться данными специальной литературы. Протокол десенсибилизации должен включать дробное введение препарата, вызвавшего аллергическую реакцию, и профилактическое применение препаратов, снижающих риск гиперчувствительности (H1-гистамино-блокаторы, ГКС). При лечении пациенток с реакциями гиперчувствительности обязательно следование выбранному протоколу десенсибилизации при проведении каждого последующего курса лечения.
-
3) Перед проведением терапии с использованием десенсибилизирующей схемы следует убедиться, что персонал клиники знаком с симптомами аллергических реакций, порядком действий в случае их возникновения. Должен быть обеспечен быстрый доступ к необходимым препаратам (H1-гистаминоблокаторы, ГКС, адреналин) и/или к реанимационной службе.
-
4) При повторном развитии реакций гиперчувствительности, несмотря на следование протоколу десенсибилизации, дальнейшие решения по тактике лечения следует принимать индивидуально, с учетом соотношения риска и пользы от продолжения терапии, а также выраженности реакции гиперчувствительности.
-
5) В некоторых случаях может быть целесообразной замена платинового агента, вызвавшего реакцию гиперчувствительности, на другой препарат того же класса (например, карбоплатина на цисплатин или оксалиплатин). При замене препарата следует учитывать спектр его токсичности и эффективности в составе используемого режима лечения.
В настоящее время отсутствуют данные, демонстрирующие преимущество какого-либо конкретного протокола перед другими возможными схемами десенсибилизации. В качестве примера можно привести следующий алгоритм действий (протокол десенсибилизации к карбоплатину). Десенсибилизация к цисплатину, оксалиплатину может проводиться по аналогичным принципам проведения лечения):
-
а) фексофенадин 60 мг (или аналогичный Н1-блокатор) внутрь 2 раза в сутки, начиная за 24 ч до проведения ХТ; 120 мг внутрь за 3 часа до ХТ;
-
б) дексаметазон 20 мг в/ м, в/в или внутрь за 12 ч до ХТ; 20 мг — за 3 часа до ХТ; 20 мг в/в — за 30 мин. до ХТ;
-
в) фамотидин 20 мг (или аналогичный Н2-блокатор) в / в или внутрь за 30 мин. до ХТ;
-
г) дифенгидрамин 50 мг (или аналогичный Н1-блокатор) в/в за 30 мин. до ХТ, далее — 25 мг каждые 4 часа 3 введения;
-
д) дробное введение карбоплатина (суммарная доза препарата определяется по формуле Кальверта), доза препарата разводится дробно на 4 флакона 0,9% раствора NaCl:
– 1 флакон — 1 /1000 суммарной дозы на 30 мл 0,9 % NaCl в/в капельно в тече
ние 30 мин.;
– 2 флакон — 1 / 100 суммарной дозы на 50 мл 0,9 % NaCl в/ в капельно в тече ние 30 мин.;
– 3 флакон — 1/ 10 суммарной дозы на 100 мл 0,9 % NaCl в /в капельно в тече ние 60 мин.;
– 4 флакон — вся оставшаяся доза препарата на 250 мл 0,9 % NaCl в/в капельно в течение ≥ 90 мин.
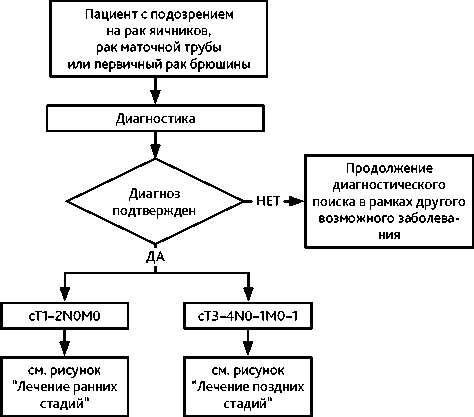
Рисунок 1. Рекомендуемый алгоритм первичной диагностики при подозрении на рак яичников, рак маточной трубы и первичный рак брюшины
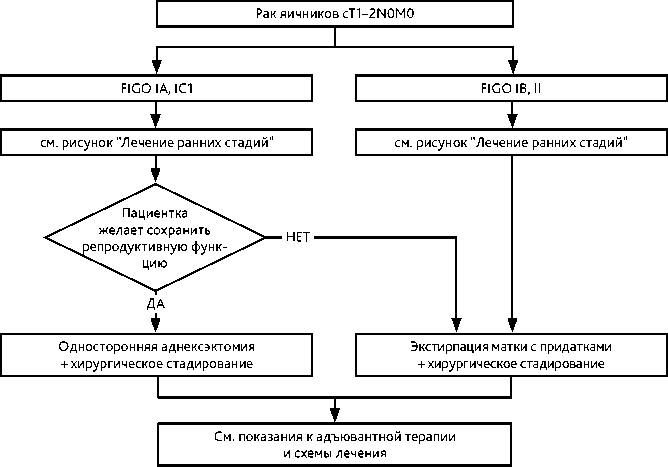
Рисунок 2. Рекомендуемый алгоритм лечения раннего рака яичников
ДА ♦
См. схемы ХТ II линии (табл. 5)
Рисунок 3. Рекомендуемый алгоритм лечения первичного распространенного рака яичников
Пациентка после операции по поводу первичного рака яичников
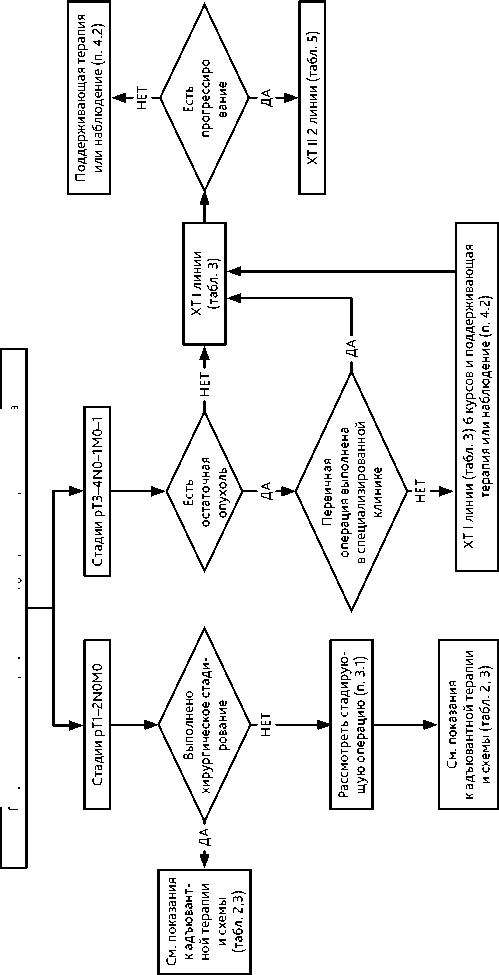
Рисунок 4. Рекомендуемый алгоритм лечения первичного рака яичников после хирургического вмешательства
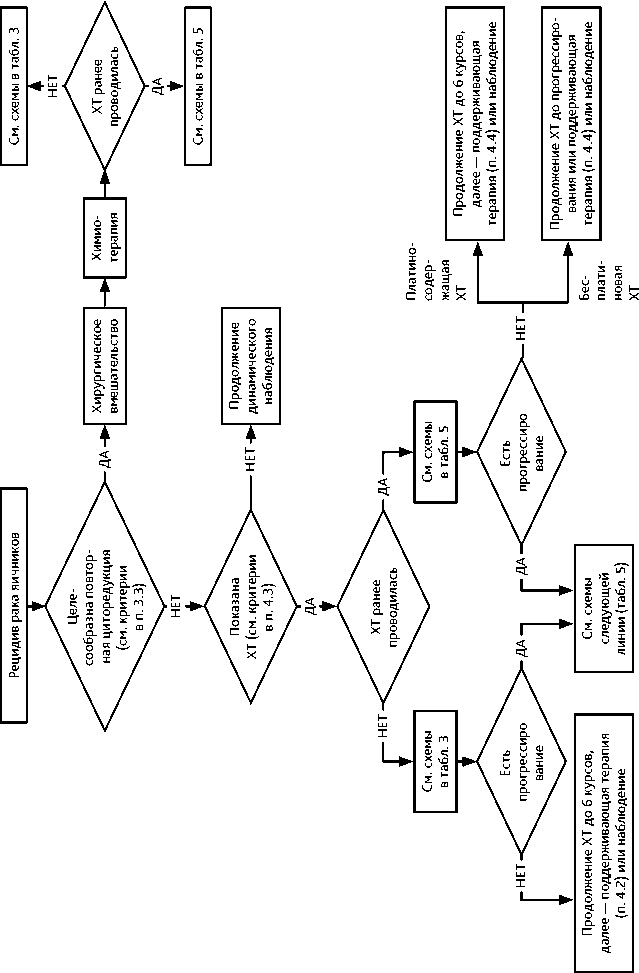
Рекомендуемый алгоритм лечения рецидивов рака яичников
том /vol. 14(3s2) 2024
|
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


