Рак мочевого пузыря
Автор: Румянцев А.А., Булычкин П.В., Волкова М.И., Гладков О.A., Зуков Р.А., Матвеев В.Б., Носов Д.А.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1.2 т.15, 2025 года.
Бесплатный доступ
В данном разделе указаны критерии оценки клинической значимости применения дорогостоящей противоопухолевой лекарственной терапии в соответствии со шкалой, разработанной экспертной группой (см. стр. 7). В тексте они обозначены, как магнитуда клинической значимости (МКЗ).
Рак мочевого пузыря, трансуретральная резекция, внутрипузырная терапия, радикальная цистэктомия, тримодальная терапия, химиотерапия, иммунотерапия
Короткий адрес: https://sciup.org/140312963
IDR: 140312963 | DOI: 10.18027/2224-5057-2025-15-3s2-1.2-09
Текст научной статьи Рак мочевого пузыря
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Классификация рака мочевого пузыря (РМП) по системе TNM и группировка по стадиям представлены в табл. 1 и 2. Определение категорий T, N, M 8-го издания соответствуют 9-му изданию. Классификация применима только для рака; папиллома и папиллярная интраэпителиальная неоплазия исключается. Гистологическое или цитологическое подтверждение диагноза обязательно.
Т — первичная опухоль. Индекс (m), добавленный к категории «Т», указывает на множественные опухоли. Индекс (is) может быть добавлен к любой категории «Т» для указания ассоциации с CIS.
N — регионарные лимфатические узлы. Регионарными лимфатическими узлами являются лимфатические узлы малого таза, расположенные ниже бифуркации общих подвздошных артерий, с включением лимфатических узлов вдоль подвздошных артерий.
M — отдаленные метастазы. Категории pT и pN соответствуют категориям сT и сN. Категории pM0 и pMX недействительны.
Таблица 1. Классификация рака мочевого пузыря по системе TNM (9-е издание, 2025 г.)
|
Категории T, N, M Описание распространения опухоли |
|
|
ТХ |
Первичная опухоль не может быть оценена |
|
Т0 |
Нет признаков первичной опухоли |
|
Та |
Неинвазивная папиллярная карцинома |
|
Tis |
Уротелиальная CIS: «плоская опухоль» |

|
Категории T, N, M |
Описание распространения опухоли |
|
Т1 |
Опухоль распространяется на слизистую до lamina propria (субэпителиальная соединительная ткань) |
|
Т2 • Т2а • Т2b |
Опухоль распространяется на мышечный слой стенки мочевого пузыря Опухоль распространяется на поверхностный мышечный слой (внутренняя половина мышц) Опухоль распространяется на глубокий мышечный слой (наружная половина мышц) |
|
Категории T, N, M |
Описание распространения опухоли |
|
ТЗ • ТЗа • ТЗb |
Опухоль распространяется перивисцерально Опухоль распространяется перивисцерально микроскопически Опухоль распространяется перивисцерально макроскопически (экстравезикальное распространение опухоль) |
|
Т4 • Т4а • Т4b |
Опухоль распространяется на любое из перечисленного: предстательная железа, семенные пузырьки, матка, влагалище, стенка таза, брюшная стенка Опухоль распространяется на предстательную железу, семенные пузырьки, матку, влагалище Опухоль распространяется на стенку таза, брюшную стенку |
|
NX |
Регионарные лимфоузлы не могут быть оценены |
|
N0 |
Нет признаков метастазов в регионарных лимфоузлах |
|
N1 |
Метастаз в одном перивезикальном, запирательном, внутреннем или наружном подвздошном, крестцовом лимфоузле |
|
N2 |
Множественные метастазы в регионарных лимфоузлах (перивезикальных, запирательных, внутренних или наружных подвздошных или крестцовых) |
|
N3 |
Метастазы в одном или более общих подвздошных лимфоузлах |
|
М0 |
Нет отдаленных метастазов |
|
M1 • М1a • M1b |
Отдаленные метастазы Отдаленные метастазы, ограниченные лимфатическими узлами выше уровня общей подвздошной артерии Отдаленные нелимфогенные метастазы |
Степень злокачественности опухоли (G):
Low-grade (LG) — низкая степень
High-grade (HG) — высокая степень
Таблица 2. Группировка рака мочевого пузыря по стадиям
|
Стадия |
T |
N |
M |
|
0a |
Ta |
N0 |
M0 |
|
0is |
Tis |
N0 |
M0 |
|
I |
T1 |
N0 |
M0 |
|
II |
T2a, b |
N0 |
M0 |
|
Стадия |
T |
N |
M |
|
IIIA |
T3a, b |
N0 |
M0 |
|
T4a |
N0 |
M0 |
|
|
T1–4a |
N1 |
M0 |
|
|
IIIB |
T1–4a |
N2, N3 |
M0 |
|
IVA |
T4b |
Любая N |
М0 |
|
Любая |
Любая N |
M1а |
|
|
IVB |
Любая |
Любая N |
M1b |
2. НЕМЫШЕЧНО-ИНВАЗИВНЫЙ РАК МОЧЕВОГО ПУЗЫРЯ (TA, T1, TIS) 2.1. Диагностика
-
• Сбор анамнеза: наличие гематурии, в семейном анамнезе рака мочевого пузыря, колоректального рака, рака эндометрия, факта курения, профессиональные вредности, сопутствующие заболевания.
-
• Физикальный осмотр: выполнить пальпацию мочевого пузыря, области почек с определением симптома поколачивания; проведение тщательного осмотра и пальпации зон возможного лимфогенного метастазирования.
-
• Общий анализ крови с подсчетом лейкоцитарной формулы и количества тромбоцитов.
-
• Биохимический анализ крови с определением показателей функции печени, почек.
-
• Общий анализ мочи.
-
• Экскреторная урография методом компьютерной томографии (КТ) или магнитнорезонансной томографии с контрастным усилением (особенно в тех случаях, когда опухоль локализуется в области треугольника Льето, имеются множественные очаги или при опухолях высокого риска).
-
• УЗИ органов брюшной полости, забрюшинного пространства, малого таза.
-
• Фиброцистоскопия.
-
• Цитологическое исследование мочи (позволяет поставить диагноз CIS и заподозрить уротелиальный рак верхних мочевых путей и уретры при отсутствии цистоскопических данных за рак мочевого пузыря).
-
• Морфологический диагноз устанавливается на основании данных морфологического исследования биоптата послe выполнения трансуретральной резекции (ТУР) мочевого пузыря, включающей удаление опухоли и подлежащей части детрузора. В гистологическом материале обязательно должен присутствовать подлежащий мышечный слой, при его отсутствии невозможно точно определить
стадию заболевания. Холодная биопсия не дает полной информации. При наличии участков визуально измененной слизистой мочевого пузыря необходимо выполнение их биопсии. Биопсия случайных участков нормальной слизистой показана: при положительных результатах цитологического исследования мочи при отсутствии опухоли и/или при непапиллярных опухолях; «рандомная» биопсия выполняется по схеме — треугольник Льето, купол мочевого пузыря, левая, передняя, задняя стенки мочевого пузыря, у мужчин — преколликуляр-ная область на 5 и 7 часах условного циферблата). Биопсия слизистой простатического отдела уретры показана: при визуально измененной слизистой, CIS, поражении шейки мочевого пузыря, положительном цитологическом анализе мочи и отсутствии опухоли в мочевом пузыре (берутся биоптаты из аномальных областей и преколликулярной зоны на 5 и 7 часах условного циферблата).
-
• Повторная ТУР мочевого пузыря в течение 2–4 недель после первичной ТУР показана при отсутствии в операционном материале мышечного слоя (кроме уротелиальных карцином категории TaLG), высокой степени злокачественности (high-grade) опухоли, категории T1, неполном удалении опухоли или сомнениях в её полном удалении во время первичной ТУР.
В патологоанатомическом заключении после трансуретральной резекции мочевого пузыря следует указывать:
-
• гистологический тип опухоли;
-
• процент опухоли вариантного гистологического строения (плоскоклеточ-ной/железистой/трофобластической и т. п.) и/или специфического подтипа уротелиальной карциномы (при наличии);
-
• гистологическую степень злокачественности опухоли (грейд);
-
• наличие инвазии в субэпителиальную строму и мышечный слой стенки;
-
• наличие или отсутствие мышечного слоя;
-
• наличие лимфоваскулярной инвазии;
-
• наличие карциномы in situ ;
-
• категорию T по ТNM;
-
• гистологический код по МКБ-О.
-
2.2. Лечение немышечно-инвазивного рака мочевого пузыря (НМИРМП)
Оценка категории рТ на основании исследования материала, полученного при ТУР мочевого пузыря, не производится.
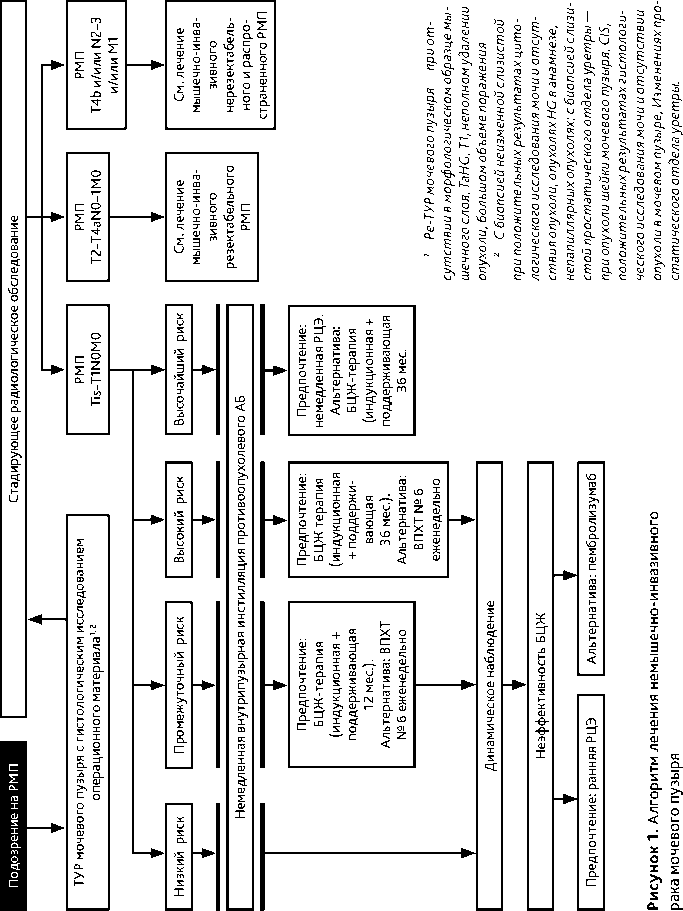
Схема лечения отображена на рис. 1. Основным методом лечения НМИРМП является ТУР. Адъювантная внутрипузырная терапия проводится после ТУР и позволяет снизить риск местного рецидива и опухолевой прогрессии. План адъювантной лекарственной терапии основывается на определении группы риска (табл. 3).
Таблица 3. Группы риска при раке мочевого пузыря
Группы риска Характеристики опухоли
Низкий Папиллярная уротелиальная неоплазия низкого злокачественного потенциала
Солитарная уротелиальная карцинома Ta low-grade ≤ 3 см
Промежуточный Уротелиальная карцинома low-grade:
-
• T1 или
-
• > 3 см или
-
• мультифокальный рост или
-
• рецидив в течение 1 года.
-
• солитарная уротелиальная карцинома Ta high-grade ≤ 3 см
Высокий Уротелиальная карцинома high-grade:
-
• CIS или
-
• T1 или
-
• > 3 см или
-
• мультифокальный рост
Очень высокий • Вариантная морфология (микропапиллярный, саркоматоидный, плазмоцитоидный (высочайший) варианты и другие);
-
• неэффективность БЦЖ-терапии;
-
• наличие лимфоваскулярной инвазии;
-
• инвазия простатической части уретры
Однократное внутрипузырное введение химиопрепарата (доксорубицина 30–50 мг в 25–50 мл 0,9% раствора NaCl или гемцитабина 2000 мг в 50 мл раствора NaCl 0,9% или митомицина в дозе 40 мг в 40 мл раствора NaCl 0,9%; время экспозиции для всех препаратов — 1 час) в течение 24 часов (оптимально — в течение 6 часов) после ТУР у пациентов с первичными и рецидивными папиллярными опухолями, визуально соответствующими картине уротелиального НМИРМП, позволяет снизить риск местного рецидива.
Больным группы низкого риска дополнительная адъювантная терапия не показана.
Больным групп промежуточного и высокого риска показана адъювантная внутри-пузырная терапия: режимом предпочтения является адъювантная внутрипузырная терапия противоопухолевой вакциной БЦЖ, снижающей риск местного рецидива и развития мышечно-инвазивного рака, а также метастазирования по сравнению с ТУР без адъювантной терапии или с любой химиотерапией. Первые инстилляции проводятся через 3–4 нед. после ТУР противоопухолевой вакциной БЦЖ: 100 мг в 40 мл 0,9% раствора хлорида натрия (при неудовлетворительной переносимости — 50 мг). Экспозиция — 2 часа. Оптимальный режим — 6 еженедельных инстилляций с последующим переходом на поддерживающую терапию при отсутствии местного рецидива папиллярной опухоли или персистирующей CIS при первом контроле эффекта:
-
• при промежуточном риске рецидива: 3 еженедельных введения препарата на 3, 6 и 12-м месяцах ИЛИ ежемесячно в течение 36 мес.
-
• при высоком риске рецидива: 3 еженедельных введения препарата на 3,
-
6, 12, 18, 24, 30 и 36-м месяцах ИЛИ ежемесячно в течение 36 мес.
Противопоказано проведение БЦЖ-терапии в следующих случаях:
-
• в течение первых 2 недель после ТУР мочевого пузыря;
-
• пациентам с макрогематурией;
-
• после травматичной катетеризации;
-
• пациентам с наличием симптомов инфекции мочевого пузыря;
-
• пациентам с выраженной дизурией.
Наличие лейкоцитурии или бессимптомной бактериурии не является противопоказанием для проведения БЦЖ-терапии, в этих случаях нет необходимости в проведении антибиотикопрофилактики.
Альтернативой у больных групп промежуточного и высокого риска с противопоказаниями или отказом от проведения БЦЖ-терапии является индукционная адъювантная внутрипузыр-ная химиотерапия (доксорубицин 30–50 мг в 25–50 мл 0,9% раствора NaCl или гемцитабин 2000 мг в 50 мл раствора NaCl 0,9% или митомицин в дозе 40 мг в 40 мл раствора NaCl 0,9%; время экспозиции для всех препаратов — 1 час; 6 еженедельных циклов). Поддерживающая внутрипузырная химиотерапия не имеет доказанной эффективности. Внутрипузырная химиотерапия уступает БЦЖ-терапии в отношении снижения риска местного рецидива и не влияет на частоту опухолевой инвазии, метастазирования и общую выживаемость.
Пациентам группы высочайшего риска показана немедленная РЦЭ. Альтернативой РЦЭ является индукционная и 3-летняя поддерживающая внутрипузырная БЦЖ-терапия.
Необходимо учитывать возможные осложнения внутрипузырного введения вакцины БЦЖ и дальнейшей лечебной тактики (приложение 1 и 2). Частота БЦЖ-инфекций после БЦЖ-инстилляций может составлять 1 %.
Критериями отсутствия эффекта БЦЖ-терапии являются:
-
1) появление мышечно-инвазивной карциномы;
-
2) БЦЖ-рефрактерность:
-
– выявление опухоли T1HG к 3-му месяцу лечения;
-
– выявление опухоли TaHG к 3-му месяцу лечения и /или 6-му месяцу после реиндукции или 1 курса поддерживающей терапии;
-
– выявление CIS (без папиллярной опухоли) к 3-му месяцу лечения и сохранение ее к 6 месяцу после реиндукции или 1 курса поддерживающей терапии. При выявлении CIS на 3-м месяце лечения дополнительное введение БЦЖ может обеспечить полный ответ более чем в 50% случаев;
-
– появление опухоли HG в процессе поддерживающей терапии БЦЖ
-
3) БЦЖ-рецидивирующая опухоль: рецидив опухоли HG после завершения БЦЖ-терапии независимо от первоначального ответа;
-
4) опухоль, не ответившая на БЦЖ: БЦЖ-рефрактерность или рецидив T1–Ta /HG в течение 6 месяцев после завершения лечения БЦЖ или развитие CIS в течение 12 месяцев после завершения адекватной терапии БЦЖ;
-
5) непереносимость БЦЖ.
-
2.3. Наблюдение
Пациентам с опухолевой прогрессией показано лечение в соответствии со стандартами ведения больных мышечно-инвазивным РМП (МИРМП).
Пациентам с БЦЖ-резистентностью и непереносимостью БЦЖ показана ранняя РЦЭ. Альтернативой является монотерапия пембролизумабом (200 мг 1 раз в 3 недели в/в, до 35 введений). У больных с персистирующей CIS к 3 месяцу и пациентов с поздним (> 2 лет после ТУР мочевого пузыря) рецидивом папиллярной опухоли на фоне БЦЖ-терапии возможно продолжение данного вида лечения до 6 мес. Допустимый метод лечения у пациентов с противопоказаниями к пембролизумабу — внутрипузыр-ная монохимиотерапия или полихимиотерапия ( гемцитабин 1000 мг в 50 мл раствора NaCl 0,9%, время экспозиции — 90 мин, опорожнить мочевой пузырь; доцетаксел 40 мг в 50 мл раствора NaCl 0,9%, тотчас после эвакуации раствора гемцитабина, время экспозиции — 90 мин; 6 еженедельных инстилляций).
Наблюдение после лечения имеет целью раннюю диагностику рецидива и различается по интенсивности в зависимости от группы риска развития рецидива:
• низкий риск рецидива: в первый год после ТУР — цистоскопия через 3 и 12 мес., далее — ежегодно в течение 5 лет, затем — по клиническим показаниям;
• промежуточный риск рецидива: в первый год после ТУР — цистоскопия, цитологическое исследование мочи через 3, 6 и 12 мес., во второй год — каждые 6 мес., далее — ежегодно в течение 5 лет, затем — по клиническим показаниям;
• высокий и высочайший риск рецидива: в первые 2 года после ТУР — цистоскопия, цитологическое исследование мочи каждые 3 мес., 3–5 год — каждые 6 мес., далее — ежегодно, после 10 лет наблюдения — по клиническим показаниям. КТ — выделительная урография — через 12 мес., затем до 10 лет — один раз в 1–2 года, затем — по клиническим показаниям.
3. МЫШЕЧНО-ИНВАЗИВНЫЙ РАК МОЧЕВОГО ПУЗЫРЯ СТАДИИ II (T2N0M0) И СТАДИИ IIIA (T3–T4аN0M0, T1–T4AN1M0)
3.1. Диагностика
Сбор анамнеза, физикальное обследование, анализы крови, обследование мочевыводящих путей — в соответствии с принципами раздела 2.1. Дополнительно используются методы инструментальной диагностики:
-
• МРТ таза с в/в контрастированием.
-
• КТ органов брюшной полости, забрюшинного пространства, грудной клетки с в/в контрастированием (лимфатические узлы малого таза ≥ 8 мм, абдоминальные и ретроперитонеальные узлы ≥ 10 мм при измерении наименьшего диаметра
следует относить к патологически увеличенным). При невозможности используется УЗИ брюшной полости, таза и забрюшинного пространства.
-
• ТУР мочевого пузыря.
-
• Сцинтиграфия костей и МРТ головного мозга — при наличии симптомов, указывающих на возможное наличие опухолевых очагов в этих органах.
-
• Рутинное использование ПЭТ-КТ с любыми трейсерами не рекомендуется.
-
3.2. Лечение
-
3.2.1. Общие принципы лечения мышечно-инвазивного рака мочевого пузыря (МИРМП)
-
КТ и МРТ (предпочтительно) могут быть использованы для оценки локальной инвазии, но не позволяют точно установить наличие микроскопической инвазии перивезикаль-ной жировой клетчатки для проведения дифференциальной диагностики между T2 и T3a стадиями.
Схемы лечения отображены на рис. 2, 3 и 4. Стандартный подход к лечению МИРМП — РЦЭ с неоадъювантной цисплатин-содержащей химиотерапией для пациентов, являющихся кандидатами для РЦЭ и без противопоказаний к назначению цисплатина. Оптимальным для пациентов в удовлетворительном общем состоянии и с сохраненной почечной функцией (СКФ ≥ 60 мл/мин) следует считать проведение 6 циклов химиотерапии по схеме ddMVAC (метотрексат, винбластин, доксорубицин, цисплатин с гранулоцитарным колониестимулирующим фактором) или 3–4 циклов GC (гемцитабин, цисплатин). Режим ddMVAC улучшает общую выживаемость по сравнению с GC, но может сопровождаться повышением частоты осложнений.
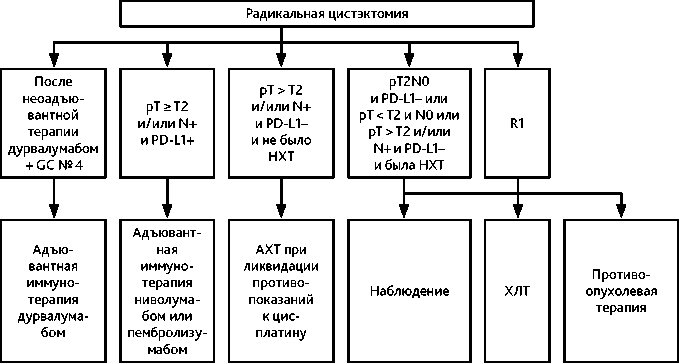
Периоперационная иммунохимиотерапия (неоадъювантная терапия в режиме дурвалумаб + GC c последующей РЦЭ и адъювантная монотерапия дурвалумабом ) увеличивает общую выживаемость в сравнении с самостоятельным применением химиотерапии в режиме GC (МКЗ А1).
Не рекомендуется рутинное назначение карбоплатин-содержащей неоадъювантной химиотерапии.
Роль адъювантной ХТ противоречива, опция 4 циклов GC может быть использована после РЦЭ при pT3–T4a или pN+ у пациентов, не получавших неоадъювантную химиотерапию. Оптимальным временем для проведения лечения следует считать 6–8 недель после РЦЭ. При задержке в проведении адъювантной химиотерапии более чем на 3 месяца, следует предпочесть динамическое наблюдение.
Адъювантная терапия ниволумабом (в течение 12 месяцев) — опция для пациентов с уротелиальным раком c позитивной экспрессией PD-L1 (CPS ≥ 1 %), pT2–4 и /или pN+ M0R0, подвергнутых РЦЭ (МКЗ B1)*. Альтернативно может быть рассмотрено назначение адъювантной терапии пембролизумабом (МКЗ C1).
Режимы нео- и адъювантной ХТ РМП представлены в табл. 4.
Таблица 4. Рекомендуемые режимы неоадъювантной и адъювантной ХТ рака мочевого пузыря
Название Режим введения химиопрепаратов
|
Предпочтительные режимы |
|
|
ddMVAC 1 |
Метотрексат 30 мг/м 2 в/в в 1-й день + винбластин 3 мг/м 2 в/в во 2-й день + доксорубицин 30 мг/м 2 в/в во 2-й день + цисплатин 70 мг/м 2 в/в во 2-й день + филграстим 5 мкг/кг п/к в 4–10-й дни каждые 2 нед. (только в неоадъювантном режиме) — 6 курсов |
|
Дурвалумаб + GC |
Цисплатин 70 мг/м 2 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1, 8-й дни каждые 3 нед. + дурвалумаб 1500 мг в/в в 1-й день — только в неоадъювантном режиме, 4 курса (с последующим выполнением радикальной цистэктомии и продолжением адъювантной терапии дурвалумабом 1500 мг в/в каждые 4 недели — 8 курсов) |
|
GC 1 |
Цисплатин 70 мг/м 2 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1, 8-й дни каждые 3 нед. |
Альтернативные режимы
GC 1 Цисплатин 70 мг/м 2 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1, 8 и 15-й дни каждые
4 нед.
MCV 1 Метотрексат 30 мг/м 2 в/в в 1, 8-й дни + винбластин 4 мг/м 2 в/в в 1, 8-й дни + цисплатин
100 мг/м 2 в/в во 2-й день + кальция фолинат 15 мг в/в или перорально каждые 6 часов № 4 во 2 и 9-й дни каждые 4 нед.
Split GC 1, 2 Цисплатин 35–40 мг/м 2 в/в в 1, 8-й дни + гемцитабин 1000 мг/м 2 в/в в 1, 8-й дни каждые
3 нед.
-
1 Введение цисплатина осуществляется на фоне в/в гидратации, например 0,9% р-ром NaCl в суммарном суточном объеме ≥ 2,5 л. Дополнительное назначение магния сульфата в дозе 1000–1250 мг (5 мл 25 % раствора сульфата магния) перед цисплатином снижает риск нефротоксичности.
-
2 Для пациентов с повышенными рисками нежелательных явлений.
Неоадъювантная и адъювантная ЛТ после РЦЭ не рекомендованы. Возможно проведение послеоперационной химиолучевой терапии у отобранных больных с радиологически определяемой резидуальной опухолью или протяженным положительным краем хирургической резекции. Альтернативой химиолучевому лечению у пациентов с определяемой резидуальной опухолью является системная химиотерапия (см. лечение метастатической болезни).
Тримодальная терапия (ТМТ) — альтернатива РЦЭ у отобранных больных РМП с солитарными или единичными опухолями подвижной стенки мочевого пузыря сT2N0M0, < 3 см, без гидронефроза, обусловленного опухолью, без CIS и с удовлетворительной функцией мочевого пузыря. ТМТ включает максимальную ТУР опухоли мочевого пузыря с после- дующей химиолучевой терапией. ТМТ должна использоваться в специализированных центрах или центрах, имеющих достаточный опыт лечения этих пациентов.
ТМТ может проводиться по непрерывной и разделенной схемам. При непрерывной ТМТ после максимальной ТУР мочевого пузыря проводится дистанционная ЛТ до полной запланированной суммарной дозы (СД) на фоне радиомодифицирующей химиотерапии с последующей цистоскопией и биопсией мочевого пузыря. В случае полного ответа рекомендуется динамическое наблюдение, при неполном ответе — спасительная РЦЭ. При разделенной ТМТ после максимальной ТУР мочевого пузыря проводится дистанционная ЛТ до СД 40 Гр на фоне радиомодифицирующей химиотерапии с последующей цистоскопией и биопсией мочевого пузыря. В случае достижения полного или почти полного ответа завершается запланированный курс химиолучевого лечения, далее — динамическое наблюдение, при неполном ответе — спасительная РЦЭ. Критерии полного ответа на ТМТ: негативные результаты цитологического исследования мочи, отсутствие опухоли при цистоскопии, негативные результаты биопсии, выполненной во время цистоскопии. По данным анализа нескольких исследований, при почти полном ответе (pTis–Ta) на индукционную терапию разделенной ТМТ целесообразно завершение органосохраняющего лечения, поскольку это не приводит к ухудшению онкологических результатов. Режимы радиомодифицирующей химиотерапии приведены в таблице 5.
Пациенты с противопоказаниями или отказом от РЦЭ являются кандидатами для химиолучевой терапии. Неоадьювантная ХТ при cT2–T3aN0 до ТМТ не обеспечивает преимущества в общей выживаемости и не должна использоваться в рутинной практике. Возможные режимы химиолучевой терапии представлены в таблице 5.
Таблица 5. Рекомендуемые режимы одновременной химиолучевой терапии рака мочевого пузыря
|
Режим химиотерапии |
Режим лучевой терапии |
|
Предпочтительный режим |
|
|
Цисплатин 40 мг/м 2 в/в еженедельно, 6 введений |
|
|
Альтернативные режимы |
|
|
Фторурацил 500 мг/м 2 /сут. в/в в 1–5-й и 16–20-й дни + митомицин С 12 мг/м 2 в/в в 1-й день 1 |
СД 55 Гр (20 фракций) или 64 Гр (32 фракции) |
|
Карбоплатин AUC2 в/в еженедельно, 6 введений |
СД 60–66 Гр (30–33 фракции), 6 нед. |
|
Гемцитабин 27 мг/м 2 в/в в 1 и 4-й дни каждой недели (интервал не менее 72 часов) |
СД 60–66 Гр (30–33 фракции), более 4 нед. |
1 Режим/препарат зарегистрирован в РФ, но не входит в Клинические рекомендации Минздрава РФ.
Рутинная замена радиомодификации цисплатином на карбоплатин не рекомендуется из-за отсутствия доказательств равной эффективности. Возможно использование карбоплатина, гемцитабина или фторурацила с митомицином у пациентов с противопоказаниями к назначению радиомодификации цисплатином.
Суммарная доза (СД) при проведении ЛТ в режиме классического фракционирования (разовая доза (РД) — 2 Гр) на область мочевого пузыря и/или опухоль должна составлять не менее 60–66 Гр. Возможно использование гипофракционирования с РД 2,75 Гр до СД 55 Гр за 20 сеансов (онкологические результаты и частота развития лучевых реакций аналогичны классическому фракционированию). Рекомендовано рассматривать вопрос элективного облучения регионарных лимфатических узлов таза с РД 2 Гр до СД 44–50 Гр. При условии поражения регионарных лимфатических узлов таза рекомендовано эска-лировать СД на метастатические лимфоузлы до 60–66 Гр с обязательным элективным облучением регионарных лимфатических узлов с РД 2 Гр до СД 50 Гр. С целью соблюдения принципов гарантии качества, увеличения точности и уменьшения токсичности облучения, ЛТ рекомендовано проводить с использованием технологий — 3-DCRT, IMRT, VMAT, IGRT. При наличии технических возможностей и соответствующего клинического опыта возможно применение методики интегрированного «буста» на область первичной опухоли и метастазов в лимфатических узлах.
Только резекция мочевого пузыря, только лучевая терапия и только химиотерапия не являются методами, рекомендованными для лечения МИРМП в связи с неудовлетворительными результатами.
-
3.2.2. Особенности лечения пациентов с вариантными и неуротелиальными морфологическими формами рака мочевого пузыря
-
3.3. Наблюдение
-
3.3.1. После радикальной цистэктомии:
Плоскоклеточный и плазмоцитоидный рак мочевого пузыря (без уротелиальной дифференцировки) характеризуются низкой чувствительностью к лекарственной терапии. Проведение неоадъювантной лекарственной терапии не улучшает общую выживаемость пациентов. При локализованном процессе возможно проведение хирургического лечения или химиолучевой терапии на первом этапе. Оптимальные подходы к системной терапии при метастатическом процессе неизвестны.
Пациенты с аденокарциномой мочевого пузыря (или урахуса) малочувствительны к стандартной цисплатин-содержащей химиотерапии. При чистой аденокарциноме мочевого пузыря необходимо исключить локализацию первичной опухоли в желудочно-кишечном тракте. Наилучшие результаты при лечении распространенного рака урахуса демонстрирует режим mFOLFIRINOX (оксалиплатин 85 мг/м 2 день 1 + иринотекан 150 мг/м 2 день 1 + кальция фолинат 400 мг/м 2 день 1 + фторурацил 2400 мг/м 2 в/в инфузия в течение 46 ч), проводится до 12 курсов химиотерапии. Возможно использование этого режима химиотерапии при аденокарциномах мочевого пузыря.
Мелкоклеточный рак мочевого пузыря характеризуется высокоагрессивным течением. У данной категории пациентов могут применяться подходы к лечению в соответствии с рекомендациями по терапии мелкоклеточного рака легкого, например, проведение индукционной химиотерапии по схеме этопозид + цисплатин (или карбоплатин) с последующим консолидирующим локальным лечением при отсутствии прогрессирования.
Саркоматоидный подтип рака мочевого пузыря относится к высокоагрессивным морфологическим формам данного заболевания. В силу крайне высоких рисков прогрессирования при немышечно-инвазивном саркоматоидном раке мочевого пузыря на первом этапе лечения следует рассматривать выполнение РЦЭ. При наличии мышечной инвазии у цисплатин-подходящих пациентов следует рассматривать проведение стандартной неоадъювантной химиотерапии.
Наблюдение после лечения имеет целью раннюю диагностику рецидива и способствует выявлению больных, которым могут быть назначены «спасительные» варианты лечения.
-
• КТ или МРТ брюшной полости и таза с в /в контрастированием, КТ органов грудной клетки — каждые 3 мес. в течение 2 лет, далее каждые 6 мес. — до 5 лет; в последующие 5 лет показано ежегодное УЗИ органов брюшной полости, забрюшинного пространства и таза;
-
• цитологическое исследование мочи каждые 6–12 мес. — в течение 2 лет, далее —
по клиническим показаниям;
-
• Клинический осмотр, общий и биохимический анализы крови, в т. ч. с оценкой почечной функции, если проводилась химиотерапия каждые 3–6 месяцев — в течение 1 года, далее — по клиническим показаниям.
-
3.3.2. Для пациентов после органосохраняющего лечения:
-
• КТ или МРТ брюшной полости и таза с в /в контрастированием, КТ органов грудной клетки — каждые 3–6 мес. в течение 2 лет, далее ежегодно — до 5 лет;
-
• цистоскопия — каждые 3 мес. в течение 2 лет, каждые 6 мес. — в течение 3 и 4 года, далее ежегодно — до 10 лет;
-
• цитологическое исследование мочи каждые 6–12 мес. — в течение 2 лет, далее —
по клиническим показаниям;
• клинический осмотр, общий и биохимический анализы крови — каждые 3–6 мес. в течение 2 лет, далее — по клиническим показаниям;
4. РАСПРОСТРАНЕННЫЙ РАК МОЧЕВОГО ПУЗЫРЯ СТАДИИ IIIB (T1–T4A N2–3 M0) ИЛИ IVA (T4B N0–3 M0, T1–4B N0–3 M1A)
5. МЕТАСТАТИЧЕСКИЙ РАК МОЧЕВОГО ПУЗЫРЯ СТАДИЯ IVB (T1–4B, N0–3, M1B)
5.1. Лечение5.1.1. Локальное лечение
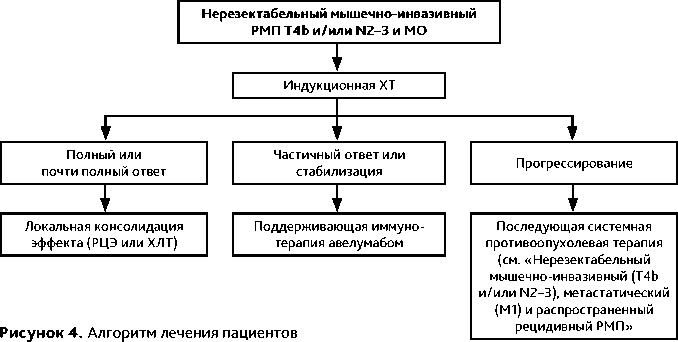
Схема лечения отображена на рис. 4. При РМП стадии IIIB и IVA рекомендуется либо сочетанная ХЛТ, либо индукционная противоопухолевая терапия с оценкой ответа и с последующим проведением консолидирующего локального лечения (РЦЭ либо ХЛТ при полном или частичном ответе на ХТ). Выполнение первичной РЦЭ не рекомендуется.
Для индукционной терапии неоперабельного местно-распространенного РМП используются режимы, перечисленные в табл. 8. При выраженном местно-распространенным характере роста опухоли (сT4b) и/или массивной патологической регионарной лимфаденопатии (сN2–3) индукционная ХТ позволяет уменьшить размеры опухоли и метастазов, что создает предпосылки для достижения целевых параметров при дозиметрическом планировании.
При достижении контроля над опухолью после индукции выполняется РЦЭ или проводится ХЛТ. Рекомендуемые режимы ХЛТ представлены в табл. 7.
У пациентов без признаков прогрессирования после индукционной ХТ, основанной на препаратах платины, в случае невозможности консолидирующего локального лечения (РЦЭ или ХЛТ) целесообразно проведение поддерживающей иммунотерапии авелумабом.
Лечение диссеминированной болезни является паллиативным и направлено на улучшение качества жизни и увеличение ее продолжительности. Основным методом является лекарственная терапия. Рекомендуемые режимы лекарственной противоопухолевой терапии распространенного РМП представлены в табл. 9.
В ряде случаев встречается олигометастатическая болезнь (до 5 метастазов в различных органах). Благоприятными факторами являются одиночное поражение или появление рецидива более чем через 36 месяцев после лечения первичной опухоли. При метахронных солитарных метастазах возможно использование метода локального контроля метастатических очагов. Метод локального контроля — хирургическая резекция или стереотаксическая ЛТ (при наличии технических возможностей и клинического опыта); допустимо использование РЧА (при наличии технических возможностей и клинического опыта. Вопрос о локальном лечении олигометастазов РМП должен решаться на междисциплинарном консилиуме, исходя из экспертизы лечащих врачей и предпочтений пациентов.
ЛТ с паллиативной целью может использоваться для уменьшения симптомов, ассоциированных с опухолевым процессом. Паллиативная/симптоматическая ЛТ на мочевой пузырь и/или опухоль может проводиться со следующими возможными вариантами фракционирования: РД 7 Гр до СД 21 Гр (3 фракции), РД 3,5 Гр до СД 35 Гр (10 фракций), РД 6 Гр (еженедельно) до СД 36 Гр и однофракционное лучевое воздействие с РД 8 Гр.
-
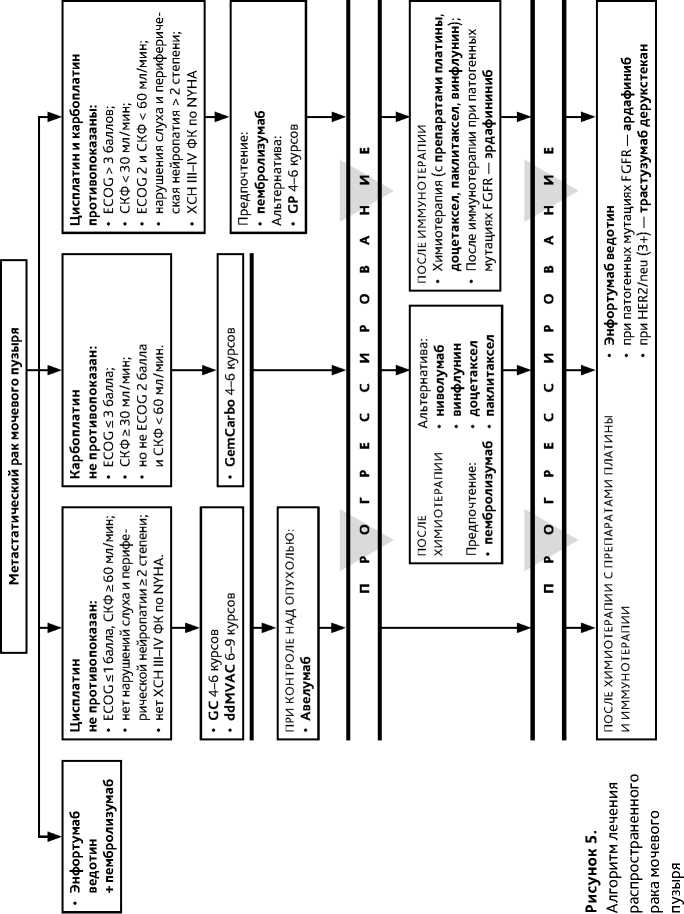
5.1.2. Терапия 1 линии
Выбор варианта лечения I линии определяется общим состоянием пациента и функцией почек (рис. 5). Платиносодержащая комбинированная ХТ (ddMVAC, GC, GemCarbo) является стандартной и способствует увеличению продолжительности жизни больных. Проводится 4–6 курсов химиотерапии с препаратами платины с последующим назначением поддерживающей иммунотерапии авелумабом при отсутствии признаков прогрессирования (предпочтительно) (МКЗ I-B1).
Режим пембролизумаб + энфортумаб ведотин может рассматриваться как одна из приоритетных опций терапии метастатического рака мочевого пузыря, обеспечивающая преимущество общей выживаемости по сравнению с режимами, основанными на гемцитабине и препарате платины (МКЗ I-A1).
Возможно назначение режима ниволумаб + гемцитабин / цисплатин , что увеличивает общую выживаемость пациентов в сравнении с самостоятельным назначением гемцитабина и цисплатина (МКЗ I-D1). При выборе данного режима терапии следует учитывать высокие риски тяжелой негематологической токсичности.
Интенсификация лечения за счёт добавления паклитаксела к цисплатину и гемцитабину не приводит к достоверному улучшению общей выживаемости, но может увеличивать вероятность достижения объективного ответа и выживаемость без прогрессирования.
При отсутствии противопоказаний предпочтение следует отдавать комбинациям на основе цисплатина.
При противопоказаниях к цисплатину предпочтительны режимы с включением карбоплатина.
При противопоказаниях к применению любых препаратов платины может быть использован пембролизумаб или атезолизумаб без определения уровня экспрессии PD-L1 или комбинация гемцитабин + паклитаксел. Относительные противопоказания для использования препаратов платины представлены в таблице 8.
Таблица 8. Противопоказания к применению препаратов платины
|
Для терапии цисплатином |
Для терапии карбоплатином |
Для любых платиновых агентов |
|
ECOG > 1 балла |
ECOG > 2 баллов |
ECOG ≥ 3 баллов |
|
СКФ < 60 мл/мин |
СКФ >30 мл/мин |
СКФ < 30 мл/мин |
|
Потеря слуха или периферическая нейропатия > 2 ст |
ECOG 2 и СКФ < 60 мл/мин |
|
|
Сердечная недостаточность III–IV класса по NYHA |
Сопутствующая патология > 2 степени |
-
5.1.3. Терапия 2 линии после химиотерапии, основанной на препаратах платины
У пациентов с прогрессированием болезни после ранее проведенной ХТ, не получавших анти-PD-(L)1-терапию, во II линии предпочтительно назначение пембролизумаба (МКЗ IA). В качестве альтернативы допустимо применение других МКА к PD-1/PD-L1 (ниволумаб) или монохимиотерапии таксанами или винфлунином.
Таблица 9. Рекомендуемые режимы химиотерапии метастатического рака мочевого пузыря
|
Название |
Режим введения химиопрепаратов |
Предпочтительные режимы для первоначального лечения
|
Пембролизумаб + энфортумаб ведотин |
Пембролизумаб 200 мг в/в капельно в 1-й день + энфортумаб ведотин 1,25 мг/кг в/в капельно в 1 и 8-й дни, курсы каждые 21 день. Терапия проводится до прогрессирования или непереносимой токсичности. |
|
GC + ниволумаб |
Цисплатин 70 мг/м 2 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1 и 8-й дни + ниво-лумаб 360 мг в/в в 1-й день каждые 3 нед.; переход на поддерживающую терапию ниволумабом в стандартном режиме после 4–6 циклов |
|
ddMVAC 1 |
Метотрексат 30 мг/м 2 в/в в 1-й день + винбластин 3 мг/м 2 в/в во 2-й день + доксорубицин 30 мг/м 2 в/в во 2-й день + цисплатин 70 мг/м 2 в/в во 2-й день + филграстим 5 мкг/кг в 4–10-й дни каждые 2 нед. |
|
GC 1,2 |
Цисплатин 70 мг/м 2 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1 и 8-й дни каждые 3 нед. |
|
GemCarbo |
Карбоплатин AUC4–5 в/в в 1-й день + гемцитабин 1000 мг/м 2 /сут. в/в в 1 и 8-й дни каждые 3 нед. (для пациентов с абсолютными или относительными противопоказаниями к применению цисплатина) |
|
Авелумаб |
800 мг в виде в/в инфузии в течение 60 минут каждые 2 недели (режим поддерживающей терапии для пациентов без признаков прогрессирования болезни после завершения платиносодержащей химиотерапии) |
Альтернативные режимы и режимы 2-й и последующих линий химиотерапии
|
GC 1 |
Цисплатин 70 мг/м 2 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1, 8 и 15-й дни каждые 4 нед. |
|
PCG 2 |
Паклитаксел 70 мг/м 2 в/в в 1 и 8-й дни + цисплатин 70 мг/м 2 в/в в 1-й день + гемцитабин 1000 мг/м 2 /сут. В/в в 1 и 8-й дни каждые 3 нед. |
|
GP 1 |
Гемцитабин 2500 мг/м 2 /сут. В/в в 1-й день + паклитаксел 150 мг/м 2 в/в в 1-й день каждые 2 нед. |
|
Винфлунин |
250–320 мг/м 2 в/в в 1-й день каждые 3 нед. |
|
Гемцитабин |
800–1200 мг/м 2 в/в в 1, 8, 15-й дни каждые 4 нед. |
|
Паклитаксел |
80 мг/м 2 в/в в 1, 8, 15-й дни каждые 4 нед. Или 135–200 мг/м 2 в/в кап. 1-й день каждые 3 нед. |
|
Доцетаксел |
60–100 мг/м 2 в/в в 1-й день каждые 3 нед. |
|
Пембролизумаб |
200 мг в/в 1 день каждые 3 нед. Или 400 мг в виде в/в инфузии в течение 30 минут каждые 6 недель |
|
Название |
Режим введения химиопрепаратов |
|
Ниволумаб |
3 мг/кг или 240 мг в виде в/в инфузии каждые 2 недели, либо 480 мг в виде в/в инфузии каждые 4 недели. Первое введение должно быть осуществлено в течение 60 минут, при хорошей переносимости все последующие — на протяжении 30 минут |
|
Энфортумаб |
1,25 мг/кг в виде в/в инфузии в течение 30 минут, в 1, 8, 15-й дни цикла, циклы каждые |
|
ведотин 3 |
28 дней |
|
Эрдафитиниб 4 |
8 мг 1 раз в сутки внутрь |
|
Атезолизумаб |
840 мг в/в день 1 каждые 2 недели ИЛИ 1200 мг в/в день 1 каждые 3 недели ИЛИ 1680 мг каждые 4 недели |
-
1 Введение цисплатина — на фоне в / в гидратации 0,9 % р-ром NaCl или других растворов, суммарный объем ≥ 2,5 л. Назначение магния сульфата в дозе 1000–1250 мг (5 мл 25 % раствора сульфата магния) перед введением цисплатина снижает риски нефротоксичности.
-
2 Режим/препарат зарегистрирован в РФ, но не входит в Клинические рекомендации Минздрава РФ.
-
3 Суммарная доза препарата не должна превышать 125 мг.
-
4 Для пациентов с альтерациями FGFR, подбор дозы осуществляется под контролем уровня фосфатов (< 9 мг / дл, отсутствии нежелательных явлений (НЯ) со стороны органа зрения и любых НЯ ≥ 2 степени — эскалация дозы до 9 мг 1 раз в сутки, в иных случаях — приостановка терапии и возможная деэскалация дозы).
-
5.1.4. Последующая терапия после иммунотерапии
-
5.1.5. Последующая терапия после химиотерапии, основанной на препаратах платины, и иммунотерапии
-
5.2. Наблюдение в процессе лечения и оценка эффекта
Пациентам с опухолями, резистентными к ИТ, показана комбинированная ХТ, основанная на препаратах платины; при противопоказаниях — монохимиотерапия таксанами или гемцитабином или их комбинацией; при наличии патогенных мутаций генов FGFR3 (точечные мутации FGFR3 (R248C (экзон 7), S249C (экзон 7), G370C (экзон 10), Y373C (экзон 10)) и/или транслокации FGFR3 (FGFR3: BAIAP2L1; FGFR3: TACC3v1; FGFR3: TACC3v3)) возможно назначение терапии эрдафитинибом (МКЗ I-A1), особенно — при опухолях верхних отделов мочевыводящих путей.
Пациентам с мультирезистентными опухолями, получавшим платиносодержащую ХТ и анти-PD-(L)1-агенты, может быть рекомендована терапия энфортумабом ведоти-ном (МКЗ I-B1), при наличии патогенных мутаций генов FGFR3, — таргетная терапия эрдафитинибом (МКЗ I-A1), при наличии гиперэкспрессии HER2/neu (3+) — терапия трастузумабом дерукстеканом. Альтернативно возможно повторное назначение платиносодержащей ХТ в случае ранее отмеченной эффективности или отказ от дальнейшей активной противоопухолевой терапии, особенно — при неудовлетворительном общем состоянии.
Наблюдение в процессе лечения проводится с целью оценки эффективности и токсичности, и включает периодический осмотр и оценку различных симптомов, лабораторных данных и результатов инструментального обследования. Оценку эффекта рекомендуется проводить после каждых 2–3 циклов ХТ с помощью данных общего осмотра, выяснения жалоб, цистоскопии и цитологического исследования мочи по клиническим показаниям и результатов инструментальных методов обследования, использовавшихся на этапе первоначальной диагностики:
КТ/рентгенография грудной клетки, КТ/МРТ органов брюшной полости и малого таза не реже 1 раза в 3 мес. в зависимости от клинических проявлений и появления новых симптомов. Результаты обследования оцениваются с использованием критериев RECIST 1.1. Оценку эффективности иммунотерапии следует проводить с использованием критериев iRECIST, но следует учитывать, что псевдопрогрессия практически не встречается при раке мочевого пузыря.
ПРИЛОЖЕНИЕ 1. Локальные осложнения, индуцированные внутрипузырной иммунотерапией вакциной БЦЖ
|
Мочеполовые осложнения |
Инициальная терапия |
Вспомогательное лечение |
Адаптация БЦЖ |
|
Цистит (непереносимое или болезненное опорожнение мочевого пузыря > 48 часов) |
Феназопиридина гидрохлорид 200 мг × 3 раза в день или НПВС |
Назначение антибактериальных препаратов в случае диагностики бактериального цистита |
Воздержаться от введения до разрешения симптомов и завершения антибактериальной терапии |
|
Сморщенный мочевой пузырь |
Гидродистенция мочевого пузыря |
Системные стероиды. В исключительных случаях аугментация мочевого пузыря или цистэктомия |
Прекратить введение для увеличения емкости мочевого пузыря |
|
Изъязвление мочевого пузыря |
300 мг изониазида и 600 мг рифампицина ежедневно в течение 6 месяцев |
Нет |
Воздержаться от введения до разрешения очагов в мочевом пузыре и получения БЦЖ-негативной мочи |
|
Гранулематозный баланит |
Различные комбинации изониазида, этамбу-тола, рифампицина от 6 до 12 месяцев |
Нет |
Воздержаться от введения до разрешения очагов |
|
Мочеполовые осложнения |
Инициальная терапия |
Вспомогательное лечение |
Адаптация БЦЖ |
|
Туберкулёзный эпидидимоорхит |
300 мг изониазида и 600 мг рифампицина ежедневно в течение 3–6 месяцев |
Для изониазид-резистент-ных — фторохинолоны или антитуберкулёзные аминогликозиды; для очагов, рефрактерных к антитуберкулёзной терапии, ревизия мошонки и орхэпидидимэктомия |
Полная отмена БЦЖ |
|
Симптомный простатит |
300 мг изониазида и 600 мг рифампицина ежедневно в течение 3–6 месяцев |
Антибиотики (фторхинолоны), если необходимо; хирургическое дренирование абсцессов; биопсия, если нет улучшения на фоне лекарственной терапии |
Полная отмена БЦЖ |
|
Стриктура уретры |
300 мг изониазида и 600 мг рифампицина ежедневно в течение 3–6 месяцев |
Установка временного дренажа (уретральное стентирование или чрескожная нефростомия) при гидронефрозе несмотря на консервативное лечение |
Прекратить введение в случае появления гидронефроза; можно возобновить после разрешения осложнения |
|
Острый пиелонефрит |
300 мг изониазида, 600 мг рифампицина и 1 200 мг этамбутола ежедневно в течение 6 месяцев |
Биопсия при отсутствии ответа на лекарственное лечение |
Полная отмена БЦЖ |
ПРИЛОЖЕНИЕ 2. Системные осложнения, индуцированные внутрипузырной иммунотерапией вакциной БЦЖ
|
Артралгия и/или артриты |
Лечение с помощью неспецифических противовоспалительных средств; при отсутствии эффекта или частичном ответе — назначение кортикостероидов, хинолонов в высоких дозах или противотуберкулёзных препаратов |
|
Персистирующая лихорадка (> 38,5 °C в течение > 48 часов) |
Полная отмена БЦЖ. Немедленное обследование: посев мочи, анализы крови, рентгенография органов грудной клетки. Попытка лечения более чем двумя антимикробными препаратами в процессе проведения диагностических процедур. Консультация инфекционистом. |
|
БЦЖ-сепсис |
Профилактика: начало внутрипузырного введения БЦЖ не ранее 2 недель после ТУР мочевого пузыря (при отсутствии симптомов гематурии). Полная отмена БЦЖ. Для тяжёлой инфекции: хинолоны в высоких дозах или изониазид, рифампицин и этамбутол 1,2 г ежедневно в течение 6 месяцев; раннее назначение ГКС в высоких дозах в течение всего периода существования симптомов сепсиса; рассмотреть эмпирическое назначение неспецифических антибактериальных препаратов для лечения грам-негативных бактерий и/или Enterococcus. |
|
Аллергические реакции |
Антигистаминные и противовоспалительные средства. Рассмотреть назначение хинолонов в высоких дозах или изониазида и рифампицина при наличии симптомов. Отсрочить терапию до разрешения симптомов. |
Резектабельный РМП T2–T4aN0–N1M0
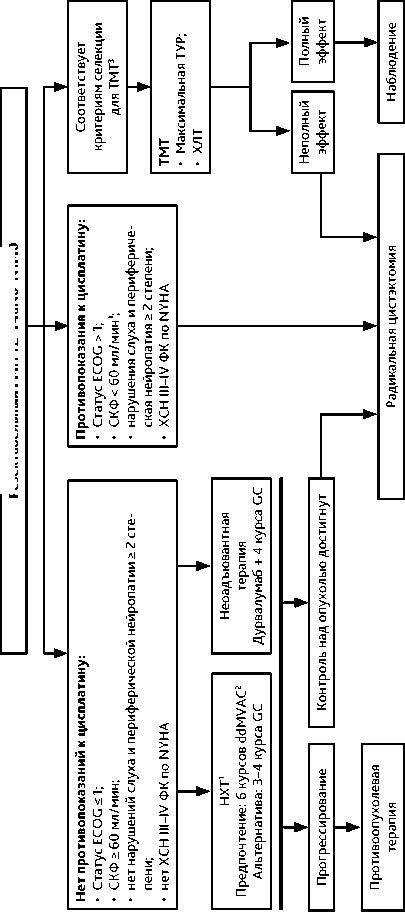


Рисунок 2. Алгоритм лечения пациентов с резектабельным мышечно-инвазивным раком мочевого пузыря T2-4aN0-N1M0
РМП — рак мочевого пузыря; ХЛТ — химио-лучевая терапия; НХТ — неоадъювантная химиотерапия; АХТ — адъювантная химиотерапия.
Рисунок 3. Алгоритм лечения пациентов с мышечно-инвазивным раком мочевого пузыря после радикальной цистэктомии
с нерезектабельным мышечно-инвазивным раком мочевого пузыря (T4b и/или N2–3 и М0
том/vol. 15(3s2)2025
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


