Рак молочной железы
Автор: Тюляндин С.А., Артамонова Е.В., Жигулев А.Н., Жукова Л.Г., Карабина Е.В., Королева И.А., Пароконная А.А., Семиглазова Т.Ю., Стенина М.Б., Фролова М.А.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S2-1.2 т.15, 2025 года.
Бесплатный доступ
В данном разделе указаны критерии оценки клинической значимости применения дорогостоящей противоопухолевой лекарственной терапии в соответствии со шкалой, разработанной экспертной группой (см. стр. 7). В тексте они обозначены, как магнитуда клинической значимости (МКЗ).
Рак молочной железы, химиотерапия, гормонотерапия, рецепторы эстрогенов и прогестерона, мутация BRCA, Ki-67, HER2
Короткий адрес: https://sciup.org/140312955
IDR: 140312955 | DOI: 10.18027/2224-5057-2025-15-3s2-1.2-01
Текст научной статьи Рак молочной железы
При планировании и проведении лекарственной терапии следует руководствоваться стремлением обеспечить всех больных максимально качественным и экономически доступным лечением. Лечение должно планироваться при участии нескольких специалистов, включая врача-хирурга, врача-онколога (химиотерапевта) и врача-радиотерапевта, а также по возможности патоморфолога и врача-репродуктолога (при планировании терапии пациенток репродуктивного возраста, желающих сохранить фертильность). Больные должны быть информированы о плане лечебно-диагностических мероприятий, целях различных видов помощи, возможных побочных эффектах и влиянии на функциональную, эмоциональную и социальную сферы. При невозможности проведения рекомендованных методов лечения (наличие противопоказаний) необходимо составить индивидуальный план лечения. Общими противопоказаниями являются случаи тяжелых соматических заболеваний в стадии декомпенсации, когда риск возможных осложнений для жизни в процессе лечения выше риска прогрессирования рака молочной железы (РМЖ).
1. ОПРЕДЕЛЕНИЕ СТАДИИ
Для стадирования РМЖ следует использовать TNM-классификацию AJCC (8-е издание, 2017 г.). Выделяют клиническую и патоморфологическую стадии РМЖ, которые могут существенно различаться. Клиническое стадирование (обозначается префиксом “c”, от англ. “clinical”) проводится на основании результатов клинического обследования, пато-морфологическое (определяется префиксом “p”, от англ. “pathologic”) — на основании заключения морфолога после изучения удаленных во время операции тканей. Пато-морфологическое стадирование по значимости превосходит клиническое. Категории Т и N, оцениваемые после неоадъювантной терапии, обозначаются префиксом “y”: “yc” — при клиническом стадировании или “yp” — при патоморфологическом стадировании, например, “ypT” или “ypN”.
-
1.1. Клинико-патологическая классификация1.1.1. Первичная опухоль (Т) — клиническая и патологическая классификация
Категория Т Характеристика
Tх
Недостаточно данных для оценки опухоли
Т0
Нет признаков первичной опухоли
Тis (DCIS)
Протоковая карцинома in situ
Тis (Педжета)
Рак Педжета (соска), не ассоциированный с инвазивным раком и/или раком in situ (DCIS) подлежащей паренхимы молочной железы. Опухоль паренхимы молочной железы, ассоциированную с раком Педжета, следует классифицировать на основании ее размеров и характеристик; присутствие рака Педжета в этом случае обязательно должно быть зафиксировано
T1
Опухоль ≤ 20 мм в наибольшем измерении
Т1mi
Mикроинвазия ≤ 1 мм в наибольшем измерении
Т1а
Опухоль > 1 мм, но ≤ 5 мм в наибольшем измерении
Т1в
Опухоль > 5 мм, но ≤ 10 мм в наибольшем измерении
Т1с
Опухоль > 10 мм, но ≤ 20 мм в наибольшем измерении
Т2
Опухоль > 20 мм, но ≤ 50 мм в наибольшем измерении
ТЗ
Опухоль > 50 мм в наибольшем измерении
Т4
Опухоль любого размера с прямым распространением на грудную стенку и/или кожу (изъязвление или макроскопические узелки); изолированная инвазия дермы не классифицируется как T4 1
Т4а
Распространение на грудную стенку; инвазия или тесное прилегание к грудным мышцам в отсутствие вовлечения в процесс элементов грудной стенки не классифицируется как T4a
Т4b
Изъязвление и/или ипсилатеральные макроскопические сателлитные узелки и/или отек кожи (включая положительный симптом «апельсиновой корочки»), который не соответствует критериям воспалительного рака
Т4с
Признаки T4a и T4b
Т4d
Воспалительный рак
-
1.1.2. Регионарные лимфатические узлы (N)1.1.2.1. Клиническая классификация (сN)1
Категория cN
Характеристика
cNx
Состояние регионарных лимфатических узлов не может быть оценено (удалены ранее)
cN0
Нет признаков поражения метастазами регионарных лимфатических узлов по данным клинического осмотра и обследования
cN1
Метастазы в смещаемых ипсилатеральных подмышечных лимфатических узлах I, II уровней
cN1mi Микрометастазы (комплексы около 200 клеток с наибольшим размером более 0,2 мм, но менее 2 мм) 2
cN2
Метастазы в ипсилатеральных подмышечных лимфатических узлах I, II уровней, спаянные между собой или фиксированные к близлежащим структурам, или метастазы в ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлах в отсутствие клинически явного поражения подмышечных лимфатических узлов
cN2a Метастазы в ипсилатеральных подмышечных лимфатических узлах I, II уровней, спаянные между собой или фиксированные к близлежащим структурам
cN2b Метастазы в ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлах в отсутствие клинически явного поражения подмышечных лимфатических узлов
сN3
Mетастазы в ипсилатеральных подключичных (III уровень) лимфатических узлах в сочетании или без вовлечения подмышечных лимфатических узлов (I, II уровни) или метастазы в ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлах и подмышечных лимфатических узлах (I, II уровни) или метастазы в ипсилатеральных надключичных лимфатических узлах (независимо от состояния подмышечных и внутренних маммарных (парастернальных) лимфатических узлов)
cN3a Mетастазы в ипсилатеральных подключичных (III уровень) лимфатических узлах
cN3b Метастазы в ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлах и подмышечных лимфатических узлах (I, II уровни)
cN3c Метастазы в ипсилатеральных надключичных лимфатических узлах
-
-
1 Индексы (sn) или (f) должны быть добавлены к категории N для обозначения способа подтверждения метастатического поражения лимфоузлов — с помощью БСЛУ (sn) или тонкогоигольной аспирационной / core-биопсии (f).
-
2 Используется при постановке диагноза с помощью БСЛУ.
-
1.1.2.2. Патологическая классификация (pN)1
Категория pN
Характеристика
рNx
Состояние лимфатических узлов не может быть оценено (не удалены для патологического исследования или удалены ранее)
pN0
Метастазы в регионарных лимфатических узлах отсутствуют или имеются только изолированные опухолевые клетки
Категория pN
Характеристика
pN0 (i+)
Только изолированные опухолевые клетки (скопления опухолевых клеток не более 0,2 мм в наибольшем измерении) в лимфатических узлах
pN0 (mol+)
Позитивный молекулярный ПЦР тест; изолированные опухолевые клетки не определяются
pN1
Микрометастазы или метастазы в 1–3 подмышечных лимфатических узлах и/или микро-или макрометастазы в клинически негативных внутренних маммарных (парастернальных) лимфатических узлах, выявленные с помощью БСЛУ на стороне поражения
pN1mi
Микрометастазы (скопления около 200 клеток более 0,2 мм, но менее 2,0 мм в наибольшем измерении)
pN1a
Метастазы в 1–3 подмышечных лимфатических узлах, один из которых более 2,0 мм в наибольшем измерении
pN1b
Метастазы в ипсилатеральных внутренних маммарных (парастернальных) сентинальных лимфоузлах, исключая изолированные опухолевые клетки
pN1c
Признаки pN1a и pN1b
pN2
Метастазы в 4–9 подмышечных лимфатических узлах или клинически определяемое поражение ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлов при отсутствии поражения подмышечных лимфатических узлов
pN2a
Метастазы в 4–9 подмышечных лимфатических узлах (как минимум одно скопление опухолевых клеток ≥ 2 мм)
pN2b
Клинически определяемое поражение ипсилатеральных внутренних маммарных (парастернальных) лимфатических узлов (± микроскопическое подтверждение) при отсутствии поражения подмышечных лимфатических узлов
pN3
Метастазы в 10 и более подмышечных лимфоузлах или подключичных (III уровень) лимфатических узлах или клинически определяемое поражение ипсилатеральных внутренних маммарных (парастернальных) и подмышечных лимфатических узлов (I, II уровни) или поражение 4 и более подмышечных лимфатических узлов в сочетании с микро- или макроскопическим поражением по данным БСЛУ ипсилатеральных клинически интактных внутренних маммарных (парастернальных) лимфатических узлов или поражение ипсилатеральных надключичных лимфатических узлов
pN3a
Метастазы в 10 и более подмышечных лимфоузлах или подключичных (III уровень) лимфатических узлах
pN3b
pN1a или pN2a в сочетании с cN2b (клинически определяемым поражением внутренних маммарных (парастернальных) лимфоузлов)
или pN2a в сочетании с pN1b
pN3c
Метастазы в ипсилатеральных надключичных лимфоузлах
-
1 Индексы (sn) или (f) должны быть добавлены к категории N для обозначения способа подтверждения метастатического поражения лимфоузлов — с помощью БСЛУ (sn) или тонкогоигольной аспирационной / core-биопсии (f) соответственно (без последующего удаления лимфоузлов).
-
1.1.3. Отдаленные метастазы (М)
Категория М Характеристика сМ01 Нет клинических или радиографических признаков отдаленных метастазов cM0 Нет клинических или радиографических признаков отдаленных метастазов
(i+) в сочетании с наличием опухолевых клеток или комплексов опухолевых клеток размером не более 0,2 мм, определяемых микроскопически или с помощью молекулярных технологий в крови, костном мозге или иных не регионарных тканях при отсутствии клинических симптомов или признаков метастазов cM1 Есть отдаленные метастазы, определяемые клинически или с помощью методов визуализации pM1 Любые гистологически доказанные отдаленные метастазы или метастазы более 0,2 мм в нерегионарных лимфоузлах
-
1 Категория сМ0 не требует подтверждения с помощью методов визуализации.
1.2. Клиническая (анатомическая) классификация
Категория T
Категория N
Категория M
Стадия
Tis
N0
M0
0
T1
N0
M0
IA
T0
N1mi
M0
IB
T1
N1mi
M0
T0
N1
M0
IIA
T1
N1
M0
T2
N0
M0
T2
N1
M0
IIB
T3
N0
M0
T0
N2
M0
IIIA
T1
N2
M0
T2
N2
M0
T3
N1
M0
T3
N2
M0
T4
N0
M0
IIIB
T4
N1
M0
T4
N2
M0
Любая Т
N3
M0
IIIC
Любая Т
Любая N
M1
IV
2. РАННИЙ (ПЕРВИЧНО ОПЕРАБЕЛЬНЫЙ)И МЕСТНОРАСПРОСТРАНЕННЫЙ (ПЕРВИЧНОНЕ ОПЕРАБЕЛЬНЫЙ) РАК МОЛОЧНОЙ ЖЕЛЕЗЫ
2.1. Диагностика
1.3. Гистологическая степень злокачественности опухоли (G)
|
Категория G Характеристика |
|
|
Gx |
Категория G не может быть определена |
|
G1 |
Низкая степень злокачественности (благоприятный вариант), 3–5 баллов по шкале SBR 1 |
|
G2 |
Умеренная степень злокачественности (промежуточный вариант), 6–7 баллов по шкале SBR |
|
G3 |
Высокая степень злокачественности (неблагоприятный вариант), 8–9 баллов по шкале SBR |
|
1 SBR — 1 |
шкала Scarff – Bloom – Richardson, Ноттингемская модификация. |
Диагноз РМЖ основывается на данных осмотра, результатах инструментальных методов обследования и патологоанатомического исследования биопсийного/опера-ционного материала. Первичное обследование должно быть проведено до всех видов лечебных воздействий и включает в себя:
-
• выяснение жалоб и сбор анамнеза с целью выявления клинико-анамнестических особенностей пациента и заболевания, а также факторов, которые могут повлиять на тактику дальнейшего обследования и лечения;
-
• общий осмотр, пальпацию молочных желез и зон регионарного метастазирования (подмышечных, над-, подключичных) с целью оценки общего состояния пациента и определения клинической стадии заболевания;
-
• общий (клинический) анализ крови развернутый;
-
• биохимический общетерапевтический анализ крови, включая показатели функции печени (билирубин, АЛТ, АСТ, ЩФ), почек (мочевина, креатинин), уровень глюкозы;
-
• исследование свертывающей системы крови (коагулограмма);
-
• общий (клинический) анализ мочи;
-
• билатеральную маммографию + УЗИ молочных желез и лимфатических узлов регионарных зон; МРТ молочных желез — по показаниям 1 ;
-
• R-графию органов грудной клетки; КТ органов грудной клетки — по показаниям 1 ;
-
• УЗИ органов брюшной полости, забрюшинного пространства и малого таза;
КТ/МРТ органов брюшной полости, забрюшинного пространства и малого таза с контрастированием — по показаниям 1 ;
-
• радиоизотопное исследование скелета + рентгенографию и / или КТ / МРТ зон накопления РФП — по показаниям 1 ;
-
• биопсию опухоли с патологоанатомическим исследованием биопсийного/опера-ционного материала, включая определение гистологического варианта опухоли и степени злокачественности;
-
• определение в опухолевой ткани РЭ, РП, HER2 и Ki-67, а также E-cadherin при подозрении на инвазивный дольковый вариант;
-
• исследование уровня ФСГ и общего эстрадиола в сыворотке крови для оценки функции яичников 2 (см. раздел 2.2.1.5, «Критерии менопаузы»);
-
• определение герминальных мутаций BRCA1 / 2 методом ПЦР при наличии, по крайней мере, одного из следующих факторов:
-
– РМЖ в возрасте ≤ 50 лет;
-
– РМЖ с тройным негативным фенотипом в любом возрасте;
-
– второй (синхронный или метахронный) РМЖ в любом возрасте;
-
– первично множественный рак: РМЖ + эпителиальный рак яичников (включая рак маточных труб и первичный рак брюшины) или экзокринный рак поджелудочной железы в любом возрасте;
-
– РМЖ у мужчин в любом возрасте;
-
– отягощенный семейный анамнез:
-
• наличие у кровных родственников 1–2 степени родства в возрасте ≤ 50 лет РМЖ, рака яичников, рака поджелудочной железы, рака предстательной железы, РМЖ у мужчины;
-
• наличие у кровных родственников герминальных мутаций BRCA1/ 2.
Примечание: больным с вышеперечисленными факторами при отсутствии мутаций BRCA1/2 по данным ПЦР показано выполнение высокопроизводительного секвенирования (NGS) при наличии такой возможности. Для лиц неславянской этнической группы предпочтительным методом определения мутаций BRCA является высокопроизводительное секвенирование (NGS) при наличии такой возможности.
Патоморфологический диагноз устанавливается с помощью биопсии первичной опухоли, которая должна быть выполнена до всех видов лечебных воздействий (при невозможности биопсии первичной опухоли может быть выполнена биопсия регионарного лимфоузла либо любого доступного для биопсии патологического очага). Для адекватного клинического стадирования и определения оптимальной тактики лечения в дополнение к верификации опухоли в молочной железе рекомендуется морфологическое исследование подозрительных в отношении метастатического поражения регионарных лимфатических узлов (цитологическое или гистологическое и ИГХ). Биопсию опухоли рекомендуется выполнять, даже если на первом этапе планируется оперативное лечение. При назначении неоадъювантной системной терапии полноценное клиническое стадирование должно быть проведено до начала лечения.
Определение в опухоли уровня экспрессии РЭ, РП, HER2 и Ki-67 является обязательным; предпочтение отдается ИГХ методу. Оценку рецепторного статуса предпочтительно проводить по методу Allred, который включает данные не только о процентном содержании клеток, положительных по РЭ и РП, но и об интенсивности их окрашивания. Итоговый показатель по каждому рецептору представляет собой сумму баллов, полученных при определении доли окрашенных ядер клеток и интенсивности их окрашивания. Таким образом, результат может колебаться от 0 до 8, при этом уровень экспрессии 0–2 балла соответствует негативному значению, 3–4 балла — слабоположительному, 5–6 баллов — умеренному и 7–8 баллов — выраженному. Опухоли с содержанием окрашенных на РЭ ядер от 1 до 10% считаются слабоположительными и отличаются низкой чувствительностью к ГТ. Определение РП дополняет прогностическую характеристику опухоли и служит контролем возможного ложноотрицательного результата определения РЭ. Случаи положительных РП при отрицательных РЭ требуют повторного определения РП и исключения фонового окрашивания. Больные с опухолями, положительными по РП и отрицательными по РЭ, могут быть кандидатами для ГТ, однако, данные об эффективности этого метода в данной подгруппе больных ограничены.
Интерпретация морфологом результатов определения РЭ должна включать оценку конкордантности результатов ИГХ и гистологического исследований. Так, например, дольковые и протоковые инвазивные карциномы низкой степени злокачественности, «чистые» тубулярные, крибриформные и муцинозные карциномы, а также инкапсулированная и солидная папиллярные карциномы крайне редко бывают отрицательными по РЭ, в то время как метапластическая карцинома (все типы), аденокистозная карцинома (и другие карциномы, похожие на рак слюнной железы), секреторная карцинома и карцинома с апокринной дифференцировкой, наоборот, крайне редко бывают положительными по РЭ.
При дискордантности данных гистологического и ИГХ исследований клиницист должен обсудить с морфологом возможные причины расхождения в полученных результатах и при необходимости назначить повторное тестирование или получение мнения второго морфолога с целью уточнения иммунофенотипа опухоли.
Определение HER2 должно проводиться только в инвазивном компоненте опухоли. При неопределенном результате ИГХ анализа HER2 (2+) следует провести определение амплификации гена HER2 методом in situ гибридизации (FISH, CISH или SISH).
Заключительные клинический и патоморфологический диагнозы устанавливаются в соответствии с действующими классификациями ВОЗ и TNM после изучения всех удаленных тканей. При патоморфологическом исследовании удаленной опухоли должны быть определены:
-
• гистологический вариант опухоли;
-
• степень злокачественности;
-
• состояние краев резекции;
-
• выраженность лимфоваскулярной инвазии;
-
• состояние подмышечных лимфоузлов;
-
• в случае отрицательных значений РЭ, РП и HER2 по данным ИГХ исследования биопсийного материала рекомендуется повторное определение этих рецепторов в удаленной опухоли и /или метастатических лимфоузлах с учетом возможной гетерогенности опухоли;
-
• выраженность патоморфологического ответа в первичной опухоли и регионарных лимфоузлах (в случае неоадъювантной лекарственной терапии); рекомендуемыми методами оценки степени выраженности патоморфологического ответа являются:
– классификация ВОЗ с указанием категорий ypTypN
– система RCB (Residual Cancer Burden; бесплатный онлайн калькулятор доступен на сайте http://www3.mdanderson.org/app/medcalc/index . cfm?pagename=jsconvert3) или https://share.xpractice.ru/rcb-calc/index-temporary.html# .
-
2. 2. Лечение
-
-
2.2.1. Ранний (первично операбельный) рак молочной железы
-
-
-
2.2.1.1. Стадия 0 (ТisN0М0), протоковый рак in situ
Рекомендуемый алгоритм дигностики при подозрении на РМЖ представлен на рис. 1.
(0, I, IIA, IIB, IIIA стадии)
Для профилактики развития вторых опухолей в контралатеральной и резецированной (в случае выполнения органосохраняющей операции) молочной железе при положительных РЭ во внутрипротоковом ( in situ ) раке рекомендуется рассмотреть назначение ГТ c использованием одного из следующих режимов:
-
• тамоксифен 20 мг внутрь ежедневно в течение 5 лет у больных в пре- и постменопаузе;
-
• тамоксифен 5 мг внутрь ежедневно или 10 мг внутрь через день в течение 3 лет у больных в пре- и постменопаузе в случае плохой переносимости стандартной дозы тамоксифена (является не зарегистрированным в РФ показанием);
-
• ингибиторы ароматазы (летрозол 2,5 мг или анастрозол 1 мг или эксеместан 25 мг внутрь ежедневно) в течение 5 лет у больных в стойкой менопаузе.
-
2.2.1.2. Общие принципы адъювантной/постнеоадъювантной лекарственной терапии инвазивного РМЖ
Овариальная супрессия при TisN0M0 не показана. ХТ при TisN0M0 не показана.
Адъювантная/постнеоадъювантная лекарственная терапия проводится в дополнение к локальным (хирургическому и лучевому) методам лечения и позволяет снизить риск рецидива болезни и смерти. При планировании адъювантной/постнеоадъювантной лекарственной терапии необходимо учесть прогноз, эффективность неоадъювантной терапии (если таковая проводилась), ожидаемую пользу данного вида лечения, возможные побочные эффекты, сопутствующую патологию, а также предпочтения больной. Возраст сам по себе не является ограничением для лекарственной терапии при отсутствии сопутствующей патологии.
При опухолях небольших размеров (≤ 0,5 см) в сочетании c N0, являющихся прогностически благоприятными, адъювантная лекарственная терапия обладает минимальной эффективностью. Назначение адъювантной ГТ (при гормонозависимых опухолях) в такой ситуации имеет целью профилактику вторых (контралатеральных) гормонозависимых опухолей.
План адъювантной/постнеоадъювантной лекарственной терапии основывается на принадлежности опухоли к одному из молекулярно-биологических подтипов, стадии заболевания и факторах прогноза (табл. 2, 3). Адъювантная лекарственная терапия должна начинаться с ХТ, если таковая показана. Не рекомендуется одновременное введение антрациклинов и анти-HER2-препаратов ввиду высокого риска кардиотоксичности; адъювантная ХТ таксан-содержащими режимами должна проводиться одновременно с анти-HER2-терапией, если таковая показана. ГТ должна начинаться после завершения ХТ и проводиться одновременно с продолжающейся анти-HER2-терапией, включая постнеоадъювантную терапию трастузумабом эмтанзином (у больных с положительным HER2-статусом опухоли). ЛТ должна начинаться после завершения ХТ и проводиться одновременно с ГТ и анти-HER2-терапией, включая постнеоадъювантную терапию трастузумабом эмтанзином, а также одновременно с постнеоадъювантной терапией капецитабином при тройном негативном РМЖ и перед олапарибом при BRCA-ассоциированном тройном негативном РМЖ.
Адъювантная ХТ, как правило, не рекомендуется больным, получившим стандартный объем неоадъювантной ХТ (табл. 8); исключение составляют больные тройным негативным и HER2-позитивным РМЖ с резидуальной опухолью (см. разделы 2.2.1.3 и 2.2.1.4 и табл. 4, 5). В тех случаях, когда план неоадъювантной ХТ по каким-либо причинам не был полностью выполнен, рекомендуется проведение недостающих курсов лечения в послеоперационном периоде.
Таблица 2. Суррогатное определение молекулярно-биологических подтипов рака молочной железы
|
Молекулярно-биологический подтип |
Клинико-патологическое (суррогатное) определение подтипа |
|
Люминальный А |
Наличие всех факторов:
|
|
Люминальный В (HER2-отрицательный) |
– Ki-67 высокий (≥ 30%) – РП низкие (< 20%) |
|
Люминальный В (HER2-положительный) |
|
|
HER2-положительный (не люминальный) |
• HER2-положительный
|
|
Базальноподобный |
• отрицательные РЭ, РП, HER2 (тройной негативный протоковый) |
-
1 Значение Ki-67 следует оценивать, исходя из опыта локальной патоморфологической лаборатории: например, если медиана значений Ki-67 при гормонозависимом РМЖ составляет в данной лаборатории 20 %, то значение этого показателя, равное ≤ 10 %, следует расценивать как низкое, а ≥ 30 % — как высокое; при уровне Ki-67 от 20 до 30 % при решении вопроса о тактике лечения следует учитывать другие, клинико-морфологические факторы прогноза (стадию, степень злокачественности, морфологический вариант и др.).
-
2 Пороговым значением при определении РП считается 20 %.
-
2.2.1.3. Адъювантная/постнеоадъювантная химиотерапия HER2-отрицательного рака молочной железы (рис. 3 и 4)
Таблица 3. Рекомендуемый алгоритм назначения адъювантной системной терапии в зависимости от молекулярно-биологического подтипа и стадии
|
Молекулярнобиологический подтип |
Рекомендуемая адъювантная системная терапия Примечания |
|
Люминальный А (табл. 4, рис. 3) |
Только ГТ в большин- Назначение адъювантной ХТ (в дополнение к адъювантной стве случаев ГТ) должно быть рассмотрено при поражении метаста зами ≥ 4 регионарных лимфатических узлов; в качестве ХТ рекомендуются режимы:
|
|
Молекулярнобиологический подтип |
Рекомендуемая адъювантная системная терапия Примечания |
|
Люминальный В (HER2-отрицатель-ный) (табл. 4, рис. 3) |
ХТ в большинстве • При T1a-b (≤ 10 мм) и N0 показана только адъювантная ГТ; случаев + ГТ • для остальных больных (в дополнение к адъювантной ГТ):
в качестве ХТ могут быть использованы режимы: – DC (доцетаксел + циклофосфамид, 4 цикла; предпочтительный режим) или – АС/ЕС (4 цикла); – у больных в пременопаузе возможен отказ от адъювантной ХТ в пользу овариальной супрессии (в сочетании с тамоксифеном или ингибиторами ароматазы);
– DC (доцетаксел + циклофосфамид, 6 циклов) или – АС/ЕС 4 цикла с последующими 4 циклами доцетаксела/12 еженедельными введениями паклитаксела;
|
|
Люминальный В (HER2-положитель-ный) (табл. 5, 7; рис. 2) |
ХТ + анти-HER2- • При T1a (≤ 5 мм) и N0: только адъювантная ГТ; ХТ терапия + ГТ и анти-HER2-терапия не показаны;
в течение 1 2 мес. в сочетании с одним из следующих режимов ХТ без антрациклинов: – паклитаксел 12 еженедельных введений или – DC (доцетаксел + циклофосфамид) 4 цикла;
– доцетаксел + карбоплатин (6 циклов) или – АС/ЕС (4 цикла), далее — доцетаксел 4 цикла/12 еженедельных введений паклитаксела;
12 мес. в сочетании с одним из следующих режимов ХТ: – доцетаксел + карбоплатин (6 циклов) или – АС/ЕС (4 цикла), далее — доцетаксел 4 цикла/12 еженедельных введений паклитаксела);
|
|
Молекулярно- Рекомендуемая биологический адъювантная подтип системная терапия |
Примечания |
|
HER2-положительный ХТ + анти-HER2-(не люминальный) терапия (табл. 5; рис. 2); |
в течение 12 мес. в сочетании с одним из следующих режимов ХТ без антрациклинов: – паклитаксел 1 2 еженедельных введений или – DC (доцетаксел + циклофосфамид) 4 цикла;
– доцетаксел + карбоплатин (6 циклов) или – АС/ЕС (4 цикла), далее — доцетаксел 4 цикла/12 еженедельных введений паклитаксела
– доцетаксел + карбоплатин (6 циклов) или – АС/ЕС (4 цикла), далее — доцетаксел 4 цикла/ 1 2 еженедельных введений паклитаксела) |
|
Тройной негативный ХТ с включе-(рис. 4) нием антрациклинов и таксанов |
4 цикла АС/ЕС (предпочтительно 1 раз в 2 нед.) ^ 12 еженедельных введений паклитаксела ± карбоплатин/4 цикла паклитаксела 1 раз в 2 нед./4 цикла доцетаксела (при невозможности назначения паклитаксела) (табл. 4, рис. 5) |
Основными принципами адъювантной/постнеоадъювантной ХТ являются:
-
• использование стандартных режимов с соблюдением рекомендуемой дозовой интенсивности: необходимо избегать необоснованной (в отсутствие токсичности) редукции доз препаратов и увеличения интервалов между курсами;
-
• последовательное (а не одновременное!) использование антрациклинов и так-санов;
-
• еженедельное (а не 1 раз в 3 нед.) введение паклитаксела; при невозможности еженедельного введения паклитаксела следует использовать доцетаксел или паклитаксел 175 мг/м 2 1 раз в 2 нед (+ Г-КСФ);
-
• начало адъювантной / постнеоадъювантной ХТ — не позднее 4–6 нед. после оперативного вмешательства в отсутствие хирургических осложнений; в случае хирургических осложнений — после их разрешения; проведение адъювантной ХТ по прошествии 3 и более месяцев после хирургического лечения нецелесообразно.
Больным РМЖ с тройным негативным фенотипом, получившим неоадъювантную ХТ антрациклинами и таксанами в стандартном объеме, при наличии инвазивной резидуальной опухоли любого объема рекомендуется назначение капецитабина (табл. 4).
Больным BRCA-ассоциированным тройным негативным РМЖ, получившим стандартную неоадъювантную ХТ, при наличии инвазивной резидуальной опухоли, соответствующей ypT ≥ 1b или ypN+ или RCB II–III, рекомендуется назначение олапариба с адъювантной целью (табл. 4) [МКЗ 0-B1].
При наличии показаний к проведению адъювантной ЛТ рекомендуется проводить ее одновременно с приемом капецитабина. Олапариб следует назначать после окончания ЛТ. Рекомендуемые режимы адъювантной/постнеоадъювантной лекарственной терапии HER2-отрицательного РМЖ представлены в табл. 4.
Таблица 4. Рекомендуемые режимы адъювантной/постнеоадъювантной терапии HER2-отрицательного рака молочной железы
|
ddAC x 4 ^ ddP x 4 1,2,3 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед. с первичной Г-КСФ профилактикой, 4 цикла > паклитаксел 175 мг/м 2 в/в в 1-й день 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой |
|
ddAC x 4 > P x 12 1 , 2 , 3 , 4 , 5 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой > паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений |
|
ddAC x 4 > P + С x 12 1 , 2 , 3 , 4 , 5 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой > паклитаксел 80 мг/м 2 в/в + карбоплатин AUC2 в/в еженедельно, 12 введений |
|
DC × 4–6 3 |
Доцетаксел 75 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день 1 раз в 3 нед., 4–6 циклов с первичной Г-КСФ профилактикой |
|
AC × 41 |
Доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день 1 раз в 3 нед., 4 цикла |
|
AC x 4 > D x 4 1 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла > доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед., 4 цикла |
|
AC x 4 > P x 12 1,4,5 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла > паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений |
|
Капецитабин (монотера-пия) 6,7,8 |
Капецитабин 2000–2500 мг/м 2 внутрь в 1-й — 14-й дни каждые 3 нед. в течение 6 мес. |
|
Капецитабин 1300 мг/м 2 /сут. внутрь ежедневно в течение 1 года |
|
|
Олапариб 9 |
Олапариб (в таблетках) по 300 мг внутрь × 2 раза в день ежедневно в течение 1 года |
1 Доксорубицин может быть заменен на эпирубицин в курсовой дозе 90 мг /м 2 (режим ЕС).
-
2 Режим с уплотненным введением химиопрепаратов (dd — dose-dense) следует рассмотреть при быстро пролиферирующих (с высоким Ki-67 и / или G3) вариантах РМЖ, в первую очередь — при тройном негативном РМЖ.
-
3 Требуется профилактическое назначение Г-КСФ (филграстим 5 мкг /кг п /к через 24–72 часа после окончания введения химиопрепаратов минимум в течение 5 дней или до восстановления нормального числа нейтрофилов после надира; пэгфилграстим 6 мг или эмпэгфилграстим 7,5 мг п /к, через 24–72 часа после введения химиопрепаратов однократно, принимая во внимание, что следующий курс ХТ может быть начат не ранее, чем через 14 дней после их введения).
-
4 При использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) и проводиться по схеме: 1–2-й курсы — за 30–60 мин. до введения паклитаксела дексаметазон 10 мг в /м или внутрь, блокаторы рецепторов H1 (дифенгидрамин 25–50 мг или эквивалентные дозы аналогов) в / в струйно, блокаторы рецепторов H2 (фамотидин 20 мг или циметидин 300 мг в / в струйно). При возникновении реакции гиперчувствительности на фоне сокращенной премедикации рекомендуется использовать стандртную премедкацию дексаметазоном по 20 мг в /м или внутрь за 12 и 6 часов до введения паклитаксела в сочетании с блокаторами рецепторов H1 /H2. При отсутствии реакций гиперчувствительности на первых двух курсах в дальнейшем возможно ограничиться введением блокаторов H1 гистаминовых рецепторов (дифенгидрамин 25–50 мг или эквивалентные дозы аналогов). Введение паклитаксела может проводиться при АЧН ≥ 1,0 × 10 9 /л и количестве тромбоцитов ≥ 100,0 × 10 9 /л.
-
5 Режим введения паклитаксела 175 мг /м 2 1 раз в 3 нед. является менее эффективным по сравнению с еженедельным, особенно при тройном негативном подтипе РМЖ.
-
6 Рекомендуется больным РМЖ с тройным негативным фенотипом (отрицательные РЭ, РП и HER2), получившим неоадъювантную ХТ антрациклинами и таксанами в стандартном объеме, при наличии инвазивной резидуальной опухоли.
-
7 Адъювантная ХТ капецитабином может проводиться как совместно с ЛТ (при показаниях к ее назначению), так и после ее окончания.
-
8 В исследовании OlympiA (посвящено оценке эффективности олапариба в адъювантной терапии BRCA-ассоциированного РМЖ) больные тройным негативным РМЖ не получали капецитабин с пост-нео-адъювантной целью, в связи с этим данных о целесообразности использования и капецтабина, и олапа-риба, а также преимуществах того или иного препарата у больных тройным негативным BRCA-ассоциированным РМЖ при резидуальной болезни нет.
-
9 Назначение олапариба с адъювантной целью следует рассмотреть при BRCA-ассоциированном тройном негативном подтипе РМЖ после стандартной неоадъювантной ХТ при наличии инвазивной резидуальной опухоли, соответствующей ypT ≥ 1b или ypN+ или RCB II–III [МКЗ 0-B1]. Олапариб следует назначать после окончания лучевой терапии.
-
2.2.1.4. Адъювантная/постнеоадъювантная терапия HER2-положительного рака молочной железы (рис. 2)
Адъювантная/постнеоадъювантная терапия HER2-положительного РМЖ включает анти-HER2-терапию, ХТ (если она не назначалась неоадъювантно) и ГТ (при наличии в опухоли РЭ и РП) и назначается по следующим принципам:
-
1) больные, не получавшие никакой неоадъювантной лекарственной терапии:
– при pT1N0 — трастузумаб в течение 12 мес. в сочетании с одним из следующих режимов ХТ без антрациклинов (± ГТ в зависимости от РЭ и РП):
– паклитаксел 12 еженедельных введений или
– DC (доцетаксел + циклофосфамид) 4 цикла (табл. 5);
– при pT любая N1M0–Т2N0M0 трастузумаб в течение 12 мес. в сочетании с одним из следующих режимов химиотерапии (± ГТ в зависимости от РЭ): – доцетаксел + карбоплатин (6 циклов) или
– АС/ЕС (4 цикла), далее — доцетаксел 4 цикла/12 еженедельных введений паклитаксела ± карбоплатина;
– при pT любая N2–3 — трастузумаб ± пертузумаб в течение 12 мес. в сочетании с одним из следующих режимов химиотерапии (± ГТ в зависимости от РЭ) [МКЗ 0-С1]:
– доцетаксел + карбоплатин (6 циклов) или
– АС/ЕС (4 цикла), далее — доцетаксел 4 цикла/12 еженедельных введений паклитаксела (табл. 5);
-
2) больные, получавшие неоадъювантную лекарственную терапию антрациклинами и/или таксанами в сочетании с анти-HER2-терапией:
– при ypT0–IаypN0 или RCB 0–I — постнеоадъювантная терапия трастузумабом до общей продолжительности 12 мес., включая дооперационный этап (17 введений за вычетом количества введений анти-HER2-препаратов на дооперационном этапе) (± адъювантная ГТ в зависимости от уровня РЭ);
-
– при ypT ≥ 1b или ypN (+) или RCB II–III — постнеоадъювантная терапия трастузумабом эмтанзином, 14 циклов (± ГТ в зависимости от РЭ) [МКЗ 0-B1]; при наличии показаний к проведению адъювантной ГТ и адьювантной ЛТ рекомендуется проводить их одновременно с введением трастузумаба эмтанзина; при досрочном прекращении введения трастузумаба эмтанзина (например, в связи с токсичностью) следует продолжить введение трастузумаба в стандартной дозе до общей продолжительности анти-HER2-терапии 1 год, включая дооперационный этап;
-
– при потере гиперэкспресии HER2 в резидуальной опухоли после проведения неоадъювантной терапии рекомендуется продолжать анти-HER2-терапию адъювантно.
Рекомендуемые режимы адъювантной/постнеоадъювантной лекарственной терапи HER2-положительного РМЖ представлены в табл. 5.
Таблица 5. Рекомендуемые режимы адъювантной/постнеоадъювантной лекарственной терапии HER2-положительного рака молочной железы
|
(DC + трастузумаб) × 4–6 1, 2, 3, 4 |
Доцетаксел 75 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день 1 раз в 3 нед. + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед., 4 цикла; далее — трастузумаб до общей длительности 12 мес. |
|
DCН × 6 1, 2, 4 |
Доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед. + карбоплатин AUC6 в/в в 1-й день 1 раз в 3 нед. + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед., 6 циклов с первичной Г-КСФ профилактикой; далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
(DCН + пертузумаб) × 6 1, 2, 4, 5, 10 |
Доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед. + карбоплатин AUC6 в/в в 1-й день 1 раз в 3 нед. + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед. + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в 1-й день 1 раз в 3 нед., 6 циклов с первичной Г-КСФ профилактикой; общая длительность введения трастузумаба и пертузумаба составляет 12 мес. |
|
(Р + трастузумаб) × 12 1, 2, 3, 6 |
Паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно 12 введений; далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
AC x 4 > (D + трастузумаб) × 4 1, 2, 7 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла > доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед., 4 цикла + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед.; далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
AC x 4 > (Р + трастузумаб) × 12 1, 2, 6, 7 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла > паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно 12 введений, далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
ddAC x 4 > (Р + трастузумаб) × 12 1, 2, 4, 7, 6, 8 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 курса с первичной Г-КСФ профилактикой > паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно 12 введений, далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
ddAC x 4 > (Р + трастузумаб) × 4 1, 2, 4, 7, 8 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла > паклитаксел 175 мг/м 2 в/в в 1-й день 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой + трастузумаб 2 мг/кг (нагрузочная доза 4 мг/кг) в/в еженедельно; далее — трастузумаб 6 мг/кг в/в 1 раз в 3 нед. до общей длительности 12 мес. |
|
AC x 4 > (таксаны + трастузумаб + пертузумаб) × 4 1, 2, 5, 7, 10 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла > таксаны (доцетаксел 75 мг/м 2 в/в в 1-й день каждые 3 нед. 4 цикла или паклитаксел 80 мг/м 2 в/в еженедельно 12 введений) + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед. + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в 1-й день 1 раз в 3 нед.; общая длительность введения трастузумаба и пертузумаба составляет 12 мес. |
|
Трастузумаб эмтанзин × 14 |
9 Трастузумаб эмтанзин 3,6 мг/кг в/в в 1-й день 1 раз в 3 нед., до 14 циклов |
|
2-препаратов (трастузумаба, пертузумаба) рекомендуется начинать одно-иновым таксан-содержащим режимом. вание лекарственной формы трастузумаба для подкожного введения в дозе т массы тела пациента) 1 раз в 3 нед.; нагрузочная доза не требуется. смотреть применение данного режима при T1b, c (> 5 мм, но ≤ 20 мм) и N0. ктическое назначение Г-КСФ (филграстим 5 мкг /кг п /к через 24–72 часа после опрепаратов минимум в течение 5 дней или до восстановления нормального надира; пэгфилграстим 6 мг или эмпэгфилграстим 7,5 мг п /к, через 24–72 часа паратов однократно, принимая во внимание, что следующий курс ХТ может через 14 дней после их введения). ся больным c N2–3, не получавшим неоадъювантной лекарственной терапии; четании с трастузумабом в течение 12 мес. [МКЗ 0-C1]. |
-
6 При использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) (см. табл. 4); введение паклитаксела может проводиться при АЧН ≥ 1,0 × 10 9 /л и количестве тромбоцитов ≥ 100,0 × 10 9 /л.
-
7 Доксорубицин может быть заменен на эпирубицин в курсовой дозе 90 мг /м 2 (режим ЕС); не рекомендуется одновременное введение антрациклинов (доксорубицина и эпирубицина) и анти-HER2-препа-ратов (трастузумаба, пертузумаба) ввиду высокого риска кардиотоксичности; до и в процессе терапии антрациклинами и / или трастузумабом необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3 мес. (или чаще при наличии показаний).
-
8 Режим с уплотненным введением химиопрепаратов рекомендуется использовать при быстро пролиферирующих (с высоким Ki-67 и / или G3) вариантах РМЖ.
-
9 Рекомендуется больным, получившим неоадъювантную ХТ антрациклинами и / или таксанами и трастузумабом (± пертузумабом) в стандартном объеме, при наличии инвазивной резидуальной опухоли, соответствующей ypT ≥ 1b или ypN+ или RCB II–III [МКЗ 0-B1]. В исследовании KATHERINE адъювантная ГТ и адьювантная ЛТ проводились одновременно с введением трастузумаба эмтанзина. При досрочном прекращении введения трастузумаб эмтанзина в связи с токсичностью следует продолжить введение трастузумаба до общей продолжительности анти-HER2-терапии 1 год, включая дооперационный этап.
-
10 Возможно использование лекарственной формы «трастузумаб + пертузумаб» для подкожного введения; нагрузочная доза составляет 1200 мг пертузумаба / 600 мг трастузумаба, далее — 600 мг пертузу-маба / 600 мг трастузумаба, вводится через 3 нед. после нагрузочной дозы и повторяется каждые 3 нед.
-
2.2.1.5. Адъювантная гормонотерапия рака молочной железы (рис. 3)
Адъювантная ГТ показана всем больным гормонозависимым РМЖ независимо от возраста, функции яичников, стадии заболевания, HER2-статуса, проведения нео-/адъю-вантной ХТ или анти-HER2-терапии. Гормонозависимыми считаются опухоли с определяемой экспрессией РЭ в ≥ 1% клеток инвазивного РМЖ. Выбор режима ГТ зависит от функции яичников (табл. 6, 7).
Таблица 6. Лекарственные препараты, рекомендуемые для адъювантной гормонотерапии рака молочной железы
Антиэстрогены 1,4,6 Тамоксифен 20 мг внутрь ежедневно
Ингибиторы ароматазы 2,3,4 Летрозол 2,5 мг внутрь ежедневно
Анастрозол 1 мг внутрь ежедневно
Эксеместан 25 мг внутрь ежедневно
Аналоги ГРГ 5 Гозерелин 3,6 мг п/к 1 раз в 28 дней
Трипторелин 3,75 мг в/м 1 раз в 28 дней
Бусерелин 3,75 мг в/м 1 раз в 28 дней
Лейпрорелин 3,75 мг в/м 1 раз в 28 дней
-
4 Больным люминальным HER2-негативным РМЖ III стадии (pN2–3) или с ypN2–3 после неоадъювантной ХТ к ГТ тамоксифеном или ингибиторами ароматазы может быть добавлен абемациклиб 150 мг внутрь 2 раза еждневно в течение 2 лет [МКЗ 0-C1].
-
5 Рекомендуется использовать только у больных с сохранной функцией яичников при необходимости овариальной супрессии; назначаются в сочетании с антиэстрогенами или ингибиторами ароматазы; аналоги ГРГ рекомендуется вводить 1 раз в 28 дней.
-
6 Все женщины, принимающие тамоксифен, должны быть информированы о риске развития патологии эндометрия и необходимости незамедлительно сообщать врачу о любых вагинальных кровотечениях или кровянистых выделениях любой интенсивности.
Таблица 7. Рекомендуемые режимы адъювантной гормонотерапии рака молочной железы в зависимости от функции яичников
|
Режимы гормонотерапии |
Примечания |
|
Пременопауза |
|
|
Тамоксифен 5 лет |
– |
|
Тамоксифен 2-3 года ^ ингибиторы ароматазы 2–3 года (суммарно — 5 лет) |
Для больных, достигших стойкой менопаузы к моменту окончания приема тамоксифена |
|
Тамоксифен 10 лет |
При наличии, по крайней мере, одного фактора неблагоприятного прогноза 1 |
|
Тамоксифен 5 лет ^ ингибиторы ароматазы 2–3 года |
Для больных, достигших стойкой менопаузы к моменту окончания приема тамоксифена, при наличии, по крайней мере, одного фактора неблагоприятного прогноза 1 |
|
Овариальная супрессия + тамоксифен или ингибиторы ароматазы 5 лет |
При наличии, по крайней мере, одного фактора неблагоприятного прогноза 1,2,3,4 |
|
Постменопауза |
|
|
Тамоксифен 5 лет |
– |
|
Ингибиторы ароматазы 5 лет |
– |
|
Ингибиторы ароматазы 2–3 года, далее — тамоксифен 2–3 года |
При использовании режимов переключения предпочтительно на первом этапе использовать ингибиторы |
|
Тамоксифен 2-3 года ^ ингибиторы ароматазы 2–3 года (суммарно — 5 лет) |
ароматазы |
|
Ингибиторы ароматазы 7 лет |
При наличии, по крайней мере, одного фактора неблагоприятного прогноза 1 |
|
Тамоксифен 10 лет |
При наличии, по крайней мере, одного фактора неблагоприятного прогноза 1 |
|
Тамоксифен 5 лет ^ ингибиторы ароматазы 2 года |
При наличии, по крайней мере, одного фактора неблагоприятного прогноза 1 |
Терапия ингибиторами ароматазы ассоциируется с меньшей частотой тромбоэмболических осложнений и рака эндометрия и с большей частотой остеопороза (и связанных с ним переломов костей) и осложнений со стороны сердечнососудистой системы по сравнению с тамоксифеном. Ингибиторы ароматазы третьего поколения (летрозол, анастрозол, эксеместан) равно эффективны и сопоставимы по профилю токсичности.
Критериями постменопаузы являются:
-
• билатеральная овариэктомия;
-
• возраст ≥ 60 лет;
-
• возраст < 60 лет:
– в отсутствие ХТ, терапии тамоксифеном или торемифеном и овариальной супрессии: аменорея в течение ≥ 12 мес. в сочетании с постменопаузальными уровнями ФСГ и эстрадиола;
– в процессе терапии тамоксифеном или торемифеном: постменопаузальные уровни ФСГ и эстрадиола.
Аменорея, развившаяся в процессе или по окончании ХТ (нео-/адъювантной), не является достаточным признаком постменопаузы, и для оценки функции яичников необходимо определение ФСГ и эстрадиола.
Для достижения овариальной супрессии могут быть использованы следующие методы:
-
• лекарственный (аналоги ГРГ; табл. 6):
– вызывает обратимое подавление функции яичников;
– не всегда обеспечивает полное подавление функции яичников, особенно у женщин молодого возраста; для подтверждения полной овариальной супрессии необходимо определение эстрадиола в сыворотке крови 1 раз в 3–6 мес.; определение ФСГ в период лечения аналогами ГРГ неинформативно; прием ингибиторов ароматазы следует начинать через 6–8 нед. после первого введения аналогов ГРГ;
– аналоги ГРГ рекомендуется вводить ежемесячно;
-
• хирургический (билатеральная овариэктомия); вызывает необратимое подавление функции яичников;
-
• лучевой; вызывает необратимое подавление функции яичников.
-
2.2.1.6. Остеомодифицирующие препараты в адъювантной терапии
У молодых женщин, особенно не завершивших репродуктивную функцию, для достижения овариальной супрессии рекомендуется назначение аналогов ГРГ, подавляющих функцию яичников обратимо.
Больным гормонозависимым РМЖ в постменопаузе (в т. ч. получающим овариальную супрессию) с целью профилактики остеопороза и снижения риска рецидива рекомендуется назначить:
-
• бисфосфонаты (золедроновая кислота 4 мг в /в 1 раз в 6 мес.) в течение 2–3 лет;
-
• колекальциферол 400–800 МЕ /сут. внутрь ежедневно + кальция карбонат 500–1000 мг/сут. внутрь ежедневно длительно;
-
• контроль минеральной плотности костей (денситометрия) 1 раз в год.
-
2.2.1.7. Неоадъювантная лекарственная терапия первично операбельного рака молочной железы
Больным с низким риском рецидива (T1N0, G1,2) профилактику остеопороза следует проводить под контролем эндокринолога.
Примечание: оптимальным является начало терапии остеомодифицирующими агентами не позднее 6 мес. после начала адъювантной ГТ.
Неоадъювантная лекарственная терапия первично операбельного РМЖ позволяет:
-
1 ) выполнить органосохраняющую операцию и /или улучшить косметический эффект;
-
2 ) оценить эффект лекарственной терапии и своевременно прекратить ее в случае прогрессирования (с выполнением хирургического лечения);
-
3 ) оценить выраженность патоморфологического ответа и индивидуализировать постнеоадъювантную терапию.
Неоадъювантная лекарственная (ХТ ± анти-HER2-терапия) показана при доказанном инвазивном первично операбельном РМЖ стадий T0–1N1M0, T2N0M0, T2N1M0, T3N0M0, T3N1M0 с тройным негативным или HER2-позитивным фенотипом.
Неоадъювантная ХТ не рекомендуется больным первично операбельным люминальным HER2-негативным РМЖ. Лечение этой категории больных должно начинаться с оперативного вмешательства соответствующего объема и патоморфологического стадирования. В отдельных случаях неоадъювантная ХТ может быть рассмотрена у больных первично операбельным люминальным В HER2-негативным РМЖ высокого риска (G3, высокий Ki-67) при наличии четких показаний к проведению ХТ данного объема и желании больной выполнить органосохраняющую операцию; с пациенткой должны быть обсуждены необходимость ЛТ в случае выполнения органосохраняющего лечения, а также вероятность повторной операции при обнаружении резидуальной опухоли в краях резекции.
Лечение первично операбельного РМЖ у больных старше 70 лет, а также у больных с выраженной сопутствующей патологией целесообразно начинать с хирургического лечения независимо от иммунофенотипа, т. к. возможность проведения полноценной неоадъювантной лекарственной терапии у этой категории больных сомнительна.
При отсутствии достаточной для стадирования информации (например, о размерах опухолевого узла, состоянии подмышечных лимфоузлов, наличии инвазивного компонента при внутрипротоковом РМЖ) на первом этапе рекомендуется оперативное лечение с изучением удаленной опухоли и патоморфологическим стадированием.
Перед началом неоадъювантной лекарственной терапии, в т. ч. «тестового» курса ГТ должно быть проведено полноценное клинико-лабораторное обследование (см. раздел 2.1. «Диагностика»), в том числе биопсия опухоли с гистологическим исследованием и определением РЭ, РП, HER2 и Ki-67. Желательна маркировка первичной опухоли для определения ее точной локализации после проведенной неоадъювантной терапии у больных с тройным негативным и HER2-позитивным раком. Режимы неоадъювантной лекарственной терапии представлены в табл. 8.
Основные принципы неоадъювантной лекарственной терапии:
-
• все рекомендуемые курсы ХТ следует проводить до операции в полных дозах с соблюдением заданных интервалов, так как это повышает вероятность достижения полной морфологической регрессии;
-
• если по каким-либо причинам на дооперационном этапе не удалось провести все запланированные курсы ХТ, то недостающие курсы необходимо провести после операции;
-
• на 6–8 неделе проведения неоадъювантной терапии целесообразно оценить промежуточный эффект лечения с целью исключения возможного прогрессирования; оценку эффекта следует производить с помощью осмотра и инструментальных методов, зафиксировавших патологические изменения в молочной железе и регионарных зонах до начала лечения; при выявлении прогрессирования на фоне неоадъювантной лекарственной терапии рекомендуется выполнить хирургическое лечение (если процесс остается операбельным) или рассмотреть смену режима лекарственной терапии;
-
• после завершения неоадъювантной терапии при отсутствии клинических признаков прогрессирования болезни оценку эффекта следует производить с помощью осмотра и инструментальных методов, зафиксировавших патологические изменения в молочной железе и регионарных зонах до начала лечения.
Таблица 8. Рекомендуемые режимы неоадъювантной лекарственной терапии рака молочной железы
HER2-отрицательный
|
AC x 4 > D x 4 1 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла > доцетаксел 75 мг/м 2 в/в в 1 -й день 1 раз в 3 нед., 4 цикла |
|
AC x 4 > Р x 12 1, 2 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 3 нед., 4 цикла > паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений |
|
ddAC x 4 > ddР × 4 1, 3, 4 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой > паклитаксел 175 мг/м 2 в/в в 1-й день 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой |
|
ddAC x 4 > Р × 12 1, 3, 4, 10 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой > паклитаксел 80 мг/м 2 в/в еженедельно, 12 введений |
|
AC x 4 > (Р + карбо) × 12 1, 2, 3, 4, 5,11 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 или 3 нед., 4 цикла > паклитаксел 80 мг/м 2 в/в еженедельно 12 введений + карбоплатин AUC6 в/в 1 раз в 3 нед. 4 цикла |
|
ddAC x 4 > (Р + карбо) × 12 1, 2, 3, 4, 5,11 |
АС (доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день) 1 раз в 2 нед., 4 цикла с первичной Г-КСФ профилактикой > паклитаксел 80 мг/м 2 в/в + карбоплатин AUC1,5–2 в/в еженедельно, 12 введений |
HER2-положительный
-
5 Режимы с включением производных платины могут быть использованы при тройном негативном фенотипе.
-
6 Введение анти-HER2-препаратов (трастузумаба, пертузумаба) должно начинаться одновременно с безантрациклиновым таксан-содержащим режимом.
-
7 Возможно использование лекарственной формы трастузумаба для п /к введения в дозе 600 мг /5 мл (независимо от массы тела пациента) 1 раз в 3 нед.; нагрузочная доза не требуется.
-
8 Режим может быть использован в качестве неоадъювантной терапии при опухолях ≥ Т2 или N+ [МКЗ 0-C1].
-
9 Не рекомендуется одновременное введение антрациклинов (доксорубицина, эпирубицина) и анти-HER2-препаратов (трастузумаба, пертузумаба) ввиду высокого риска кардиотоксичности; до и в процессе терапии антрациклинами и / или трастузумабом необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3 мес. (или чаще при наличии показаний).
-
10 Возможно использование лекарственной формы «трастузумаб + пертузумаб» для подкожного введения; нагрузочная доза составляет 1200 мг пертузумаба / 600 мг трастузумаба, далее — 600 мг пертузу-маба / 600 мг трастузумаба, вводится через 3 нед. после нагрузочной дозы и повторяется каждые 3 нед.
-
11 Для лечения больных тройным негативным раком молочной железы II–III стадий может быть использована схема: Пембролизумаб 200 мг в /в в 1 день каждые 3 недели 8 введений + паклитаксел 80 мг /м 2 в / в еженедельно 12 недель + карбоплатин AUC5 в /в 1 день каждые 3 недели 4 курса или AUC1,5 еженедельно 1 2 недель, затем доксорубицин 60 мг /м 2 в /в + циклофосфан 600 мг в /в 1 день каждые 3 недели 4 курса, после операции — продолжение пембролизумаба в дозе 200 мг в / в каждые 3 недели 9 введений [МКЗ 0-В1]. Эффективность данной схемы по сравнению с оптимальной схемой неоадъювантной химиотерапии (АС 1 раз в 2 недели, карбоплатин AUC6 1 раз в 3 нед. или AUC2 еженедельно + таксан, адъювантная терапия капецитабином при резидуальной опухоли) неизвестна. Также неясна целесообразность продолжения терапии пембролизумабом при достижении pCR, эффективность и безопасность назначения капецитабина и олапариба в сочетании с пембролизумабом в адъювантном режиме.
-
2.2.1.8. «Тестовая» гормонотерапия у больных первично операбельным люминальным HER2-негативным РМЖ в постменопаузе
-
2.2.2. Местнораспространенный первично не операбельный инвазивный рак молочной железы (стадии IIIA (кроме T3N1M0), IIIB и IIIC, в т. ч. инфильтративноотечная форма)
Больным в менопаузе первично операбельным (T1–3N0–1 стадии) люминальным HER2-негативным РМЖ при планировании на первом этапе хирургического лечения на период выполнения предоперационных обследований и подготовки к операции может быть назначен короткий (в течение 2–3 нед.) «тестовый» курс ГТ ингибиторами ароматазы. Определение Ki-67 в динамике (в материале биопсии и в послеоперационном материале первичной опухоли после «тестового» курса предоперационной ГТ) является дополнительным фактором прогноза и предсказывающим фактором чувствительности к ГТ (табл. 3). Клинически значимым является уровень Ki-67 в послеоперационном материале < 10%, что позволяет отнести данный клинический случай к прогностически благоприятному и при отсутствии факторов неблагоприятного прогноза (G3, N2) отказаться от адъювантной ХТ в пользу адъювантной ГТ. Уровень Ki-67 в послеоперационном материале > 30% свидетельствует о менее благоприятном прогнозе и меньшей чувствительности к ГТ и является аргументом в пользу назначения адъювантной ХТ в рамках показаний, изложенных в табл. 3, особенно при наличии других факторов неблагоприятного прогноза (G3, N+). Уровень Ki-67 в послеоперационном материале от 10% до 30% имеет неопределенное прогностическое значение, и решение вопроса о назначении адъювантной ХТ должно приниматься на основании стандартных клинико-морфологических признаков (табл. 3).
Перед началом «тестового» курса ГТ должно быть проведено полноценное клиниколабораторное обследование (см. раздел 2.1. «Диагностика»), в том числе биопсия опухоли с гистологическим исследованием и определением РЭ, РП, HER2 и Ki-67.
Рак молочной железы стадий IIIA (кроме T3N1M0), IIIB и IIIC, в т. ч. инфильтративноотечная форма является первично не операбельным и требует лекарственной терапии в качестве первого этапа лечения. Основными целями неоадъювантной лекарственной терапии являются уменьшение размеров опухоли с целью достижения операбельного состояния и получение прогностической информации, основанной на степени выраженности лекарственного патоморфоза и необходимой для индивидуализации постнеоадъювантной терапии. Локальное лечение (хирургическое, лучевое) на первом этапе не рекомендуется. Тактика лечения местно-распространенного первично не операбельного РМЖ представлена на рис. 2–4.
Первичное обследование проводится в стандартном объеме, включая дополнительные диагностические методы, позволяющие исключить наличие отдаленных метастазов, вероятность которых у данной категории больных значительно выше, чем у больных с первично операбельным процессом (см. раздел 2.1. «Диагностика»).
Неоадъювантная лекарственная терапия проводится по тем же правилам, что и при первично операбельном РМЖ (табл. 8). Больным в менопаузе с люминальным подтипом РМЖ может быть рекомендована неоадъювантная ГТ, которую следует проводить в течение 4–8 мес. или до достижения максимального эффекта. Препаратами выбора для неоадъювантной ГТ являются ингибиторы ароматазы.
Алгоритм назначения адъювантной/постнеоадъювантной лекарственной терапии аналогичен таковому при первично операбельном РМЖ:
-
• адъювантная ХТ, как правило, не назначается, если все запланированные курсы проведены до операции; больным РМЖ с тройным негативным и HER2-поло-жительным фенотипом, получившим неоадъювантную ХТ антрациклинами и таксанами в полном объеме, при наличии резидуальной опухоли может быть назначена постнеоадъювантная лекарственная терапия капецитабином (при тройном негативном РМЖ), олапарибом (при тройном негативном BRCA-ассоциированном РМЖ) или трастузумабом/трастузумабом эмтанзином (при HER2-положительном РМЖ) (табл. 4, 5);
-
• адъювантная ГТ назначается всем больным с гормонозависимыми опухолями (см. раздел 2.2.1.4., табл. 6, 7);
-
• адъювантная анти-HER2-терапия назначается всем больным при HER2-положи-тельных опухолях.
-
2.2.3. Диспансерное наблюдение после первичного лечения раннего и местнораспространенного рака молочной железы
Основной целью наблюдения является максимально ранее выявление местных рецидивов и рака контралатеральной молочной железы, так как это обеспечивает возможность радикального лечения.
-
• Клинические группы: третья клиническая группа (пациенты, после завершения лечения, в том числе получающие адъювантную ГТ.
-
• Кратность: в течение первого года с момента установления диагноза злокачественного новообразования — 1 раз в 3 месяца, в течение второго года — 1 раз в 6 месяцев, в дальнейшем — 1 раз в год (если течение заболевания не требует изменения тактики диспансерного наблюдения). В случае завершения противоопухолевого лечения при прогрессировании и/или рецидиве злокачественного новообразования и нахождения в ремиссии (стабилизация) кратность диспансерного наблюдения сохраняется такой же, как для пациента первого года с момента установления диагноза.
Медицинские услуги, предоставляемые при проведении диспансерного наблюдения:
-
• диспансерный прием (осмотр, консультация) врача-онколога, в том числе с использованием телемедицинских технологий. В рамках приема при проведении физикального осмотра необходимо осуществить общий осмотр, пальпацию молочных желез и зон регионарного метастазирования (подмышечных, над-, подключичных лимфатических узлов);
-
• УЗИ молочных желез не реже 1 раза в 6 месяцев в течение первых 2 лет наблюдения, далее — не реже 1 раза в год;
-
• УЗИ лимфатических узлов (одна анатомическая зона — подмышечные лимфатические узлы с обеих сторон) не реже 1 раза в 6 месяцев в течение первых 2 лет наблюдения; далее не реже 1 раза в год;
-
• маммография (с учетом технической возможности в случае органосохраняющей операции) не реже 1 раз в год;
-
• УЗИ органов брюшной полости (комплексное) не реже 1 раз в год;
-
• рентгенография легких 1 раз в год;
Дополнительные исследования при наличии медицинских показаний:
-
• общий (клинический) анализ крови развернутый, анализ крови биохимический общетерапевтический, УЗИ исследование органов малого таза (комплексное), УЗИ кожи (одна анатомическая зона — зона послеоперационного рубца), диспансерный прием (осмотр, консультация) врача-акушера-гинеколога. Иные лабораторные
и инструментальные методы диагностики в рамках диспансерного наблюдения могут быть проведены по индивидуальным клиническим показаниям;
• не рекомендуется при отсутствии жалоб и симптомов, подозрительных в отношении
3. РЕЦИДИВНЫЙ И МЕТАСТАТИЧЕСКИЙ РАКМОЛОЧНОЙ ЖЕЛЕЗЫ
3.1. Диагностика
прогрессирования заболевания, рутинное лабораторное и/или инструментальное обследование (КТ, МРТ, ПЭТ-КТ, сканирование костей, а также определение опухолевых маркеров СА15.3, СА125, РЭА и др.)
Женщины с неудаленной маткой, получающие адъювантно тамоксифен, должны осматриваться гинекологом ежегодно. Любые патологические состояния, подозрительные в отношении рака эндометрия, подлежат максимально быстрой уточняющей диагностике. В отсутствие симптомов не рекомендуется более частое гинекологическое обследование, в том числе с включением лучевых и инвазивных методик исследования эндометрия.
Следует обращать особое внимание на отдаленные нежелательные эффекты, в частности остеопороз, особенно у женщин, длительно получающих ингибиторы ароматазы, а также достигших ранней менопаузы в результате противоопухолевой терапии. Этой категории пациенток показано ежегодное выполнение денситометрии и профилактическое назначение препаратов кальция, витамина D и бисфосфонатов (см. раздел 2.2.1.5). Следует информировать пациенток о пользе здорового образа жизни, включающего рациональную диету, достижение и поддержание идеальной массы тела, ведение активного образа жизни.
Рекомендуемый алгоритм диспансерного наблюдения после первичного первичного лечения раннего и местнораспространенного РМЖ представлен на рис. 5.
При наличии клинических подозрений необходимо подтверждение диагноза с помощью инструментальных методов обследования с выполнением общего и биохимического анализов крови (см. раздел 2.1. «Диагностика»). Морфологическое (гистологическое или цитологическое) исследование первичной опухоли с определением РЭ, РП, HER2 и Ki-67 должно выполняться во всех случаях впервые выявленного метастатического РМЖ, а также во всех возможных случаях в метастатических и рецидивных очагах при прогрессировании после первичного лечения раннего и местно-распространенного РМЖ. Кроме того, для выбора оптимального метода лекарственной терапии:
-
• всем больным с рецидивным и метастатическим HER2-негативным РМЖ показано генетическое тестирование с определением герминальных мутаций BRCA1/2 (если не проводилось ранее) (см. п. 2.1);
-
• у больных метастатическим гормонозависимым HER2-негативным РМЖ рекомендуется определение мутаций PIK3CA для решения вопроса о назначении алпелисиба в комбинации с фулвестрантом (табл. 9);
-
• у больных тройным негативным РМЖ, не получавших лечение по поводу метастатической болезни, рекомендуется определение уровня экспрессии PD-L1 на опухолевых и мононуклеарных клетках (CPS-комбинированный позитивный счет) клоном 22С3 на платформе DACO для решения вопроса о назначении дополнительно к ХТ пембролизумаба (табл. 10);
-
• при метастатическом секреторном раке рекомендуется определение транслокации NTRK для назначения энтректиниба или ларотректиниба (табл. 13).
-
3.2. Лечение изолированных местных рецидивов
Терапия изолированных местных рецидивов имеет целью излечение и должна проводиться аналогично лечению первичной опухоли с подключением необходимых методов диагностики (клиническое обследование с целью уточнения степени распространения болезни, определение РЭ, РП, HER2 и Ki-67 в рецидивной опухоли; см. раздел 2.1 «Диагностика») и лечения (см. раздел 2.2 «Лечение»). После удаления изолированного местного рецидива рекомендуется назначение лекарственной терапии, выбор которой должен быть индивидуальным и учитывать иммунофенотип первичной и рецидивной опухоли, предшествующее нео-/адъювантное лечение и срок ремиссии, общее состояние больного, в т. ч. остаточные явления токсичности ранее проведенного лечения. Рекомендуется:
-
• при тройном негативном фенотипе: адъювантная ХТ (необходимо учесть суммарную дозу антрациклинов, если они назначались ранее) (табл. 4);
-
• при люминальном HER2-отрицательном фенотипе: только адъювантная ГТ; выбор препарата определяется предшествующей ГТ, если таковая проводилась, и функцией яичников (табл. 7);
-
• при HER2-положительном фенотипе: ХТ + анти-HER2-терапия ± ГТ (в зависимости от уровня экспрессии РЭ и РП) (табл. 5).
-
3.3. Лечение метастатического рака молочной железы
Следует рассмотреть назначение ЛТ во всех случаях, когда она не проводилась ранее, а также при наличии возможности дополнительного безопасного облучения пораженной зоны.
Наблюдение после лечения по поводу местных рецидивов аналогично таковому при первичном РМЖ.
Лечение метастатической болезни является паллиативным и направлено на улучшение качества жизни и увеличение ее продолжительности. Основным методом лечения метастатической болезни является лекарственная терапия. Единого стандарта лечения метастатического РМЖ не существует. Выбор варианта лекарственной терапии осуществляется с учетом биологических маркеров (экспрессия РЭ и РП, HER2, Ki-67, мутации PIK3CA, транслокации NTRK, экспрессия PD-L1, герминальные мутации BRCA1/2) и кли- нико-анамнестических особенностей больного. До начала терапии необходимо клиниколабораторное обследование для определения степени распространенности заболевания и оценки функции внутренних органов, в том числе определение концентрации кальция при наличии (подозрении) метастазов в костях (см. раздел 2.1. «Диагностика»).
Системная терапия при необходимости может дополняться локальными видами лечения (лучевым и/или хирургическим).
При метастазах в головном мозге в сочетании с отсутствием иных (экстракраниальных) проявлений болезни, а также при стабилизации или регрессии экстракраниальных метастазов в результате эффективной противоопухолевой лекарственной терапии целесообразно проведение локального лечения метастазов в головном мозге в соответствии с действующими Клиническими рекомендациями Минздрава РФ и сохранение режима проводимой противоопухолевой лекарственной терапии (при отсутствии неприемлемой токсичности).
При метастазах в костях показано назначение ОМА:
-
• золедроновая кислота 4 мг в /в 1 раз в 4–12 нед.
-
• деносумаб 120 мг п /к 1 раз в 4 нед.
-
3.3.1. Лекарственная терапия метастатического гормонозависимого рака молочной железы (гормонотерапия)
Подробнее — см. раздел по профилактике и лечению патологии костной ткани (часть 2, стр. 50–63).
Методом выбора терапии гормонозависимого (люминального) РМЖ является ГТдаже при наличии висцеральных метастазов. Назначение химиотерапии следует рассмотреть в следующих ситуациях:
-
• быстропрогрессирующие варианты РМЖ, сопровождающиеся висцеральным кризом, в том числе развившимся в процессе предшествующих линий ГТ;
-
• иные клинические ситуации, требующие максимально быстрого достижения противоопухолевого эффекта;
-
• случаи исчерпанности возможностей ГТ.
У пациенток с ГР + HER2-мРМЖ с высоким (> 50%) уровнем РЭ и положительными РП при множественных висцеральных метастазах или надвигающемся висцеральном кризе в первой линии терапии возможно рассмотреть назначение комбинации ингибиторов ЦЗК4/6 с ингибитором ароматазы (и овариальной супрессией у больных в пременопаузе) как альтернативу химиотерапии
Признаками висцерального криза являются:
-
• множественное метастатическое поражение внутренних органов;
-
• клинические и/или лабораторные признаки нарушения функции внутренних органов, создающие угрозу жизни пациента и требующие быстрого достижения противоопухолевого эффекта.
Асцит и плеврит не являются признаками висцерального криза и не должны служить основанием для отказа от ГТ (в пользу ХТ) в отсутствие клинических и/или лабораторных признаков нарушения функции внутренних органов после локального воздействия (плевроцентез, лапароцентез).
После завершения ХТ, назначенной в связи с висцеральным кризом, возможно назначение «поддерживающей» гормонотерапии с учетом предшествующих линий ± ингибиторы CDK4/6 если не использовался ранее.
Алгоритм назначения лекарственной терапии при метастатическом гормонозависимом РМЖ представлен на рис. 6.
ГТ одной линии проводится до прогрессирования болезни (данные осмотра и инструментального обследования или появление/усиление симптомов, связанных с опухолевым ростом) или признаков неприемлемой токсичности. В отсутствие признаков висцерального криза рекомендуется последовательное назначение всех возможных линий ГТ. Неэффективность трех последовательных линий ГТ свидетельствует об устойчивости к данному виду лечения и необходимости назначения ХТ. При выборе варианта ГТ следует учитывать функцию яичников (пре- или постменопауза), предшествующую ГТ и ее эффективность, сопутствующую патологию. Больным с сохранной функцией яичников рекомендуется выполнить овариальную супрессию любым доступным способом (предпочтительнее выполнить овариэктомию) (см. раздел 2.2.1.4.) и назначить ГТ, рекомендованную больным в постменопаузе (рис. 7, табл. 9). В отдельных случаях (например, при отказе больной от овариальной супрессии) могут быть назначены селективные модуляторы РЭ. Одновременное использование ХТ и ГТ не рекомендуется.
Таблица 9. Рекомендуемые режимы лекарственной терапии метастатического гормонозависимого HER2-отрицательного рака молочной железы (гормонотерапия)
|
Аналоги ГРГ 1 |
Гозерелин 3,6 мг п/к 1 раз в 28 дней Бусерелин 3,75 мг в/м 1 раз в 28 дней Лейпрорелин 3,75 мг в/м 1 раз в 28 дней Любой из препаратов назначается на весь период ГТ |
|
Ингибиторы ароматазы третьего поколения + ингибиторы CDK4/6 2,3,4,5 |
Анастрозол 1 мг или летрозол 2,5 мг или эксеместан 25 мг внутрь ежедневно + рибоциклиб 600 мг/сут. внутрь в 1–21-й дни, интервал 7 дней (длительность цикла 28 дней) [МКЗ I-A1] или абемациклиб по 150 мг 2 раза в день внутрь ежедневно [МКЗ II-A1] или палбоциклиб 125 мг/сут. внутрь в 1–21-й дни, интервал 7 дней [МКЗ II-A1] до прогрессирования или неприемлемой токсичности (длительность цикла 28 дней) |
|
Фулвестрант + ингибиторы CDK4/6 2,3,5 |
Фулвестрант 500 мг в/м 1 раз в мес. (в первый месяц — по 500 мг в 1-й и 15-й дни) + рибоциклиб 600 мг однократно. внутрь в 1–21-й дни, интервал 7 дней (длительность цикла 28 дней) [МКЗ I-A1] или абемациклиб по 150 мг 2 раза вдень [МКЗ I-C1] или палбоциклиб 125 мг/сут. внутрь в 1–21-й дни, интервал 7 дней до прогрессирования или неприемлемой токсичности (длительность цикла 28 дней) [МКЗ II-B1] |
-
8 Рекомендуется при наличии мутаций PIK3CA больным распространенным гормонозависимым HER2-отрицательным РМЖ с прогрессированием на фоне моно- или комбинированной ГТ [МКЗ II-B]. Алпе-лисиб не следует назначать больным с сахарным диабетом I типа, а также неконтролируемым диабетом II типа. До начала применения алпелисиба следует определить уровень глюкозы плазмы натощак и уровень HbA1c (гликированного гемоглобина). При уровне HbA1c > 7,0 % перед назначением терапии алпелиси-бом требуется консультация эндокринолога.
-
9 При прогрессировании на фоне ГТ и одной или нескольких линий ХТ.
-
1 0 При развитии токсичности возможна редукция дозы абемациклиба до 300 мг, 200 мг и 100 мг внутрь (в два приема) (см. инструкцию по применения препарата). Не рекомендуется назначение Г-КСФ для профилактики нейтропении, связанной с применением абемациклиба. Больным гормонозависимым HER2-по-ложительным РМЖ, не нуждающимся в немед ленном начале ХТ, может быть назначена ГТ ингибиторами ароматазы, тамоксифеном или фулвестрантом в сочетании или без анти-HER2-терапии (табл. 9, 12).
-
3.3.2. Лекарственная терапия метастатического HER2-негативного рака молочной железы (химиотерапия)
ХТ показана следующим категориям больных:
-
• РМЖ с отрицательными РЭ и РП;
-
• люминальный РМЖ, резистентный к ГТ;
-
• люминальный РМЖ с признаками висцерального криза.
Стандарта ХТ первой линии рецидивного и метастатического РМЖ нет. Выбор режима должен быть индивидуальным и учитывать особенности опухоли и больного, а также состав и эффективность предшествующей, в т. ч. адъювантной/неоадъювантной ХТ, если таковая проводилась. Наиболее часто в I линии назначаются антрациклины (если не назначались в нео- или адъювантной терапии) и таксаны (могут быть назначены если после назначения в нео- или адъювантной терапии прошло более 12 мес.). Кроме того, вариантами для назначения могут быть капецитабин и винорелбин, особенно если пациентка хочет избежать алопеции. Рекомендуется последовательное назначение химиопрепаратов в монотерапии. В качестве комбинированной терапии могут использоваться антрациклин-содержащие режимы, а также режимы, включающие платиновые производные (с таксанами, гемцитабином), иксабепилон + капецитабин (при тройном негативном РМЖ). Комбинировать между собой антрациклины, таксаны, винорелбин, капецитабин не рекомендуется. Режимы ХТ и рекомендуемый алгоритм назначения лекарственной терапии при метастатическом тройном негативном и люминальном гормонорезистентном HER2-негативном РМЖ представлены в табл. 10 и на рис. 7.
ХТ с использованием одной и той же комбинации может продолжаться до прогрессирования болезни, доказанного клинически и/или с помощью методов инструментальной диагностики, или неприемлемой/дозолимитирующей токсичности. Длительная стабилизация болезни расценивается как положительный эффект лечения и не должна являться основанием для прекращения или смены терапии в отсутствие серьезной токсичности.
Не существует стандартных подходов к проведению второй и последующих линий ХТ, равно как и каких-либо данных, свидетельствующих о преимуществах того или иного препарата или режима (наиболее часто используются капецитабин, эрибулин, винорелбин). Продолжение ХТ после III линии может обсуждаться для больных в удовлетворительном общем состоянии, ответивших на предшествующие линии ХТ.
Таблица 10. Рекомендуемые режимы лекарственной терапии метастатического HER2-отрицательного рака молочной железы
Антрациклиновые 1,2
-
• АС: доксорубицин 60 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день каждые 3 нед.; до прогрессирования или неприемлемой токсичности или достижения суммарной дозы доксорубицина 400–500 мг/м 2 (с учетом нео-/адъювантной терапии);
-
• ЕС: эпирубицин 60–75 мг/м 2 в/в в 1-й день + циклофосфамид 600 мг/м 2 в/в в 1-й день каждые 3 нед.; до прогрессирования или неприемлемой токсичности или достижения суммарной дозы эпирубицина 900 мг/м 2 (с учетом нео-/адъювантной терапии);
-
• доксорубицин 60–75 мг/м 2 в/в в 1-й день каждые 3 нед. до прогрессирования или неприемлемой токсичности или достижения суммарной дозы доксорубицина 400–500 мг/м 2 (с учетом нео-/адъювантной терапии);
-
• эпирубицин 60–90 мг/м 2 в/в в 1-й день каждые 3 нед. до прогрессирования или неприемлемой токсичности или достижения суммарной дозы эпирубицина 900 мг/м 2 (с учетом нео-/адъювантной терапии)
-
• пегилированный липосомальный доксорубицин 50 мг/м 2 в/в в 1-й день 1 раз в 4 нед., до прогрессирования или неприемлемой токсичности 3
Таксановые
-
• паклитаксел 80 мг/м 2 в/в еженедельно; до прогрессирования или неприемлемой токсичности 4, 5 ;
-
• паклитаксел 90 мг/м 2 в/в в 1, 8, 15-й дни каждые 4 нед; до прогрессирования или неприемлемой токсичности 5 ;
-
• паклитаксел 175 мг/м 2 в/в 1 раз в 3 нед.; до прогрессирования или неприемлемой токсичности 4 ;
-
• доцетаксел 75 мг/м 2 в/в в 1-й день каждые 3 нед.; до прогрессирования или неприемлемой токсичности
-
• паклитаксел 80 мг/м 2 в/в + карбоплатин AUC2 в/в еженедельно; до прогрессирования или неприемлемой токсичности 5 ;
-
• паклитаксел 90 мг/м 2 в/в в 1, 8, 15-й дни + бевацизумаб 10 мг/кг в/в в 1-й и 15-й дни каждые 28 дней или
- 15 мг/кг каждые 21 день до прогрессирования или неприемлемой токсичности5, 6;
-
• доцетаксел 75 мг/м 2 в/в 1-й день каждые 3 нед. + бевацизумаб 15 мг/кг в/в в 1-й день каждые 3 нед. или до прогрессирования или неприемлемой токсичности 6
Другие
-
• капецитабин 2000–2500 мг/м 2 внутрь в 1-й — 14-й дни каждые 3 нед.; до прогрессирования или неприемлемой токсичности 6 ;
-
• эрибулин 1,4 мг/м 2 в/в в 1-й и 8-й дни каждые 3 нед.; до прогрессирования или неприемлемой токсичности 6 ;
-
• винорелбин 25 мг/м 2 в/в в 1-й и 8-й дни в/в каждые 3 нед.; до прогрессирования или неприемлемой токсичности;
-
• винорелбин 60 мг/м 2 внутрь в 1, 8, 15-й дни; с 22-го дня — 80 мг/м 2 1 раз в нед.;
-
• гемцитабин 800–1200 мг/м 2 в/в в 1, 8, 15-й дни каждые 4 нед.; до прогрессирования или неприемлемой токсичности;
-
• гемцитабин 800–1000 мг/м 2 в/в в 1-й и 8-й дни + цисплатин 75 мг/м 2 в/в в 1-й день (или карбоплатин AUC4–5 в/в в 1-й день или карбоплатин AUC2 в 1-й и 8-й дни) каждые 3 нед.; до прогрессирования или неприемлемой токсичности;
-
• цисплатин 75 мг/м 2 в/в в 1-й день или карбоплатин AUC6 в/в в 1-й день каждые 3 нед.; до прогрессирования или неприемлемой токсичности;
-
• иксабепилон 40 мг/м 2 в/в в 1-й день каждые 3 нед. (при резистентности к антрациклинам, таксанам, капецитабину); до прогрессирования или неприемлемой токсичности;
-
• иксабепилон 40 мг/м 2 в/в в 1-й день каждые 3 нед. + капецитабин 2000 мг/м 2 внутрь в 1-й — 14-й дни
каждые 3 нед.; до прогрессирования или неприемлемой токсичности 7
Химиоиммунотерапия
-
• паклитаксел 90 мг/м 2 в/в в 1, 8, 15-й дни каждые 4 нед. + пембролизумаб 200 мг в/в каждые 3 нед. или
- 400 мг в/в каждые 6 нед [МКЗ I-С]8;
-
• гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни каждые 3 нед. + карбоплатин AUC2 в/в в 1-й и 8-й дни каждые
3 нед. + пембролизумаб 200 мг в/в каждые 3 нед. или 400 мг в/в каждые 6 нед [МКЗ I-C] 8
-
1 Суммарная доза антрациклинов с учетом всех линий терапии, включая нео- /адъювантную, не должна превышать 400–500 мг /м 2 для доксорубицина и 900 мг /м 2 для эпирубицина.
-
2 До и в процессе терапии антрациклинами необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3–6 мес. (или чаще при наличии показаний).
-
3 При противопоказаниях к назначению доксорубицина и эпирубицина.
-
4 Предпочтительно еженедельное введение паклитаксела.
-
5 При использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) (см. табл. 4); введение паклитаксела может проводиться при АЧН ≥ 1,0 × 10 9 /л и количестве тромбоцитов ≥ 100,0 × 10 9 /л.
-
6 Бевацизумаб может быть добавлен к режимам ХТ первой или второй линии при HER2-негативном РМЖ; рекомендуемые режимы введения бевацизумаба: 15 мг /кг в / в 1 раз в 3 нед., 10 мг / кг в /в 1 раз в 2 нед.
-
7 При неэффективности предшествующей терапии таксанами и антрациклинами; не следует назначать данный режим при повышении АЛТ/АСТ более 2,5 ВГН и / или билирубина выше ВГН.
-
8 Для больных тройным негативным РМЖ с прогрессированием по прошествии 6 мес. и более после завершения нео- /адъювантной ХТ в качестве первой линии лечения при CPS ≥ 10 (определение PD-L1 на иммунокомпетентных клетках рекомендуется проводить с помощью клона 22С3 на платформе DACO).
-
3.3.3. Лекарственная терапия BRCA1/2-ассоциированного HER2-негативного метастатического рака молочной железы
-
3.3.4. Лекарственная терапия метастатического HER2-положительного рака молочной железы
Больным BRCA1/2-ассоциированным HER2-негативным метастатическим РМЖ, получавшим ранее ХТ антрациклинами и таксанами с нео-/адъювантной и/или лечебной целью, рекомендуется назначение PARP-ингибиторов (табл. 11). У больных BRCA-ассоциированным гормонозависимым РМЖ оптимальная последовательность назначения PARP-ингибиторов и ГТ (± ингибиторы CDK4/6) не определена; с учетом известного увеличения продолжительности жизни при назначении ГТ в сочетании с ингибиторами CDK4/6 рекомендуется эту опцию использовать в первую очередь.
Таблица 11. Рекомендуемая терапия BRCA1/2-ассоциированного HER2-негативного метастатического рака молочной железы
|
Название препарата |
Режим применения |
|
Олапариб [МКЗ II-В1] |
В таблетках по 300 мг внутрь × 2 раза в день ежедневно, до прогрессирования или неприемлемой токсичности |
|
Талазопариб [МКЗ II- В1] |
1 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
| том/vol. 15(3s2)2025 |
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ Malignant Tumors |
Больные HER2-положительным РМЖ должны получать анти-HER2-терапию в сочетании с ХТ или ГТ (при люминальных опухолях) или в самостоятельном виде. Анти-HER2-тера-пия должна начинаться как можно раньше (с первой линии терапии) и продолжаться как можно дольше. При первом эпизоде прогрессирования на фоне терапии трастузумабом возможно продолжение лечения этим же препаратом со сменой химио-/гормоно-терапевтического компонента. Рекомендуемые режимы и алгоритм анти-HER2-терапии представлены в табл. 12 и на рис. 8.
Таблица 12. Рекомендуемые режимы лекарственной терапии HER2-положительного метастатического рака молочной железы
I линия:
-
• трастузумаб + пертузумаб + таксаны (предпочтительный режим I линии лечения): трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в/в в 1-й день 1 раз в 3 нед. + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в в 1-й день 1 раз в 3 нед. + таксаны (доцетаксел 75 мг/м 2 в/в в 1-й день 1 раз в 3 нед. 6 курсов или паклитаксел 80 мг/м 2 в/в еженедельно 18 введений или паклитаксел 175 мг/м 2 в/в в 1-й день 1 раз в 3 нед. 6 циклов); после завершения химиотерапии таксанами — продолжение анти-HER2-терапии трастузумабом 6 мг/кг в/в в 1-день 1 раз в 3 нед. и пертузумабом 420 мг в/в в 1-й день 1 раз в 3 нед. до прогрессирования или неприемлемой токсичности [МКЗ I-A1] 1, 2, 3, 10
– циклофосфамид 50 мг внутрь ежедневно + метотрексат по 2,5 мг внутрь 2 раза в день в 1-й и 2-й дни каждой недели (метрономный режим) до прогрессирования или неприемлемой токсичности;
– иксабепилон 40 мг/м 2 в/в в 1-й день каждые 3 нед. (при резистентности к антрациклинам, таксанам, капецитабину) до прогрессирования или неприемлемой токсичности;
– трастузумаб 2 мг/кг в/в еженедельно или 6 мг/кг в/в 1 раз в 3 нед. в монотерапии (без химиотерапевтического препарата) в качестве продолжения терапии в случае возникновении непереносимой токсичности химиопрепарата;
-
• лапатиниб 1250 мг внутрь ежедневно + капецитабин 2000 мг/м 2 внутрь в 1-й — 14-й дни каждые 3 нед.
до прогрессирования или неприемлемой токсичности [МКЗ II-B1];
-
• лапатиниб 1000 мг внутрь ежедневно + трастузумаб 2 мг/кг в/в еженедельно (нагрузочная доза 4 мг/ кг в/в) или 6 мг/кг (нагрузочная доза 8 мг/кг) в/в 1 раз в 3 нед. до прогрессирования или неприемлемой токсичности;
-
• трастузумаб дерукстекан 5,4 мг/кг в/в каждые 3 нед. до прогрессирования или неприемлемой токсичности [МКЗ I-A] 8
HER2-положительный люминальный РМЖ 9, 10
-
• ингибиторы ароматазы + трастузумаб до прогрессирования или неприемлемой токсичности
-
• ингибиторы ароматазы + лапатиниб 1500 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности
-
• ингибиторы ароматазы + трастузумаб + лапатиниб 1000 мг внутрь ежедневно до прогрессирования или неприемлемой токсичности
-
• фулвестрант + трастузумаб до прогрессирования или неприемлемой токсичности
-
• тамоксифен + трастузумаб до прогрессирования или неприемлемой токсичности.
Если лечение было начато с режима «трастузумаб (± пертузумаб) + химиотерапия», после завершения
-
6 курсов ХТ к трастузумабу (± пертузумабу) может быть добавлена ГТ.
-
1 Увеличение количества циклов ХТ доцетакселом свыше 6 не приводит к улучшению безрецидивной выживаемости.
-
2 Режим может быть рекомендован больным, не получавшим пертузумаб нео- /адъювантно, а также больным, получавшим пертузумаб нео- /адъювантно, если с момента завершения терапии пертузумабом до прогрессирования болезни прошло не менее 1 года.
-
3 Возможно использование лекарственной формы «трастузумаб + пертузумаб» для подкожного введения; нагрузочная доза составляет 1200 мг пертузумаба / 600 мг трастузумаба, далее — 600 мг пертузу-маба / 600 мг трастузумаба, вводится через 3 нед. после нагрузочной дозы и повторяется каждые 3 нед.
-
4 Для больных, получавших трастузумаб (± пертузумаб); является предпочтительным в качестве первой линии лечения, если с момента окончания нео- или адъювантной терапии прошло менее 1 года.
-
5 Возможно использование лекарственной формы трастузумаба для п /к введения в дозе 600 мг /5 мл (независимо от массы тела пациента) 1 раз в 3 нед.; нагрузочная доза не требуется.
-
6 До и в процессе терапии трастузумабом необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3–6 мес. (или чаще при наличии показаний).
-
7 При использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) (см. табл. 4); введение паклитаксела может проводиться при АЧН ≥ 1,0 × 10 9 /л и количестве тромбоцитов ≥ 100,0 × 10 9 /л.
-
8 Трастузумаб дерукстекан при метастатическом HER2-позитивном РМЖ может быть назначен при прогрессировании после ≥ 2 линий анти-HER2-терапии по поводу метастатической болезни [МКЗ I-A].
-
9 В отсутствие признаков висцерального криза.
-
10 Все препараты используются в стандартных дозах и режимах; назначение ингибиторов ароматазы и фулвестранта возможно женщинам в состоянии менопаузы.
-
3.3.5. Лекарственная терапия метастатического рака молочной железы с транслокацией NTRK
-
3.4. Наблюдение за больными при метастатическом раке молочной железы3.4.1. Наблюдение в процессе лечения. Оценка эффекта
При прогрессировании на фоне одного из режимов лечения следует перейти на другой режим с включением анти-HER2-препаратов.
При метастатическом секреторном РМЖ с транслокацией NTRK рекомендуется рассмотреть терапию ингибиторами протеинкиназ энтректинибом или ларотректинибом при исчерпанности других возможностей терапии (табл. 13).
Таблица 13. Рекомендуемые режимы терапии метастатического секреторного рака молочной железы с транслокацией NTRK
|
Название препарата |
Режим применения |
|
Энтректиниб |
600 мг/сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности |
|
Ларотректиниб |
200 мг/сут. внутрь (в 2 приема) ежедневно до прогрессирования или неприемлемой токсичности |
Наблюдение в процессе лечения имеет целью оценить пользу проводимой терапии (эффект) и ее возможные осложнения (токсичность) и внести необходимые коррективы (смена режима, редукция доз, отмена лечения, назначение симптоматической терапии и т. д.). Наблюдение включает периодический осмотр и оценку различных симптомов, лабораторных данных и результатов инструментального обследования.
Оценку эффекта рекомендуется проводить после каждых 2–3 мес. ГТ и каждых 2–3 курсов ХТ с помощью данных общего осмотра, выяснения жалоб, анализов крови и результатов инструментальных методов обследования, выявивших патологию на этапе первоначальной диагностики. Интервалы между обследованиями могут быть изменены в зависимости от конкретной клинической ситуации. Результаты осмотра и обследования классифицируются следующим образом:
• объективный эффект: существенное уменьшение размеров и /или количества опухолевых очагов; является показанием для продолжения проводимой терапии в отсутствие серьезной токсичности;
• стабилизация болезни: отсутствие значимых изменений размеров и количества опухолевых очагов; при удовлетворительном общем состоянии и хорошей переносимости лечение может быть продолжено;
• прогрессирование заболевания является показанием к смене лечения. При подозрении на прогрессирование болезни по данным осмотра необходимо выполнить уточняющие обследования, в т. ч. с оценкой зон, не исследовавшихся до начала терапии; признаками прогрессирования являются:
– появление и/или усугубление симптомов, обусловленных опухолевым ростом (например, боли или одышки);
– существенное увеличение размеров или появление новых опухолевых очагов, выявляемых при осмотре;
– ухудшение общего состояния (дифференцировать с токсичностью лечения);
– немотивированная потеря веса (дифференцировать с токсичностью лечения);
– повышение ЩФ, АЛТ, АСТ, билирубина (дифференцировать с токсичностью лечения);
– гиперкальциемия;
– появление новых и/или существенное увеличение имевшихся ранее очагов по данным объективных методов обследования; при оценке результатов рентгенографии, сканирования костей и ПЭТ следует иметь в виду, что процессы репарации метастазов в костях, начавшиеся в результате эффективной противоопухолевой терапии (в сочетании с ОМА), сопровождаются повышенным метаболизмом, что может создавать формальную картину прогрессирования за счет появления на сканограммах новых остеобластических очагов и увеличения накопления РФП в имевшихся ранее очагах, особенно при первом оценочном исследовании.
3.4.2. Наблюдение после окончания лечения
4. ОСОБЕННОСТИ ОБСЛЕДОВАНИЯ И ЛЕЧЕНИЯ ПАЦИЕНТОК МОЛОДОГО ВОЗРАСТА4.1. Рак молочной железы у пациенток детородного возраста
Больные с метастатическим процессом должны наблюдаться с частотой, позволяющей проводить максимально возможное паллиативное лечение, обеспечивающее контроль симптомов, наилучшее качество и максимальные сроки жизни.
Молодой возраст сам по себе не является фактором, определяющим выбор более агрессивного лечения. Тактика лекарственной терапии должна определяться общепринятыми (для больных старшей возрастной группы) характеристиками: степенью распространения опухоли, ее биологическими особенностями, сопутствующей патологией и предпочтениями больной.
Пациентки детородного возраста должны использовать надежные средства контрацепции в период лекарственной терапии и ближайшее время после нее. На этапе обследования следует информировать пациенток о возможном негативном влиянии лекарственного лечения на функцию яичников и фертильность. При желании пациентки в будущем иметь детей желательна консультация врача-репродуктолога для обсуждения возможных вариантов вспомогательных репродуктивных технологий (при потенциально излечимых стадиях РМЖ). Рекомендуемыми методами сохранения фертильности являются:
-
• криоконсервация эмбрионов;
-
• криоконсервация ооцитов.
-
4.2. Рак молочной железы у беременных
-
4.3. Рак молочной железы у мужчин
-
4.4. Рекомендации по поддержанию здорового образа жизни
Криоконсервация ткани яичников является экспериментальным методом сохранения фертильности и в рутинной практике не рекомендуется. Безопасность стимуляции суперовуляции у больных люминальным РМЖ не доказана; использование данного метода возможно только в рамках клинических исследований. При невозможности использования рекомендуемых выше методов сохранения фертильности до начала ХТ могут быть назначены аналоги ГРГ в стандартных дозах, однако данный метод не является стандартным и не гарантирует сохранение функции яичников и фертильности. Методы вспомогательных репродуктивных технологий могут применяться только при наличии заключения онколога.
При выявлении РМЖ у беременной женщины пациентка должна быть направлена в специализированное лечебное учреждение онкологического профиля и проконсультирована в консультативно-диагностическом отделении или акушерском дистанционном консультативном центре на базе акушерстких стационаров третьей группы (уровня) для определния акушерской тактики и дальнейшего наблюдения совместно с врачами-онкологами. Рекомендуемый алгоритм обследования и лечения беременных пациенток с РМЖ представлен на рис. 9. Особенности противоопухолевой и сопроводительной лекарственной терапии при лечении РМЖ на фоне беременности — см. раздел по лекар ственной терапии солидных опухолей на фоне беременности (часть 1.1, стр. 73–89).
Рекомендации по лечению РМЖ у мужчин в целом экстраполированы из аналогичных рекомендаций для женщин, однако, имеются некоторые различия. В частности, генетическое тестирование рекомендуется всем мужчинам, страдающим РМЖ. Принципы локальной терапии не отличаются от таковых для женщин. В качестве нео- и адъювантной терапии используются те же режимы ХТ (+ анти-HER2-терапия по показаниям), что и у женщин.
В качестве адъювантной ГТ используется тамоксифен в течение 5–10 лет или, при противопоказаниях к приему тамоксифена, — ингибиторы ароматазы в сочетании с аналогами ГРГ. Адъювантная монотерапия ингибиторами ароматазы не рекомендуется, так как ассоциируется с более низкими отдаленными результатами по сравнению с монотерапией тамоксифеном, возможно вследствие недостаточной супрессии эстрадиола. Системная терапия распространенной болезни проводится в соответствии с аналогичными рекомендациями по лечению женщин. При назначении ингибиторов ароматазы рекомендуется одновременное введение аналогов ГРГ (или орхидэктомия). Согласно имеющимся данным, монотерапия фулвестрантом у мужчин так же эффективна, как и у женщин. Новые препараты, такие как ингибиторы CDK4/6, m-TOR, PIK3CA, PARP-ингибиторы систематически не изучались в соответствующих клинических исследованиях у мужчин, страдающих РМЖ. Однако доступные данные реальной клинической практики свидетельствуют о сопоставимой эффективности этих препаратов у мужчин и позволяют рекомендовать их по показаниям, аналогичным таковым при лечении женщин. Рекомендации по назначению ХТ, анти-HER2-терапии, иммунотерапии и PARP-ингибиторов аналогичны таковым для женщин.
Наблюдение после первичного лечения: имеются лишь ограниченные данные, поддерживающие скрининг (прогрессирования) РМЖ у мужчин. Оценку плотности костной ткани рекомендуется проводить каждые 2 года у мужчин, получающих аналоги ГРГ с адъювантной целью. Принципы терапии при снижении минеральной плотности костей не отличаются от таковых для женщин.
У больных операбельным РМЖ доказано позитивное влияние на прогноз и течение заболевание соблюдения правил здорового образа жизни:
-
• отказ от курения
-
• поддержание оптимального веса в зависимости от возраста;
-
• сохранение физической активности;
-
• включение в рацион питания овощей и фруктов, цельнозерновых продуктов;
-
• ограничение потребления красного и обработанного мяса и продуктов быстрого питания (“fast food”);
-
• ограничение сахаросодержащих напитков;
-
• ограничение употребления спиртных напитков.
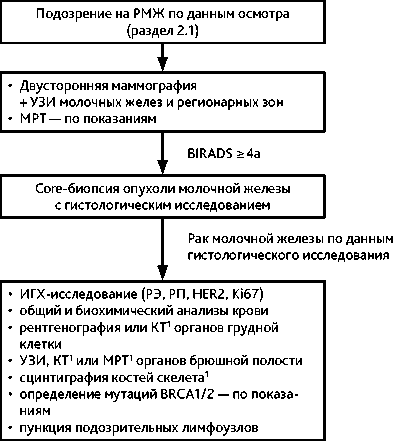
1 При T3, N+, агрессивных подтипах, симптомах, подозрительных на наличие метастазов.
Рисунок 1. Рекомендуемый алгоритм обследования при подозрении на рак молочной железы
HER2-положительный РМЖ T1–4N1–3M0 стадий (разделы 2.2.1.4, 2.2.1.7)
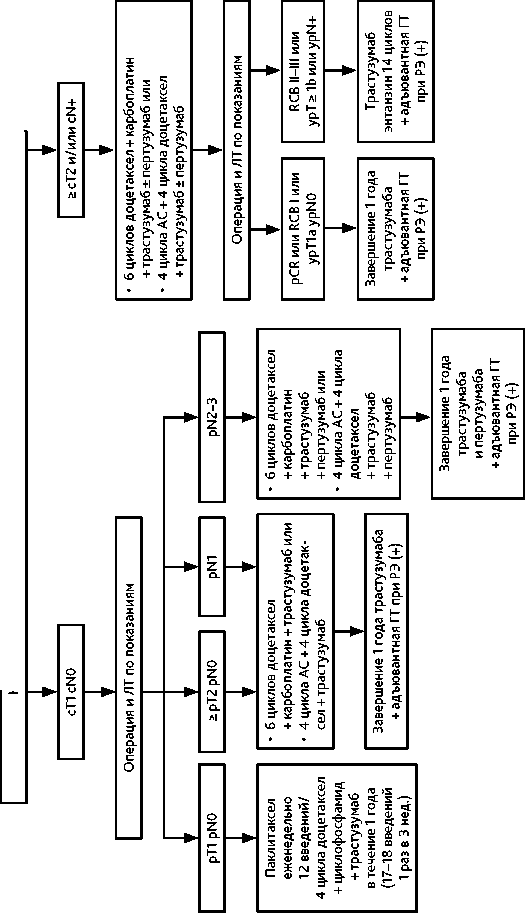
Люминальный HER2-негативный РМЖ T1–4N1–3M0 стадий (разделы 2.2.1.3, 2.2.1.5 и 2.2.1.7)
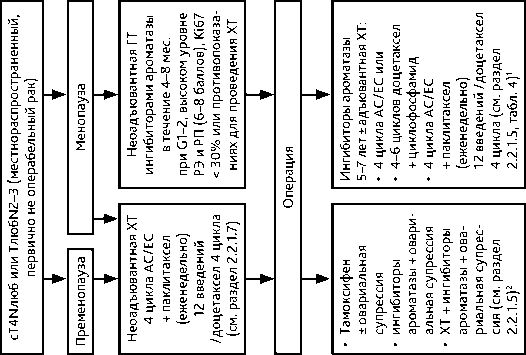
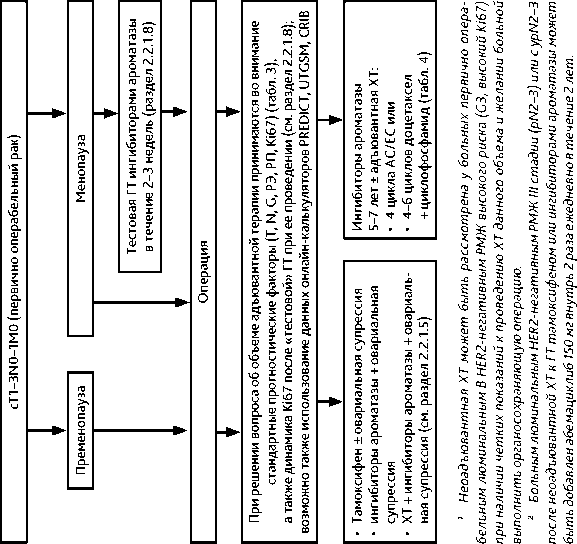
Рисунок 3. Рекомендуемый алгоритм нео-/адъювантной/постнеоадъювантной лекарственной терапии раннего и местнораспространенного люминального HER2-негативного рака молочной железы.
Тройной негативный РМЖ T1–4N1–3M0 стадий (разделы 2.2.1.3, 2.2.1.7)
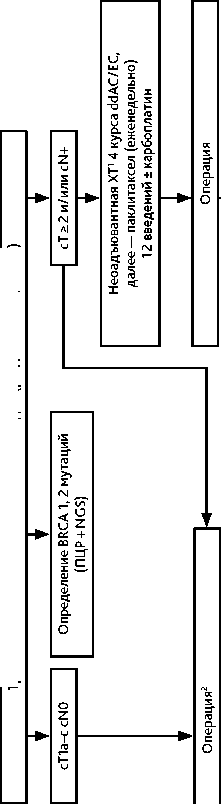
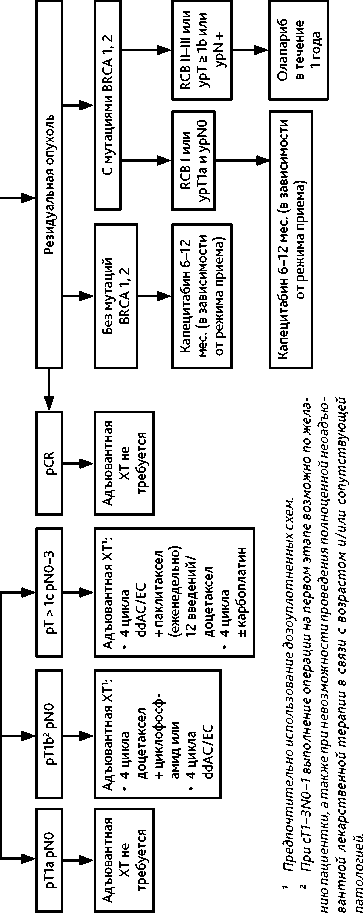
Рисунок 4. Рекомендуемый алгоритм нео-/адъювантной/постнеоадъювантной лекарственной терапии раннего и местнораспространенного тройного негативного рака молочной железы


ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ

Рисунок 5. Рекомендуемый алгоритм диспансерного наблюдения после первичного лечения РМЖ (раздел 2.2.3)
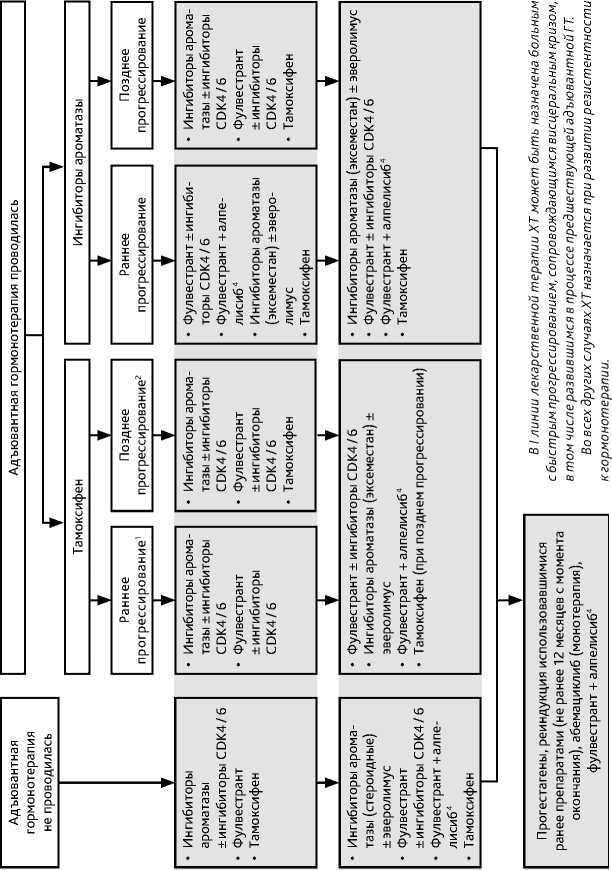
Рисунок 6. Рекомендуемый алгоритм лекарственной терапии метастатического гормонозависимого НER2-негативного рака молочной железы (раздел 3.3.1)
I ЛИНИЯ II ЛИНИЯ III ЛИНИЯ
Метастатический тройной негативный и люминальный гормонорезистентный HER2-негативный РМЖ (раздел 3.3.2)
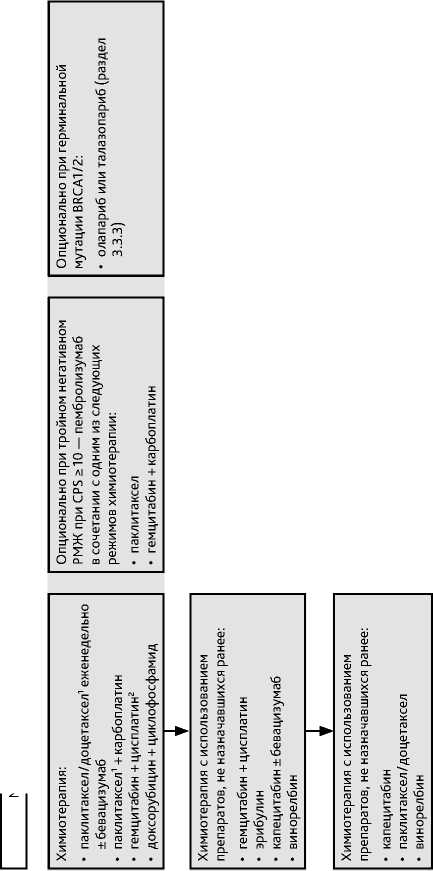
I ЛИНИЯ II ЛИНИЯ III ЛИНИЯ
Рисунок 7. Рекомендуемый алгоритм назначения лекарственной терапии при метастатическом тройном негативном и люминальном гормонорезистентном HER2-негативном РМЖ
Метастатический HER2-положительный РМЖ (раздел 3.3.4)
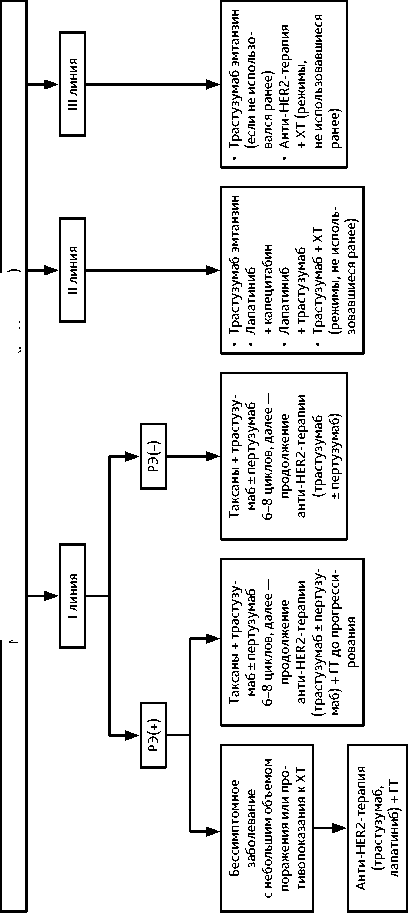
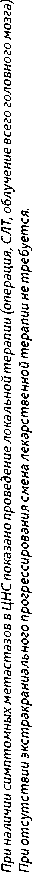



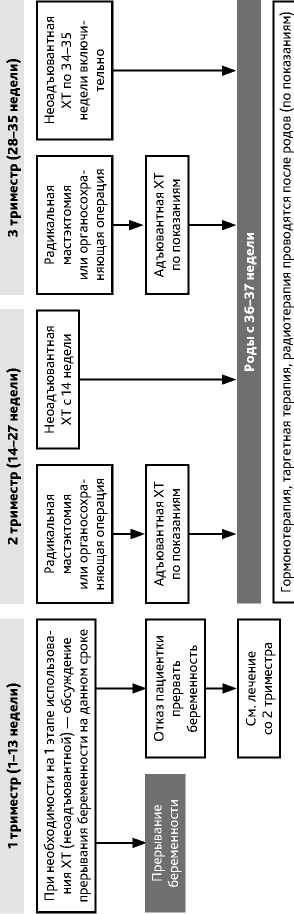
том/vol. 15(3s2)2025
|
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


