Рак панкреатодуоденальной зоны: диагностика и лечение
Автор: Жерлов Г.К.
Журнал: Сибирский онкологический журнал @siboncoj
Статья в выпуске: 1 (17), 2006 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14054247
IDR: 14054247
Текст статьи Рак панкреатодуоденальной зоны: диагностика и лечение
НИИ гастроэнтерологии Сибирского государственного медицинского университета, г. Северск
В настоящее время заболеваемость раком поджелудочной железы (РПЖ) составляет в среднем 9,0 на 100 000 чел. в год, занимая 10-е место по заболеваемости и 4-е место по смертности [4]. В России в 2000 г. диагноз рака поджелудочной был поставлен у 13 100 больных [1]. За последние 30 лет заболеваемость РПЖ в России возросла на 30 % [5]. Вместе с тем показатели 5-летней выживаемости этой категории больных колеблются в пределах от 0 до 41 %, но наиболее часто указывают цифры 8‒11 % [11]. В первую очередь это обусловлено тем, что только 10‒20 % пациентов с впервые выявленной опухолью поджелудочной железы подлежат радикальной операции [14, 25], а в остальных случаях проводится либо паллиативное вмешательство, либо симптоматическая терапия.
Таким образом, решение проблемы продления жизни больных раком поджелудочной железы складывается из своевременной диагностики и адекватного (комбинированного) лечения.
Диагностика
Сегодня при постановке своевременного и верного диагноза рака поджелудочной железы практически невозможно обойтись без использования современных методов: ультразвуковой томографии, компьютерной томографии, магнито-резонансной томографии, ангиографии, эндоскопической эхографии и др.
Ультразвуковое исследование является наиболее простым и достаточно эффективным методом обнаружения опухоли поджелудочной железы [4]. Недостатком ее является определенная зависимость от квалификации врача-исследователя, а также технического уровня самого ультразвукового аппарата [7].
В последние годы широкое распространение получает интраоперационное ультразвуковое исследование. Первый опыт использования ультразвука во время операции относится к 60-м годам [3]. Однако широкое применение интраоперационная ультразвуковая компьютерная томография получила в 80-х годах, когда были созданы специализированные датчики для применения в условиях операционной, рабо- тающие в режиме реального времени [10]. При раке поджелудочной железы интраоперационное ультразвуковое исследование позволяет оценить состояние паренхимы поджелудочной железы, вирсунгова протока, определить распространенность патологического процесса, вовлечение сосудистых структур и забрюшинного пространства.
Компьютерная томография (КТ) является методом выбора в качестве уточняющей диагностики. Лучшие результаты получаются при использовании КТ с контрастированием [11, 22, 28].
Maгнитно-резонансная томография ‒ методика, обладающая высокой разрешающей способностью при опухолях поджелудочной железы. Считается, что по данным этого исследования опытный специалист может сделать вывод не только о распространенности опухолевого процесса и связи его с магистральными сосудами, но и предположить его гистологическую структуру [24].
Ретроградная холангиопанкреатография ‒ дополнительный метод диагностики, позволяющий в ряде случаев проводить дифференцированный диагноз между опухолевым и воспалительным процессом в головке поджелудочной железы, а также между опухолью дистального отдела холедоха и головки pancreas [6].
Чрескожная чреспеченочная холангиография позволяет уточнить характер и уровень обтурации. Наиболее характерным рентгенологическим признаком является наличие полного блока и конической или полукруглой культи с неровными, нечеткими контурами [3].
Таким образом, только комплексное обследование с использованием современных методик позволит выявить и дифференцировать рак поджелудочной железы, а также оценить распространенность процесса и определить тактику лечения.
Лечение
Лечение рака поджелудочной железы включает: хирургическое вмешательство, химиотерапию, лучевую терапию, а также комбинированное лечение.
Хирургическое лечение может быть:
‒ радикальным (панкреатодуоденальная резекция или модифицированная операция),
‒ паллиативным (уменьшение обструктивной желтухи путем эндоскопического стентирования, хо-лецисто- или холедохоеюностомии),
‒ направленным на уменьшение болевого синдрома (химическая денервация солнечного сплетения 6 % фенолом или 50 % алкоголем).
Первые попытки хирургического лечения были предприняты еще в начале XX века. Однако только в 40-е годы прошлого столетия Allen O. Whipple разработал хирургические подходы при резекции поджелудочной железы [29]. Долгие годы такие вмешательства выполнялись крайне редко и зачастую заканчивались смертью пациента. Столь неудовлетворительные непосредственные результаты лечения пациентов этой патологии создали достаточно стойкое мнение даже среди врачей о бесперспективности лечения больных опухолями поджелудочной железы. Однако в последние годы совершенствование хирургической техники, развитие анестезиологии и реаниматологии позволили добиться значительных успехов в этой области медицины. В крупных специализированных центрах летальность после таких операций не превышает 6 % [9, 12, 13], а по данным некоторых авторов, вообще равна 0 [16].
На сегодняшний день в России и в мире общепринятыми являются следующие радикальные операции при злокачественных опухолях панкреатодуоденальной зоны:
-
1) стандартная гастропанкреатодуоденальная резекция ‒ ГПДР (субтотальная панкреатикодуоденэктомия, операция Whipple);
-
2) панкреатэктомия (тотальная панкреатикодуоденэктомия);
-
3) дистальная (левосторонняя) резекция поджелудочной железы;
-
4) расширенная ГПДР (расширенная субтоталь-
- ная или тотальная панкреатикодуоденэктомия, региональная субтотальная или тотальная панкреатикодуоденэктомия).
Другие операции (органосохраняющие), выполняющиеся по функциональным соображениям, относятся к разряду сравнительно редких операций, так как их онкологическая адекватность, по мнению некоторых ученых, крайне сомнительна [9].
Ключевым моментом любого варианта операции панкреатодуоденальной резекции является панкреа-тоеюноанастомоз. Именно несостоятельность последнего, возникающая у 1,2‒23 % пациентов, является одной из основных причин неблагоприятных исходов в раннем послеоперационном периоде [9, 26, 27]. При этом причиной несостоятельности панкреато-еюнального соустья чаще всего является заброс кишечного содержимого в вирсунгов проток, с развитием послеоперационного панкреатита [5].
Исходя из этого, в нашей клинике разработан и широко применяется способ панкреатодуоденальной резекции с формированием арефлюксного панкреа-тоеюноанастомоза. После выполнения резекционного этапа операции на конце отключенной из пищеварения по Ру петли тощей кишки циркулярно отсепа-ровывают и удаляют серозно-мышечную оболочку шириной 12 мм (рис. 1). Мобилизованную петлю проводят через окно в мезоколон и подводят к культе поджелудочной железы, которую катетеризируют «потерянным» полимерным дренажем соответствующего диаметра и фиксируют к стенке протока швом (рис. 2а). Культю кишки фиксируют к поджелудочной
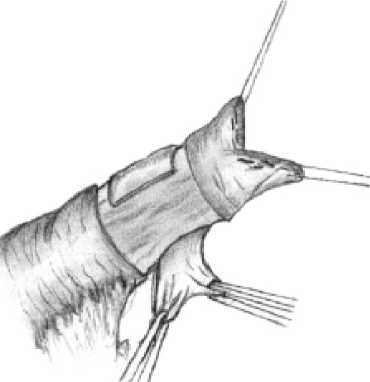
Рис. 1. Удаление серозно-мышечной оболочки на дистальном конце мобилизованной петли тонкой кишки
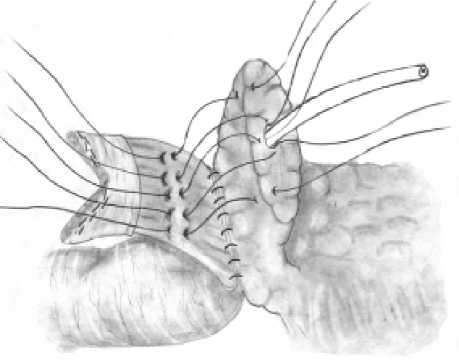
панкреатоеюноанастомоза
Рис. 2а. Катетеризация вирсунгова протока «потерянным дренажем»
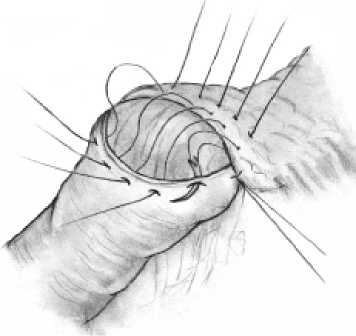
Рис. 2в. Завершение формирования панкреатоеюноанастомоза
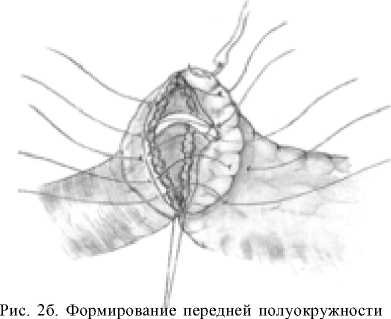
железе швами-держалками по углам анастомоза, проходящими через край ее серозно-мышечной оболочки, а на поджелудочной железе ‒ через капсулу, отступя от края нa 18‒20 мм (рис. 2б). Затем инвагини-руют культю поджелудочной железы в просвет тощей кишки путем наложения внутреннего ряда узловых швов между краями «оголенного» подслизистого слоя кишки и капсулы поджелудочной железы, а затем наружного ряда узловых швов между краем серозно-мышечного слоя кишки и капсулой поджелудочной железы, отступив от первого ряда швов на глубину инвагината (18‒20 мм) (рис. 2в). При этом pars nuda кишки обращена на середину задней полуокружности соустья.
В завершении операции создают антирефлюкс-ный клапан путем циркулярного рассечения серозно-мышечной оболочки кишки нa 5‒7 см ниже панк-реатоеюноанастомоза и еще 2 полуовальных разрезов выше и ниже первого на 15‒18 мм. Инвагинаци-
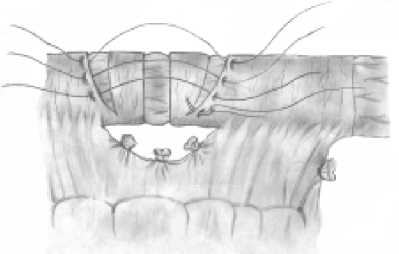
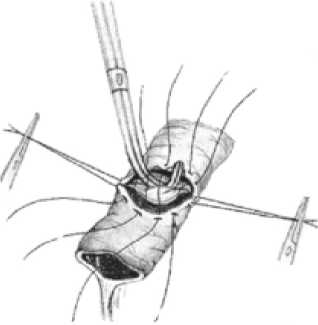
Рис. 3а, б. Этапы формирования инвагинационного клапана в отводящей петле кишки (пояснение в тексте)
Рис. 4. Окончательный вид сформированного панкреатоеюноанастомоза онный клапан образуется после сшивания прокси- мального и дистального краев разрезов серозно-мышечными швами (рис. 3а, б). Ha рис. 4 представлен окончательный вид сформированного анастомоза. Подобная технология формирования соустья показана и применяется у пациентов с малоизмененной тканью поджелудочной железы и узким вирсунговым ружности анастомоза захватываем в шов вместе с краями «оголенной» подслизистой оболочки кишки и капсулы поджелудочной железы подслизистую основу культи панкреатического протока. При завязы-вaнии этих швов слизистые оболочки кишки и протока сопоставляются, а срез культи поджелудочной железы укрывается слизисто-подслизистой оболочкой кишки. Таким образом формируется панкреатико-еюностома (рис. 5а-в).
Всего в клинике радикальные операции выполнены у 77 больных, в том числе 43 мужчин и 34 женщин в возрасте от 29 до 72 лет (табл. 1).
Гастропанкреатодуоденальная резекция выполнена у 52 (67,5 %) больных, пилоросохраняющая панкреатодуоденальная резекция ‒ у 25 (32,5 %). Показанием к оперативному лечению послужили рак головки поджелудочной железы ‒ 65 (84,4 %) и рак фатерова сосочка ‒ 12 (15,6 %) больных.
Таблица 1
Распределение больных, оперированных радикально, по полу и возрасту протоком.
У пациентов с фиброзно-измененной тканью под-
|
желудочной железы, при расширении главного панк- |
|||||||
|
Пол |
реат Всего свет |
ического ппото В а з Р |
вЫш лет 4—5 мм |
дренаж в про- |
|||
|
прОТОк |
а 3 н е4 ус |
ганавл |
иваем : |
I Пр - И О н |
аЛоженИи внуг- |
||
|
Мужчины |
ренн |
его- ря |
да шво |
।в на з; |
1 днюю |
и пер; |
: днюю полуок- |
|
Женщины |
34 |
1 |
1 |
12 |
12 |
7 |
1 |
|
Итого |
77 |
1 |
3 |
22 |
30 |
19 |
2 |
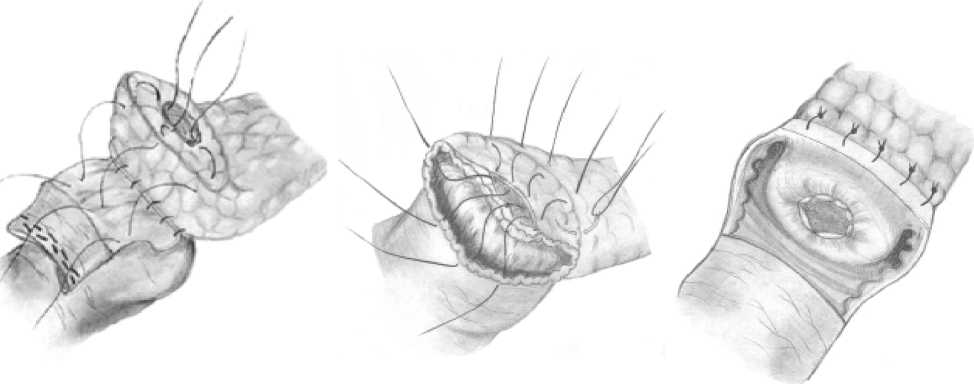
Рис. 5а-в. Формирование панкреатоеюноанастомоза при широком вирсунговом протоке (пояснение в тексте)
С учетом большого числа запущенных форм рака панкреатодуоденальной зоны, осложненного механической желтухой, в институте разработаны методики желчеотводящих операций, предусматривающих сохранение «изолированности» желчного дерева от кишечного содержимого путем формирования ареф-люксных билиодигестивных анастомозов). Bсе они представлены нa рис. 6а-в.
Паллиативные операции выполнены у 221 пациента, в том числе у 128 мужчин и 93 женщин в возрасте от 38 до 86 лет (табл. 2). По поводу рака головки поджелудочной железы IV ст. было оперировано 197 (89,1 %) больных, рака гепатикохоледоха ‒ 24 (8,9 %).
Общая летальность после радикальных операций cоставила 9,1 %, в том числе от прогрессирующей печеночно-почечной недостаточности умeрло 5 пациентов, по одному больному погибло вследствие несостоятельности швов гепатикоэнтероанастомоза и внутрибрюшного кровотечения.
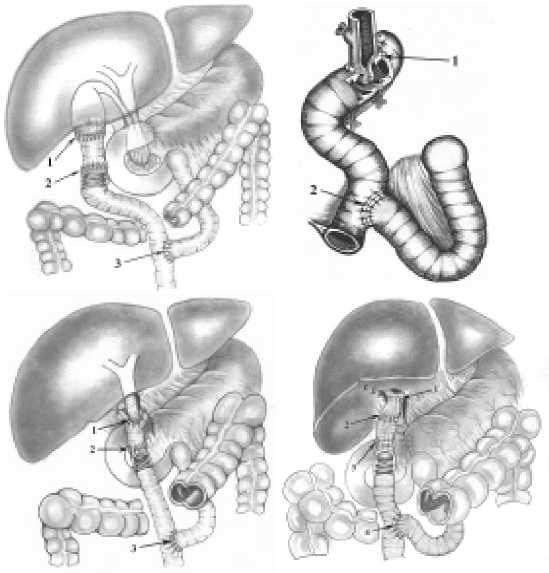
Рис. 6. Желчеотводящие операции при механической желтухе: а ‒ холецистоеюноанастомоз; б ‒ холедохоеюноанастомоз;
в ‒ гепатикоеюноанастомоз; г ‒ гепатикохолецистоеюноанастомоз
Таблица 2
Распределение больных после паллиативных операций по полу и возрасту
После паллиативных операций в рaннeм послеоперационном периоде умeрло 18 больных (8,1 %). При этом основной причиной гибели больных была фульминантная печеночная недостаточность ‒ 12, а также ТЭЛА ‒ 3 и легочные осложнения ‒ 3. В раннем послеоперационном периоде осложнения возникли у 97 (43,9 %) больных. Чаще всего отмечалась фульминантная печеночная недостаточность ‒ 41 и легочные ослож-нeния ‒27.
После радикальных операций в сроки от 3 мeс до 9 лет обследовано 47 пациентов. С целью объективной оценки ближайших и отдаленных результатов хирургического лечения клинические данные дополнены проведением лабораторных, ультразвуковых, эндоскопических, рентгенологических исследований в различные сроки после операции.
Ультразвуковое исследование в разные сроки после операции дает возможность оценить морфологическое состояние остатка поджелудочной железы и панкреатоею-ноанастомоза и косвенно судить о eго функциональных возможностях. У двух пациентов в ближайшем послеоперационном периоде отмечалась тенденция к увеличению размера панкреатического протока культи поджелудочной железы в ходе наблюдения, однако через год после операции ни у одного из них расширения протока не было. У 45 пациентов расширения вирсунгова протока в течение всего срока наблюдений не фиксировали. Размеры протока были в пределах 2‒4 мм и оставались без изменений в тече-
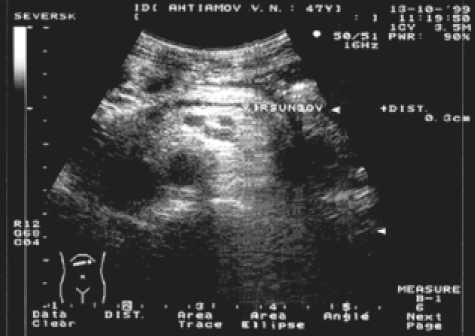
Рис. 7. Ультрасонограммы больных после панкреатодуоденальной резекции: а ‒ через 6 мес после операции, б ‒ через 18 мес после операции
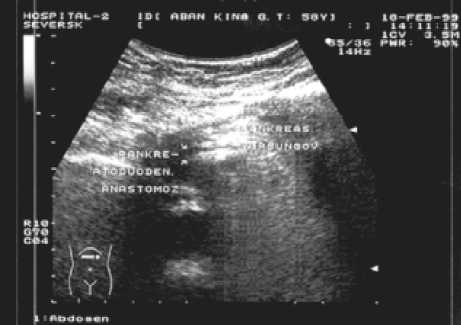
ние всего времени наблюдения (рис. 7а,б). Размеры культи поджелудочной железы не выходили за верхнюю границу нормы ни у одного пациента. В среднем толщина (переднезадний размер) культи железы в области тела составила 20,56 ± 4,3 мм, максимально 30 мм. Средняя толщина в области хвоста 20,78 ± 1,94 мм, наибольшая до 24 мм. Рефлюкса содержимого кишки выше кишечного клапана в зону панкреатоеюноанастомоза по данным УЗИ (доплерография) не отмечается, инваги- национный клапан функционально активен. Структура клапана сохраняется постоянной во все сроки обследования с момента операции.
У восьми пациентов при рентгеноскопии хорошо контурировался инвагинационный клапан в тощей кишке (рис. 8). Заброса контрастной массы выше инвагинационного клапана, в зону панкреатоеюноа-настомоза и в проток культи поджелудочной железы, ни в одном случае отмечено не было.
При эндоскопическом исследовании у пациентов,
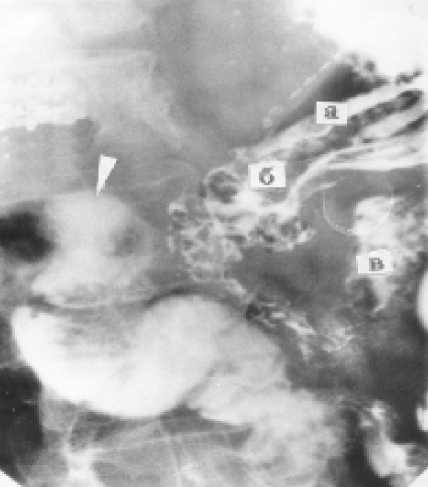
Рис. 8. Рентгенограмма больного С. через 1,5 года после радикальной ПДР. Стрелкой указана зона инвагинационного кишечного клапана
перенесших гастропанкреатодуоденальную резекцию, в отводящей петле тощей кишки при ретроградном осмотре удавалось визуализировать инвагинационный клапан (рис. 9). Клапан представляет собой циркулярный конусовидный инвагинат стенок кишки. При инсуффляции воздуха клапан пролабирует в сторону панкреатоеюноа-настомоза, но не раскрывается, что убедительно свидетельствует о его антирефлюксной функции.
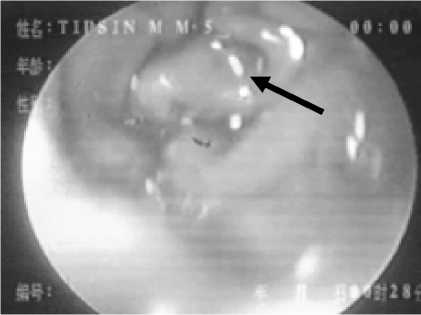
Рис. 9. Эндоскопическое исследование больного Т. через 12 мес после радикальной операции с формированием панкреатоеюноанастомоза (указан стрелкой)
Вместе с тем, как уже говорилось выше, только 20 % больных раком поджелудочной железы подлежат радикальному оперативному лечению, остальные могут рассчитывать только на паллиативное лечение.
Лучевая терапия занимает определенное место в лечении рака поджелудочной железы, так как клетки этой опухоли являются радиочувствительными. Применяется не только дистанционная лучевая терапия, но и интраоперационная лучевая терапия. Наиболее часто используется пролонгированный курс мелкими фракциями до суммарной очаговой дозы 40‒50 Гр после удаления опухоли. Некоторые авторы сообщают о медиане продолжительности жизни 20 мес [21].
Однако рядом исследований в настоящее время показано, что отдалённая выживаемость среди больных протоковым раком поджелудочной железы, перенесших хирургическое удаление опухоли с интраоперационным облучением, как правило, не лучше, чем при адъювантной химио- или радиотерапии. Медиана выживаемости больных, получивших интраоперационную лучевую терапию, составила 13‒15 мес. [20, 23]. Кроме того, такая терапия требует использования современных лучевых установок (линейные ускорители), которые являются крайне дорогостоящими, что ограничивает их широкое использование.
Химиотерапия , как правило, применяется у больных с распространенным опухолевым процессом или в комбинации с другими методами лечения. Из раннего периода применения химиопрепаратов в арсенале онкологов остались: 5-фторурацил, митомицин, доксорубицин и т.д. Однако эффективность монотерапии 5-FU и его различных комбинаций была крайне низкой и колебалась от 0 до 20 %, а медиана выживаемости составляла всего 5‒6 мес [18].
Из современных препаратов наибольшую противоопухолевую активность при раке поджелудочной железы проявил гемцитабин. Его первые клинические испытания были проведены E. Casper et al. (1994) у 43 больных с запущенным раком поджелудочной железы. У 14 из них был местнораспространенный процесс, в 26 случаях диагностированы метастазы в печень и у 3 пациентов ‒ метастазы в легкие. У 5 из 39 больных был зарегистрирован объективный эффект в виде частичной регрессии опухоли, что составило 12,8 %. Средняя продолжительность жизни у 5 больных, леченных с эффектом, превысила 6 мес. В 3 случаях (7,7 %) была отмечена регрессия опухоли менее 50 %. У всех больных с объективным эффектом зарегистрировано улучшение общего состояния.
-
H. Burris et al. (1997) представили данные сравнительного рандомизированного исследования по оцен-
- ке эффективности гемцитабина и 5-фторурацила у больных с распространенным раком поджелудочной железы. Объективный эффект был зарегистрирован у 5,4 % больных, получавших гемцитабин, и 0 % ‒ при назначении 5-фторурацила. Симптоматический эффект наблюдался в 23,8 и 4,8 % случаев соответствен-ʜo. Ha основании проведенных исследований автор делает вывод о том, что применение гемцитабина приводит к статистически достоверному увеличению выживаемости по сравнению с 5-FU в рандомизированных исследованиях, обеспечивает статистически достоверно более частое клиническое улучшение, наконец, вызывает клиническое улучшение у больных, рефрактерных к 5-FU.
С 2001 г. мы применяем антиметаболит гемцитабин (Гемзар) в качестве адъювантного средства после паллиативных операций, а также как паллиативное средство при неоперабельных случаях. Гемцитабин вводился в дозе 1000 мг/м2 в виде 30-минутной инфузии один раз в три недели.
Под нашим наблюдением находилось 12 больных, в том числе 8 женщин и 4 мужчины, в возрасте от 33 до 74 лет (m = 56,4), с оценкой по шкале D.A. Karnofsky (1949) от 70‒100 баллов (m = 80). У 7 из них была выполнена паллиативная (желчеотводящая) операция. Bсе пациенты имели IV стадию заболевания. Каждый больной получил от 3 до 7 курсов (всего проведено 54 курса). Оценка эффекта проводилась после 3 курсов по следующим параметрам.
Динамика болевого синдрома. Перед началом лечения оценивали болевой синдром по визуальноаналоговой шкале (ВАШ) интенсивности боли от 0 до 10 в виде линии длиной 10 см, над которой графически отражена степень болевых ощущений. Эту шкалу давали пациенту, и он сам отмечал над ней степень своих болевых ощущений. Поскольку данные ВАШ, полученные в покое, не позволяют судить об эффективности обезболивания, пациенту рекомендовали отмечать степень болевых ощущений при движении, откашливании, глубоком дыхании. Как видно из табл. 3, на фоне приема гемцитабина произошло значительное уменьшение болевого синдрома.
Таблица 3
Динамика болевого синдрома на фоне приема Гемзара у больных раком поджелудочной железы
|
До лечения |
После лечения |
|
|
Нет боли |
2 |
7 |
|
Умеренная боль |
4 |
4 |
|
Сильная боль |
6 |
1 |
Оценка общего состояния проводилась по шкале D.A. Karnofsky (1949). Из табл. 4 видно, что химиотерапия гемцитабином способствует улучшению общего состояния больного.
Оценка общего состояния терапии гемцитабином по
Таблица 4 пациентов до и после шкале D.A. Karnofsky
|
Оценка по шкале D.A. Karnofsky |
К-во больных до лечения |
К-во больных после лечения |
|
|
100 |
Без признаков заболевания |
0 |
4 |
|
90 |
Активность сохранена, легкие симптомы заболе вания |
4 |
5 |
|
80 |
Сохраняет активность с трудом, есть симптомы |
5 |
3 |
|
70 |
Обслуживает себя полностью, но нетрудоспособен |
3 |
0 |
При оценке эффективности проведения химиотерапии гемцитабином установлено, что частичная регрессия опухоли зафиксирована у 4 (33,3 %) больных, стабилизация процесса наступила у 5 (41,7 %), прогрессирование ‒ у 3 (25 %) пациентов.
Таким образом, раннее выявление рака поджелудочной железы с применением современных диагностических методик, внедрение расширенных радикальных хирургических вмешательств, применение комбинированного лечения позволяют улучшить как непосредственные, так и отдаленные результаты лечения, способствуют увеличению продолжительности жизни и улучшению ее качества. Разработанная технология формирования панкреатоеюноанастомо-за при панкреатодуоденальной резекции у больных раком поджелудочной железы позволяет значительно улучшить непосредственные результаты операции, исключив несостоятельность швов анастомоза и развитие послеоперационного панкреатита. Проведение химиотерапии препаратом гемцитабин (ГЕМЗАР) у больных с запущенным раком поджелудочной железы позволяет сохранить качество жизни больного, увеличив период безрецидивной выживаемости.


