Рак поджелудочной железы
Автор: Покатаев И.А., Гладков О.А., Загайнов В.Е., Кудашкин Н.Е., Кучин Д.М., Лядов В.К., Подлужный Д.В., Трякин А.А., Федянин М.Ю., Черных М.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-1 т.13, 2023 года.
Бесплатный доступ
Рак поджелудочной железы, карцинома, химиотерапия, классификация резектабельности
Короткий адрес: https://sciup.org/140302396
IDR: 140302396 | DOI: 10.18027/2224-5057-2023-13-3s2-1-555-572
Текст статьи Рак поджелудочной железы
Злокачественные опухоли поджелудочной железы делятся на две группы: экзокринной части (95% случаев) и эндокринной части (5% случаев). В казуистически редких случаях встречаются мезенхимальные опухоли и лимфомы. Данные рекомендации посвящены только карциномам экзокринной части поджелудочной железы.
Тактика лечения рака поджелудочной железы (РПЖ) должна определяться на междисциплинарном онкологическом консилиуме с обязательным участием панкреатобилиар-ного хирурга, лучевого диагноста, специалистов по лекарственной и лучевой терапии.
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Злокачественные опухоли, исходящие из экзокринной части поджелудочной железы, включают следующие гистологические подтипы:
-
• протоковая аденокарцинома (85–90%)
-
• внутрипротоковая папиллярная муцинозная опухоль, ассоциированная с инвазивной аденокарциномой (2–3 %)
-
• муцинозная кистозная опухоль, ассоциированная с инвазивной аденокарциномой (1%)
-
• солидная псевдопапиллярная опухоль (< 1%)
-
• ацинарно-клеточная карцинома (< 1 %)
-
• панкреатобластома (< 1 %)
-
• серозная цистаденокарцинома (< 1 %).
Стадирование осуществляется на основании TNM классификации РПЖ (8-е издание, 2017 г.) (табл. 1).
Первичная опухоль (T)
ТХ — недостаточно данных для оценки первичной опухоли;
Tis — карцинома in situ (данная категория включает панкреатическую интраэпителиальную неоплазию высокой степени (ПанИН-3), внутрипротоковую папиллярную муцинозную опухоль с тяжелой дисплазией, внутрипротоковую тубулопапилляр- ную опухоль с тяжелой дисплазией, муцинозную кистозную опухоль с тяжелой дисплазией);
T1 — опухоль ограничена поджелудочной железой до 2 см в наибольшем измерении (дополнительно введены группы T1a, T1b, T1c — для уточнения прогноза образований с размером инвазивного компонента до 0,5 см, 0,5–1 см и 1–2 см соответственно);
Т2 — опухоль размером 2–4 см в наибольшем измерении;
Т3 — опухоль размером более 4 см в наибольшем измерении;
Т4 — опухоль вовлекает чревный ствол, верхнюю брыжеечную или общую печеночную артерию, вне зависимости от размера.
Регионарные лимфатические узлы (N)
NХ — недостаточно данных для оценки регионарных лимфоузлов;
N0 — нет признаков метастатического поражения регионарных лимфоузлов;
N1 — наличие метастазов в 1–3 регионарных лимфоузлах;
N2 — наличие метастазов в 4 или более регионарных лимфоузлах.
Адекватное послеоперационное стадирование предполагает морфологическое изучение не менее 12 лимфатических узлов.
К регионарным лимфоузлам для опухоли головки поджелудочной железы относятся лимфоузлы вдоль общего желчного протока, общей печеночной артерии, воротной вены, задней и передней панкреатодуоденальных аркад, вдоль верхней брыжеечной вены и правой латеральной стенки верхней брыжеечной артерии. К регионарным лимфоузлам для опухоли тела и хвоста поджелудочной железы относятся лимфоузлы вдоль общей печеночной артерии, чревного ствола, селезеночной артерии, ворот селезенки, а также забрюшинные и латеральные аортальные лимфоузлы. Существуют принципиальные разночтения в описании регионарных лимфатических узлов в классификации ТNM 8 редакции по версиям AJCC и UICC, в то же время отсутствуют ссылки на работы, на основании которых в UICC латеральные аортальные лимфатические узлы были отнесены к регионарным. Необходимо учитывать данную информацию при составлении плана лечения пациентов.
Отдаленные метастазы (M)
M0 — нет отдаленных метастазов;
M1 — наличие отдаленных метастазов.
Таблица 1. Стадирование рака поджелудочной железы.
|
Стадия |
T |
N |
M |
|
0 |
Tis |
N0 |
M0 |
|
IA |
T1 |
N0 |
M0 |
|
IB |
T2 |
N0 |
M0 |
|
IIA |
T3 |
N0 |
M0 |
|
IIB |
T1–3 |
N1 |
M0 |
|
Стадия |
T |
N |
M |
|
III |
T1–3 |
N2 |
M0 |
|
T4 |
N любая |
M0 |
|
|
IV |
T любая |
N любая |
M1 |
2. ДИАГНОСТИКА
Диагноз РПЖ устанавливается на основании анамнестических, лабораторных данных и результатов инструментального обследования. Морфологическое исследование необходимо только в тех случаях, когда пациенту планируется проведение лекарственной терапии (предоперационной или паллиативной) или облучения. Оптимальным вариантом получения материала для верификации процесса является эндосонография и тонкоигольная аспирационная биопсия. Толстоигольная биопсия под контролем эндосонографии позволяет получить дополнительный материал для ИГХ или молекулярно-генетического исследования, однако является более сложным и дорогостоящим методом. Биопсия должна быть выполнена также в ходе эксплоративной лапаротомии или лапароскопии у тех пациентов, которым планировалась радикальная операция без предшествующей верификации, однако интраоперационно процесс был признан нерезектабельным.
У пациентов с резектабельными опухолями (15–20% от общего числа больных) отрицательный результат биопсии не должен приводить к задержке или отмене хирургического лечения в том случае, если тактика лечения обсуждается на междисциплинарном консилиуме и клинический диагноз РПЖ не вызывает сомнения.
В план обследования должны быть включены:
-
• осмотр, сбор анамнеза болезни, семейного анамнеза;
-
• клинический анализ крови;
-
• биохимический анализ крови с оценкой функции печени, почек;
-
• определение CA19-9 в сыворотке крови (необходимо помнить, что уровень CA19-9 может быть повышен на фоне желтухи, холангита или иного воспалительного процесса в панкреатобилиарной области, в связи с чем определение базового уровня CA19-9 должно проводиться после билиарной декомпрессии, нормализации уровня билирубина и купирования воспалительных явлений);
-
• КТ грудной клетки, брюшной полости и малого таза; исследование брюшной полости должно проводиться строго с в/в болюсным контрастированием по разработанному для оценки поджелудочной железы протоколу: без перорального контрастирования йодсодержащими препаратами, толщина среза < 3 мм (предпочтительно < 1 мм), с обязательной оценкой «панкреатической» (40–50 сек после начала введения контраста) и портальной (65–70 сек) фаз контрастирования, с использованием высокой концентрации (> 300 мг йода на литр) и скорости его введения 3–5 мл/сек.;
-
• УЗИ органов брюшной полости, забрюшинного пространства, малого таза, шейнонадключичной области является допустимым при нецелесообразности КТ (например, у пациентов с диссеминацией опухоли) или невозможности КТ;
-
• рентгенография органов грудной клетки является альтернативой при нецелесообразности КТ (например, у пациентов с диссеминацией опухоли) или невозможности КТ;
-
• ЭГДС;
-
• ЭКГ.
При наличии показаний дополнительно рекомендованы следующие методы обследования:
• эндоУЗИ преимущественно для верификации опухоли, в т. ч. биопсии подозрительных аортокавальных лимфоузлов, наличие метастазов в которых является противопоказанием для радикальной операции, а также для дополнительной оценки резек-табельности;
• МРТ брюшной полости и малого таза с в /в контрастированием для определения степени распространенности, резектабельности или оценки эффективности консервативного лечения у пациентов с аллергией на йод-содержащие контрастные препараты, а также при сомнительных результатах КТ в отношении первичной опухоли либо очагов в печени;
• ПЭТ-КТ для выявления отдаленных метастазов у пациентов с высокой вероятностью их наличия (например, высокий уровень маркера CA19-9 или крупные размеры первичной опухоли). Однако ПЭТ-КТ не является заменой КТ по вышеописанному протоколу в отношении оценки первичной распространенности при решении вопроса о возможности выполнения радикальной операции или при планировании ЛТ;
• диагностическая лапароскопия используется преимущественно при подозрении на перитонеальный карциноматоз, в т. ч. в смывах с брюшины, либо для биопсии в тех ситуациях, когда менее инвазивные способы получения материала оказались неинформативны или недоступны;
• определение хромогранина А в сыворотке крови (при клиническом подозрении на наличие у пациента нейроэндокринной опухоли).
3. ЛЕЧЕНИЕ
3.1. Лечение неметастатического рака поджелудочной железы (Тлюбая , Nлюбая , M0)
С учетом немалой частоты выявления мутаций в генах BRCA1, BRCA2 и PALB2 (более 5% случаев) и их существенного влияния на выбор схемы ХТ, определение данных мутаций целесообразно проводить у всех пациентов при неоперабельном РПЖ. Учитывая крайне низкую чувствительность существующих тест-систем на основе ПЦР, следует отдать предпочтение секвенированию. При невозможности секвенирования лаборатория должна использовать тест-систему на основе ПЦР, зарегистрированную для выявления мутаций при РПЖ, что связано с наибольшей вероятностью выявления мутации в гене BRCA2.
При наличии гистологического материала целесообразно выполнение секвенирования в ткани опухоли с дополнительным определением статуса MSI, а также мутаций в гене KRAS с указанием локализации мутации в гене. При отсутствии мутаций в KRAS опционально дополнительное молекулярное и ИГХ тестирование на альтерации BRAF, мутации EGFR, транслокацию ALK, NTRK, ROS1, слияние гена (fusion) NRG1, гиперэкс-прессию/амплификацию HER2.
Решение о тактике лечения неметастатического РПЖ основано на оценке резектабель-ности первичной опухоли и должно приниматься мультидисплинарной командой, включающей химиотерапевта, радиолога, рентгенолога и хирурга, обладающего достаточным опытом хирургического лечения больных с опухолями билио-панкреатодуоденальной области. В табл. 2 приведена классификация, которая позволяет судить о резектабель-ности по данным КТ, выполненной до начала лечения.
Таблица 2. Оценка резектабельности неметастатического рака поджелудочной железы (критерии NCCN).
|
Статус резектабельности |
Артерия |
Вена |
|
Резектабельный |
Нет контакта с артерией [чревный ствол (ЧС), верхняя брыжеечная артерия (ВБА) или общая печеночная артерия (ОПА)] |
Отсутствие контакта опухоли с верхней брыжеечной (ВБВ) или воротной веной (ВВ) или контакт ≤ 180° без нарушения контура вены |
|
Погранично резектабельный |
Головка поджелудочной железы/крючковидный отросток:
при этом наличие и степень контакта с опухолью следует отметить, если он присутствует, так как это может повлиять на план операции; Тело/хвост поджелудочной железы:
|
Контакт солидной опухоли с ВБВ или ВВ > 180°, контакт ≤ 180° с неровностью контура вены или тромбозом вены, но с подходящими сосудами проксимальнее и дистальнее места вовлечения, позволяющими выполнить безопасную и полную резекцию и реконструкцию вены. Контакт солидной опухоли с нижней полой веной (НПВ) |
|
Местно распространенный |
Головка поджелудочной железы/крючковидный отросток:
|
Отсутствие перспектив реконструкции ВБВ/ВВ из-за вовлечения опухоли или окклюзии (из-за опухоли или тромба) |
При резектабельном РПЖ рекомендуется на первом этапе проведение хирургического лечения. При погранично резектабельном раке необходимо проведение предоперационной ХТ с последующей оценкой результатов. При отсутствии отрицательной динамики рекомендуется выполнение операции. Начало лечения с ХТ также целесообразно при клинических ситуациях, подходящих под рентгенологические критерии резектабельного процесса, но имеющих признаки высокого риска метастатического заболевания — уровень CA19-9 более 500 Ед/мл, метастатическое поражение регионарных лимфоузлов. При наличии данных факторов риска желательно рассмотреть вопрос о проведении диагностической лапароскопии и ПЭТ-КТ.
Режимы предоперационной ХТ представлены в табл. 4. Начало лечения с ХТ сопряжено с необходимостью биопсии опухоли для морфологической верификации диагноза и выполнения желчеразгрузочных процедур.
При нерезектабельном раке рекомендовано проведение индукционной терапии с последующей повторной оценкой резектабельности (рис. 1).
-
3.1.1. Предоперационная/индукционная химиотерапия
-
3.1.2. Предоперационная/индукционная или самостоятельная лучевая терапия
Роль ЛТ в рамках индукционной терапии РПЖ окончательно не определена. Опубликованные рандомизированные исследования не поддерживают использование ЛТ как при погранично резектабельном (исследование ALIANCE A021501, ESPAC5f), так и при нерезектабельном раке (исследование LAP 07, CONCKO 007). На настоящий момент применение ЛТ по данным показаниям не рекомендуется вне рамок клинических исследований.
-
3.1.3. Хирургическое лечение
Единого протокола предоперационной/индукционной терапии не существует. Основным методом лечения остается ХТ. Режимы ХТ аналогичны таковым для лечения метастатического рака (табл. 4). Предпочтительными режимами (при отсутствии противопоказаний) являются (m) FOLFIRINOX или комбинации гемцитабина и nab-паклитаксела (табл. 4). При наличии у пациентов мутаций в генах BRCA или PALB2, оптимальным является применение комбинации FOLFIRINOX или комбинации гемцитабина с производными платины. При выборе режима ХТ следует учитывать следующие данные: общее состояние пациента, возраст, наличие осложнений опухолевого процесса и серьезных сопутствующих заболеваний.
Длительность индукционной ХТ при погранично резектабельном и нерезектабель-ном процессе составляет 12–18 недель. В случае сохранения нерезектабельного процесса и отсутствия нарастания эффекта после окончания 16–18 нед. индукционной ХТ рекомендуется продолжение ранее начатого режима ХТ (при его хорошей переносимости) либо проведение поддерживающей ХТ (например, монотерапии фторпиримидиновым производным, если до этого пациент получал FOLFIRINOX). Доказательств преимущества какой-либо тактики на момент составления рекомендаций нет.
Рекомендуемая суммарная продолжительность ХТ с учетом индукционного и поддерживающего этапов должна составлять не менее 6 мес. Применение ХТ более 6 мес. (например, до прогрессирования опухоли) также является возможной опцией ввиду отсутствия клинических исследований, посвященных изучению оптимальной длительности ХТ в этой группе пациентов. Решение о продолжении ХТ до прогрессирования должно приниматься с учетом динамики эффекта и переносимости данного лечения.
После проведения курсов предоперационного лечения решение о хирургическом лечении должно приниматься мультидисциплинарной группой. Хирургическое лечение целесообразно только при отсутствии отдаленных метастазов. При изолированном местном прогрессировании опухоли решение об операции принимается индивидуально в условиях специализированного центра. Пациентам с погранично резектабельными карциномами, которым проводилось неоадъювантное лечение, операция целесообразна только при отсутствии инструментальных признаков прогрессирования, а также стабильном уровне CA19-9, измеренным в отсутствии желтухи и холангита.
При погранично резектабельных опухолях головки поджелудочной железы сохранение инфильтрации вокруг артериальных сосудов не является абсолютным противопоказанием к лапаротомии. Рентгенологические методы визуализации, будучи относительно точными для определения резектабельности до начала лечения, становятся ненадежными после неоадъювантной терапии, и это должно быть принято во внимание при принятии решения о возможности и необходимости хирургической ревизии.
Стандартным доступом при всех операциях на поджелудочной железе является срединная лапаротомия. При опухолях головки поджелудочной железы следует выполнять (гастро) панкреатодуоденальную резекцию. При опухолях тела или хвоста поджелудочной железы следует выполнять дистальную субтотальную резекцию поджелудочной железы, включающую удаление тела, хвоста железы, а также селезенки. При поражении карциномой всех отделов поджелудочной железы рекомендуется выполнить тотальную панкреатэктомию. Стандартный объем лимфодиссекции при раке головки поджелудочной железы предполагает удаление следующих лимфатических узлов: надпилорических и подпилорических лимфоузлов по ходу печеночной артерии и чревного ствола, лимфоузлов вдоль общего желчного протока, пузырного протока и воротной вены, ретропанкреатических лимфоузлов, лимфоузлов по нижнему краю головки поджелудочной железы, лимфоузлов по правой полуокружности верхней брыжеечной артерии, лимфоузлов по верхнему краю головки поджелудочной железы. При раке головки поджелудочной железы рекомендуется иссечение клетчатки и нервных сплетений вдоль правой полуокружности верхней брыжеечной артерии.
При карциномах тела и хвоста поджелудочной железы рекомендовано удаление следующих групп лимфоузлов: лимфоузлов ворот селезенки, лимфоузлов вдоль селезеночной артерии, лимфоузлов по нижнему краю поджелудочной железы, вдоль общей печеночной артерии и чревного ствола, расположенных вдоль левой полуокружности верхней брыжеечной артерии, средних ободочных лимфоузлов вдоль одноименной артерии. Стандартная лимфаденэктомия должна включать удаление не менее 12 лимфатических узлов. Расширенная лимфаденэктомия не показала преимуществ в ходе сравнительных исследований, ее применение не рекомендовано на сегодняшний день.
Многочисленные исследования, посвященные возможностям выполнения операций по поводу РПЖ лапароскопическим способом, продемонстрировали сопоставимые с эффективностью традиционных вмешательств хирургические и онкологические результаты. В связи с этим они могут рассматриваться в качестве альтернативы стан- дартным операциям с лапаротомным доступом в центрах, имеющих существенный опыт подобных вмешательств.
Операция Appleby (дистальная резекция поджелудочной железы с резекцией чревного ствола) может применяться только в специализированных клиниках с участием специалистов, имеющих опыт подобных вмешательств, на фоне стабилизации или частичного ответа на предоперационную терапию.
При функционально не операбельном РПЖ (на фоне тяжелой сопутствующей патологии) рекомендуется проведение паллиативного противоопухолевого лекарственного лечения (табл. 4) либо симптоматической терапии (см. раздел 3.1.5).
-
3.1.4. Адъювантная терапия
В случае предоперационной ХТ длительностью 6 мес. с последующим хирургическим лечением после операции рекомендовано динамическое наблюдение без адъювантной терапии. Если длительность предоперационной ХТ была меньше 6 мес., рекомендовано применение адъювантной ХТ так, чтобы общая продолжительность ХТ составила 6 мес.
В этом случае рекомендуется проводить адъювантный этап ХТ с использованием тех же цитотоксических препаратов, которые были использованы перед операцией. Однако, с учетом более высокого риска непереносимой токсичности после операции по сравнению с предоперационным этапом, следует адаптировать дозы препаратов из предоперационного режима в соответствии с состоянием пациента после операции.
В случае выполнения хирургического лечения без предоперационной ХТ проведение адъювантной ХТ рекомендовано всем пациентам вне зависимости от стадии и радикальности операции.
Лечение должно быть начато в течение 3 мес. после операции (оптимально начинать ХТ в промежутке между 4 и 8 неделями после операции). Если состояние пациента после операции не позволяет начать ХТ в течение 3 мес., более позднее начало адъювантной терапии все же целесообразно, хотя и менее эффективно. Перед началом ХТ целесообразно выполнить обследование (оценка грудной и брюшной полостей, а также CA19-9), чтобы убедиться в отсутствии прогрессирования заболевания. Рекомендуемые режимы адъювантной ХТ представлены в табл. 3.
Таблица 3. Режимы адъювантной химиотерапии при раке поджелудочной железы.
|
Показания |
Режим химиотерапии |
|
Оптимальный объем ХТ |
• mFOLFIRINOX 1,3 : оксалиплатин 85 мг/м 2 в/в 120 мин., иринотекан 150 мг/м 2 в/в 90 мин., кальция фолинат 400 мг/м 2 в/в 120 мин., 5-фторурацил 2400 мг/м 2 в/в инфузия в течение 46 часов, каждые 2 нед., всего 12 циклов |
|
Показания |
Режим химиотерапии |
|
Минимальный объем ХТ 2,3 |
+ капецитабин 1660 мг/м 2 внутрь ежедневно с 1-го по 21-й день каждые 4 нед., всего 6 циклов или
|
1 mFOLFIRINOX рекомендуется только пациентам с ECOG 0–1, без серьезных осложнений хирургического лечения, сопутствующих заболеваний при уровне общего билирубина < 1,5 ВГН.
2 У пациентов, которым невозможно проведение адъювантной ХТ mFOLFIRINOX, предпочтительным режимом является GEMCAP.
3 При положительных краях резекции (R1) режимы ХТ остаются теми же, однако польза режима GEMCAP при R1 статусе сомнительна
Применение предикторов эффективности гемцитабина при планировании адъювантной ХТ (например, hENT, RRM1 и др.) не рекомендуется вне рамок клинических исследований.
Роль адъювантной ЛТ в настоящее время изучается в проспективных рандомизированных исследованиях. Ее рутинное применение не рекомендуется даже при положительных краях резекции (R1) или при подтвержденных метастазах в регионарных лимфоузлах (рN1–2).
-
3.1.5. Коррекция осложнений опухолевого процесса
Пациенты с механической желтухой нуждаются в выполнении билиодигестивных вмешательств, если лечение планируется начать с консервативного этапа. Решение о выполнении желчеотведения при планировании радикального хирургического лечения принимается индивидуально. Имеющиеся данные свидетельствуют о том, что гипербилирубинемия существенно не повышает риск серьезных послеоперационных осложнений, а желчеразгрузочные операции значительно и часто необоснованно отдаляют радикальное хирургическое лечение. Билиодигестивные вмешательства [антеградные (чрескожные чреспеченочные), ретроградные (эндоскопические) и открытые операции)] целесообразны при наличии осложнений холестаза, например, при активном холангите, уровне общего билирубина более 250 мкмоль/л, а также при невозможности хирургического лечения в ближайшие 2 недели. Предпочтение должно быть отдано миниинвазивным вмешательствам (антеградные (чрескожные чреспеченочные), ретроградные (эндоскопические)); открытые операции следует осуществлять только в случае неэффективности миниинвазивных.
При наличии выраженного болевого синдрома возможно выполнение блокады чревного сплетения. Данная миниинвазивная процедура выполняется чрескожно или эндоскопически. Эндоскопическая блокада чревного сплетения считается более безопасной. В качестве альтернативы с обезболивающей целью может быть применена ЛТ: стереотаксический курс в РОД 5–6 Гр, 5 раз в нед., СОД 25–30 Гр в зависимости от объема облучения окружающих критических органов и с учетом их толерантности. Пациент должен получать анальгетические препараты, обеспечивающие стойкое купирование болевого синдрома.
Большинство пациентов имеют признаки алиментарной недостаточности, выражающейся в виде существенного снижения массы тела, кахексии, саркопении. Одной из причин данного осложнения, которая должна быть скорректирована, является экзокринная недостаточность функции поджелудочной железы. Частота ферментативной недостаточности по данным метаанализа составляет 44% у пациентов с нерезецированной поджелудочной железой и 36–100% после операции.
Клиническая картина ферментативной недостаточности не обладает специфическими симптомами и включает похудание, диарею, боли/дискомфорт в животе, анемию, электролитные нарушения и др.
Диагностика ферментативной недостаточности не всегда дает точный результат. Прямой метод в виде оценки поступления панкреатического сока в двенадцатиперстную кишку является инвазивным и трудозатратным, ввиду чего редко используется в практике. Чаще используются непрямые тесты, например, измерение коэффициента абсорбции жира в стуле, фекальной эластазы, радиоизотопный дыхательный тест и измерение биохимических маркеров (например, альбумин, пре-альбумин, магний, ретинол-связы-вающие белки, витамины А, D, E).
Терапия ферментативной недостаточности показана всем пациентам после операции или в отсутствие резекции поджелудочной железы при наличии клиники ферментативной недостаточности и должна быть направлена на ее коррекцию даже при отсутствии лабораторного подтверждения диагноза. Стартовая доза заместительной ферментативной терапии (ЗФТ) включает 40000–50000 Ед липазы во время приема пищи и 25000 Ед во время перекусов. В дальнейшем доза препарата может быть изменена в индивидуальном порядке. Чаще всего необходимая доза липазы после тотальной панкреатэктомии существенно выше указанной начальной дозы.
Данные метаанализа указывают на ухудшение общего прогноза пациентов при отказе от ЗФТ. Более подробная информация ЗФТ представлена в соответствующем разделе клинических рекомендаций по поддерживающей и сопроводительной терапии RUSSCO.
Вторичное нарушение метаболизма глюкозы на фоне рака поджелудочной железы получила название панкреатогенного сахарного диабета (3с типа). Данное осложнение ассоциировано с риском прогрессирования, неблагоприятным прогнозом, увеличивает риски токсичности лекарственного лечения и требует коррекции у эндокринолога.
-
3.1.6. Динамическое наблюдение после первичного лечения
Не существует доказательств того, что активное наблюдение за пациентами после первичного лечения и раннее выявление рецидива заболевания увеличивает продолжительность жизни. Поэтому допустимо проводить только выяснение жалоб пациента и физикальный осмотр на регулярной основе. Однако быстрое ухудшение состояния при прогрессировании заболевания лимитирует перспективы использования современных режимов ХТ. Поэтому оптимальными являются визиты пациента каждые 12 нед. в течение первых двух лет, каждые 6 мес. — в последующем для выполнения следующего обследования:
-
• УЗИ брюшной полости или КТ/ МРТ брюшной полости с в/в контрастированием;
-
• УЗИ малого таза для женщин;
-
• рентгенография органов грудной клетки;
-
• определение CA19-9 в случае их повышенных уровней до лечения, а также общий и биохимический анализы крови для оценки функции печени и почек.
-
3.2. Лечение метастатического рака поджелудочной железы (Тлюбая , Nлюбая , M1) и рецидивов после хирургического лечения
-
3.2.1. Химиотерапия I линии
Основным методом лечения данной группы пациентов является ХТ (рис. 1). Однако продолжительность жизни определяется не только эффективностью ХТ, но и своевременным купированием возможных осложнений опухолевого процесса (см. раздел 3.1.5.).
Рекомендуемые режимы ХТ I линии при РПЖ суммированы в табл. 4. При применении любого режима ХТ рекомендуется продолжение лечения до прогрессирования или до неприемлемой токсичности, которая сохраняется, несмотря на редукции доз препаратов.
Таблица 4. Рекомендуемые режимы химиотерапии I линии рака поджелудочной железы.
|
Режим химиотерапии (лечение до прогрес-сирования/неприемлемой токсичности) |
Критерии выбора режима химиотерапии |
|
FOLFIRINOX (оксалиплатин 85 мг/м 2 в/в 120 мин., иринотекан 180 мг/м 2 в/в 90 мин., кальция фолинат 400 мг/м 2 в/в 120 мин., 5-фторурацил 400 мг/м 2 в/в болюс, 5-фторурацил 2400 мг/м 2 в/в инфузия в течение 46 часов, каждые 2 нед.) |
|
|
Режим химиотерапии (лечение до прогрес-сирования/неприемлемой токсичности) |
Критерии выбора режима химиотерапии |
|
Nab-паклитаксел 125 мг/м 2 в/в капельно 30 мин. + гемцитабин 1000 мг/м 2 в/в капельно 30 мин. в 1-й, 8-й, 15-й дни каждые 4 нед. (у ослабленных пациентов или при наличии серьезных сопутствующих заболеваний допустима редукция доз препаратов до 100–75 мг/м 2 и 750–600 мг/м 2 для nab-паклитаксела и гемцитабина соответственно и/или использование режима в 1-й и 8-й дни каждые 3 нед. или в 1-й и 15-й дни каждые 4 нед.) |
|
|
Гемцитабин 1000 мг/м 2 в/в 1-й и 8-й дни каждые 3 нед. в сочетании с производным платины:
|
|
|
Гемцитабин 1000 мг/м 2 в/в 1-й, 8-й, 15-й дни каждые 4 нед. |
|
|
Капецитабин 2000 мг/м 2 внутрь в 1–14-ый дни 21-дневного курса |
|
|
Олапариб 300 мг 2 раза в сутки внутрь ежедневно |
16 недель терапии с включением производных платины |
Выбор режима ХТ при метастатическом РПЖ определяется, в первую очередь, состоянием пациента. При относительно удовлетворительном общем состоянии (по шкале ECOG 0–1 балл), нормальной функции печени и почек, отсутствии серьезных осложнений опухолевого процесса и сопутствующих заболеваний рекомендуется применение режимов FOLFIRINOX или гемцитабин + nab-паклитаксел. Отдельным пациентам, имеющим значительное распространение опухолевого процесса и связанные с этим симптомы (общее состояние по шкале ECOG 2 балла), может быть рекомендована комбинация гемцитабина и nab-паклитаксела, если ожидается, что в случае достижения противоопухолевого эффекта симптомы болезни могут регрессировать.
Пациенты, получавшие ранее ХТ по поводу неметастатического РПЖ (индукционную или адъювантную), могут получать лечение теми же препаратами, если период от окончания предыдущего лечения до прогрессирования заболевания составил более 6 мес. Если этот период составил менее 6 мес., целесообразно назначить ХТ другими препаратами (табл. 5).
Комбинация гемцитабина и эрлотиниба не рекомендуется для применения при РПЖ, так как по данным рандомизированного исследования продемонстрировало минимальное преимущество в продолжительности жизни при существенном увеличении токсичности.
Значительная токсичность режима FOLFIRINOX обосновывает изначальную модификацию данного режима, которая может включать один или несколько нижеперечисленных вариантов: • первичная профилактика нейтропении Г-КСФ;
-
• редукция дозы болюсного (до 320 мг / м 2 или полная отмена) и инфузионного (до 2000 мг/м 2 ) введения 5-фторурацила;
-
• редукция дозы иринотекана (до 150 мг / м 2 );
-
• редукция дозы оксалиплатина (до 65 мг / м 2 ).
-
3.2.2. Лучевая терапия
В случае отсутствия прогрессирования после окончания 16 нед. ХТ (m) FOLFIRINOX рекомендуется либо продолжение (m) FOLFIRINOX (при его хорошей переносимости) либо переход на поддерживающую ХТ фторпиримидинами или режимом FOLFIRI.
Лечение гемцитабином в монорежиме или в комбинации с nab-паклитакселом рекомендуется до прогрессирования заболевания либо до неприемлемой токсичности, несмотря на редукции доз препаратов.
Пациентам с мутацией в генах BRCA1, BRCA2 или PALB2 рекомендуется применение комбинации FOLFIRINOX или комбинации гемцитабина с производным платины (цисплатином, карбоплатином или оксалиплатином).
У пациентов с метастатическим РПЖ и патогенными герминальными мутациями в генах BRCA или PALB2 в случае отсутствия прогрессирования после проведения не менее 16 недель платиносодержащей ХТ I линии рекомендуется рассмотреть либо продолжение ХТ (в том числе в виде поддерживающей ХТ фторпиримидинами или режимом FOLFIRI), либо переход на поддерживающую терапию олапарибом в таблетках в дозе 300 мг 2 раза сутки до прогрессирования заболевания или непереносимой токсичности. Допустим более поздний переход на поддерживающую терапию олапарибом, в том числе при сохранении эффекта или стабилизации на фоне поддерживающей ХТ фторпиримидинами или FOLFIRI.
Во всех случаях, не соответствующих критериям выбора многокомпонентных режимов ХТ (табл. 4), рекомендуется монохимиотерапия гемцитабином или фторпиримидинами. Пациентам в тяжелом общем состоянии проведение ХТ не рекомендуется, показана только симптоматическая терапия.
Применение ЛТ возможно в случае локорегионарного рецидива после хирургического лечения и адъювантной ХТ, а также продолженного роста первичной нерезектабельной опухоли после ХТ при отсутствии отдаленных метастазов.
Методом выбора является стереотаксическая ЛТ при наличии технических возможностей (внутривенное контрастирование, контроль за дыханием) в СОД 30–45 Гр за 5 фракций. В случае планирования именно стереотаксической ЛТ на первом этапе лечения следует провести ХТ в течение 16–24 недель и далее ЛТ при отсутствии признаков прогрессирования в виде отдаленного метастазирования. Альтернативно при использовании ХЛТ облучение проводится в РОД 1,8–2,0 Гр до СОД 45–54 Гр в сочетании с капецитабином в дозе 1600 мг/м 2 /сут. внутрь ежедневно в течение всего периода облучения. В объем ЛТ включается первичная опухоль с вовлеченными лимфатическими узлами или рецидивная опухоль.
-
3.2.3. Химиотерапия II линии
Рекомендуемые режимы ХТ II линии при РПЖ суммированы в табл. 5.
Таблица 5. Рекомендуемые режимы химиотерапии II линии рака поджелудочной железы.
|
Режим химиотерапии (лечение до прогрессирова-ния/неприемлемой токсичности) |
Критерии выбора режима химиотерапии |
|
Nab-паклитаксел 100–125 мг/м 2 в/в капельно 30 мин. + гемцитабин 750–1000 мг/м 2 в/в капельно 30 мин. в 1-й, 8-й, 15-й дни каждые 4 нед. (у ослабленных пациентов или при наличии серьезных сопутствующих заболеваний допустима редукция доз препаратов до 100–75 мг/м 2 и 750–600 мг/м 2 для nab-паклитаксела и гемцитабинасо-ответственно и/или использование режима в 1-й и 8-й дни каждые 3 нед. или в 1-й и 15-й дни каждые 4 нед.) |
|
|
Гемцитабин 750–1000 мг/м 2 в/в в 1-й, 8-й дни каждые
|
|
|
Гемцитабин 750–1000 мг/м 2 в/в в 1-й, 8-й, 15-й дни каждые 4 нед. |
|
|
mFOLFIRINOX (оксалиплатин 60–85 мг/м 2 в/в 120 мин., иринотекан 120–180 мг/м 2 в/в 90 мин., кальция фолинат 400 мг/м 2 в/в 120 мин., 5-фторурацил 2000–2400 мг/м 2 в/в инфузия в течение 46 часов, интервал между циклами 2 нед.) |
|
|
Режим химиотерапии (лечение до прогрессирова-ния/неприемлемой токсичности) |
Критерии выбора режима химиотерапии |
|
mFOLFOX6 (оксалиплатин 85 мг/м 2 в/в 120 мин., кальция фолинат 400 мг/м 2 в/в 120 мин., 5-фторурацил 400 мг/м 2 в/в болюс, 5-фторурацил 2400 мг/м 2 в/в инфузия в течение 46 часов, интервал между циклами 2 нед.) XELOX (оксалиплатин 130 мг/м 2 в/в 120 мин. в 1-й день, капецитабин 2000 мг/м 2 /сут. внутрь в 1–14-й дни каждые 3 нед.) FOLFIRI (иринотекан 180 мг/м 2 в/в 90 мин. в 1-й день, кальция фолинат 400 мг/м 2 в/в 120 мин. 5-фторурацил 400 мг/м 2 в/в болюс, 5-фторурацил 2400 мг/м 2 в/в инфузия в течение 46 часов, интервал между циклами 2 нед.) FOLFIRI 3 (иринотекан 90 мг/м 2 в/в 60 мин. в 1-й день, кальция фолинат 400 мг/м 2 в/в 120 мин. в 1-й день, 5-фторурацил 2000 мг/м 2 в/в инфузия в течение 46 часов, иринотекан 90 мг/м 2 в/в 60 мин. в 3-й день после окончания инфузии 5-фторурацила, интервал между циклами 2 нед.) CAPIRI (иринотекан 200 мг/м 2 в/в 90 мин. в 1-й день, капецитабин 1600 мг/м 2 /сут. внутрь в 1–14-й дни каждые 3 нед.) OFF (оксалиплатин 85 мг/м 2 в/в 120 мин. в 8-й и 22-й дни, кальция фолинат 200 мг/м 2 в/в 120 мин. в 1-й, 8-й, 15-й, 22-й дни, 5-фторурацил 2000 мг/м 2 в/в инфузия в течение 24 часов в 1-й, 8-й, 15-й, 22-й дни, интервал между циклами 6 нед |
|
|
Капецитабин 2000-мг/м 2 /сут. внутрь в 1–14-й дни каждые 3 нед.; 5-фторурацил 425 мг/м 2 в/в струйно + кальция фолинат 20 мг/м 2 в/в струйно в 1–5-й дни каждые 4 нед. |
|
|
Пембролизумаб 200 мг в/в 30 мин. 1 раз в 3 нед. каждые 3 нед. или 400 мг в/в каждые 6 нед.; Ниволумаб 1 240 мг или 3 мг/кг в/в 30 мин. каждые 2 нед. или 480 мг в/в каждые 4 нед.; Ниволумаб 1 3 мг/кг в/в 30 мин. каждые 3 нед. и ипи-лимумаб 1 мг/кг в/в 30 мин. 1 раз в 3 нед. (4 введения, в дальнейшем продолжается монотерапия ниволумабом в дозе 240 мг или 3 мг/кг в/в 1 раз в 2 нед. или 480 мг в/в капельно 1 раз в 4 нед.); Ниволумаб 1 3 мг/кг в/в 30 мин. каждые 2 нед. и ипилиму-маб 1 мг/кг в/в 30 мин. 1 раз в 6 нед. до прогрессирования или непереносимой токсичности |
|
|
Афатиниб 1 40 мг внутрь ежедневно; Эрлотиниб 1 100–150 мг + пертузумаб 420 мг (нагрузочная доза 840 мг) в/в 30 мин (первая доза 60 мин) 1 раз в 3 нед. |
|
|
Ларотректиниб 1 100 мг 2 раза в день внутрь ежедневно; Энтректиниб 1 600 мг 1 раз в день внутрь ежедневно |
|
|
Режим химиотерапии (лечение до прогрессирова-ния/неприемлемой токсичности) |
Критерии выбора режима химиотерапии |
|
Трастузумаб 1 6 мг/кг в/в (нагрузочная доза 8 мг/кг) каждые 21 день и пертузумаб 420 мг (нагрузочная доза 840 мг) в/в (первая доза 60 мин) 1 раз в 3 нед. каждые 21 день; Трастузумаб дерукстекан 1 5,4 мг/кг в/в каждые 3 нед. |
|
|
Дабрафениб 1 150 мг 2 раза в сутки внутрь ежедневно + траметиниб 2 мг 1 раз в день внутрь ежедневно; Вемурафениб 1 960 мг внутрь 2 раза в день ежедневно + кобиметиниб 60 мг в день 3 нед. приема 1 неделя перерыв |
|
|
Кризотиниб 1 по 250 мг 2 раза в сутки внутрь ежедневно; Церитиниб 1 450 мг в сутки внутрь ежедневно; Лорлатиниб 1 100 мг 1 раз в сутки внутрь ежедневно |
|
|
Алектиниб 1 600 мг 2 раза в сутки внутрь ежедневно |
|
|
Гефитиниб 1 по 250 мг внутрь ежедневно; Эрлотиниб 1 по 150 мг внутрь ежедневно; Афатиниб 1 40 мг внутрь ежедневно; Осимертиниб 1 80 мг внутрь ежедневно |
|
1 Данный режим отсутствует в рекомендациях Минздрава России.
ХТ II линии может быть рекомендована пациентам в относительно удовлетворительном состоянии (ECOG 0–1) и отдельным пациентам в состоянии средней тяжести (ECOG 2), связанном с распространением опухолевого процесса, если эффект ХТ позволяет рассчитывать на улучшение общего состояния. Пациентам в тяжелом общем состоянии рекомендуется только симптоматическое лечение. В случае кахексии возможно назначение мегестрола ацетата в дозе 320–480 мг внутрь 1 раз в сутки. Данных, поддерживающих применение ХТ III линии, не существует. Решение о применении химиотерапии III линии принимается индивидуально.
В случае выявления редких молекулярных нарушений, например, мутации BRAF, EGFR, транслокации ALK, NTRK, ROS1, возможно применение персонализированной терапии во второй и более линии лечения, направленной на ингибирование данных сигнальных путей. Применение анти-HER МКА возможно при гиперэкспрессии или амплификации HER2 при отсутствии мутаций в гене КRAS.
-
3.3. Лечение редких гистологических подтипов новообразований экзокринной части поджелудочной железы
Солидные псевдопапиллярные опухоли встречаются в менее чем 1% случаев из всех новообразований поджелудочной железы, преимущественно у женщин (в 90% случаев) в молодом возрасте (средний возраст 20 лет). Если ранее они классифицировались как опухоли с неопределенным потенциалом злокачественности, то в настоящее время они рассматриваются как опухоли с низкой степенью злокачественности.
Опухоли обладают индолентным течением. Прогноз благоприятный. Отдаленные метастазы выявляются в ≈ 8% случаев. Лечение преимущественно хирургическое, включая случаи с отдаленными метастазами. Частота рецидивов составляет менее 5%. Адъювантная терапия как правило не используется.
Для пациентов с неоперабельными метастазами протоколов ХТ не разработано, и опубликованные наблюдения указывают на невысокую непосредственную эффективность ХТ, хотя индолентное течение обеспечивает продолжительную стабилизацию. Эти опухоли часто экспрессируют рецепторы половых гормонов, и эндокринная терапия тамоксифеном или ингибиторами ароматазы (в сочетании с овариальной супрессией при необходимости) может быть рассмотрена.
Ацинарные карциномы и смешанные ацинарно-эндокринные карциномы отличаются более благоприятным течением по сравнению с протоковыми карциномами. Общие принципы лечения не отличаются от таковых для протокового РПЖ. Смешанные ацинарно-эндокринные карциномы также лечатся по принципам лечения экзокринного рака.
На молекулярном уровне в этих опухолях редко встречаются мутации KRAS. Среди молекулярных нарушений, заслуживающих внимание, следует выделить альтерации BRAF. Хотя мутации BRAF выявляются редко, в 23% случаев выявляются перестройки BRAF или RAF1 (например, слияние SND1-BRAF), что делает эти опухоли потенциально чувствительными к терапии ингибиторами МЕК. Анализ небольших работ показывает также более высокую частоту мутаций в генах BRCA и MSI-H при ацинарных карциномах поджелудочной железы.
Внутрипротоковая папиллярная муцинозная опухоль, ассоциированная с инвазивной аденокарциномой, и муцинозная кистозная опухоль, ассоциированная с инвазивной аденокарциномой, являются группой опухолей, возникших на фоне озлокачествления доброкачественных кистозных новообразований. Их прогноз определяется биологией злокачественного компонента и распространенностью процесса. Накопленный опыт не позволяет сформировать особый алгоритм лечения. Поэтому рекомендуется следовать тем же правилам, которые сформированы для классического протокового рака.
Серозная цистаденокарцинома развивается из доброкачественного предшественника и имеет более благоприятный прогноз, несмотря на способность метастазировать. Индо-лентное течение ставит на первое место хирургический метод лечения даже при наличии отдаленных метастазов.
Панкреатобластома — крайне редко встречающаяся опухоль, возникающая в детском возрасте. В мире опубликовано порядка 15 случаев диагностирования панкреатобластомы у взрослых пациентов, большинство из которых погибли в короткие сроки. Принципы хирургического лечения, (нео) адъювантной терапии и терапии диссеминированного процесса должны соответствовать клиническим рекомендациям для детей.
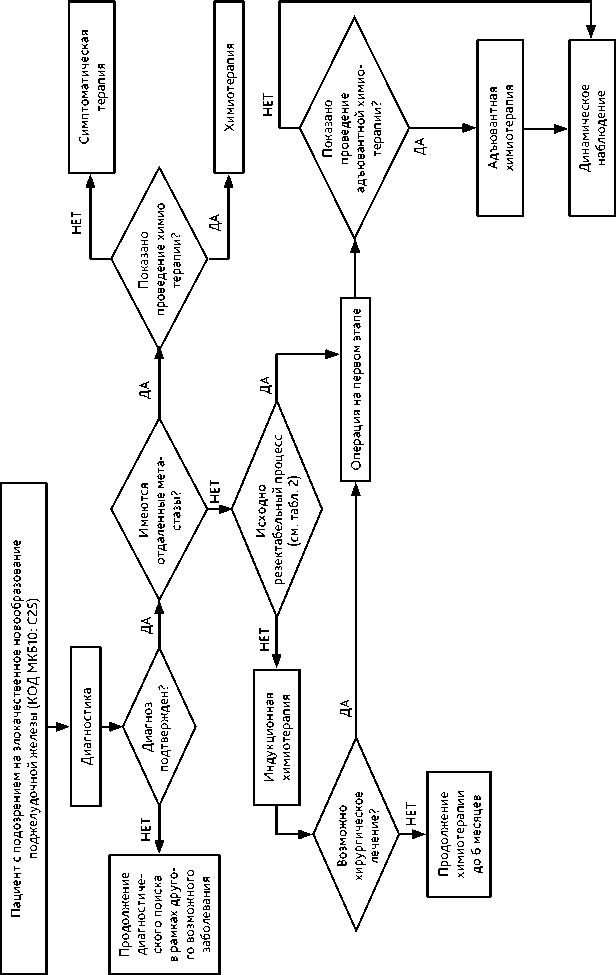
Рисунок 1. Рекомендуемый алгоритм лечебно-диагностических мероприятий при раке поджелудочной железы.


