Рак шейки матки
Автор: Хохлова С.В., Кравец О.А., Морхов К.Ю., Нечушкина В.М., Саевец В.В., Румянцев А.А., Ульрих Е.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-2 т.14, 2024 года.
Бесплатный доступ
Рак шейки матки, вирус папилломы человека
Короткий адрес: https://sciup.org/140307407
IDR: 140307407 | DOI: 10.18027/2224-5057-2024-14-3s2-1.2-05
Текст статьи Рак шейки матки
Рак шейки матки (РШМ) — одно из наиболее часто встречающихся злокачественных новообразований у женщин в мире. Причиной большинства случаев РШМ является персистенция ВПЧ онкогенных подтипов. Онкогенные подтипы ВПЧ 16 и 18 обнаруживаются у 71% больных РШМ, в то время как 31, 33, 45, 52 и 58 подтипы ВПЧ выявляются у 19% пациенток. Стратегия снижения смертности от РШМ включает вторичную профилактику (цитологическое исследование мазков по Папаниколау и/или тестирование ДНК ВПЧ) и первичную профилактику (вакцинация от ВПЧ).
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Диагноз РШМ устанавливается только на основании результатов гистологического исследования.
Для определения стадии РШМ возможно использование любых методов визуализации и/или данных морфологического исследования. Стадия РШМ устанавливается до начала специальной терапии, что необходимо для выбора метода и составления плана лечения. Стадия РШМ не изменяется после начала специального лечения. В случаях, когда есть затруднения в точном определении стадии, следует устанавливать более раннюю. Морфологические находки у больных, подвергнутых хирургическому лечению, должны быть отмечены отдельно. Для этой цели подходит номенклатура TNM (буквенной аббревиатурой перед TNM необходимо указывать, на основании каких данных определен статус первичной опухоли (T), лимфатических узлов (N) и отдаленных метастазов (M): клинические данные (cTNM), данные лучевых методов обследования (rTNM), данные послеоперационного морфологического исследования (pTNM).
Определение стадии производится на основании классификации FIGO (2018 г.) и TNM (8-е издание, обновление 2021 г.) (табл. 1).
Таблица 1. Классификация РШМ по стадиям (классификация FIGO (2018 г.) и TNM (8-е издание, обновление 2021 г.)
|
TNM |
FIGO |
|
|
TX |
Недостаточно данных для оценки первичной опухоли |
|
|
T0 |
Первичная опухоль не определяется |
|
|
Tis |
В классификации FIGO стадию 0 (Tis) не применяют |
Рак in situ , преинвазивный рак (эти случаи не входят в статистику заболеваемости РШМ) |
|
T1 |
Стадия I |
Опухоль ограничена шейкой матки (распространение на тело матки не учитывается) |
|
T1a |
IА |
Инвазивная карцинома, диагностирующаяся только микроскопически, с наибольшей глубиной инвазии ≤ 5 мм 1, 2 |
|
T1a1 |
IА1 |
Стромальная инвазия ≤ 3 мм |
|
T1a2 |
IА2 |
Стромальная инвазия > 3 мм, но ≤ 5 мм |
|
T1b |
IВ |
Инвазивная карцинома с глубиной инвазии > 5 мм (больше, чем стадия IA), опухоль ограничена шейкой матки |
|
T1b1 |
IВ1 |
Инвазивная карцинома с глубиной инвазии > 5 мм и размером опухоли ≤ 2 см в наибольшем измерении |
|
T1b2 |
IВ2 |
Инвазивная карцинома размером > 2 см, но ≤ 4 см в наибольшем измерении |
|
T1b3 |
IB3 |
Инвазивная карцинома размером > 4 см в наибольшем измерении |
|
T2 |
Стадия II 3 |
Опухоль, распространившаяся за пределы матки, без перехода на стенки таза и поражения нижней трети влагалища |
|
T2a |
IIА |
Опухоль поражает до двух третей верхней части влагалища без вовлечения параметрия |
|
T2a1 |
IIА1 |
Инвазивная карцинома размером ≤ 4 см в наибольшем измерении |
|
T2a2 |
IIА2 |
Инвазивная карцинома размером > 4 см в наибольшем измерении |
|
T2b |
IIВ |
С вовлечением параметрия, но без распространения на стенку таза |
|
T3 |
Стадия III |
Опухоль распространяется на стенку малого таза и/или вовлекает нижнюю треть влагалища и/или является причиной гидронефроза или нефункционирующей почки и/или имеется поражение тазовых и/или парааортальных лимфатических узлов 4 |
|
T3a |
IIIА |
Опухоль вовлекает нижнюю треть влагалища, но не распространяется на стенку таза |
|
T3b |
IIIВ |
Опухоль распространяется на стенку таза и/или является причиной гидронефроза или нефункционирующей почки |
|
IIIС |
Поражение тазовых и/или парааортальных лимфатических узлов независимо от размера и распространения первичной опухоли (T1–T3) (с обозначением индексов r и p) 4 |
|
|
IIIС1 |
Поражение только тазовых лимфатических узлов |
|
|
IIIС2 |
Поражение парааортальных лимфатических узлов |
|
|
Стадия IV |
Опухоль, распространившаяся за пределы таза или прорастающая слизистую оболочку мочевого пузыря или прямой кишки (буллезный отек не позволяет отнести опухоль к стадии IV) |
|
|
TNM |
FIGO |
|||
|
T4 |
IVА |
Прорастание мочевого пузыря или прямой кишки 5 |
||
|
M1 |
IVВ |
Отдаленные метастазы 6 |
||
|
Состояние регионарных лимфатических узлов |
Отдаленные метастазы |
|||
|
NX |
Недостаточно данных для оценки |
M0 |
Отдаленные метастазы отсутствуют |
|
|
N0 |
Признаков поражения регионарных лимфатических узлов нет |
M1 6 |
Имеются отдаленные метастазы |
|
|
N1 7 |
Метастазы в тазовых лимфатических узлах |
|||
|
N2 7 |
Метастазы в парааортальных лимфатических узлах (в сочетании или без метастазов в тазовых лимфатических узлах) |
|||
-
1 Методы визуализации и гистологическое исследование могут быть использованы на всех этапах в дополнение к клиническим данным о размере опухоли и ее распространении.
-
2 При стадии IA горизонтальное распространение опухоли не учитывается. Глубина инвазии определяется от базальной мембраны, независимо от того, исходит опухоль из поверхностного эпителия или из железистого. Выявление опухолевых эмболов в кровеносных или лимфатических сосудах не меняет стадию, но должно быть отражено в заключении гистологического исследования, поскольку может повлиять на тактику лечения.
-
3 При вовлечении параметрия стадия III диагностируется тогда, когда инфильтрат в параметрии имеет узловую форму и доходит до стенки таза. В остальных случаях диагностируется стадия IIb. При гинекологическом исследовании судить о природе инфильтрата (воспалительный или опухолевый) невозможно.
-
4 Добавление обозначений индексов r (методы визуализации) и р (гистологическое исследование) необходимо для уточнения метода, на основании которого установлена стадия IIIС. Например, если метастатическое поражение тазовых лимфатических узлов выявлено методами визуализации, стадия будет IIIC1r, при гистологическом подтверждении поражения тазовых лимфатических узлов — IIIС1p. При этом метод визуализации или методика гистологического исследования должны быть описаны в заключении. При затруднениях в точном определении стадии следует устанавливать более раннюю.
-
5 Инвазия в слизистую оболочку мочевого пузыря или прямой кишки должна быть подтверждена результатами биопсии.
-
6 Включая метастазы в паховых лимфатических узлах, а также на брюшине, за исключением серозных оболочек органов малого таза. Исключены метастазы во влагалище, серозных оболочках органов малого таза и придатках.
-
7 Суффикс “mi”добавляется при размере метастазов в лимфатических узлах > 0,2 мм, но ≤ 2 мм; суффикс “mа” добавляется при размере метастазов в лимфатических узлах > 2 мм; суффикс “sn” добавляется, если метастаз выявлен при БСЛУ.
Регионарными лимфатическими узлами при РШМ считаются наружные, внутренние, общие подвздошные, параметральные, запирательные, крестцовые и поясничные лимфатические узлы.
У 70–80% больных инвазивным РШМ диагностируется плоскоклеточный рак, у 10–20% — аденокарцинома и у 10% — низкодифференцированный рак. Другие гистологические типы злокачественных опухолей шейки матки составляют не более 1%. Морфологическая классификация злокачественных опухолей шейки матки представлена в табл. 2.
Таблица 2. Морфологическая классификация злокачественных опухолей шейки матки (ВОЗ, 2020 г.)
ОПУХОЛИ ИЗ ПЛОСКОГО ЭПИТЕЛИЯ
-
• 8077/0 — плоcкоклеточные интраэпителиальные поражения (поражение плоского эпителия (SIL)):
– 8077/0 — поражение плоского эпителия легкой степени (LSIL)
– 8077/2 — поражение плоского эпителия тяжелой степени (HSIL)
-
• 8085/3 — плоскоклеточный рак ВПЧ-ассоциированный
-
• 8086/3 — плоскоклеточный рак ВПЧ-не ассоциированный
-
• 80870/3 — плоскоклеточный рак неспецифического типа
ОПУХОЛИ ИЗ ЖЕЛЕЗИСТОГО ЭПИТЕЛИЯ
-
• 8140/2 — аденокарцинома in situ
-
• 8483/2 — аденокарцинома in situ ВПЧ-ассоциированная
-
• 8484/2 — аденокарцинома in situ ВПЧ -не ассоциированная
-
• 8140/3 — аденокарцинома неспецифического типа
-
• 8483/3 — аденокарцинома ВПЧ-ассоциированная
-
• 8482/3 — аденокарцинома ВПЧ-не ассоциированная желудочного типа
-
• 8310/3 — аденокарцинома ВПЧ-не ассоциированная светлоклеточного типа
-
• 9110/3 — аденокарцинома ВПЧ-не ассоциированная мезонефроидного типа
-
• 8484/3 — аденокарцинома ВПЧ-не ассоциированная неспецифического типа
-
• 8380/3 — эндометриоидная аденокарцинома неспецифического типа
-
• 8980/3 — карциносаркома неспецифического типа
-
• 8560/3 — железистоплоскоклеточная карцинома
-
• 8430/3 — мукоэпидермоидная карцинома
-
• 8098/3 — аденоидно-базальная карцинома
-
• 8020/3 — карцинома недифференцированная неспецифического типа
СМЕШАННЫЕ ЭПИТЕЛИАЛЬНЫЕ И МЕЗЕНХИМАЛЬНЫЕ ОПУХОЛИ
-
• 8933/3 — аденосаркома
ГЕРМИНОГЕННЫЕ ОПУХОЛИ
-
• 9064/3 — герминогенные опухоли неспецифического типа
НЕЙРОЭНДОКРИННЫЕ ОПУХОЛИ
• 8240/3 — нейроэндокринные карциномы
– 8041/3 — мелкоклеточная нейроэндокринная карцинома
– 8013/3 — крупноклеточная нейроэндокринная карцинома
• 8045/3 — смешанная мелкоклеточная нейроэндокринная карцинома
• 8013/3 — смешанная крупноклеточная нейроклеточная карцинома
2. ДИАГНОСТИКА
Объем обследований для установки диагноза:
-
• физикальное обследование включает гинекологический осмотр и ректовагинальное исследование;
-
• кольпоскопия, биопсия всех подозрительных участков шейки матки, при необходимости — конизация шейки матки;
-
• клинический анализ крови, биохимический анализ крови (показатели функции печени и почек), коагулограмма, общий анализ мочи, ЭКГ;
-
• КТ органов грудной клетки;
МРТ таза с в/в контрастированием (УЗИ малого таза возможно только при отсутствии МРТ);
КТ/МРТ брюшной полости с в/в контрастированием.
По показаниям выполняются:
-
• цистоскопия;
-
• ректороманоскопия;
-
• экскреторная урография, ренография;
-
• УЗИ шейно-надключичных лимфоузлов (при наличии метастазов в забрюшинных лимфоузлах);
-
• УЗИ паховых лимфоузлов (при подозрении на метатстическое поражение);
-
• определение уровня SCC в сыворотке (при плоскоклеточном раке);
-
• ПЭТ-КТ (наиболее информативна для выявления поражения лимфатических узлов и отдаленных метастазов);
-
• сцинтиграфия костей скелета (при подозрении на метастатическое поражение костей).
При многоцикловом лечении необходимые показатели для мониторинга определяются перед каждым курсом ХТ и сроки их выполнения описаны в главе по общим принципам проведения противоопухолевой терапии (пункт 2.6).
-
• Определение PD-L1 и MSI в опухолевом материале (при прогрессировании заболевания после радикального первичного лечения или при наличии первичного диссеминированного процесса перед началом терапии)
-
• Определение HER2 статуса в опухолевом материале (при прогрессировании после как минимум одной линии лечения диссеминированного процесса)
Гистологическое исследование хирургически удаленного опухолевого препарата должно отражать следующие параметры:
1) гистологический тип опухоли;
2) степень дифференцировки опухоли;
3) размеры опухоли (три размера);
4) глубину инвазии опухоли;
5) толщину шейки матки в месте наибольшей инвазии опухоли;
6) наличие /отсутствие опухолевых эмболов в кровеносных и лимфатических сосудах;
7) опухоль в крае резекции влагалища, параметриев, по границам резекции шейки матки (при выполнении конизации/ампутации или трахелэктомии); при близком крае резекции указывается расстояние от края резекции до опухоли;
8) переход опухоли на влагалище;
9) опухолевое поражение параметрия справа, слева;
10) общее число удаленных и поражённых лимфоузлов параметрия справа, слева; размер метастазов в мм (изолированные опухолевые клетки, микрометастазы, макрометастазы);
11) общее число удаленных и поражённых тазовых лимфоузлов справа, слева; размер метастазов в мм (изолированные опухолевые клетки, микрометастазы, макрометастазы);
12) общее число удаленных и поражённых поясничных лимфоузлов; размер метастазов в мм (изолированные опухолевые клетки, микрометастазы, макрометастазы);
13) переход опухоли на тело матки;
14) метастатическое поражение яичников;
15) прорастание опухоли в стенку мочевого пузыря, прямой кишки (при выполнении экзентерации или резекции смежных органов);
16) степень лечебного патоморфоза первичной опухоли и метастазов в лимфоузлах в случае предоперационной терапии со ссылкой на классификацию, по которой оценивается степень лечебного патоморфоза.
3. ЛЕЧЕНИЕ3.1. IA1стадия (инвазия ≤ 3 мм; горизонтальное распространение не учитывается)
Рекомендуемые алгоритмы лечения РШМ в зависимости от стадии представлены на рис. 1–8.
В табл. 3 представлены две классификации типов хирургических вмешательств при РШМ по Piver M.S., Rutledge F. (1974 г.) и Querleu D., Morrow С.P. (2017 г.).
Таблица 3. Классификация типов хирургических вмешательств при РШМ
|
Классификация Piver М. S, Rutledge F. (1974 г.) |
|||
|
I тип |
Экстрафасциальная экстирпация матки |
||
|
II тип |
Модифицированная расширенная экстирпация матки подразумевает удаление медиальной трети кардинальных, пузырно-маточных и крестцово-маточных связок, верхней трети влагалища и тазовую лимфаденэктомию. Мочеточники туннелируются, но не мобилизуются по нижнелатеральной полуокружности. Маточные сосуды пересекаются на уровне мочеточника |
||
|
III тип |
Расширенная экстирпация матки по Мейгсу подразумевает полное удаление кардинальных и крестцово-маточных связок от стенок таза, пузырно-маточной связки — от стенки мочевого пузыря, верхней трети влагалища и тазовую лимфаденэктомию. Мочеточники мобилизуются полностью до места впадения в мочевой пузырь. Маточные сосуды пересекаются у места отхождения от внутренних подвздошных сосудов |
||
|
IV тип |
Расширенная экстирпация матки включает пересечение верхней пузырной артерии, удаление периуретеральной клетчатки и до 3/4 влагалища |
||
|
V тип |
Комбинированная расширенная экстирпация матки подразумевает удаление дистальных отделов мочеточников и резекцию мочевого пузыря |
||
|
Классификация Querleu D., Morrow С.P. (2017 г.) |
|||
|
Тип |
Латеральный параметрий |
Передний параметрий |
Задний параметрий |
|
А |
Середина расстояния между шейкой маткии мочеточником (мочеточник не мобилизуется) |
Минимально |
Минимально |
|
В1 |
На уровне мочеточника (мочеточник мобилизуется от латерального параметрия) |
Частичное удаление |
Частичное удаление |
|
В2 |
В1 + парацервикальные лимфоузлы |
В1 |
В1 |
|
Тип |
Латеральный параметрий |
Передний параметрий |
Задний параметрий |
|
С1 |
Верхняя часть до стенки таза (латерально) и до уровня глубокой маточной вены (вертикально) |
Верхняя часть (над мочеточником) на уровне мочевого пузыря |
Верхняя часть до уровня прямой кишки (гипогастральные нервы сохраняются) |
|
С2 |
Полностью до стенки таза |
Полностью до мочевого пузыря |
Полностью до крестца |
|
D1 |
Удаление внутренних подвздошных сосудов и клетчатки за ними |
С2 |
С2 |
|
D2 |
Резекция примыкающих фасциальных и мышечных структур стенки таза |
С2 |
С2 |
Выбор метода лечения РШМ определяется индивидуально и зависит от распространенности опухолевого процесса и тяжести сопутствующей соматической патологии.
Адекватным объемом хирургического вмешательства при РШМ IA1 стадии в отсутствие эмболов в лимфатических щелях является конизация шейки матки с выскабливанием оставшейся части цервикального канала и, по показаниям, полости матки. При отсутствии опухоли в крае резекции и соскобе из оставшейся части цервикального канала выполнение экстирпации матки нецелесообразно, поскольку не улучшает результаты лечения.
При обнаружении в краях резекции шейки матки или в соскобе из оставшейся части цервикального канала дисплазии (CIN III) или клеток рака необходимо провести повторную конизацию. При невозможности реконизации проводится лечение как при IB1 стадии.
При наличии лимфоваскулярной инвазии и отсутствии необходимости сохранения детородной функции показана экстирпация матки (операция I типа) и тазовая лимфодис-секция (возможна БСЛУ). У молодых пациенток (до 45 лет) при удалении матки возможно сохранить функцию яичников, выполнив их транспозицию.
При наличии лимфоваскулярной инвазии и необходимости сохранения детородной функции показана конизация шейки матки с выскабливанием оставшейся части цервикального канала или трахелэктомия (операция I типа) и тазовая лимфодиссекция (возможна БСЛУ).
-
3.2. IA2 стадия (инвазия > 3 мм и ≤ 5 мм, горизонтальное распространение не учитывается)
-
3.3. IB и IIA стадии
Основным хирургическим доступом является лапаротомный. Если пациентка настаивает на лапароскопическом доступе, она должна быть предупреждена о рисках ухудшения отдаленных онкологических результатов лечения при выполнении расширенной экстирпации матки лапароскопическим доступом.
Показано выполнение экстирпации матки (операции I типа) и тазовой лимфодис-секции (возможна БСЛУ). У молодых пациенток (до 45 лет) возможно сохранить функцию яичников, выполнив их транспозицию.
Молодым пациенткам, желающим сохранить фертильность, независимо от лимфоваскулярной инвазии и при отсутствии метастазов в тазовых лимфатических узлах, может быть предложена трахелэктомия (тип I).
У молодых больных, желающих сохранить фертильность, возможно выполнение ультраконсервативного лечения в объеме ампутации шейки матки, выскабливания оставшейся части цервикального канала (отсутствие опухоли в крае резекции и соскобе из оставшейся части цервикального канала) и тазовой лимфодиссекции (возможна БСЛУ).
При противопоказаниях к хирургическому лечению или по желанию больной может проводиться ЛТ.
В зависимости от распространенности опухолевого процесса и размера первичной опухоли при IB и IIA стадиях РШМ возможно хирургическое лечение, ЛТ или химиолучевое лечение. При планировании лечения больных с IB и IIА стадиями РШМ следует избегать комбинации хирургического лечения и ЛТ из-за увеличения частоты осложнений.
Стандартным хирургическим доступом при IB и IIA стадиях РШМ является лапаротомный.
При IB (IB1–IB3) и IIA (IIA1–IIA2) стадиях РШМ при наличии метастазов в тазовых лимфатических узлах рекомендовано выполнение парааортальной лимфодиссекции. При выполнении парааортальной лимфодиссекции показано удаление узлов как минимум до уровня нижней брыжеечной артерии. По показаниям (данные ревизии или лучевых методов диагностики) возможно выполнение поясничной лимфодиссекции до уровня почечных сосудов. При этом удаление матки с первичной опухолью не обязательно (прерванная гистерэктомия) ввиду необходимости проведения послеоперационной ХЛТ.
По данным проспективных исследований при наличии метастазов в тазовых лимфатических узлах с одной стороны и отсутствии метастатического поражения поясничных лимфатических узлов возможно выполнение расширенной параметрэктомии (тип D1) на стороне поражения. Выполнение данного вмешательства возможно только группой квалифицированных специалистов, имеющих соответствующий опыт. При выполнении расширенной параметрэктомии адъювантная ЛТ не показана. Возможно проведение адъювантной ХТ (табл. 5).
-
3.3.1. IB1 стадии (инвазия > 5 мм; опухоль ≤ 2 см)
-
3.3.2. IB2 (опухоль > 2 см и ≤ 4 см) и IIА1 стадии (опухоль ≤ 4 см)
При IB1 стадии РШМ рекомендована модифицированная расширенная экстирпация матки (операция типа II/В или С1). Основным хирургическим доступом является лапа-ротомный. У молодых пациенток (до 45 лет) при удалении матки возможно сохранить функцию яичников, выполнив их транспозицию.
Больным РШМ IB1 стадии (опухоль ≤ 2 см) при глубине инвазии менее 1 см без метастазов в тазовых лимфатических узлах возможно выполнение ультраконсервативного лечения в объеме операции типа I и тазовой лимфодиссекции.
При необходимости сохранить детородную функцию у больных РШМ IB1 стадии возможно выполнить расширенную трахелэктомию (тип II/В или С1). При размере опухоли ≤ 2 см, глубине инвазии менее 1 см возможно выполнение ультраконсервативного лечения в объеме трахелэктомии (операция I типа) и тазовой лимфодиссекции. Органосохраняющее лечение не выполняется при нейроэндокринном РШМ и аденокарциноме желудочного типа.
Адъювантное лечение проводится в зависимости от наличия факторов риска прогрессирования (см. раздел 3.3.2).
При невозможности хирургического лечения по медицинским показаниям или в связи с отказом пациентки рекомендуется ЛТ или ХЛТ по радикальной программе. Адъювантная гистерэктомия после ЛТ или ХЛТ по радикальной программе не рекомендуется.
Результаты хирургического лечения и ХЛТ сопоставимы по эффективности.
При IB2 и IIА1 стадиях рекомендована расширенная экстирпация матки (операция типа III/С2). У молодых пациенток (до 45 лет) при удалении матки возможно сохранить функцию яичников, выполнив их транспозицию.
При необходимости сохранить детородную функцию у больных РШМ IB2 стадии рекомендуется выполнять расширенную трахелэктомию (операция типа III/С2). Органосохраняющее лечение не выполняется при нейроэндокринном РШМ и аденокарциноме желудочного типа.
При невозможности хирургического лечения по медицинским показаниям или в связи с отказом пациентки рекомендуется ЛТ или ХЛТ по радикальной программе. Адъювантная гистерэктомия после ЛТ или ХЛТ по радикальной программе не рекомендуется.
Адъювантное лечение проводится в зависимости от наличия факторов риска прогрессирования (табл. 4).
Таблица 4. Факторы риска прогресcирования при РШМ
|
Высокий риск |
Промежуточный риск |
Низкий риск |
|
Присутствует хотя бы 1 из факторов |
Присутствуют хотя бы 2 из факторов |
Отсутствуют факторы либо присутствует только 1 из факторов |
|
Инвазия опухоли в параметрий |
Лимфоваскулярная инвазия |
Лимфоваскулярная инвазия |
|
Метастазы в подвздошных лимфоузлах |
Инвазия опухоли более чем на 1/3 толщины миометрия шейки матки |
Инвазия опухоли более чем на 1/3 толщины миометрия шейки матки |
|
Опухоль в крае резекции влагалища |
Размер первичной опухоли ≥ 4 см |
Размер первичной опухоли ≥ 4 см |
Группа высокого риска прогрессирования: показана адъювантная ХЛТ (дистанционная ЛТ + еженедельное введение цисплатина 40 мг/м 2 на протяжении ЛТ). При наличии опухоли в краях резекции влагалища показана адъювантная ХЛТ (ЛТ + еженедельное введение цисплатина 40 мг/м 2 и брахитерапия). При метастазах в поясничных лимфоузлах проводится облучение расширенным полем. При выполнении расширенной экстирпации матки (операции типа III/ С2) в случае обнаружения метастазов в тазовых лимфатических узлах и/или поражения параметриев в качестве адъювантного лечения возможно проведение адъювантной ХТ (табл. 5).
Группа промежуточного риска прогрессирования: в случае расширенной экстирпации матки (операции типа II/В или С1) показана адъювантная дистанционная ЛТ. После расширенной экстирпации матки (операция типа III/С2) по факторам промежуточного риска адъювантная дистанционная ЛТ не показана (только если выполнен адекватный объем хирургического вмешательства командой квалифицированных специалистов, имеющих соответствующий опыт).
Группа низкого риска прогрессирования: в случае расширенной экстирпации матки (операция типа II/В или С1) адъювантное лечение не показано.
-
3.3.3. IB3 и IIА2 стадии (опухоль > 4 см)
При планировании лечения больных с IB3 и IIА2 стадиями (опухоль > 4 см) следует избегать комбинации хирургического лечения и ЛТ. Возможны несколько вариантов лечения. • Стандартом лечения больных IB3 и IIА2 стадий РШМ является ХЛТ по радикальной программе: ЛТ+ еженедельное введение цисплатина в дозе 40 мг/м 2 (5–6 введений) на протяжении ЛТ и БТ. Проведение адъювантной гистерэктомии после ХЛТ не рекомендовано.
-
• Вторым возможным вариантом лечения больных IB3 и IIА2 стадий РШМ является неоадъювантная ХТ (табл. 5) с последующей расширенной экстирпацией матки (операция тип III/C2).
-
• Третьим возможным вариантом лечения больных IB3 и IIА2 стадий РШМ является расширенная экстирпация матки (операция тип III/С2). Следует помнить, что выполнение хирургического вмешательства на первом этапе у больных с опухолями более 4 см сопровождается необходимостью адъювантной ЛТ или ХЛТ. Хирургическое лечение больных IB3 и IIА2 стадий РШМ проводится по тем же принципам, что и при IB2 и IIА1 стадиях РШМ.
-
• Четвертым возможным вариантом лечения является проведение НАХТ (табл. 5) с последующим быстрым (через 1–2 недели после окончания ХТ) началом ХЛТ.
-
• У больных РШМ IB3 и IIА2 стадий стандартным хирургическим доступом является лапаротомия.
-
• У молодых пациенток (до 45 лет) возможно сохранить функцию яичников, выполнив их транспозицию.
-
• При наличии метастазов в тазовых лимфатических узлах обязательно выполняется поясничная лимфодиссекция. При этом удаление матки с первичной опухолью не обязательно (прерванная гистерэктомия) ввиду необходимости послеоперационной
ХЛТ. Однако следует помнить, что при размере первичной опухоли более 4 см выше риск ее неизлеченности при проведении ХЛТ по сравнению с опухолями менее 4 см.
-
• Больным с метастазами в поясничных лимфатических узлах адъювантная ЛТ проводится расширенным полем.
-
• При наличии метастазов в тазовых лимфатических узлах с одной стороны и отсутствии метастатического поражения поясничных лимфатических узлов возможно выполнение расширенной параметрэктомии (операция типа D1) на стороне поражения только группой квалифицированных специалистов, имеющих соответствующий опыт. После выполнения расширенной параметрэктомии (тип D1) адъювантная ЛТ не показана. Возможно проведение адъювантной ХТ (табл. 5).
-
• Адъювантное лечение проводится по тем же принципам, что и при IB2 и IIА1 стадиях РШМ (см. раздел 3.3.2).
-
• После выполнения расширенной экстирпации матки (операция типа III/С2) в случае выявления метастазов в тазовых лимфатических узлах и/или поражения параметриев по данным планового гистологического исследования в качестве адъювантного лечения возможно проведение адъювантной ХТ (табл. 5).
-
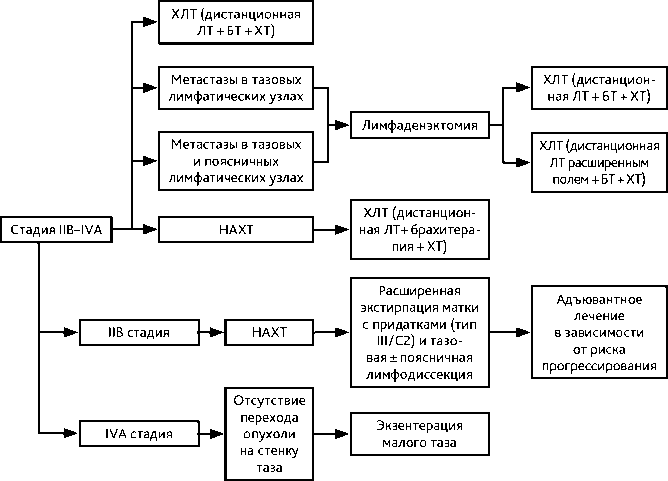
3.4. IIВ–IVA стадии
-
3.5. IVВ стадия
Согласно данным проспективных исследований, при необходимости сохранить детородную функцию у больных РШМ IB3 стадии (опухоль > 4 см) ряд авторов допускает возможность выполнения расширенной трахелэктомии (операция типа III/С2).
Рекомендованным стандартом является проведение ХЛТ по радикальной программе (сочетанная ЛТ + еженедельное введение цисплатина 40 мг/м 2 на протяжении дистанционной ЛТ). ЛТ по радикальной программе должна проводиться не более 7–8 недель. Увеличение продолжительности ЛТ терапии снижает выживаемость больных.
Больным с IIВ–IVA стадиями РШМ возможно проведение НАХТ (табл. 5) с последующим началом самостоятельной ХЛТ, в соответствии с принципами проведения данного вида лечения. ХЛТ терапия должна быть начата в минимально возможные сроки после завершения этапа ХТ (оптимально — до 7 дней). Проведение адъювантной ХТ — после ХЛТ.
Ряд авторов при РШМ IIB стадии допускают возможность хирургического вмешательства в объеме расширенной экстирпации матки (операция типа III/C2) на первом этапе или после неоадъювантной ХТ (2–3 курса). Это позволяет избежать адъювантную ЛТ у пациенток без факторов высокого риска прогрессирования (см. раздел 3.3.2). Недостатками выполнения операции на первом этапе является риск осложнений, связанных с комбинированным или комплексным лечением.
При метастатическом поражении тазовых и/ или поясничных лимфатических узлов возможно выполнение лимфаденэктомии с последующей ХЛТ по радикальной программе. При поражении поясничных лимфатических узлов облучение проводится расширенным полем.
У части больных без перехода опухоли на стенку таза альтернативой ХЛТ может служить экзентерация малого таза (особенно при наличии свищей). Выполнение этого вмешательства возможно первичным больным IVA стадии РШМ.
Рекомендуется системная ХТ (см. раздел 3.7). Вопрос о ЛТ отдельных метастатических очагов или облучении малого таза (при ответе на ХТ) рассматривается индивидуально. В случае небольшого размера первичной опухоли при наличии изолированного метастатического поражения поясничных лимфатических узлов возможно выполнение лимфодиссекции с последующим проведением ХЛТ расширенным полем.
-
3.6. Прогрессирование РШМ
У пациенток с рецидивом в малом тазу (без отдаленных метастазов), которым ранее проводилась ЛТ, возможны следующие варианты лечения:
-
• экстирпация матки возможна только у больных после ЛТ/ХЛТ по радикальной программе, если размер рецидивной опухоли в шейке матки не превышает 2 см;
-
• экзентерация малого таза (вопрос об экзентерации малого таза должен решаться до проведения ХТ).
-
• ХТ/таргетная терапия/иммунотерапия;
-
• симптоматическая терапия.
У пациенток с рецидивом в малом тазу (без отдаленных метастазов), которым ранее не проводилась ЛТ, возможны следующие варианты лечения:
-
• ХЛТ;
-
• экзентерация малого таза.
-
3.7. Химиотерапия РШМ
Наибольшей эффективностью в I линии лечения обладает комбинация с использованием препаратов платины, паклитаксела и бевацизумаба.
При экспрессии PDL1 (CPS ≥ 1) или MSI-H/dMMR в опухоли к ХТ в сочетании или без бе-вацизумаба рекомендовано добавить пембролизумаб.
Рекомендуется проведение 6 циклов ХТ в адъювантном режиме или в I линии, либо до прогрессирования или непереносимой токсичности. Пембролизумаб и/или беваци-зумаб возможно проводить до 35 циклов или до прогрессирования, если оно наступит ранее. С неоадъювантной целью рекомендуется проводить 2–3 курса ХТ.
Рекомендуемые режимы лекарственной РШМ терапии представлены в табл. 5.
Таблица 5. Рекомендуемые режимы химиотерапии рака шейки матки
Химиолучевая терапия
-
• Цисплатин 40 мг/м 2 в/в еженедельно на фоне дистанционной ЛТ, 6 введений
Неоадъювантная/адъювантная химиотерапия
-
• Паклитаксел 175 мг/м² в/в в 1-й день + цисплатин 75 мг/м² в/в в 1-й день, каждые 3 нед.
-
• Паклитаксел 175 мг/м²в/в в 1-й день + карбоплатин AUC5–6 в/в в 1-й день, каждые 3 нед.
-
• Паклитаксел 80 мг/м 2 в/в еженедельно + карбоплатин AUC2 в/в еженедельно, 6 введений для пациенток, получающих индукционную ХТ перед проведением самостоятельной ХЛТ
Химиотерапия I линии
-
• Паклитаксел 175 мг/м² в/в в 1-й день + цисплатин 75 мг/м² в/в в 1-й день + бевацизумаб 1 7,5–15 мг/кг в/в в 1-й день + пембролизумаб-200 мг в/в в 1-й день, каждые 3 нед. (при экспрессии PD-L1 CPS ≥ 1)
-
• Паклитаксел 175 мг/м² в/в в 1-й день + цисплатин 75 мг/м² в/в в 1-й день + пембролизумаб 200 мг в/в в 1-й день, каждые 3 нед. (при экспрессии PD-L1 CPS ≥ 1)
-
• Паклитаксел 175 мг/м² в/в в 1-й день + карбоплатин AUC5–6 в/в в 1-й день + бевацизумаб 1 7,5–15 мг/кг в/в в 1-й день + пембролизумаб-200 мг в/в в 1-й день, каждые 3 нед. (при экспрессии PD-L1 CPS ≥ 1)
-
• Паклитаксел 175 мг/м² в/в в 1-й день + карбоплатин AUC5–6 в/в в 1-йдень + пембролизумаб 200 мг в/в в 1-й день, каждые 3 нед. (при экспрессии PD-L1 CPS ≥ 1)
-
• Паклитаксел 175 мг/м² в/в в 1-й день + цисплатин 75 мг/м² в/в в 1-й день + бевацизумаб 1 7,5–15 мг/кг в/в в 1-й день, каждые 3 нед.
-
• Паклитаксел 175 мг/м 2 в/в в 1-й день + карбоплатин AUC5–6 в/в в 1-й день + бевацизумаб 1 7,5–15 мг/кг в/в в 1-й день, каждые 3 нед.
-
• Паклитаксел 175 мг/м 2 в/в в 1-й день + топотекан 0,75 мг/м 2 в/в в 1–3-й дни + бевацизумаб 1
-
7,5–15 мг/кг в/в в 1-й день, каждые 3 нед.
-
• Паклитаксел 2 175 мг/м² в/в в 1-й день + цисплатин 2 75 мг/м² в/в в 1-й день, каждые 3 нед.
-
• Паклитаксел 60 мг/м 2 в/в в 1-й, 8-й, 15-й дни + карбоплатин AUC2 в/в в 1-й, 8-й, 15 дни, каждые
-
3 недели (для пациенток в ослабленном состоянии и пациенток пожилого возраста)
-
• Паклитаксел 2 175 мг/м 2 в/в в 1-й день + карбоплатин 2 AUC5–6 в/в в 1-й день, каждые 3 нед.
-
• Цисплатин 50 мг/м 2 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни, каждые 3 нед.
-
• Паклитаксел 175 мг/м 2 в/в в 1-й день + топотекан 0,75 мг/м 2 в/в в 1–3-й дни, каждые 3 нед.
-
• Цисплатин 75 мг/м² в/в в 1-й день, каждые 3 нед.
-
• Карбоплатин AUC5–6 в/в в 1-й день, каждые 3 нед.
-
• Этопозид 100 мг/м 2 в/в в 1–3-й дни + цисплатин 75 мг/м² в/в в 1-й день, каждые 3 нед. (режим предпочтителен для мелкоклеточного РШМ)
Химиотерапия II линии3
-
• Пембролизумаб 200 мг в/в в 1-й день каждые 3 нед. или 400 мг в/в в 1-й день каждые 42 дня
(при экспрессии PD-L1 CPS ≥ 1 или MSI-H/dMMR в опухоли)
-
• Трастузумаб дерукстекан 5,4 мг /кг в/ в в 1-й день каждые 3 нед.
(при HER2-положительном статусе)
-
• Иринотекан 125 мг/м 2 в/в в 1-й, 8-й, 15-й дни, каждые 4 нед.
-
• Гемцитабин 800–1000 мг/м 2 в/в в 1-й, 8-й, 15-й дни, каждые 3 нед.
-
• Доцетаксел 75 мг/м 2 в/в в 1-й день, каждые 3 нед.
-
• Капецитабин 2500 мг/м 2 внутрь в 1–14-й дни, каждые 3 нед.
-
• Бевацизумаб 7,5–15 мг/кг в/в в 1-й день, каждые 3 нед.
-
• Топотекан 1,5 мг/м 2 в/в в 1–5-й дни, каждые 3–4 нед.
-
• Ифосфамид 1200–1500 мг/м 2 в/в в 1–5-й дни (+ месна 1200–1500 мг/м 2 в/в в 1–5-й дни) 4 , каждые 3 нед.
-
• Винорелбин 30 мг/м 2 в/в в 1-й и 8-й дни, каждые 3 нед.
-
• Паклитаксел 2 175 мг/м 2 в/в в 1-й день + карбоплатин 2 AUC5 в/в в 1-й день или цисплатин 50–75 мг/м 2 в/в в 1-й день каждые 3 нед. (при рецидиве в сроки > 6 мес. от окончания предшествующего лечения, включавшего производные платины)
-
• Паклитаксел 3 175 мг/м 2 в/в в 1-й день + карбоплатин 3 AUC5 в/в в 1-й день или цисплатин 50–75 мг/м 2 в/в в 1-й день каждые 3 нед. (при рецидиве в сроки > 6 мес. от окончания предшествующего лечения, включавшего производные платины)
-
• Цисплатин 50 мг/м 2 в/в в 1-й день, каждые 3 нед. (при рецидиве в сроки > 6 мес. от окончания предшествующего лечения, включавшего производные платины)
-
• Карбоплатин AUC5 в/в в 1-й день, каждые 3 нед. (при рецидиве в сроки > 6 мес. от окончания предшествующего лечения, включавшего производные платины)
как промежуточный; у пациенток с доказанной опухолевой инвазией мочевого пузыря и/или толстой кишки риск формирования свищей на фоне применения бевацизумаба оценивается как крайне высокий.
-
• Пациенткам с низким риском формирования свищей показано применение бева-цизумаба в составе I линии ХТ; при высоком риске применение бевацизумаба про-типоказазано; при промежуточном риске назначение бевацизумаба необходимо обсуждать индивидуально с учетом пожеланий пациентки.
-
• При высоком риске формирования свищей на фоне применения бевацизумаба целесообразно начинать проведение ХТ без включения данного агента, с проведе-нением повторной оценки наличия опухолевой инвазии мочевого пузыря и кишки при достижении объективного ответа после 2–3 курсов лечения.
-
• Терапию бевацизумабом, в случае назначения этого препарата, следует проводить до прогрессирования заболевания или непереносимой токсичности.
-
• Оптимальный режим дозирования бевацизумаба при РШМ неизвествен и может составлять 7,5–15 мг/кг массы тела.
-
3.8. Лучевая терапия РШМ
Проводится конформная ЛТ с оконтуриванием объемов с использованием МРТ и/или ПЭТ КТ изображений. Топометрия проводится с контролем наполнения мочевого пузыря с целью минимизации движения матки и оттеснения кишечника. Используется применение объема ITV. Рекомендуемая суммарная доза конформной ЛТ — 45 Гр/25 фракций или 46 Гр/23 фракций IMRT/VMAT.
ХТ основана на применении цисплатина 40 мг/м 2 (5–6 введений). При противопоказаниях к ХТ проводится самостоятельная ЛТ.
БТ рекомендуется под контролем МРТ визуализации с аппликатором in situ . Альтернативный контроль визуализации осуществляется с помощью КТ и УЗИ. Объем мишени для БТ: GTV-T res, CTV-HR, GTV-LR. Используются аппликаторы тандем + кольцо/овоиды или комбинированные внутриполостной/иглы. Дозы при БТ 40–45 Гр EQD2. Суммарно ЛТ + БТ 85–95 Гр EQD2 (D90) — 45 Гр от дистанционной ЛТ на CTV-T HR. CTV-T IR до 60 Гр и GTV-T res до 90 Гр (D98).
Фракционирование HDR за 3–4 фракции с интервалом 6–8 часов.
При больших размерах опухоли БТ должна проводиться в течение 1–2 недель после окончания ЛТ/ХЛТ.
Прерывание курса сочетанной ЛТ не допускается. Продолжительность курса не должна превышать 7–8 недель.
ЛТ может проводиться в послеоперационном периоде (адъювантно) и выполняется через 21–28 дней после операции. Сокращение объема ЛТ малого таза за счет исключения общих подвздошных лимфатических узлов показано при T1b1 стадии РШМ и факторах промежуточного риска прогрессирования.
Оценка эффекта ЛТ/ХЛТ проводится не ранее чем через 3 мес. после окончания лечения, желательно с помощью МРТ.
Оптимальным вариантом проведения радиомодифкации на фоне проведения химио-лучевой терапии является введение цисплатина в дозе 40 мг/м 2 еженедельно на период проведения дистанционной ЛТ терапии (5–6 введений цисплатина за весь курс лечения).
Проведение радиомодификации цисплатином доказанно улучшает непосредственные и отдаленные результаты лечения местно-распространенного РШМ при условии проведения не менее 4 введений препарата на фоне облучения.
Введение цисплатина в процессе ХЛТ требует регулярного (перед каждым введением) контроля показателей общего (Hb, тромбоциты, АЧН) и биохимического (концентрация креатинина и электролитов) анализов крови.
Проведение очередного введения цисплатина возможно при АЧН > 1,0 × 10 9 / л и количестве тромблцитов > 75,0 × 10 9 /л; снижение концентрации Hb < 80 г/л не должно рассматриваться в качестве противопоказания к очередному введению цисплатина, но может потребовать коррекции анемического синдрома (см. соответствующий раздел Практических рекомендаций).
Нефротоксические эффекты цисплатина могут быть дозолимитирующими, вызывать необходимость редукции дозы, отсрочки и отмены очередных введений данного препарата, вследствие чего необходим регулярный контроль концентрации креатинина в плазме крови в течение всего периода применения препарата.
К известным модифицируемым факторам риска нефротоксичности цисплатина относятся электролитные нарушения, дегидратация, развитие тошноты и рвоты в процессе лечения.
Пациентам следует рекомендовать соблюдение усиленного питьевого режима на период всего проведения ХЛТ (не менее 2000 мл жидкости в сутки), контроль диуреза в дни введения цисплатина, ежедневный контроль массы тела.
Дополнительное введение сульфата магния в качестве нефропротектора непосредственно перед введением цисплатина позволяет снизить риск развития нефротоксичности в процессе лечения.
Следует учитывать, что цисплатин относится к высокоэметогенным препаратам, что требует проведения трехкомпонентной профилактики тошноты и рвоты на фоне лечения (см. Практические рекомендации RUSSCO по лечению и профилактике тошноты и рвоты).
При противопоказаниях к применению цисплатина альтернативно в целях радиомодификации возможно использование карбоплатина, однако в этом случае следует принимать во внимание большие риски развития гематологической токсичности.
4. РАК ШЕЙКИ МАТКИ И БЕРЕМЕННОСТЬ
Пациенткам, не желающим сохранять беременность, выполняют прерывание беременности и проводят лечение в соответствии со стандартами лечения дисплазий и РШМ. При выявлении РШМ на фоне беременности следует помнить, что прерывание беременности не влияет на прогноз заболевания, тогда как отсрочка в лечении может негативно отразиться на исходе заболевания.
При выявлении РШМ во время желанной беременности необходимо направлять пациенток в специализированные центры с возможностью ведения и лечения данной категории больных мультидисциплинарной командой онкологов, акушеров-гинекологов, неонатологов и возможностью интенсивной помощи недоношенным новорожденным. При диагностике РШМ во время беременности рекомендовано клиническое обследование, гистологическая верификация диагноза, выполнение УЗИ и/или МРТ (без использования контраста). Рентгенологические исследования и КТ во время беременности возможны только при экранировании матки. При подозрении на метастатическое поражение лимфатических узлов по данным объективных методов обследования необходима морфологическая верификация их метастатического поражения. Тактика лечения определяется в зависимости от стадии заболевания и срока беременности.
-
4.1. Внутриэпителиальное поражение плоского эпителия высокой степени (HSIL — high grаde squamous intraepithelial lesions) на фоне беременности
-
4.2. Микроинвазивный рак шейки матки на фоне беременности
-
4.2.1. При РШМ IА1 стадии без лимфоваскулярной инвазии (установленной в результате конизации во время беременности) в отсутствие опухоли в крае резекции больную
-
4.2.2. При РШМ IА1 стадии с лимфоваскулярной инвазией (установленной в результате конизации во время беременности) дальнейшая тактика аналогична таковой при РШМ IB1.
-
4.2.3. При РШМ IA2 стадии (установленной в результате конизации во время беременности) дальнейшая тактика аналогична таковой при РШМ IB1.
-
4.3. Инвазивный рак шейки матки на фоне беременности
Диагностика во время беременности: при выявлении HSIL по данным цитологического исследования мазков с шейки матки необходимо исключить инвазивный РШМ с помощью гистологического исследования (биопсия под контролем кольпоскопии, получают 2–5 биоптатов объемом 1–5 мм 3 ).
Ведение во время беременности: при гистологическом подтверждении диагноза HSIL беременность пролонгируют, кольпоскопию и цитологическое исследование мазков с шейки матки проводят в каждом триместре беременности.
Метод родоразрешения: через естественные родовые пути.
Ведение после родов: всем женщинам показан очередной осмотр через 2 месяца после родоразрешения для цитологического мониторинга и планирования конизации шейки матки. В случае персистенции HSIL необходима незамедлительная конизация шейки матки. При регрессе HSIL можно отложить конизацию на 3–4 мес., чтобы избежать осложнений, связанных с повышенной кровоточивостью из неполностью сформированной шейки матки после родов
Единственным показанием к конизации (широкой петлевой эксцизии) шейки матки во время беременности является микроинвазивный РШМ по данным биопсии. Конизация (широкая петлевая эксцизия) шейки матки позволяет разграничить больных микроинва-зивным раком, которых можно наблюдать, и больных, которым показано дальнейшее лечение. Конизация оправдана до 22 недель беременности.
можно наблюдать до завершения беременности, родоразрешение — через естественные родовые пути.
При установлении диагноза РШМ IB1 стадии в I триместре беременности лечение, как правило, начинают сразу по радикальной программе без сохранения беременности. Однако, если женщина настаивает на сохранении беременности, возможно пролонгировать ее до II триместра, когда выполняется тазовая лимфодиссекция (целесообразно до 22 недели беременности). Возможно оценить статус лимфатических узлов с помощью МРТ.
4.3.1. При РШМ IB1 стадии ≤ 2 см, без метастазов в тазовых лимфатических узлах возможно отложить лечение до момента родоразрешения. Радикальное хирургическое лечение (в соответствии с критериями хирургического лечения для РШМ соответствующих стадий, см. выше) выполняют одномоментно с операцией кесарева сечения. В случае отсутствия возможности выполнения одномоментной операции радикальное хирургическое лечение выполняют в ближайшие сроки после операции кесарева сечения. Рекомендуемый алгоритм лечения рака шейки матки IA2, IB1 < 2 см N0 стадий на фоне беременности представлен на рис. 9.
4.3.2. При РШМ IB2 стадии > 2 и ≤ 4 см, без метастазов в тазовых лимфатических рекомендовано проведение неоадъювантной ХТ, которую начинают после I триместра беременности (не ранее 14 недели беременности) и заканчивают за 3 недели до планируемой даты родоразрешения. Радикальное хирургическое лечение (в соответствии с критериями хирургического лечения для РШМ соответствующих стадий, см. выше) выполняют одномоментно с операцией кесарева сечения. В случае отсутствия возможности выполнения одномоментной операции радикальное хирургическое лечение выполняют в ближайшие сроки после операции кесарева сечения. Рекомендуемый алгоритм лечения рака шейки матки IB1 > 2 см, IB2, IIA1, N0 стадий на фоне беременности представлен на рис. 10.
4.3.3. При РШМ IB3 > 4 см стадии единственным возможным способом сохранения беременности является проведение неоадъювантной ХТ с начала II триместра (не ранее 14 недели беременности). Радикальное хирургическое лечение (в соответствии с критериями хирургического лечения для РШМ соответствующих стадий, см. выше) выполняют одномоментно с операцией кесарева сечения. В случае отсутствия возможности выполнения одномоментной операции радикальное хирургическое лечение выполняют в ближайшие сроки после операции кесарева сечения.
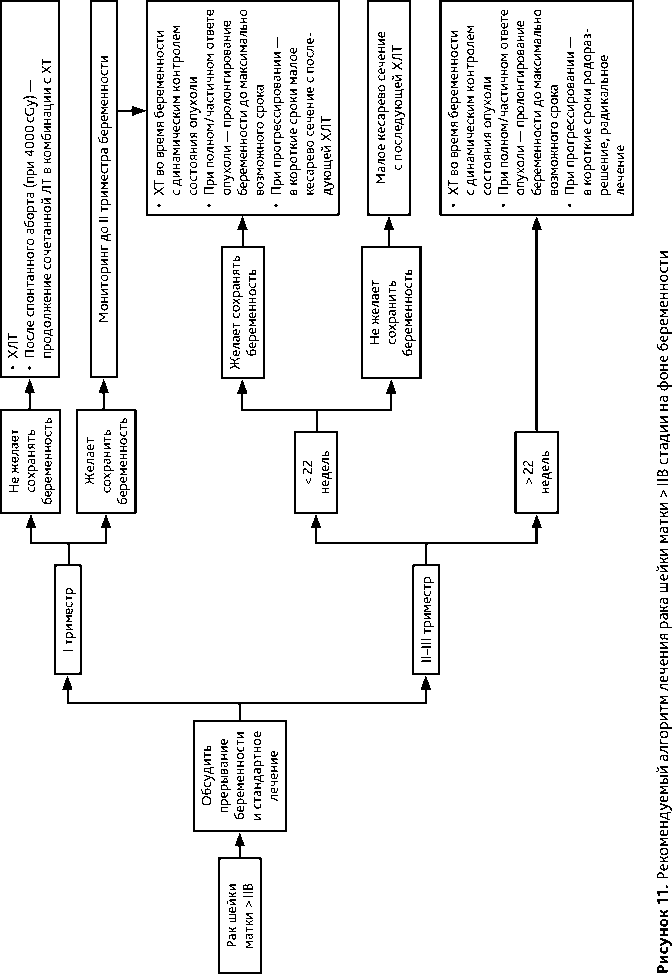
4.3.4. При РШМ ≥ IIB стадий показана ХЛТ. Если диагноз установлен на сроке беременности, когда плод жизнеспособен (после 22 недели), то выполняется кесарево сечение и через 2–3 недели назначается ХЛТ, в индивидуальных случаях возможно рассмотреть вопрос
5. ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
о неоадъювантной ХТ на фоне пролонгирования беременности. Рекомендуемый алгоритм лечения рака шейки матки > IIB стадии на фоне беременности представлен на рис. 11.
В качестве неоадъювантной ХТ рекомендуется применять режимы на основе препаратов платины. Наиболее часто применяется режим цисплатин 75 мг/м 2 или карбоплатин AUC5–6 и паклитаксел 175 мг/м 2 с интервалом 3 недели. ХТ следует закончить за 3 недели до планируемой даты родоразрешения. Родоразрешение выполняется путем кесарева сечения.
-
• Физикальное обследование, в том числе гинекологический осмотр — каждые 3 мес. в течение первых 2 лет, каждые 6 мес. — в течение 3-го и 4-го года, затем — ежегодно.
-
• В случае подозрения на рецидив рекомендована биопсия с гистологическим исследованием.
-
• КТ / МРТ органов малого таза, брюшной полости с в /в контрастированием / УЗИ
брюшной полости, малого таза и забрюшинного пространства и определение уровня SCC (при плоскоклеточном раке) при исходно повышенном маркере — каждые 3 мес. в течение первых 2 лет, каждые 6 мес. — в течение 3-го и 4-го года, затем — ежегодно.
-
• КТ грудной клетки — ежегодно.
-
• ПЭТ-КТ — по показаниям.
Наблюдение
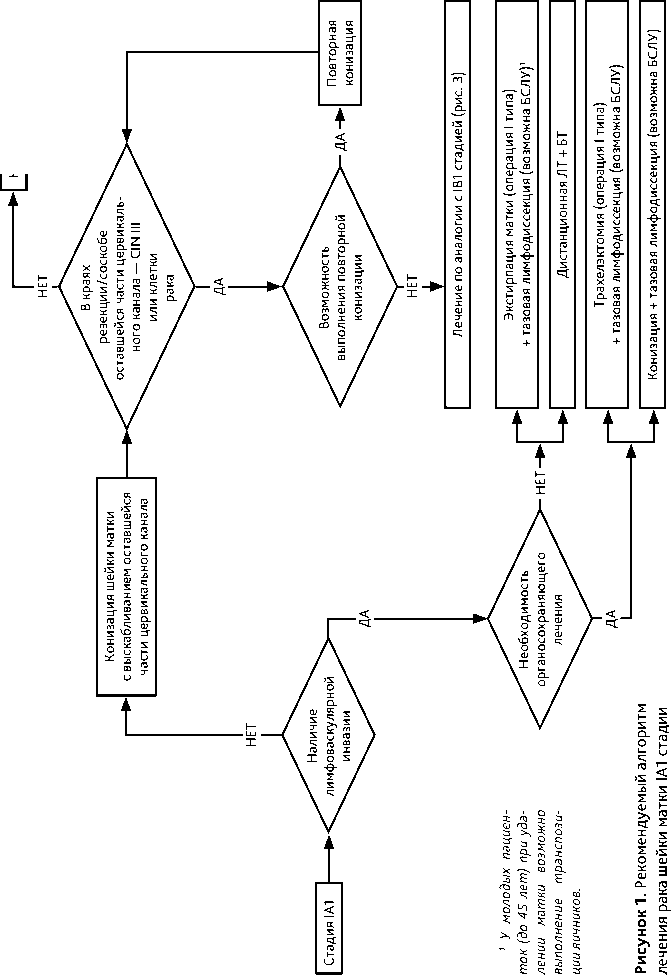
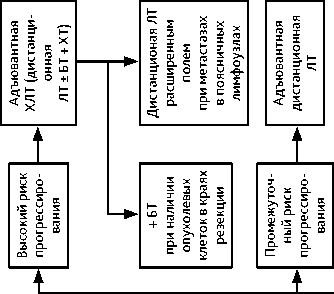
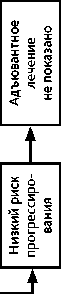
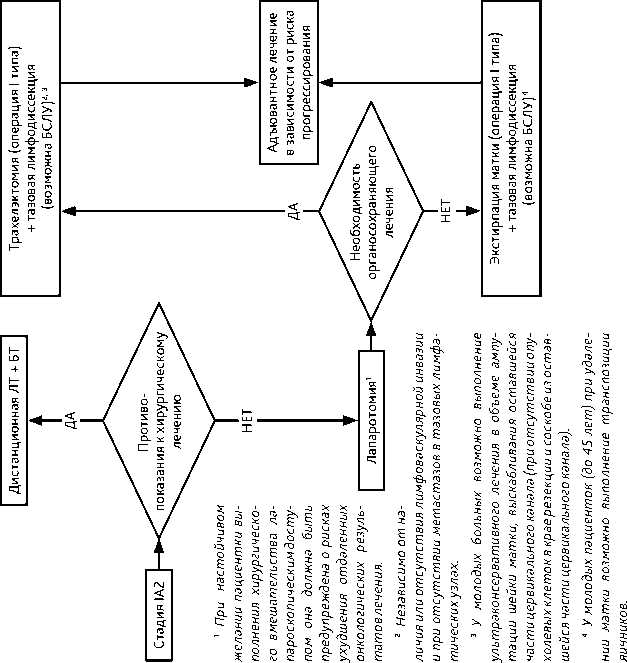
Рисунок 2. Рекомендуемый алгоритм лечения рака шейки матки IA2 стадии
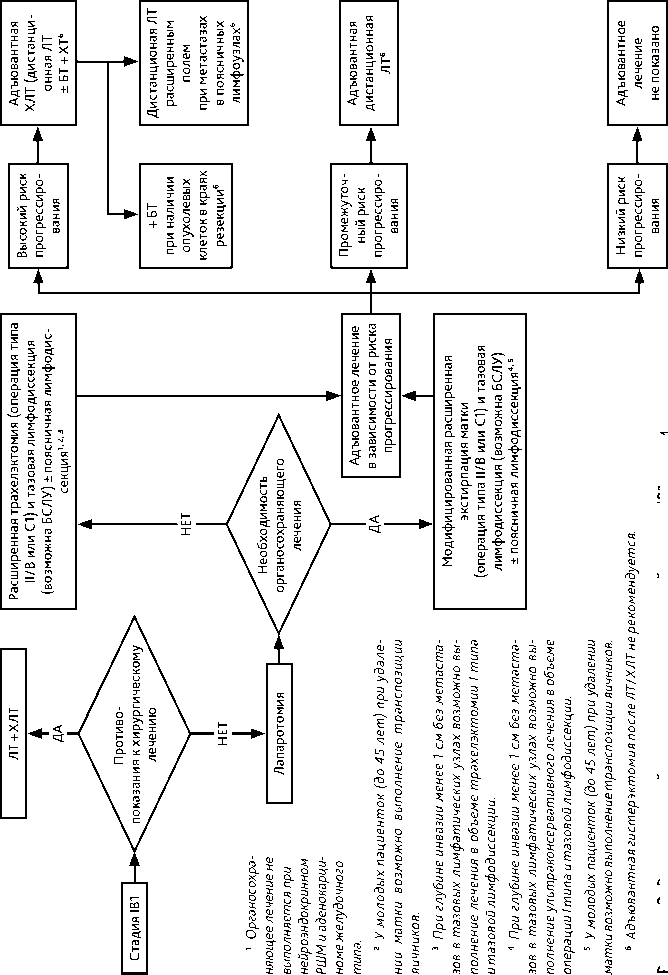
Рисунок 3. Рекомендуемый алгоритм лечения рака шейки матки IB1 стадии
Стадия IВ2 и IIA1
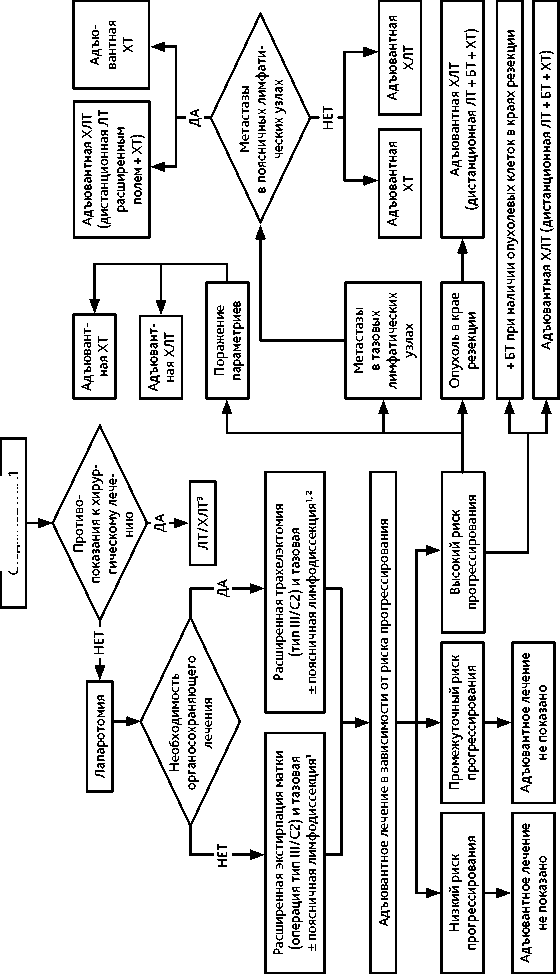
1 У молодых пациенток (до 45 лет) при удалении матки возможно выполнение транспозиции яичников. Рисунок 4. Рекомендуемый 2 Органосохраняющее лечение не выполняется при нейроэндокринном РШМ и аденокарциноме желудочного типа.
алгоритм лечения рака шейки 3 Адъювантная гистерэктомия после ЛТ или ХЛТ не рекомендуется. матки IB2 стадии При планировании лечения следует избегать комбинации хирургического лечения и ЛТ.
Стадия IВ3 и IIA2
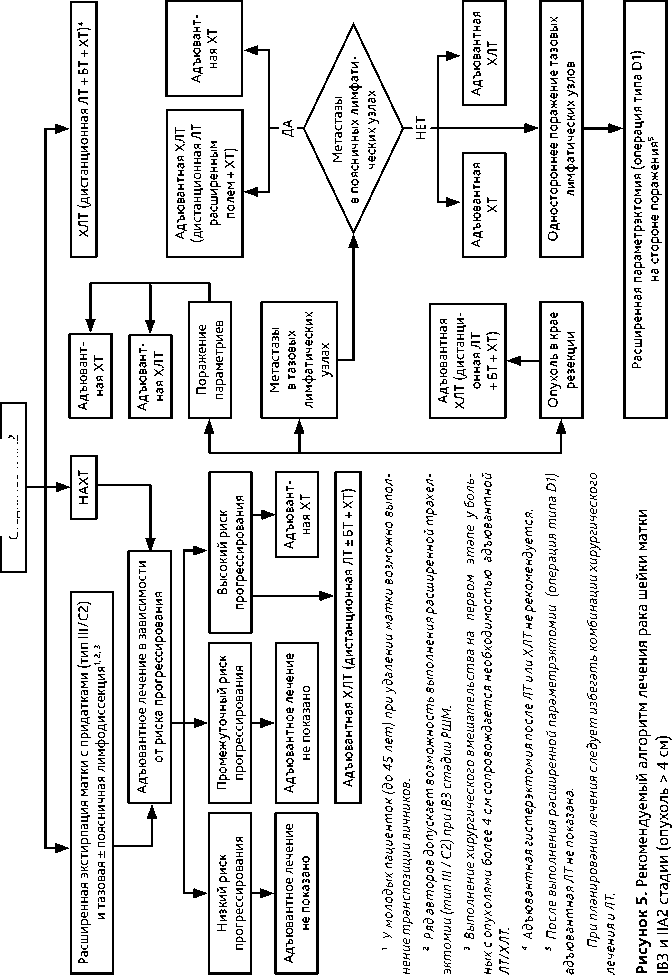
При планировании лечения следует избегать комбинации хирургического лечения и ЛТ.
Рисунок 6. Рекомендуемый алгоритм лечения рака шейки матки IIВ–IVA стадии
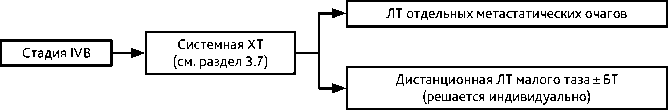
Рисунок 7. Рекомендуемый алгоритм лечения рака шейки матки IVВ стадии
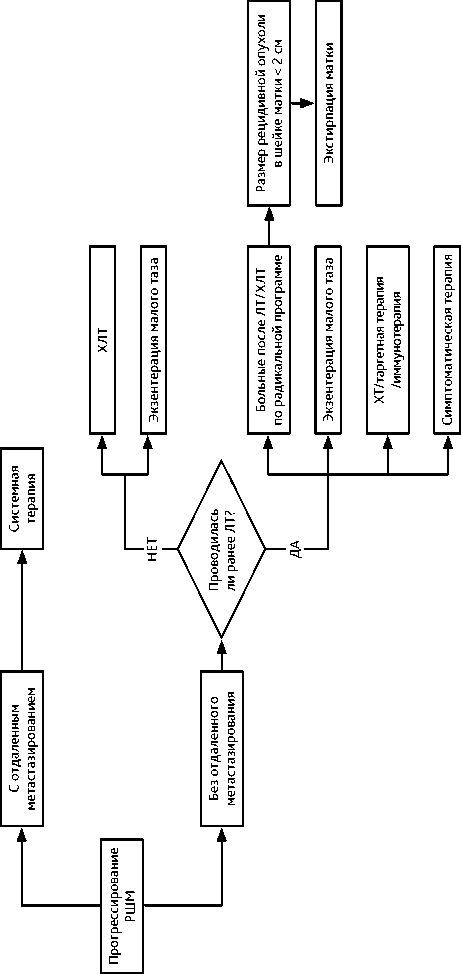
Рисунок 8. Рекомендуемый алгоритм лечения рака шейки матки при прогрессировании
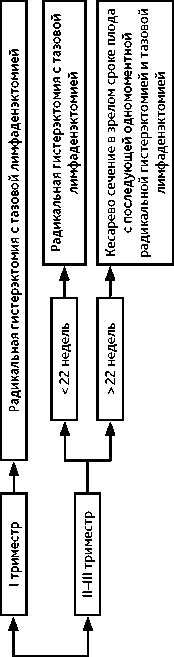

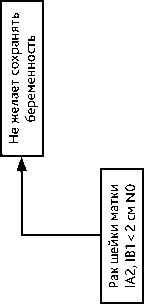

Рисунок 9. Рекомендуемый алгоритм лечения рака шейки матки IA2, IB1 < 2 см N0 стадий на фоне беременности
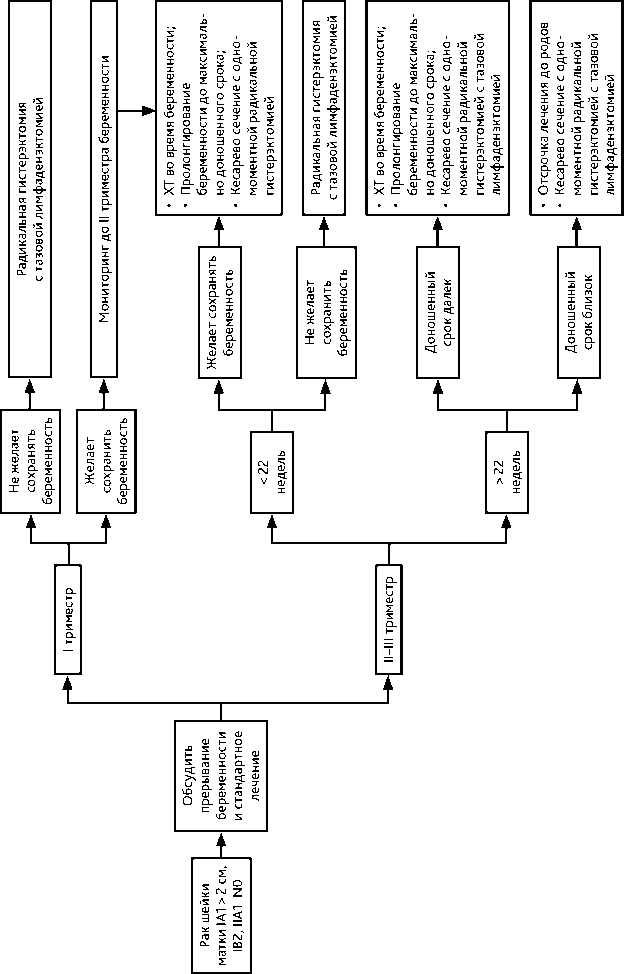
Рисунок 10. Рекомендуемый алгоритм лечения рака шейки матки IB1 > 2 см, IB2, IIA1, N0 стадий на фоне беременности
| том /vol. 14(3s2) 2024
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


