Рак шейки матки стадий IB2-IIIB: неоадъювантная химиотерапия, радикальные операции и выживаемость пациенток
Автор: Оводенко Дмитрии Леонидович, Хабас Григории Николаевич, Крейнина Юлия Михайловна, Серегин Александр Александрович, Алешикова Ольга Ивановна, Ашрафян Лев Андреевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 3 т.20, 2021 года.
Бесплатный доступ
Цель исследования - оценить результаты 5-летней безрецидивной выживаемости больных раком шейки матки стадий IB2-IIIB, пролеченных с применением неоадъювантной химиотерапии и радикальных операций. Материал и методы. Исследованы отдаленные результаты лечения 173 пациенток с морфологически верифицированным плоскоклеточным раком шейки матки стадий IB2, IIB и IIIB. Больным проводили неоадъювантную химиотерапию с применением внутривенной инфузии цитостатиков (n=106) и внутриартериального их введения в сочетании с эмболизацией артерий опухоли (n=67). При достижении резектабельности выполняли радикальные операции. Оценивали результаты безрецидивной выживаемости. Результаты. Радикальные операции после химиотерапии выполнены 160 (92,5 %) пациенткам. У 55 (34,4 %) больных не проводили адъювантную лучевую терапию. Показатель 5-летней безрецидивной выживаемости составил 79,6 %. Заключение. Неоадъювантная химиотерапия при раке шейки матки стадий IB2-IIIB позволяет в ряде случаев достигнуть условий для выполнения радикальных операций. Применение комплексного лечения, включающего неоадъювантную химиотерапию с последующей радикальной операцией, может улучшить показатели безрецидивной выживаемости.
Рак шейки матки, неоадъювантная химиотерапия, радикальная гистерэктомия, безрецидивная выживаемость, химиоэмболизация
Короткий адрес: https://sciup.org/140254512
IDR: 140254512 | УДК: 618.146-006.6-089:615.28 | DOI: 10.21294/1814-4861-2021-20-3-82-89
Текст научной статьи Рак шейки матки стадий IB2-IIIB: неоадъювантная химиотерапия, радикальные операции и выживаемость пациенток
Несмотря на достижения в области профилактики, скрининга, диагностики и лечения при раке шейки матки (РШМ), данное заболевание остается одной из важных проблем здравоохранения, представляя собой четвертую по распространенности злокачественную опухоль среди женщин в мире [1–3]. По оценкам Международной федерации гинекологии и акушерства (FIGO), более 59 % случаев РШМ выявляются на стадиях IB2–IIIB [3–5]. До 1990-х гг. единственным возможным методом лечения таких пациенток оставалась лучевая терапия, позволяющая достигать стойкой ремиссии в 21–55 % случаев при РШМ различных стадий [6, 7].
Исследование химиотерапии в лечении больных раком шейки матки IB2–IIIB стадий проводится с 1990-х гг. [8–10]. Показано, что введение цитостатиков параллельно с облучением таза позволяет улучшить результаты лечения пациенток. До настоящего времени большинство международных онкологических сообществ рекомендует проведение химиолучевой терапии при местнораспространенном раке шейки матки [11, 12]. Несмотря на улучшение результатов лечения по сравнению с сочетанной лучевой терапией, рецидивы после химиолучевого лечения отмечались в 41–68 % в зависимости от стадии РШМ [13, 14]. Кроме того, с улучшением результатов лечения стала повышаться частота побочных эффектов облучения [15].
Несмотря на появляющиеся новые данные, в настоящее время стратегия лечения больных РШМ IB2–IIIB стадий окончательно не определена. Группа отечественных авторов [16, 17], а также ряд зарубежных исследователей [18, 19] показали улучшение результатов лечения при применении неоадъювантной химиотерапии (НАХТ) с последующими радикальными операциями. Другие исследования (EORTC 55994) выявили более высокие показатели общей и безрецидивной выживаемости при использовании химиолучевой терапии. Не вызывает сомнения, что применение химиотерапии в ряде случаев приводит к уменьшению локо-регионарного распространения опухоли. Ряд авторов указывает, что на эффект от лекарственного лечения могут влиять применяемые схемы химиотерапии, а также пути введения цитостатиков [20]. В некоторых исследованиях сообщается, что внутриартериальная НАХТ связана с более высокой частотой клинического ответа, чем внутривенная химиотерапия, что приводит к более благоприятному прогнозу выживаемости пациенток [21].
Таким образом, пока не определена роль неоадъювантной химиотерапии с последующими радикальными операциями и адъювантной лучевой терапией в лечении больных местнораспространенным РШМ. В исследованиях использовались разные схемы лекарственного воздействия, разные способы введения цитостатиков, хирургические доступы.
Цель исследования – оценить результаты 5-летней безрецидивной выживаемости больных раком шейки матки стадий IB2–IIIB, пролеченных с применением неоадъювантной химиотерапии и радикальных операций.
Материал и методы
Проведено ретроспективное нерандомизированное исследование, в котором проанализированы результаты лечения 173 пациенток. Критерием включения в исследование явился морфологически верифицированный плоскоклеточный рак шейки матки стадий IB2, IIB и IIIB, пациентки дали информированное согласие на участие в исследовании. Амбулаторное и стационарное лечение проводили в ФГБУ «РНЦРР» Минздрава России и в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в период с 2007 по 2017 г. Пациенткам выполняли неоадъювантную химиотерапию с последующими радикальными операциями и/или химиолучевой терапией. Всем больным проведено комплексное обследование с использованием общеклинических, лабораторных и лучевых методов диагностики.
Cтадирование рака шейки матки осуществляли на основании принятых классификаций (FIGO – классификации Международной федерации гинекологов и акушеров, TNM [22–24]). Стадию определяли согласно критериям FIGO 2009 г., поскольку все пациентки были пролечены до появления классификации FIGO 2018 г. В исследованных группах больных отсутствовали значимые различия в возрастном составе, по индексу массы тела и стадиям рака шейки матки. Всем больным проводили комплексное лечение, включающее НАХТ с последующей радикальной операцией и/или химиолучевой терапией. В зависимости от способа неоадъювантной химиотерапии выделены 2 подгруппы:
– подгруппа 1: 106 пациенток, которым проведено 2 курса химиотерапии с внутривенной инфузией цитостатиков: на фоне стандартной премедикации внутривенно капельно вводили паклитаксел в дозе 175 мг/м2. Затем внутривенно капельно вводили карбоплатин (AUC6). Повторный курс химиотерапии проводили по аналогичной схеме через 21 день;
– подгруппа 2: 67 больных, большинство из которых отмечали различной интенсивности кровянистые выделения из половых путей. После гемостатических и корригирующих мероприятий им проводили один курс химиотерапии по следующей схеме: первый день – внутривенная инфузия паклитаксела в дозе 175 мг/м2 и карбоплатина – ½ AUC 6 на фоне стандартной премедикации и применения антиэметиков. Второй день – внутриартериальное введение карбоплатина в дозе ½ AUC 6 в сочетании с эмболизацией маточных артерий.
Оценку эффективности химиотерапии осуществляли через 2 нед после введения цитостатиков. Основным критерием ответа опухоли на лекарственную терапию считали изменение объема новообразования шейки матки, определенного по данным клинического обследования, УЗИ и МРТ. Использовали критерии эффективности химиотерапии системы RECIST1.1 (Response Evaluation Criteria In Solid Tumors) (Eisenhauer E.A. et al., 2009).
При оценке непосредственной эффективности установлено, что при внутриартериальной химиотерапии максимальный эффект был получен после одного курса введения цитостатиков, поэтому от 2-го курса НАХТ решено было воздержаться, при достижении резектабельности пациенткам проводили радикальные операции. Критерием резектабельности считали достижение объема новообразований 50 см3 и менее.
Безусловно, оценка локо-регионарного распространения процесса и топографо-анатомических взаимоотношений органов и структур малого таза к моменту операции требует комплексного подхода, заключающегося в тщательном сопоставлении данных клинического обследования с информаци- ей, полученной при УЗИ и МРТ. Окончательное решение о резектабельности принимает хирург при клиническом обследовании пациентки. В нашем исследовании опухоли шейки матки, объем которых после химиотерапии превышал 50 см3, как правило, характеризовались распространением процесса на парацервикальную клетчатку. При опухолях более 50 см3 в большинстве случаев проводили химиолучевую терапию.
После неоадъювантной химиотерапии прооперированы 160 (92,4 %) пациенток. Операции выполняли в объеме расширенных экстирпаций матки III типа по классификации M.S. Piver et al. (Piver M.S. et al., 1974) или тип C2 по классификации Quelreu-Morrow (D. Querleu et al., 2009).
После получения патоморфологического описания операционного материала выявляли группы риска по развитию прогрессирования заболевания с использованием критериев RUSSCO [23, 24]. К группе высокого риска относили пациенток, у которых при гистологическом анализе выявляли опухолевые клетки в лимфатических узлах, параметриях или краях резекции операционных препаратов. В группу промежуточного риска включали больных, у которых наблюдались два фактора из следующих: размер первичной опухоли более 4 см, инвазия более 1/3 стромы шейки матки, метастазы в лимфатических и кровеносных сосудах. К группе низкого риска прогрессирования относили пациенток, у которых при гистологическом исследовании перечисленные выше факторы не выявлялись или выявлялся только один из них. Пациенткам, относившимся к группам высокого и промежуточного рисков, проводили адъювантную химиолучевую терапию, в группе низкого риска осуществляли динамическое наблюдение.
Показатели выживаемости рассчитывали с применением метода Каплана–Мейера. Безрецидивной выживаемостью считали период от даты констатации ремиссии до регистрации прогрессирования заболевания.
Результаты и обсуждение
В первой подгруппе больных, которым проводили 2 курса НАХТ с внутривенной инфузией цитостатиков, расширенные экстирпации матки выполнили в 101 (95,3 %) случае. Факторы высокого риска при патоморфологическом исследовании операционного материала были выявлены в 51 (50,5 %), промежуточного риска – в 18 (17,8 %), низкого риска – в 32 (31,7 %) случаях (табл. 2). Адъювантную химиолучевую терапию провели в 69 (68,3 %) наблюдениях. Без адъювантных методов лечение получили 32 (31,7 %) пациентки, из них РШМ IB2 стадии был диагностирован у 8 (66,6 %) больных, IIB – у 22 (32,8 %), IIIB – у 2 (11,8 %).
Во второй подгруппе (после одного курса НАХТ с внутриартериальным введением цитостатиков
Таблица 1/table 1
Распределение пациенток по стадиям рака шейки матки distribution of patients by stages of cervical cancer
|
Стадия РШМ/ Stage of cervical cancer |
Подгруппа 1/Subgroup 1 (n=106) |
Подгруппа 2/Subgroup 2 (n=67) |
Всего/Total (n=173) |
|
IB2 |
12 (11,3 %) |
17 (25,4 %) |
29 (16,8 %) |
|
IIB |
66 (62,3 %) |
34 (50,7 %) |
100 (57,8 %) |
IIIB 28 (26,4 %) 16 (23,9 %) 44 (25,4 %)
Таблица 2/table 2
Факторы риска прогрессирования РШМ у первой подгруппы больных
Risk factors for progression in the first subgroup of patients with cervical cancer
|
Параметр/Parameter |
IB2 (n=12) |
IIB (n=64) |
IIIB (n=25) |
Всего/Total (n=101) |
|
Метастазы в лимфатических узлах/Lymph node metastases |
3 (25,0 %) |
22 (34,4 %) |
11 (44,0 %) |
36 (35,6 %) |
|
Поражение параметриев/Parametrial invasion |
1 (8,3 %) |
5 (7,8 %) |
9 (36,0 %) |
15 (14,9 %) |
|
Опухоль в краях резекции влагалища/ Positive vaginal resection margins |
– |
– |
– |
– |
|
Инвазия опухоли более чем на 1/3 толщины шейки матки/ Tumor invasion to more than 1/3 the thickness of the cervix |
2 (16,7 %) |
2 (3,1 %) |
3 (12,0 %) |
7 (6,9 %) |
|
Инвазия лимфатических и кровеносных сосудов/ Lymphatic and blood vessel invasion |
4 (33,3 %) |
12 (18,8 %) |
10 (40,0 %) |
26 (25,7 %) |
|
Размер опухоли ≥4 см/Tumor size ≥4 cm |
2 (16,7 %) |
2 (3,1 %) |
– |
4 (4,0 %) |
Таблица 3/table 3
Факторы риска прогрессирования у прооперированных пациенток второй подгруппы Risk factors for progression in patients of the second subgroup
Таким образом, у 55 (34,4 %) больных РШМ IB2–IIIB стадии, прооперированных после неоадъювантной химиотерапии, при патоморфоло-гическом исследовании не определялись факторы высокого и среднего риска, в связи с чем им не про- водили адъювантное облучение малого таза. Частота факторов риска была примерно одинаковой среди больных, при лечении которых использовали различные пути введения цитостатиков.
Медиана наблюдения составила 66 мес, максимальный срок наблюдения – 144 мес. В первой подгруппе больных раком шейки матки IB2–IIIB стадии получены следующие результаты; при РШМ IB2 стадии рецидив заболевания отмечен в 1 (8,3 %) случае, при IIB стадии – в 9 (13,6 %), при IIIB – в 5 (17,9 %) наблюдениях. Кумулятивная безрецидивная выживаемость составила 90,0 %, 82,1 % и 74,2 % соответственно (рис. 1). У больных второй подгруппы при РШМ IB2 стадии рецидив заболевания развился в 1 (5,9 %) случае, при IIB стадии – в 4 (11,8 %), при IIIB стадии – в 3 (18,8 %) наблюдениях. У 5 больных рецидивы возникали
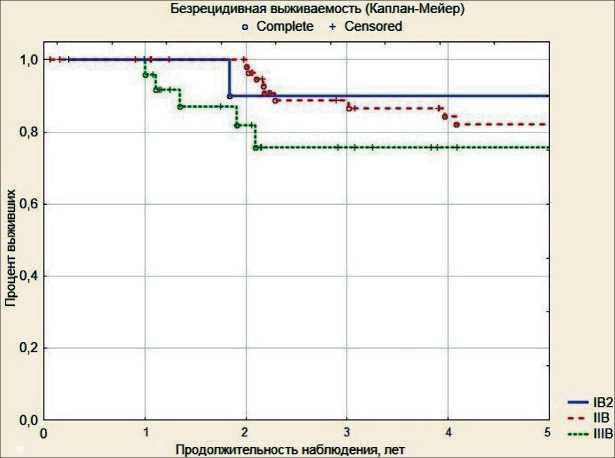
Рис. 1. Безрецидивная выживаемость больных раком шейки матки первой подгруппы
-
Fig. 1. Disease-free survival of cervical cancer patients of the first subgroup
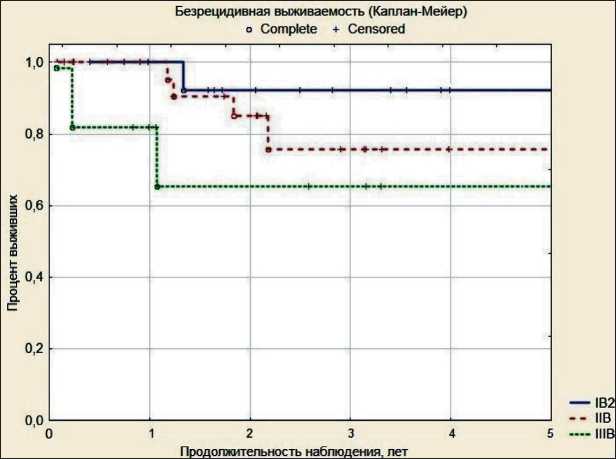
Риc. 2. Безрецидивная выживаемость во второй подгруппе больных раком шейки матки (Каплан–Мейер)
-
Fig. 2. Disease-free survival of cervical cancer patients of the second subgroup (Kaplan–Meier)
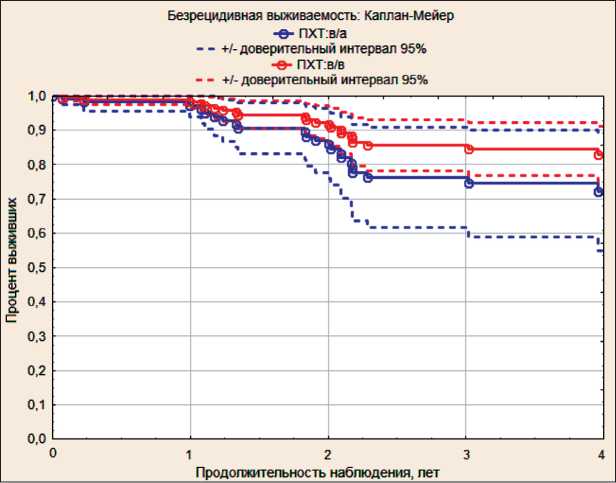
Рис. 3. Сравнение безрецидивной выживаемости больных раком шейки матки IB2–IIIB стадии (Каплан–Мейер)
-
Fig. 3. Comparison of disease-free survival of patients with stage IB2–IIIB cervical cancer (Kaplan–Meier)
в течение первого года, у 3 – в течение второго года после окончания терапии. Кумулятивный показатель безрецидивной выживаемости в данной группе при РШМ IB2 стадии составил 92,6 %, при IIB – 76,9 %, при IIIB – 68,2 % (рис. 2).
Результаты лечения всех исследованных больных, которым проводили НАХТ с последующими радикальными операциями, представлены на рис. 3. Рецидивы заболевания отмечены у 23 (13,3 %) больных. Более чем у половины (53,6 %) из них изначально определяли рак шейки матки IIIB стадии. У 20 (87,0 %) пациенток рецидивы заболевания отмечались после адъювантной лучевой терапии, что свидетельствует о том, что при патоморфологическом исследовании у всех были выявлены те или иные факторы риска прогрессирования заболевания.
После НАХТ не удалось достигнуть резекта-бельности опухолевого процесса у 13 больных раком шейки матки. Из них 5 (4,7 %) пациенткам проводили 2 курса неоадъювантной химиотерапии с внутривенной инфузией цитостатиков, 8 (11,9 %) – внутриартериальную химиотерапию и эмболизацию сосудов опухоли. Этим больным после лекарственного лечения был проведен курс
Список литературы Рак шейки матки стадий IB2-IIIB: неоадъювантная химиотерапия, радикальные операции и выживаемость пациенток
- Moshkovich O., Lebrun-Harris L., Makaroff L., Chidambaran P., Chung M., Sripipatana A., Lin S.C. Challenges and Opportunities to Improve Cervical Cancer Screening Rates in US Health Centers through Patient-Centered Medical Home Transformation. Adv Prev Med. 2015; 2015: 182073. https://doi.org/10.1155/2015/182073.
- Ferlay J., Colombet M., Soerjomataram I., Mathers C, Parkin D.M., Piñeros M., Znaor A., Bray F. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int J Cancer. 2019 Apr 15; 144(8): 1941-1953. https://doi.org/10.1002/ijc.31937.
- Kaprin A.D., Starinskii V.V., Petrova G.V. Zlokachestvennye novoobrazovaniya v Rossii v 2017 godu (zabolevaemost' i smertnost'). M., 2018. 250 s.
- Quinn M.A., Benedet J.L., Odicino F., Maisonneuve P., Beller U., Creasman W.T., Heintz A.P., Ngan H.Y., Pecorelli S. Carcinoma of the cervix uteri. FIGO 26th Annual Report on the Results of Treatment in Gynecological Cancer. Int J Gynaecol Obstet. 2006 Nov; 95 Suppl 1: S43-103. https://doi.org/10.1016/S0020-7292(06)60030-1.
- Melamed A., Margul D.J., Chen L., Keating N.L., Del Carmen M.G., Yang J., Seagle B.L., Alexander A., Barber E.L., Rice L.W., Wright J.D., Kocherginsky M., Shahabi S., Rauh-Hain J.A. Survival after Minimally Invasive Radical Hysterectomy for Early-Stage Cervical Cancer. N Engl J Med. 2018 Nov 15; 379(20): 1905-1914. https://doi.org/10.1056/NEJMoa1804923.
- Vordermark D. Radiotherapy of Cervical Cancer. Oncol Res Treat. 2016; 39(9): 516-20. https://doi.org/10.1159/000448902.
- Naga Ch.P., Gurram L., Chopra S., Mahantshetty U. The management of locally advanced cervical cancer. Curr Opin Oncol. 2018 Sep; 30(5): 323-329. https://doi.org/10.1097/CCO.0000000000000471.
- Rose P.G. Chemoradiotherapy for cervical cancer. Eur J Cancer. 2002 Jan; 38(2): 270-8. https://doi.org/10.1016/s0959-8049(01)00352-5.
- Nakao Y., Hashiguchi M., Nishiyama S., Aihara S., Iwasaka T., Yokoyama M. Preoperative Chemoradiotherapy in Locally Advanced Bulky Squamous Cell Carcinoma of the Uterine Cervix. Int J Gynecol Cancer. 2017 Nov; 27(9): 1943-1948. https://doi.org/10.1097/IGC.0000000000001094.
- Zou W., Han Y., Zhang Y., Hu C., Feng Y., Zhang H., Wang J. Neoadjuvant chemotherapy plus surgery versus concurrent chemoradiotherapy in stage IB2-IIB cervical cancer: A systematic review and meta-analysis. PLoS One. 2019 Nov 14; 14(11): e0225264. https://doi.org/10.1371/journal.pone.0225264.
- Koh W.J., Abu-Rustum N.R., Bean S., Bradley K., Campos S.M., Cho K.R., Chon H.S., Chu C., Clark R., Cohn D., Crispens M.A., Damast S., Dorigo O., Eifel P.J., Fisher C.M., Frederick P., Gaffney D.K., Han E., Huh W.K., Lurain J.R., Mariani A., Mutch D., Nagel C., Nekhlyudov L., Fader A.N., Remmenga S.W., Reynolds R.K., Tillmanns T., Ueda S., Wyse E., Yashar C.M., McMillian N.R., Scavone J.L. Cervical Cancer, Version 3.2019, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2019 Jan; 17(1): 64-84. https://doi.org/10.6004/jnccn.2019.0001.
- Marth C., Landoni F., Mahner S., McCormack M., GonzalezMartin A., Colombo N.; ESMO Guidelines Committee. Cervical cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and followup. Ann Oncol. 2017 Jul 1; 28(suppl_4): iv72-iv83. https://doi.org/10.1093/annonc/mdx220.
- Yang S., Gao Y., Sun J., Xia B., Liu T., Zhang H., Li Q., Xiao M., Zhang Y. Neoadjuvant chemotherapy followed by radical surgery as an alternative treatment to concurrent chemoradiotherapy for young premenopausal patients with FIGO stage IIB squamous cervical carcinoma. Tumour Biol. 2015 Jun; 36(6): 4349-56. https://doi.org/10.1007/s13277-015-3074-2.
- Gupta S., Maheshwari A., Parab P., Mahantshetty U., Hawaldar R., Sastri Chopra S., Kerkar R., Engineer R., Tongaonkar H., Ghosh J., Gulia S., Kumar N., Shylasree T.S., Gawade R., Kembhavi Y., Gaikar M., Menon S., Thakur M., Shrivastava S., Badwe R. Neoadjuvant Chemotherapy Followed by Radical Surgery Versus Concomitant Chemotherapy and Radiotherapy in Patients With Stage IB2, IIA, or IIB Squamous Cervical Cancer: A Randomized Controlled Trial. J Clin Oncol. 2018; 36(16): 1548-55. https://doi.org/10.1200/JCO.2017.75.9985.
- Maksimov S.Ya. Pervichno mnozhestvennye opukholi organov reproduktivnoi sistemy. Prakticheskaya onkologiya. 2009; 10(2): 117-123.
- Ashrafyan L.A., Antonova I.B., Aleshikova O.I., Dobrovol'skaya N.Yu. Khirurgicheskii etap kak odin iz osnovnykh komponentov v lechenii raka sheiki matki IIb-IIIb stadii. Rossiiskii onkologicheskii zhurnal. 2007; 3: 21-25.
- Ashrafyan L.A., Aleshikova O.I., Babaeva N.A., Antonova I.B., Ivashina S.V., Vashakmadze S.L., Myagkova A.A., Motskobili T.A. Otsenka rezul'tatov neoad"yuvantnoi khimioterapii mestno-rasprostranennogo raka sheiki matki IIB-IIIB stadii pri kompleksnoi ul'trazvukovoi diagnostike. Opukholi zhenskoi reproduktivnoi sistemy. 2015; 2: 76-81.
- Angioli R., Plotti F., Luvero D., Aloisi A., Guzzo F., Capriglione S., Terranova C., De Cicco Nardone C., Benedetti-Panici P. Feasibility and safety of carboplatin plus paclitaxel as neoadjuvant chemotherapy for locally advanced cervical cancer: a pilot study. Tumour Biol. 2014 Mar; 35(3): 2741-6. https://doi.org/10.1007/s13277-013-1361-3.
- Li X., Huang K., Zhang Q., Shen J., Zhou H., Yang R., Wang L., Liu J., Zhang J., Sun H., Jia Y., Du X., Wang H., Deng S., Ding T., Jiang J., Lu Y., Li S., Wang S., Ma D. Early response to neoadjuvant chemotherapy can help predict long-term survival in patients with cervical cancer. Oncotarget. 2016 Dec 27; 7(52): 87485-87495. https://doi.org/10.18632/oncotarget.11460.
- He D., Duan C., Chen J., Lai L., Chen J., Chen D. The safety and efficacy of the preoperative neoadjuvant chemotherapy for patients with cervical cancer: a systematic review and meta analysis. Int J Clin Exp Med. 2015 Sep 15; 8(9): 14693-700.
- Kosenko I.A., Litvinova T.M., Matylevich O.P. Novye vozmozhnosti khirurgicheskogo lecheniya patsientok s pervichno nerezektabel'nym rakom sheiki matki. Sibirskii onkologicheskii zhurnal. 2016; 15(1): 44-48. https://doi.org/10.21294/1814-4861-2016-15-1-44-48
- Bhatla N., Aoki D., Sharma D.N., Sankaranarayanan R. Cancer of the cervix uteri. Int J Gynaecol Obstet. 2018; 143 Suppl 2: 22-36. https://doi.org/10.1002/ijgo.12611.
- Khokhlova S.V., Kolomiets L.A., Kravets O.A., Krikunova L.I., Morkhov K.Yu., Nechushkina V.M., Novikova E.G., Teletaeva G.M., Urmancheeva A.F., Tyulyandina A.S. Prakticheskie rekomendatsii po lekarstvennomu lecheniyu raka sheiki matki. Prakticheskie rekomendatsii po lecheniyu zlokachestvennykh opukholei Rossiiskogo obshchestva klinicheskoi onkologii. Moskva: RUSSCO, 2016. Prakticheskie rekomendatsii po lecheniyu zlokachestvennykh opukholei Rossiiskogo obshchestva klinicheskoi onkologii. RUSSCO. 2019; 9(#3s2): 203-217.
- Kravets O.A., Kuznetsov V.V., Morkhov K.Yu., Nechushkina V.M., Khokhlova S.V. Klinicheskie rekomendatsii po diagnostike i lecheniyu raka sheiki matki. M., 2018. 17 p.
- Chopra S., Gupta M., Mathew A., Mahantshetty U., Engineer R., Lavanya G., Gupta S., Ghosh J., Thakur M., Deodhar K., Menon S., Rekhi B., Bajpai J., Gulia S., Maheshwari A., Kerkar R., Shylasree T.S., Shrivastava S.K. Locally advanced cervical cancer: A study of 5-year outcomes. Indian J Cancer. 2018 Jan-Mar; 55(1): 45-49. https://doi.org/10.4103/ijc.IJC_428_17.


