Рак тела матки и саркомы матки
Автор: Нечушкина В.М., Коломиец Л.А., Кравец О.А., Морхов К.Ю., Новикова Е.Г., Новикова О.В., Тюляндина А.С., Ульрих Е.А., Феденко А.А., Хохлова С.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-2 т.14, 2024 года.
Бесплатный доступ
Рак тела матки, саркома матки
Короткий адрес: https://sciup.org/140307408
IDR: 140307408 | DOI: 10.18027/2224-5057-2024-14-3s2-1.2-06
Текст статьи Рак тела матки и саркомы матки
Рак тела матки (РТМ) — злокачественная опухоль, исходящая из слизистой оболочки тела матки (эндометрия). Выделяют два патогенетических типа РТМ.
-
• Опухоли I патогенетического типа встречаются чаще, развиваются в более молодом возрасте на фоне длительной гиперэстрогении и гиперплазии эндометрия. У больных РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстроген-секретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта имеют, как правило, низкую степень злокачественности и благоприятный прогноз.
-
• Опухоли II патогенетического типа обычно имеют высокую степень злокачественности и менее благоприятный прогноз, возникают в старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия.
Примерно в 5% случаев РТМ ассоциирован с наследственными синдромами, в частности с синдромом Линча.
1. ОПРЕДЕЛЕНИЕ СТАДИИ
Стадии РТМ и сарком матки определяют по данным интраоперационной ревизии и результатам послеоперационного гистологического исследования с помощью классификации TNM (UICC, 8-й пересмотр, 2016 г.) или FIGO (2009 г.). В табл. 1 представлена классификация стадий РТМ и карциносаркомы, в табл. 2 — классификация стадий лейомиосаркомы и эндометриальной стромальной саркомы матки.
Таблица 1. Стадии рака тела матки и карциносаркомы матки по системе TNM (UICC, 8-й пересмотр, 2016 г.) и классификации FIGO (2009 г.)
|
TNM |
FIGO |
Описание |
|
TX |
– |
Невозможно оценить состояние первичной опухоли |
|
T0 |
– |
Первичная опухоль отсутствует |
|
TNM |
FIGO |
Описание |
|
Tis |
– |
Рак in situ |
|
T1a |
IA |
Опухоль в пределах эндометрия или опухоль с инвазией менее половины толщины миометрия |
|
T1b |
IB |
Опухоль с инвазией более половины толщины миометрия |
|
T2 |
II |
Опухоль распространяется на строму шейки матки, но не выходит за пределы матки |
|
T3a |
IIIA |
Прорастание серозной оболочки матки, поражение маточных труб или яичников (непосредственный переход опухоли или метастазы) |
|
T3b |
IIIB |
Поражение влагалища или параметриев (непосредственный переход опухоли или метастазы) |
|
T4 |
IVA |
Прорастание слизистой оболочки мочевого пузыря или прямой кишки |
|
NX |
– |
Оценить состояние регионарных лимфатических узлов невозможно |
|
N0 |
– |
Метастазов в регионарных лимфатических узлах (тазовых или поясничных) нет |
|
IIIC |
Метастазы в регионарных лимфатических узлах (тазовых или поясничных) |
|
|
N1 |
IIIC1 |
Метастазы в тазовых лимфатических узлах |
|
N2 |
IIIC2 |
Метастазы в поясничных лимфатических узлах |
|
M0 |
Отдаленных метастазов нет |
|
|
M1 |
IVB |
Отдаленные метастазы (в том числе метастазы в паховых лимфатических узлах и лимфатических узлах в пределах брюшной полости, кроме тазовых или поясничных лимфатических узлов; за исключением метастазов во влагалище, придатках матки и по тазовой брюшине) |
Таблица 2. Стадии лейомиосаркомы и эндометриальной стромальной саркомы матки по системе TNM (UICC, 8-й пересмотр, 2016 г.) и классификации FIGO (2009 г.)1
|
TNM |
FIGO |
Описание |
|
T1 |
I |
Опухоль ограничена маткой |
|
T1a |
IA |
Опухоль < 5 см |
|
T1b |
IB |
Опухоль > 5 см |
|
T2 |
II |
Опухоль распространяется за пределы матки, но не выходит за пределы таза |
|
T2a |
IIA |
Поражение придатков матки |
|
T2b |
IIB |
Поражение других органов и тканей |
|
T3 |
III |
Поражение органов брюшной полости |
|
T3a |
IIIA |
Один очаг |
|
T3b |
IIIB |
Два очага и более |
|
T4 |
IVA |
Прорастание слизистой оболочки мочевого пузыря или прямой кишки |
|
NX |
– |
Оценить состояние регионарных лимфатических узлов невозможно |
|
N0 |
– |
Метастазов в регионарных лимфатических узлах (тазовых или поясничных) нет |
|
TNM |
FIGO |
Описание |
|
N1 |
IIIC |
Метастазы в регионарных лимфатических узлах (тазовых или поясничных) |
|
M0 |
Отдаленных метастазов нет |
|
|
M1 |
IVB |
Отдаленные метастазы |
1 Одновременное поражение тела матки и яичников /тканей малого таза на фоне эндометриоза следует трактовать как первично множественные опухоли.
2. ДИАГНОСТИКА
Обследование проводят до всех видов лечебных воздействий. К обязательным исследованиям относятся:
физикальное, в том числе гинекологическое, исследование;
аспирационная биопсия эндометрия или раздельное диагностическое выскабливание матки;
УЗИ брюшной полости, малого таза и забрюшинного пространства;
МРТ малого таза с контрастированием (для оценки глубины инвазии, перехода опухоли на шейку матки, состояния тазовых лимфатических узлов); для оценки глубины инвазии миометрия может использоваться УЗИ, выполняемое квалифицированным специалистом;
общий и биохимический анализы крови, коагулограмма, общий анализ мочи, ЭКГ; R-графия или КТ органов грудной клетки.
По показаниям выполняют:
-
• гистероскопию;
-
• цистоскопию;
-
• колоноскопию;
-
• КТ с контрастированием для оценки состояния лимфатических узлов (при необходимости); следует помнить, что на момент операции метастатически измененные лимфатические узлы оказываются увеличенными менее чем у 10% больных РТМ ранних стадий;
-
• МРТ органов брюшной полости с контрастированием при подозрении на поражение паренхиматозных органов;
-
• ПЭТ-КТ (при решении вопроса о целесообразности хирургического лечения для исключения диссеминированного процесса);
-
• консультацию генетика для пациенток моложе 50 лет или при семейном анамнезе, отягощенном РТМ и/или колоректальным раком.
Диагноз устанавливают по результатам аспирационной биопсии эндометрия или раздельного диагностического выскабливания матки с гистероскопией либо без нее на основании гистологического заключения с обязательным указанием гистологического типа и степени злокачественности опухоли. Морфологическая классификация РТМ представлена в табл. 3.
Таблица 3. Морфологическая классификация злокачественных опухолей тела матки (ВОЗ, 2020 г.)
Злокачественные эпителиальные опухоли
Эндометриоидная аденокарцинома
-
• POLE-ультрамутированная
-
• с дефицитом MMR (dMMR)
-
• c мутациями p53
-
• не имеющая специфического молекулярного профиля
Серозный рак
Светлоклеточный рак
Смешанная аденокарцинома
Недифференцированный и дедифференцированный рак
Карциносаркома
Другие
Злокачественные мезенхимальные опухоли
Лейомиосаркома
-
• эпителиоидная лейомиосаркома
-
• миксоидная лейомиосаркома
-
• веретеноклеточная лейомиосаркома
Эндометриальная стромальная саркома низкой степени злокачественности
Эндометриальная стромальная саркома высокой степени злокачественности
Недифференцированная саркома матки
Другие
Злокачественные смешанные эпителиальные и мезенхимальные опухоли
Аденосаркома
В послеоперационном морфологическом заключении должно быть представлено следующее:
• гистологический тип опухоли;
• степень злокачественности опухоли (согласно классификации ВОЗ 2020 г. рекомендуется выделять эндометриоидный рак низкой (low-grade) и высокой (high-grade) степени злокачественности, к опухолям низкой степени злокачественности относятся опухоли G1 и G2, к опухолям высокой степени злокачественности — опухоли G3);
• размеры опухоли;
• глубина инвазии миометрия;
• толщина миометрия в месте наибольшей инвазии опухоли;
• прорастание опухолью серозной оболочки матки;
• опухолевые эмболы в кровеносных и лимфатических сосудах: наличие единичных эмболов рядом с первчиной опухолью считается незначимым, множественные (от 5 и более) и диффузные эмболы в лимфатических щелях считаются значимыми);
• переход опухоли на шейку матки, врастание в строму шейки матки;
• выход опухоли в параметрий;
• общее количество удаленных и пораженных тазовых лимфатических узлов справа и слева;
• общее количество удаленных и пораженных поясничных лимфатических узлов;
• метастатическое поражение яичников, маточных труб;
• любые другие находки;
• целесообразно, особенно при низкодифференцированных опухолях, определять их тип в соответствии с молекулярной классификацией; отнесение опухоли к тому или иному типу возможно только при оценке всех трех классификаторов в определенной последовательности: (1) мутации POLE (методом NGS или ПЦР); (2) MSI или dMMR (методом ИГХ, при невозможности ПЦР): (3) мутации p53 (методом ИГХ);
• при серозном РТМ, карциносаркоме, а также при прогрессировании заболевания целесообразно определять экспрессию HER2;
• при лейомиосаркомах возможно выявление мутаций генов BRCA, транслокации ALK и слияния генов NTRK.
3. ЛЕЧЕНИЕ
3.1. Рак тела матки
3.1.1. Первичное лечение рака тела матки3.1.1.1. Эндометриоидный рак тела матки I стадии
Наиболее эффективным методом лечения РТМ независимо от стадии следует считать хирургический метод, применяемый как самостоятельно, так и в комбинации с другими методами. При абсолютных противопоказаниях к хирургическому лечению проводят ЛТ по радикальной программе. При невозможности ЛТ назначают ХТ, а при эндометриоидной аденокарциноме низкой степени злокачественности — ГТ.
У больных начальным РТМ низкой степени злокачественности (G1, G2, IA стадии без инвазии миометрия) репродуктивного возраста с целью сохранения фертильности возможна ГТ, которую следует проводить в учреждениях, имеющих такой опыт. Имеются данные о снижении выживаемости при проведении самостоятельной ГТ больным старше 40 лет. Предпочтительным вариантом ГТ является сочетание внутриматочной спирали с левоноргестрелом (52 мг) и агонистов ГРГ. При невозможности применения этой схемы в качестве альтернативных вариантов ГТ могут быть использованы медроксипрогестерона ацетат (500 мг/сут.) или мегестрола ацетат (160 мг/сут.). Длительность лечения не менее 6 мес. Для оценки эффективности лечения рекомендуется гистологическое исследование эндометрия каждые 3 мес. (гистероскопия, раздельное диагностическое выскабливание). В отсутствие полного ответа через 6–12 мес. от начала ГТ показана экстирпация матки. При достижении полного ответа, но не ранее 6 мес. от начала ГТ, возможно планирование беременности.
Рекомендуемая тактика лечения эндометриоидного РТМ представлена на рис. 1.
Лечение начинают с хирургического вмешательства. Предоперационную ЛТ не проводят. Выполняют экстрафасциальную экстирпацию матки с придатками и биопсию всех выявленных при ревизии брюшной полости, малого таза и забрюшинного пространства объемных образований. При наличии выпота в брюшной полости жидкость направляют на цитологическое исследование. Получение смывов из брюшной полости не является обязательным. У больных моложе 45 лет при РТМ низкой степени злокачественности с инвазией менее половины толщины миометрия в отсутствие признаков распространения опухоли за пределы матки возможно сохранение яичников и удаление матки с маточными трубами. Сохранение яичников не рекомендуется при мутациях генов BRCA и синдроме Линча. При серозном, недифференцированном РТМ и карциносар-коме матки, а также при обнаружении во время операции метастазов в яичниках, когда высок риск имплантационного метастазирования, показано удаление большого сальника. Показания к лимфодиссекции для эндометриоидного рака определяются риском, оцениваемым по результатам предоперационного обследования (табл. 4). При наличии показаний к лимфодиссекции удаляют лимфатические узлы обеих регионарных зон: тазовые и поясничные до почечных сосудов (лимфодиссекция IV уровня).
Лимфодиссекция должна быть адекватной. По данным крупных исследований, при единичных метастазах удаление 21–25 лимфатических узлов статистически значимо повышает вероятность их обнаружения. Лимфодиссекция показана при серозном, светлоклеточном РТМ и карциносаркоме I клинической стадии. Если лимфодиссекция не выполнена, а по данным планового гистологического исследования у больной имеется высокий риск лимфогенных метастазов, в отсутствие противопоказаний больной рекомендуется повторное вмешательство в объеме тазовой и поясничной лимфодиссекции.
Таблица 4. Показания к лимфодиссекции при эндометриоидном РТМ I клинической стадии
|
Инвазия миометрия |
Степень злокачественности |
Риск лимфогенных метастазов |
Тазовая и поясничная лимфодиссекция |
|
< 1/2 |
Низкая |
Низкий |
Нет |
|
< 1/2 |
Высокая |
Промежуточный |
Возможна для уточнения стадии |
|
>1/2 |
Низкая |
Промежуточный |
Возможна для уточнения стадии |
|
>1/2 |
Высокая |
Высокий |
Да |
В качестве альтернативы лимфодиссекции при промежуточном риске прогрессирования эндометриоидного РТМ I клинической стадии можно определять сторожевые лимфатические узлы. Исследование считается информативным, если сторожевые лимфатические узлы выявлены в малом тазу с обеих сторон. Если на одной из сторон сторожевой узел не найден, выполняют ипсилатеральную лимфодиссекцию. При гистологическом исследовании сторожевых лимфатических узлов следует применять ультрастадирова-ние. При выявлении метастазов в сторожевых лимфатических узлах выполняют тазовую и поясничную лимфодиссекцию.
Тактика хирургического лечения РТМ I стадии определяет тактику последующей адъювантной ЛТ. Показания к адъювантной дистанционной ЛТ определяются в первую очередь факторами риска лимфогенного метастазирования РТМ, которые полностью нивелируются при выполнении адекватной лимфодиссекции. Несмотря на то, что ни одно из опубликованных на сегодняшний день рандомизированных исследований, посвященных изучению роли тазовой лимфаденэктомии при РТМ, не продемонстрировало повышение выживаемости при ее выполнении, регионарная лимфодиссекция при РТМ решает следующие задачи:
-
• уточнение стадии;
-
• увеличение выживаемости больных с метастазами в лимфатических узлах;
-
• определение тактики дальнейшего лечения.
С точки зрения профилактики регионарного прогрессирования лимфодиссекцию при РТМ ранних стадий можно рассматривать как альтернативу дистанционной ЛТ, более безопасную с точки зрения отдаленных последствий (поздних осложнений, радио-индуцированных опухолей), что особенно важно у больных моложе 60 лет. Негативные последствия дистанционной ЛТ при РТМ I стадии продемонстрированы в рандомизированном исследовании и метаанализах. Единого мнения о тактике послеоперационного лечения больных РТМ, у которых выявлены только опухолевые клетки в смывах из брюшной полости, нет. Показания к адъювантному лечению зависят от группы риска, к которой относится больная (табл. 5). Рекомендуемое адъювантное лечение эндометриоидного РТМ I стадии согласно рекомендациям консенсуса ESGO, ESMO, ESTRO (2020 г.) представлено в табл. 6 и на рис. 2.
Таблица 5. Группы риска при РТМ (консенсус ESGO, ESMO, ESTRO, 2020 г.)
|
Риск |
Без учета молекулярной классификации |
С учетом молекулярной классификации1 |
|
Низкий |
• Эндометриоидный РТМ, стадия IA, низкая степень злокачественности (G1 и G2), нет опухолевых эмболов в лимфатических щелях или незначимые |
|
|
Промежуточный |
(G3), нет опухолевых эмболов в лимфатических щелях или незначимые
(G1 и G2), нет опухолевых эмболов в лимфатических щелях или незначимые
|
|
|
Риск |
Без учета молекулярной классификации |
С учетом молекулярной классификации1 |
|
Промежуточный – высокий |
|
и не имеющий специфического молекулярного профиля), стадия IB, высокая степень злокачественности (G3), нет опухолевых эмболов в лимфатических щелях или незначимые
и не имеющий специфического молекулярного профиля), стадия I, значимые опухолевые эмболы в лимфатических щелях
|
|
Высокий |
|
|
|
Распространенная болезнь |
|
|
1 При выявлении мутации POLE опухоль является POLE-ультрамутированной независимо от наличия других изменений. РТМ с мутацией p53 диагностируют в отсутствие мутаций POLE и dMMR.
Таблица 6. Рекомендуемое адъювантное лечение эндометриоидного РТМ I стадии (консенсус ESGO, ESMO, ESTRO, 2020 г.)
|
Риск |
Лимфодиссекция выполнена, метастазов в лимфатических узлах нет |
Лимфодиссекция не выполнена |
|
Низкий |
Нет |
|
|
Промежуточный |
Брахитерапия или наблюдение, особенно для больных моложе 60 лет |
|
|
Промежуточный — высокий: |
||
|
• стадия IA, значимые опухолевые эмболы в лимфатических щелях, стадия IB, низкая степень злокачественности, значимые опухолевые эмболы в лимфатических щелях) |
Брахитерапия или наблюдение |
Дистанционная ЛТ малого таза — при значимых опухолевых эмболах; брахитерапия — при высокой степени злокачественности (G3) |
|
Риск |
Лимфодиссекция выполнена, метастазов в лимфатических узлах нет |
Лимфодиссекция не выполнена |
|
• стадия IB, высокая степень злокачественности |
Брахитерапия или дистанционная ЛТ малого таза |
Дистанционная ЛТ малого таза |
-
3.1.1.2. Эндометриоидный рак тела матки II стадии
-
3.1.1.3. Эндометриоидный рак тела матки III–IV стадий
-
3.1.1.4. Неэндометриоидный рак тела матки
-
3.1.2. Лечение при прогрессировании рака тела матки
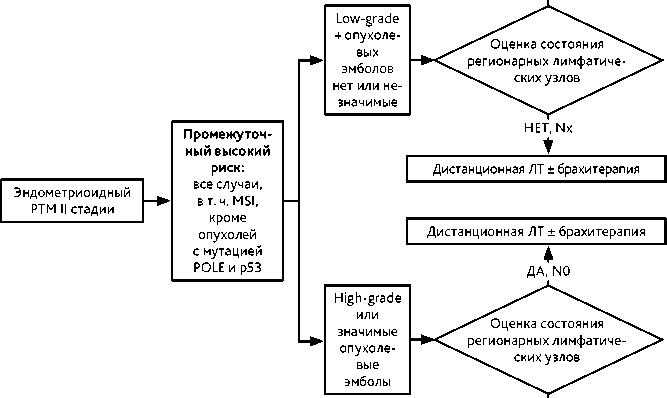
Примерно у 30% больных РТМ II стадии имеются метастазы в тазовых лимфатических узлах. Риск поражения поясничных лимфатических узлов, яичников и диссеминации по брюшине при II клинической стадии РТМ выше, чем при I. Методом выбора является хирургическое вмешательство в объеме экстирпации матки с придатками с тазовой и поясничной лимфодиссекцией на I этапе с последующим адъювантным лечением. Рекомендуемое адъювантное лечение эндометриоидного РТМ II стадии представлено в табл. 7 и на рис. 3.
Таблица 7. Рекомендуемое адъювантное лечение эндометриоидного РТМ II стадии (консенсус ESGO, ESMO, ESTRO, 2020 г.)
|
Риск |
Лимфодиссекция выполнена, метастазов в лимфатических узлах нет |
Лимфодиссекция не выполнена |
|
Промежуточный — высокий |
||
|
Низкая степень злокачественности (G1 и G2), нет опухолевых эмболов или незначимые |
Брахитерапия |
Дистанционная ЛТ малого таза ± брахитерапия |
|
Высокая степень злокачественности (G3), значимые опухолевые эмболы |
Дистанционная ЛТ малого таза ± брахитерапия |
Дистанционная ЛТ малого таза ± брахитерапия |
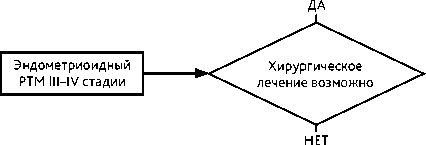
План лечения определяется индивидуально (рис. 4). Лечение, как правило, начинают с операции. Она позволяет уточнить распространение опухоли и выполнить циторедукцию. Операция на первом этапе обязательна, если при обследовании выявляется объемное образование в области придатков матки. Тазовая и поясничная лимфодис-секция показана при III стадии, выявлении макроскопически увеличенных регионарных лимфатических узлов, а также при IV стадии, если выполнена полная циторедукция. Удаление макрометастазов в лимфатических узлах повышает выживаемость больных РТМ. При распространенном РТМ следует стремиться к выполнению полной циторедукции, поскольку она статистически значимо улучшает результаты лечения. Тактика лечения РТМ IIIB стадии определяется индивидуально. По возможности на первом этапе проводят хирургическое лечение. Если операция невозможна, назначают ХТ или ЛТ. В редких случаях при РТМ IV стадии в отсутствие отдаленных метастазов возможна экзентерация малого таза. При РТМ III–IV стадий после циторедуктивных операций целесообразно проведение ХТ. По показаниям проводят ЛТ, в частности при вовлечении стромы шейки матки целесообразна брахитерапия. ХТ рекомендуется начинать не позднее 4 недель, брахитерапию — не позднее 12 недель после операции.
Неэндометриоидный РТМ (серозный, светлоклеточный рак, смешанная аденокарцинома, недифференцированный рак, карциносаркома) имеет неблагоприятный прогноз. Исключение составляет муцинозный рак, который в подавляющем большинстве случаев имеет низкую степень злокачественности, а по клиническому течению и тактике лечения сходен с эндометриоидным РТМ низкой степени злокачественности. Хирургическое лечение включает в себя экстирпацию матки с придатками, тазовую и поясничную лимфо-диссекцию. Большой сальник удаляют только при серозном, недифференцированном РТМ и карциносаркоме матки. Имеются данные о том, что лимфодиссекция при карциносар-коме матки не только позволяет уточнить стадию, но и повышает выживаемость больных. При серозном и светлоклеточном РТМ IA стадии (при условии выполнения тазовой и поясничной лимфодиссекции) в отсутствие опухолевых эмболов в лимфатических щелях или при незначимых опухолевых эмболах возможна брахитерапия. Во всех остальных случаях показана ХТ. Тактика лечения неэндометриоидного РТМ представлена на рис. 5.
Тактика лечения зависит от локализации и срока прогрессирования, облучения данной зоны в анамнезе, гистологического типа опухоли (рис. 6).
-
• При рецидиве РТМ в культе влагалища или одиночном метастазе во влагалище без предшествующей ЛТ рекомендуется сочетанная ЛТ или удаление опухоли с последующей сочетанной ЛТ.
-
• При рецидиве РТМ в культе влагалища после брахитерапии рекомендуется удаление опухоли с последующей дистанционной ЛТ.
-
• При рецидиве в культе влагалища после сочетанной ЛТ возможно удаление опухоли или проведение внутритканевой ЛТ под контролем методов визуализации; при отсутствии условий для проведения хирургического лечения и ЛТ возможна ХТ.
-
• Следует помнить о низкой эффективности системного лекарственного лечения при прогрессировании в зоне облучения.
-
• При регионарных метастазах РТМ рекомендуется ЛТ или лимфаденэктомия с последующей ЛТ. Возможно дополнительное системное лекарственное лечение.
-
• При солитарных поздних отдаленных метастазах РТМ рекомендуется рассмотреть возможность хирургического лечения.
-
• При отдаленных метастазах РТМ низкой степени злокачественности, а также при небольших отдаленных не висцеральных метастазах эндометриоидного РТМ,
экспрессирующего рецепторы стероидных гормонов, в отсутствие клинических проявлений возможна ГТ (при последующем прогрессировании показана ХТ).
-
• При отдаленных метастазах РТМ высокой степени злокачественности, больших отдаленных метастазах, а также при наличии клинических проявлений целесообразна ХТ, при необходимости — в сочетании с паллиативной ЛТ.
-
• При прогрессировании РТМ проводят 6 циклов ХТ либо лечат до прогрессирования или непереносимой токсичности.
-
• Во II линии лечения РТМ целесообразно назначение иммунотерапии или иммуно-таргетной терапии. В связи с этим при прогрессировании РТМ следует определять MSI или dMMR в опухолевых клетках, если это не было сделано ранее. Для этого применяют ИГХ метод, при невозможности — ПЦР. Для исследования предпочтителен образец опухоли, полученный при прогрессировании.
-
• При прогрессировании в течение 6 месяцев после окончания адъювантной ХТ целесообразно назначение иммунотерапии или иммунотаргетной терапии в зависимости от наличия MSI/dMMR.
-
• При позднем рецидиве (более 6 мес. от окончания первичного лечения) возможно повторение I линии ХТ, если ранее уже применялась иммунотерапия или иммуно-таргетная терапия.
-
• При опухолях, экспрессирующих HER2, возможно назначение трастузумаба в комбинации с ХТ.
-
• При дальнейшем прогрессировании показана паллиативная помощь или включение в клинические исследования новых цитостатиков или таргетных препаратов.
-
3.1.3. Режимы химиотерапии, рекомендуемые при раке тела матки
Доказаны преимущества комбинированных режимов ХТ (табл. 8). Монохимиотерапия менее эффективна. Адъювантная ГТ не продемонстрировала свою эффективность и не рекомендуется. Если больной ранее проводилась дистанционная ЛТ, дозы паклитаксела, ифосфамида и гемцитабина как в монорежиме, так и в комбинациях рекомендуется редуцировать на 20%. В рамках адъювантного лечения проводится 6 циклов ХТ.
Таблица 8. Рекомендуемые режимы лекарственной терапии рака тела матки
|
Показания |
Режим |
|
Адъювантная ХТ (в отсутствие остаточной опухоли) |
|
|
Показания |
Режим |
|
Лекарственное лечение I линии (при наличии остаточной опухоли или при прогрессировании) |
и дурвалумабом 1500 мг в/в каждые 4 нед. (опухоли pMMR). Олапариб и/или дурвалумаб назначают до прогрессирования или непереносимой токсичности
|
|
ГТ (рецидив эндометриоидной аденокарциномы низкой степени зло качественности при малых объемах опухоли и индолент-ном течении) |
|
|
Показания |
Режим |
|
Лекарственное лечение 2-й линии |
ПРЕДПОЧТИТЕЛЬНЫЕ РЕЖИМЫ
(при MSI/dMMR в опухоли) до прогрессирования или непереносимой токсичности.
и ленватиниб 20 мг 1 раз в сутки внутрь ежедневно (в отсутствие MSI/dMMR в опухоли при всех гистологических типах, кроме карциносаркомы) до прогрессирования или непереносимой токсичности. РЕЖИМЫ, ПРИМЕНЯЕМЫЕ В ОСОБЫХ СЛУЧАЯХ
ПРОЧИЕ РЕЖИМЫ При рецидиве более 6 мес. от окончания первичного лечения Карбоплатин AUC5–6 в/в в 1-й день 21-дневного цикла в сочетании с одним из следующих препаратов:
Цисплатин 60–75 мг/м 2 в/в в 1-й день 21-дневного цикла в сочетании с одним из следующих препаратов:
Оксалиплатин 100–130 мг/м 2 в/в в 1-й день в сочетании с одним из следующих препаратов:
|
|
Показания |
Режим |
|
Ифосфамид 1600 мг/м 2 в/в в 1–3-й дни 1–2-часовая инфузия (+ месна из расчета 100% от дозы ифосфамида в/в в 1–3-й дни) и паклитаксел 135–175 мг/м 2 в/в в 3-й день каждые 3 нед. при поддержке Г-КСФ (возможно применение при карциносаркомах) 1 . Цисплатин 20 мг/м 2 в/в в 1–5-й дни и ифосфамид 1500 мг/м 2 в/в в 1–5-й дни 1-часовая инфузия (+ месна из расчета 100% от дозы ифосфамида в/в в 1–5-й дни) каждые 3 нед. при поддержке Г-КСФ (возможно применение при карцино-саркомах) 1 . При рецидиве менее 6 мес. от окончания первичного лечения
|
1 Месна применяется в суточной дозе, составляющей 100 % от дозы ифосфамида. Дозу делят на 3 введения в течение дня: непосредственно перед введением ифосфамида, через 4 и 8 часов после начала его инфузии.
-
3.2. Саркомы матки
-
3.2.1. Первичное лечение сарком матки
-
3.2.1.1. Лейомиосаркома матки
-
-
-
3.2.1.2. Эндометриальная стромальная и недифференцированная саркома матки
-
3.2.2. Лечение прогрессирования сарком матки
-
3.2.3. Лекарственное лечение сарком матки
При лейомиосаркоме матки выполняют экстирпацию матки с придатками. У молодых больных лейомиосаркомой матки ранних стадий возможно сохранение яичников, т. к. это не влияет на выживаемость. Удаление тазовых и поясничных лимфатических узлов нецелесообразно. ЛТ не показана. При I стадии допустимо наблюдение. ХТ возможна, если при I стадии больной ошибочно выполнена морцелляция опухолевого узла, показана при II–IV стадиях.
Прогноз при эндометриальной стромальной саркоме матки низкой степени злокачественности относительно благоприятный. Показаны экстирпация матки с придатками и удаление макроскопически определяемых опухолей. Эндометриальная стромальная саркома матки низкой степени злокачественности — гормонально-зависимая опухоль. Тазовая и поясничная лимфодиссекция может быть целесообразна. С учетом высокой экспрессии РЭ и РП и эффективности ГТ при диссеминированной эндометриальной стромальной саркоме низкой степени злокачественности назначают ГТ. В отсутствие ответа на ГТ при диссеминированной эндометриальной стромальной саркоме низкой степени злокачественности возможно проведение ХТ.
Эндометриальная стромальная саркома матки высокой степени злокачественности и недифференцированная саркома матки — крайне агрессивные опухоли со склонностью к быстрому гематогенному метастазированию. Выполняют экстирпацию матки с придатками. С учетом крайне неблагоприятного прогноза роль лимфодиссекции и циторедуктивных операций сомнительна. ХТ показана независимо от размеров и распространенности первичной опухоли. ЛТ не показана.
При одиночных метастазах проводят ХТ, при наличии эффекта на втором этапе возможно хирургическое лечение. Возможно также хирургическое лечение с последующей ХТ. При диссеминированном процессе показана ХТ или симптоматическое лечение.
ХТ рекомендуется при лейомиосаркоме, эндометриальной стромальной саркоме матки высокой степени злокачественности и недифференцированной саркоме матки всех стадий.
При лейомиосаркоме матки I стадии возможно наблюдение. Режимами выбора адъювантной терапии сарком матки являются 6 курсов монотерапии доксорубицином или комбинации гемцитабина и доцетаксела. При диссеминированной стромальной саркоме матки низкой степени злокачественности и гормонопозитивной лейомиосаркоме матки возможно назначение ГТ (эффективность ГТ при лейомиосаркоме не превышает 15–20%). При диссеминированной лейомиосаркоме матки системное лечение начинают с ХТ, а затем переходят к ГТ. При диссеминированной эндометриальной стромальной саркоме матки низкой степени злокачественности, напротив, начинают с ГТ, при дальнейшем прогрессировании проводят ХТ. Тамоксифен при саркомах матки противопоказан.
При прогрессировании лейомиосаркомы, эндометриальной стромальной саркомы матки высокой степени злокачественности и недифференцированной саркомы матки рекомендована как монохимиотерапия, так и не использованные ранее режимы I линии.
Редкие саркомы матки лечат так же, как соответствующие саркомы мягких тканей.
Режимы лекарственной терапии сарком матки представлены в табл. 9 и 10.
Таблица 9. Рекомендуемые режимы лекарственной терапии сарком матки
|
Показания |
Режим |
|
Адъювантная ХТ (6 циклов) |
|
|
Показания |
Режим |
|
Диссеминированные опухоли (6 циклов или до прогрессирования) |
и недифференцированной саркоме матки) 2,6
|
|
Лекарственное лечение 2-й линии |
|
-
1 Возможна при ECOG-2.
-
2 Можно использовать пролонгированные формы Г-КСФ.
-
3 Для пациенток, уже получавших ХТ, проводится редукция доз гемцитабина до 675 мг /м 2 в 1-й и 8-й дни и доцетаксела до 75 мг /м 2 в 8-й день. Лечение проводится с поддержкой Г-КСФ.
-
4 Режим изучался при лейомиосаркоме матки.
-
5 Режим изучался при лейомиосаркоме мягких тканей. Существует мнение о том, что лейомиосаркому матки следует лечить так же, как саркомы мягких тканей.
-
6 Месна применяется в суточной дозе, составляющей 100 % от дозы ифосфамида. Дозу делят на 3 введения в течение дня: непосредственно перед введением ифосфамида, через 4 и 8 часов после начала его инфузии.
-
7 Пазопаниб и эрибулин применяют при прогрессировании на цитостатической терапии.
Таблица 10. Рекомендуемые режимы гормонотерапии сарком матки
Показания
ГТ I линии
Режим
Мегестрола ацетат 160 мг внутрь 2 раза в сутки ежедневно
Медроксипрогестерона ацетат 500 мг внутрь 1 раз в сутки ежедневно
|
Показания |
Режим |
|
ГТ II линии |
Летрозол 2,5 мг/сут. внутрь ежедневно Анастрозол 1 мг/сут. внутрь ежедневно Эксеместан 25 мг/сут. внутрь ежедневно |
|
ГТ III линии |
Гозерелин 3,6 мг в/м 1 раз в 28 дней Бусерелин 3,75 мг в/м 1 раз в 28 дней Лейпрорелин 3,75 мг в/м 1 раз в 28 дней |
-
3.3. Принципы проведения лучевой терапии
• ЛТ применяется только при эпителиальных и смешанных опухолях матки.
• Предусматривается дистанционная ЛТ и/или брахитерапия. Брахитерапия подразумевает облучение матки при отсутствии хирургического этапа лечения или облучение культи влагалища в послеоперационном периоде.
• Предписанные дозы дистанционной ЛТ: суммарная доза 45,0–50,4 Гр в режиме фракционирования 1,8–2,0 Гр 5 раз в неделю (фракционирование, принятое в клинике). При наличии остаточной опухоли в области тазовых лимфатических узлов или в параметрии применяется послеоперационная конформная ЛТ с использованием интегрированного или последовательного стереотаксического буста до суммарных доз 55–60 Гр (EQD2) при микроскопической остаточной опухоли или до 66 Гр (EQD2) при макроскопической остаточной опухоли.
• Сроки проведения послеоперационного облучения культи влагалища зависят от ее заживления, предпочтительно проводить через 6–8 недель, но не позже 12 недель после операции. При планировании послеоперационной брахитерапии рекомендуется облучать не более верхних 2/3 влагалища на глубину 0,5 см от слизистой.
• При проведении самостоятельной брахитерапии назначают 3 фракции по 7 Гр или 5 фракций по 6 Гр или 4 фракции по 5,5 Гр.
• При противопоказаниях к хирургическому лечению проводится самостоятельная сочетанная ЛТ или самостоятельная брахитерапия в зависимости от риска прогрессирования. При самостоятельной брахитерапии дозы должны достигать 48 Гр (EQD2) на область тела, шейки матки и верхней трети (1–2 см) влагалища, при сочетанной ЛТувеличиваются до 65 Гр (EQD2). При использовании МРТсуммарная доза на GTV может быть увеличена до ≥ 80 Гр (EQD2).
• Возможности проведения паллиативной ЛТ определяются распространенностью опухолевого процесса и общим состоянием больной. Суммарные дозы могут достигать 40–50Гр.
• При рецидиве РТМ в культе влагалища или наличии метастаза во влагалище как единственного проявления заболевания рекомендовано проведение внутритканевой ЛТ. Суммарная доза планируется с учетом ранее проведенного лечения на планируемый объем опухолевого образования и может достигать 30–50 Гр (EQD2) (внутритканевая ЛТ проводится в крупных клиниках, имеющих опыт такого лечения).
4. ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
-
• Физикальное обследование, в том числе гинекологический осмотр — каждые 3 мес. в течение 2 лет, затем — каждые 6 мес. в течение еще 3 лет.
-
• КТ органов малого таза, брюшной полости и забрюшинного пространства с контрастированием— каждые 3 мес. в течение 2 лет, затем — каждые 6 мес. в течение еще 3 лет (возможна замена экспертным УЗИ тех же зон с той же периодичностью).
-
• КТ органов грудной клетки — 1 раз в год.
-
• Цитологическое исследование мазков со слизистой культи — по показаниям.
-
• МРТ и ПЭТ-КТ с контрастированием — по показаниям.
Эндометриоидный РТМ
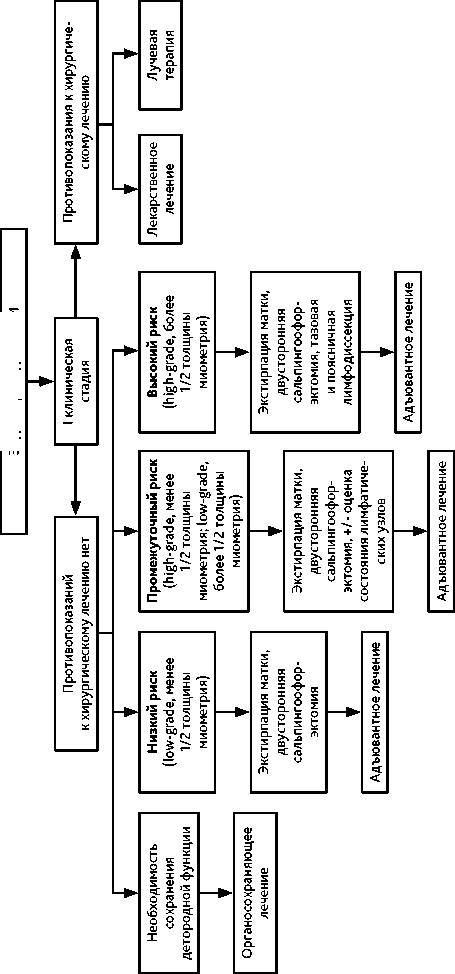
Рисунок 1. Тактика лечения эндометриоидного РТМ (I клиническая стадия)
Эндометриоидный РТМ
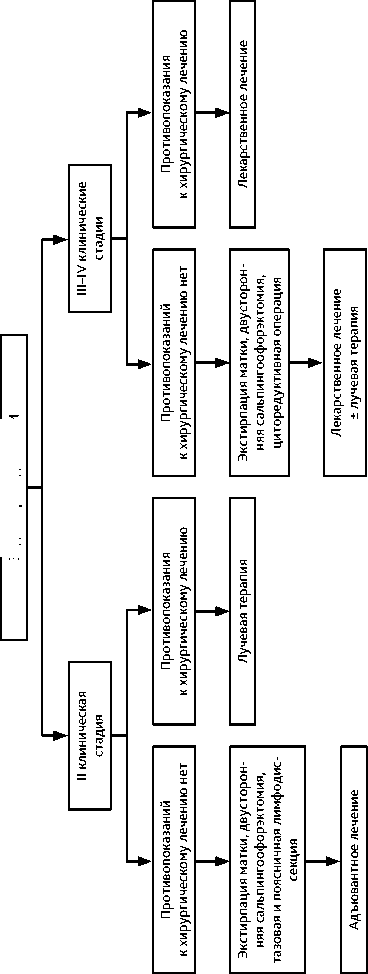
Рисунок 1. Тактика лечения эндометриоидного РТМ (продолжение, II–IV клинические стадия)
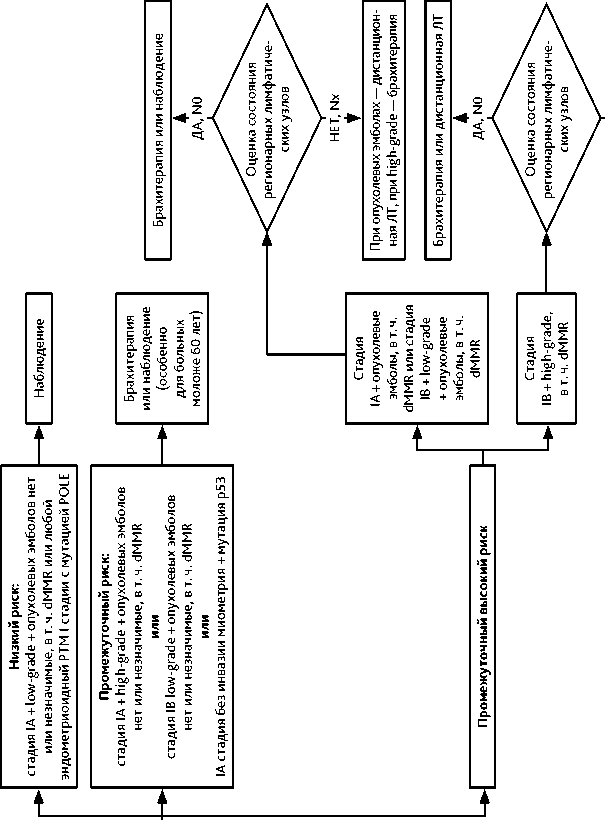
Рисунок 2. Рекомендуемое адъювантное лечение эндометриоидного РТМ I стадии (консенсус ESGO, ESMO, ESTRO, 2020 г.)
Брахитерапия
J-
ДА, N0
НЕТ, Nx
Дистанционная ЛТ ± брахитерапия
Рисунок 3. Рекомендуемое адъювантное лечение эндометриоидного РТМ II стадии (консенсус ESGO, ESMO, ESTRO, 2020 г.)
I Хирургическое лечение ZH Лекарственное лечение ± ЛТ
I Лекарственное лечение ± ЛТ
Рисунок 4. Рекомендуемая тактика лечения эндометриоидного РТМ III—IV стадий
Неэндометриоидный РТМ
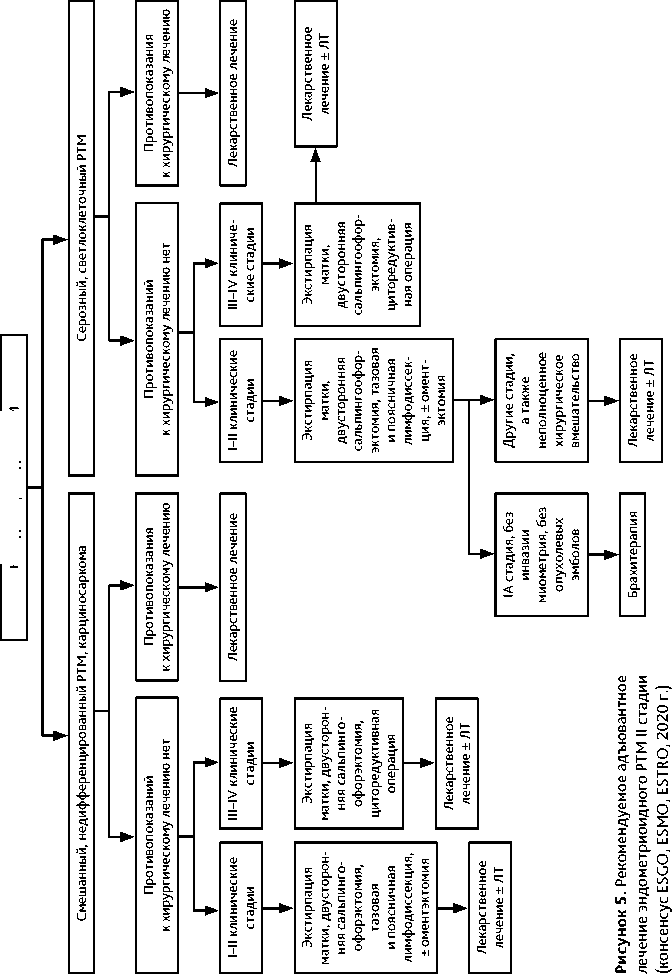

Сочетанная ЛТ
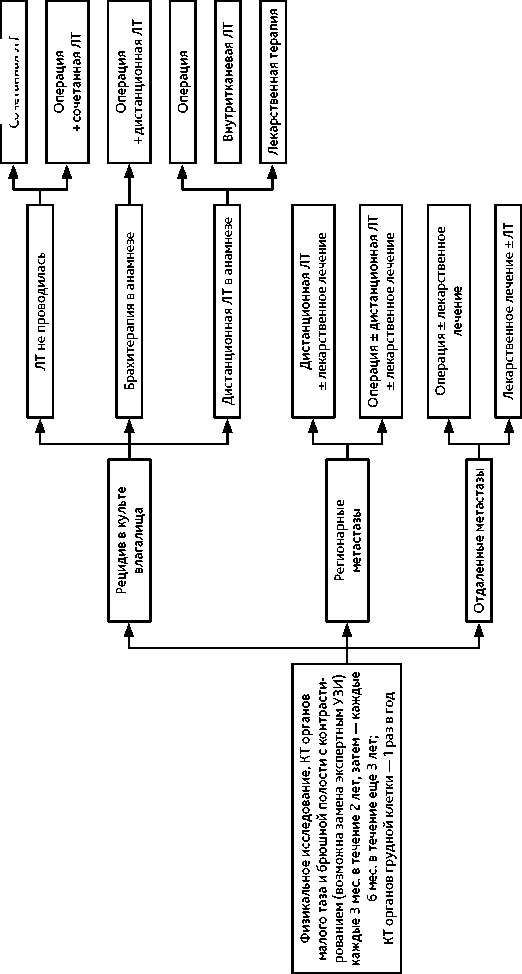
Рисунок 6. Рекомендуемый алгоритм лечения прогрессирования РТМ
| том /vol. 14(3s2) 2024
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


