Рак желудка
Автор: Бесова Н.С., Болотина Л.В., Гамаюнов С.В., Калинин А.Е., Козлов Н.А., Малихова О.А., Неред С.Н., Пирогов С.С., Проценко С.А., Стилиди И.С., Телетаева Г.М., Тер-ованесов М.Д., Трякин А.А., Хомяков В.М., Черных М.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-1 т.14, 2024 года.
Бесплатный доступ
Рак желудка, аденокарцинома желудка, аденокарцинома пищеводножелудочного перехода, лекарственная терапия, химиотерапия, трастузумаб, рамуцирумаб, эгдс
Короткий адрес: https://sciup.org/140307391
IDR: 140307391 | DOI: 10.18027/2224-5057-2024-14-3s2-1.1-13
Текст статьи Рак желудка
Если оперативное лечение было выполнено после ХТ, к указанию стадии по TNM добавляется префикс “у” , т. е. ypTNM.
При вовлечении в опухолевый процесс зоны пищеводно-желудочного перехода применяют классификацию Зиверта. Аденокарциному, центр которой расположен на 2–5 см ниже анатомической границы пищеводно-желудочного перехода (III тип по Зиверту), классифицируют и лечат как РЖ. Если центр аденокарциномы расположен на уровне зубчатой линии, т. е. в пределах 2 см ниже и 1 см выше анатомической границы пищеводно- желудочного перехода (II тип по Зиверту), или в нижней трети пищевода выше анатомической границы пищеводно-желудочного перехода в пределах 1–5 см (I тип по Зиверту), процесс классифицируют и лечат как рак пищевода. Тактика лечения локализованных форм аденокарциномы кардиоэзофагеального перехода I и II типов по Зиверту аналогична тактике лечения рака пищевода, лечение диссеминированных и метастатических форм аденокарцином аналогично лечению диссеминированного РЖ.
Классификация РЖ по системе TNM и группировка по стадиям представлены в табл. 1 и 2 соответственно.
GX —степень дифференцировки не может быть оценена;
G1 — высокодифференцированный рак;
G2 — умеренно дифференцированный рак;
G3 — низкодифференцированный, недифференцированный рак.
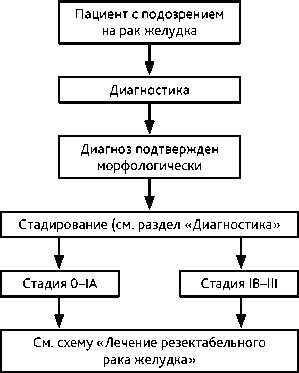
2. ДИАГНОСТИКА
Диагноз РЖ основывается на данных осмотра, результатах инструментальных методов обследования и патоморфологическом заключении. Первичное обследование должно быть проведено до начала любого вида лечения и включает в себя:
-
1) определение функционального состояния пациента
-
• сбор жалоб, анамнеза и физикальный осмотр с обязательной пальпацией левой надключичной области (исключение метастаза Вирхова в левых надключичных лимфоузлах), пупка (исключение метастаза сестры Жозеф в пупке), пальцевым исследованием прямой кишки у мужчин для исключения метастазирования в параректальную клетчатку (метастаз Шницлера) и бимануальным гинекологическим осмотром женщин (исключение метастаза Крукенберга в яичниках и метастаза Шницлера);
-
• оценка количества и тяжести сопутствующих заболеваний, адекватности их терапии;
-
• измерение роста и веса;
-
• клинический анализ крови с подсчетом лейкоцитарной формулы и количества тромбоцитов;
-
• биохимический анализ крови с исследованием показателей функции печени, почек;
-
• коагулограмма;
-
• общий анализ мочи;
-
• электрокардиография;
-
• сбор семейного онкологического анамнеза
-
• оценка функционального статуса пациента по шкале ECOG или по шкале Кар-новского
-
2) определение распространенности заболевания с помощью методов объективного обследования:
КТ органов грудной клетки, брюшной полости и таза с пероральным и в/в контрастированием позволяет оценить состояние регионарных лимфатических коллекторов, распространение опухоли на соседние органы и ткани, исключить наличие отдаленных метастазов;
УЗИ шейных лимфатических узлов;
– при подозрении на перитонеальный канцероматоз и невозможности его верификации путем забора асцитической жидкости или чрескожной биопсии брюшины;
– перед хирургическим вмешательствам при планировании конверсионного лечения;
– при подозрении на канцероматоз после ранее проведенного хирургического или комбинированного лечения.
Лапароскопия не показана при раннем РЖ, а также при наличии ургентных осложнений, требующих неотложной операции;
колоноскопия выполняется для исключения опухоли кишки у больных старше 50 лет при планировании радикального лечения;
ПЭТ-КТ — при подозрении на наличие отдаленных метастазов в случаях, когда их подтверждение значимо изменяет тактику лечения;
ПЭТ-КТ-FAPI — при локализованных стадиях РЖ диффузного или смешанного подтипов по Lauren для уточнения местного распространения процесса в качестве дополнительного метода при недостаточной информативности других методов обследования, а также для дифференциальной диагностики рецидива заболевания от послеоперационных воспалительных изменений;
-
• биопсия метастазов или подозрительных в отношении метастазов очагов под контролем УЗИ/КТ, когда их подтверждение меняет лечебную тактику;
-
• определение уровня СА-72–4, РЭА, CA19-9 для динамического контроля в процессе лечения диссеминированных форм;
-
• остеосцинтиграфия — при подозрении на метастатическое поражение костей;
-
• консультация невролога — при подозрении на метастатическое поражение ЦНС или наличии симптомов полинейропатии;
-
• стернальная пункция или трепанобиопсия подвздошной кости (при подозрении на метастатическое поражение костного мозга);
-
• гистологическое, цитологическое исследование биопсированного материала;
-
3) Молекулярно-генетическое тестирование
-
• молекулярно-генетическое обследование пациента на наличие герминальных мутаций в гене CDH1 при наличии хотя бы одного из нижеперечисленных критериев:
-
А) критерии семейного анамнеза с включением кровных родственников первой-второй степени родства:
мутаций при доступности соответствующих лекарственных препаратов, например, слияние NTRK с последующим назначением ларотректиниба).
При подготовке к хирургическому лечению с целью оценки функционального статуса по показаниям проводят дополнительные функциональные тесты: ЭхоКГ, холтеровское мониторирование, исследование ФВД, УЗДГ сосудов (вен) нижних конечностей, исследование свёртывающей системы крови, анализы мочи, консультации врачей-специалистов (кардиолога, эндокринолога, невролога и т. п.), иные диагностические исследования, необходимые для оценки состояния пациента в конкретной клинической ситуации.
Выбор лечебной тактики осуществляется на мультидисциплинарном консилиуме с участием хирурга, химиотерапевта, эндоскописта, терапевта, анестезиолога на основании результатов дооперационного обследования с определением клинической стадии заболевания и функционального состояния больного, при необходимости могут быть привлечены другие специалисты. Лечебная тактика определяется степенью распространённости (стадией) опухолевого процесса и функциональным состоянием пациента. Основным методом радикального лечения РЖ является хирургическое вмешательство, дополняемое в большинстве случаев системной противоопухолевой терапией.
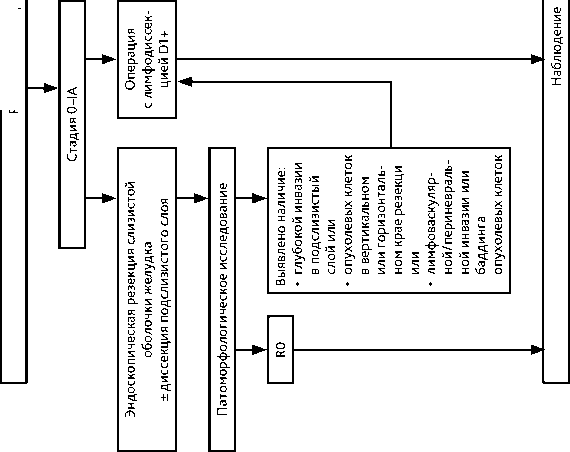
Абсолютные показания:
-
• аденокарцинома дифференцированного типа без изъязвления (UL0), без признаков инвазии в подслизистый слой (Т1а), размером ≤ 2 см (абсолютное показание к удалению методиками резекции опухоли с окружающей слизистой оболочкой и методикой диссекции подслизистого слоя);
-
• аденокарцинома дифференцированного типа без изъязвления (UL0), без признаков инвазии в подслизистый слой (Т1а), размером более 2 см (абсолютное показание к удалению методикой диссекции подслизистого слоя);
-
• аденокарцинома дифференцированного типа с наличием изъязвления (UL1), без признаков инвазии в подслизистый слой (Т1а), размером ≤ 3 см (абсолютное показание к удалению методикой диссекции подслизистого слоя).
Расширенные показания (только при возможности измерения глубины инвазии в мкм):
-
• аденокарцинома недифференцированного типа без изъязвления (UL0), без признаков инвазии в подслизистый слой (Т1а), размером ≤ 2 см (расширенное показание к удалению методикой диссекции подслизистого слоя);
-
• аденокарцинома дифференцированного типа размером ≤ 3 см, без изъязвления (UL0), при которой глубина инвазии диагностирована как T1b (SM1, т. е. ≤ 500 мкм), отсутствует лимфоваскулярная инвазия.
-
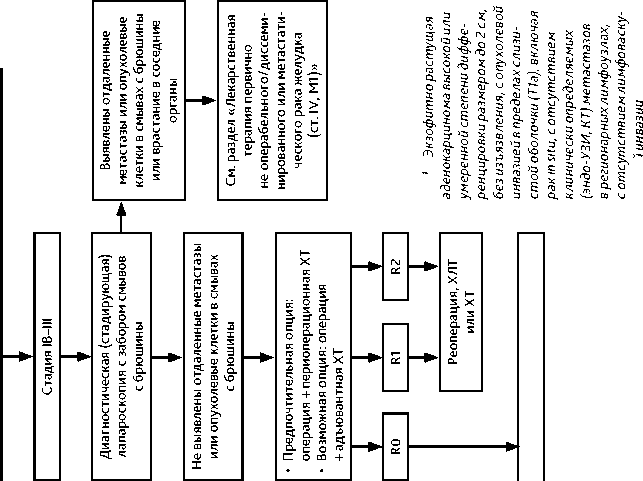
3.1.1.2. Стадии IB–III (Tis–4N1–3M0)
В случае обнаружения при плановом гистологическом исследовании глубокой (более 500 мкм) инвазии опухоли в подслизистый слой, опухолевых клеток в вертикальном крае резекции или наличия лимфоваскулярной инвазии показано стандартное хирургическое лечение с лимфодиссекцией D1 + (удаление перигастральных лимфатических узлов, а также лимфатических узлов левой желудочной артерии, передне-верхних лимфоузлов общей печеночной артерии, лимфоузлов чревного ствола).
Для пожилых пациентов с высоким операционным риском и тяжелыми сопутствующими заболеваниями возможно расширение показаний для эндоскопического лечения или выполнение условно-радикальных эндоскопических вмешательств (аргон-плазмен-ная коагуляция, ФДТ). Такие клинические ситуации требуют мультидисциплинарного консилиума и рассматриваются как относительные показания, вмешательство может быть выполнено при наличии согласия, полученного от пациента после объяснения риска сохранения резидуальной опухоли и более высокого риска возможного метастазирования в лимфатические узлы.
Вариантом хирургического лечения являются лапароскопические операции: лапароскопическая дистальная субтотальная резекция, лапароскопическая гастрэктомия. Адъювантная лекарственная терапия не показана.
Операция может быть выполнена как открытым, так и лапароскопическим способом, в том числе и при местнораспространенном РЖ. При РЖ с распространением на пищевод выше диафрагмы (III тип по Зиверту) возможно применение трансторакальных доступов.
При невозможности хирургического вмешательства (противопоказания, местная распространенность, отказ пациента) рекомендуется проведение лекарственной терапии, в индивидуальных случаях возможно рассмотреть вопрос о проведении ХЛТ.
При выполнении оперативного вмешательства в неадекватном объеме:
ХЛТ начинают на 29-й день после операции, на первом этапе проводят один 28-дневный цикл ХТ, далее с 29-го дня начинают ЛТ фракциями по 1,8 Гр 5 дней в неделю на протяжении 5 недель, СОД 45–50,4 Гр в комбинации с ХТ, по окончании комбинированного лечения проводят еще 2 цикла ХТ. ХЛТ неэффективна при диффузном подтипе по классификации Лаурена, в этом случае назначают ХТ. ХЛТ может быть применена для лечения изолированных местных рецидивов или олигометастатической болезни. Рекомендуемые режимы ХЛТ РЖ представлены в табл. 3.
|
Режим химиотерапии |
Количество курсов до начала ЛТ |
Этап лучевой терапии с радиомодификацией фторпирими-динами |
Количество курсов после ЛТ |
|
Капецитабин 1500–2000 мг/м²/сут. внутрь в два приема (т. е. по 750– 1000 мг/м 2 2 раза в день) в 1–14-й дни Цикл 21 день |
1 |
Капецитабин по 1250–1650 мг/м² /сут. внутрь в два приема (т. е. по 625–825 мг/м 2 2 раза в день) в дни 1–5 каждой недели в течение 5 недель ЛТ ИЛИ Фторурацил по 200–250 мг/м²/сут. в/в непрерывная 24-часовая инфузия в дни 1–5 каждой недели в течение 5 недель |
2 |
|
Кальция фолинат 400 мг/м² в/в капельно 2 часа в 1-й и 15-й дни + фторурацил 400 мг/м 2 в/в струй-но в день 1 + фторурацил по 1200 мг/м 2 в/в 24-часовая инфузия в 1-й, 2-й, дни. Каждые 2 недели |
2 |
4 |
|
Режим химиотерапии |
Количество курсов до начала ЛТ |
Этап лучевой терапии с радиомодификацией фторпирими-динами |
Количество курсов после ЛТ |
|
Оксалиплатин 85 мг/м² в/в в день 1 + кальция фолинат 400 мг/м² в/в в день 1 + фтор-урацил 400 мг/м 2 в/в струйно + фторурацил по 1200 мг/м 2 в/в 24-часовая инфузия в 1-й, 2-й, дни/Каждые 2 недели |
3 цикла на фоне лучевой терапии |
3 |
При решении вопроса о назначении адъювантной или периоперационной ХТ при операбельных стадиях РЖ возможен учет данных ретроспективного анализа исследований MAGIC и CLASSIC и последующих ретроспективных мета-анализов, показавших, что при MSI в опухоли добавление адъювантной ХТ к оперативному лечению не улучшает выживаемость.
Рекомендована при опухолях pT > 2pN0 и pT любое pN + в режиме XELOX, который назначается через 3–6 нед. после операции и проводится на протяжении 6 мес., всего 8 курсов (табл. 4). Согласно исследованию CLASSIC, проведенному в Южной Корее, Китае и Тайвани, дополнение радикальной операции адъювантной ХТ улучшает безрецидивную 5-летнюю выживаемость на 15%, 5-летнюю общую выживаемость — на 8%. Возможно назначение ХТ при pT2N0 c признаками высокого риска рецидива болезни (низкодифференцированный рак, наличие лимфоваскулярной или периневральной инвазии, возраст менее 50 лет или отсутствие D2 диссекции, патоморфологическое исследование менее 16 лимфоузлов).
Согласно последним рекомендациям ESMO пациентам с наличием MSI в опухоли, подвергшимся радикальному хирургическому лечению без неоадъювантной химиотерапии, адъювантная химиотерапия не рекомендуется.
Рекомендована при опухоли cT > 1N любое и cT любое N + . Предпочтительной программой является режим FLOT: 4 курса предоперационно, с последующей операцией через 4–6 нед. после окончания четвертого курса предоперационной химиотерапии, начало послеоперационного этапа химиотерапии — через 4–8 (максимум через 12) нед. после операции: проведение еще 4 курсов в режиме FLOT вне зависимости от лечебного патоморфоза в опухоли. При невозможности проведения терапии в режиме FLOT возможными вариантами могут быть комбинации mFOLFOX6 (суммарно 8–12 курсов), XELOX (3 курса — до и 3 курса — после операции, суммарно — 6 курсов) или цисплатин + фторурацил (3 курса — до и 3 курса — после операции, суммарно — 6 курсов) с началом послеоперационного этапа через 4–6 нед. после даты операции, максимально допустимый интервал до начала ХТ — 12 нед. (табл. 4).
При непереносимости режима FLOT в ходе периоперационной химиотерапии возможна редукция доз препаратов или его замена на режим mFOLFOX6.
В состав предоперационной лекарственной терапии может быть включен трастузумаб при выявлении гиперэкспрессии HER2/neu в опухоли или иммунотерапия — при наличии MSI, что увеличивает частоту достижения полных патоморфологических ответов с возможным положительным влиянием на выживаемость.
При аденокарциноме cT2N0M0 низкой степени злокачественности пациентам пожилого возраста или с отягощенным соматическим статусом на первом этапе может быть рекомендовано хирургическое лечение с последующим решением вопроса об адъювантной химиотерапии или наблюдении.
Под динамическим наблюдением подразумевают регулярный сбор жалоб и физикальный осмотр больных (после мукозэктомий в дополнение к этому рекомендуется выполнение ЭГДС) по определенному графику: каждые 3 мес. — в течение 1-го года после операции, каждые 3–6 мес. — на протяжении 2-го и 3-го года после операции, затем — ежегодно. Инструментальное обследование показано при подозрении на рецидив или метастазирование.
Инфузионное введение 5-фторурацила эффективнее струйного; в комбинациях, основанных на инфузионном введении 5-фторурацила, замена инфузионного введения струйным не допустима.
Эквивалентом инфузионному введению 5-фторурацила является капецитабин.
Цисплатин и оксалиплатин являются взаимозаменяемыми препаратами, выбор препарата определяется токсическим профилем.
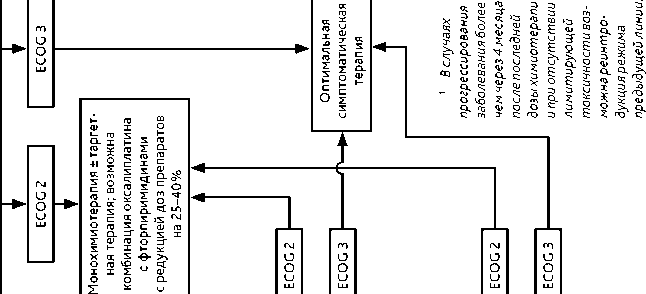
У больных пожилого и старческого возраста, в общем состоянии по шкале ECOG 2 балла и/или с сопутствующими заболеваниями средней степени тяжести наиболее опти- мальным представляется применение дуплета оксалиплатина с фторпиримидинами (XELOX или FOLFOX) с редукцией доз препаратов на 40% и возможноcтью эскалации доз после улучшения состояния. Менее предпочтительной альтернативой является монотерапия фторпиримидинами, доцетакселом, иринотеканом.
-
• При общем состоянии по шкале ECOG 3 балла, наличии тяжелых сопутствующих заболеваний показана симптоматическая терапия.
-
• При назначении тройных комбинаций химиотерапии (DCF, mDCF, FOLFIRINOX) реко
-
3.1.5.2. Продолжительность лекарственной терапии
-
3.1.5.3. Тактика лекарственной терапии при прогрессировании болезни в процессе или после окончания I линии лечения/адъювантной химиотерапии
мендовано назначение первичной или вторичной профилактики Г-КСФ: например, филграстим по 5 мкг/кг (возможно округление разовой дозы до 300 мкг) п/к через 24–72 часа после завершения курса терапии и до восстановления нормального АЧН после максимального их падения или других Г-КСФ.
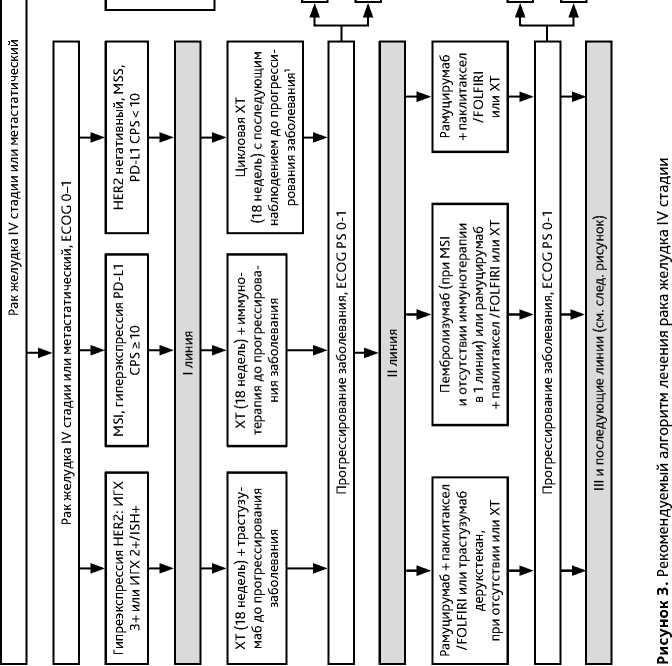
Рекомендуется проведение ХТ I линии на протяжении 18 нед. (6 трехнедельных циклов или 9 двухнедельных циклов) с последующим наблюдением до прогрессирования болезни. Роль поддерживающей ХТ фторпиримидинами изучается. Возможно проведение ХТ I линии до прогрессирования болезни. При назначении в I линии лечения РЖ и пищеводно-желудочного перехода трастузумаба или иммунотерапии рекомендуется их продолжение после окончания ХТ до прогрессирования болезни или развития неприемлемой токсичности.
При общем состоянии пациента по шкале ECOG 3 балла, наличии тяжелых сопутствующих заболеваний или осложнений опухолевого процесса показана оптимальная симптоматическая терапия. После принятия решения о проведении II линии лекарственной терапии при выборе конкретного режима лечения необходимо учесть:
-
• наличие остаточных побочных эффектов предыдущего режима лечения;
-
• имеющуюся и потенциальную кумулятивную токсичность;
-
• возможность перекрестной резистентности и токсичности;
-
• эффективность режима I линии;
-
• длительность интервала без лечения, который исчисляется от даты введения последней дозы препаратов I линии или адъювантной ХТдо момента регистрации прогрессирования процесса на основании жалоб и/или данных объективных методов обследования.
При регистрации прогрессирования болезни через 4 мес. и более после окончания ХТ I линии (для адъювантной ХТ — через 6 и более мес.) возможна реинтродукция режима I линии лечения. При регистрации прогрессирования процесса на фоне ХТ I линии или адъювантной ХТ или в течение интервала без лечения менее 3 мес. от даты окончания I линии лечения (для адъювантной ХТ < 6 мес.) показана смена режима. В качестве II линии терапии рекомендуется использовать препараты, не вошедшие в режим I линии. Таксаны и иринотекан равно эффективны во II линии ХТ. Вопрос о более высокой эффективности комбинированной терапии по сравнению с монотерапией остается открытым. Результаты сравнительных клинических исследований противоречивы.
При HER2-позитивном диссеминированном РЖ продолжение введения трастузумаба во II линии лечения оказалось неэффективным по сравнению с одной только ХТ. Однако по данным рандомизированного исследования DESTINY — Gastric01 назначение трастузумаба дерукстекана (T-DXd) во II и последующихлиниях привело к увеличению медианы выживаемости с 8,9 мес до 12,5 мес [ОР 0,60(0,42–0,86)] по сравнению со стандартной ХТ. При сохранении HER2-позитивности в опухоли после прогрессирования на I линии может обсуждаться вопрос о продолжении введения трастузумаба со сменой режима ХТ в случае длительного интервала без ХТ.
Согласно результатам рандомизированных исследований применение рамуцирумаба в монорежиме или в комбинации с паклитакселом статистически значимо увеличивает общую выживаемость больных по сравнению с оптимальной симптоматической терапией или паклитакселом, в связи с чем предпочтительно назначение комбинации рамуцирумаба с паклитакселом. При наличии полинейропатии или при прогрессировании болезни на фоне таксанов возможно назначение комбинации рамуцирумаба с иринотеканом или режимом FOLFIRI. Длительность терапии II и последующих линий определяется эффективностью и переносимостью и может проводиться до прогрессирования заболевания. Рекомендуемые режимы II линии лекарственного лечения РЖ представлены в табл. 5.
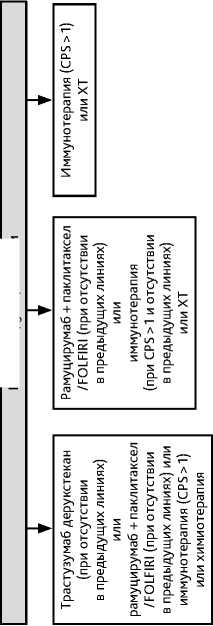
Вопрос о проведении III и последующих линий лекарственной терапии решается индивидуально по усмотрению врача с учетом функционального статуса больного, эффективности и токсичности предшествующих линий лекарственной терапии, доступности лекарственных препаратов, желания больного.
Для лечения пациентов с наличием MSI в опухоли во второй линии терапии рекомендуется назначение ингибиторов контрольных точек (пембролизумаб), если они не были назначены в составе первой линии лечения.
Решение о назначении препаратов должно приниматься на врачебном консилиуме или врачебной комиссии с соответствующей записью в медицинской документации.
|
Название режима |
Препараты |
Доза (мг/м²), способ введения |
Дни введения |
Цикличность |
|
Комбинированные режимы химиотерапии |
||||
|
CF |
Цисплатин |
80 мг/м² в/в |
1 |
Каждые 4 нед. |
|
5-ФУ |
1000 мг/м² в/в 24 часа |
1, 2, 3, 4, 5 |
||
|
FOLFIRI |
Иринотекан |
180 мг/м² в/в |
1 |
Каждые 2 нед. |
|
Кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-ФУ |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
XP |
Цисплатин |
80 мг/м² в/в |
1 |
Каждые 3 нед. |
|
Капецитабин |
2000 мг/м² в сутки внутрь в 2 приема |
1–14 |
||
|
Название режима |
Препараты |
Доза (мг/м²), способ введения |
Дни введения |
Цикличность |
|
XELOX |
Оксалиплатин 1 |
100–130 мг/м² в/в |
1 |
Каждые 3 нед. |
|
Капецитабин |
2000 мг/м² в сутки внутрь в 2 приема |
1–14 |
||
|
mFOLFOX6 |
Оксалиплатин |
85 мг/м² в/в |
1 |
Каждые 2 нед. |
|
Кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
T-XP² |
Трастузумаб |
6 мг/кг (нагрузочная доза 8 мг/кг) в/в |
1 |
Каждые 3 нед. |
|
Цисплатин |
80 мг/м² в/в |
1 |
||
|
Капецитабин |
2000 мг/м² в сутки внутрь в 2 приема |
1–14 |
||
|
T-XELOX² |
Трастузумаб |
6 мг/кг (нагрузочная доза 8 мг/кг) в/в |
1 |
Каждые 3 нед. |
|
Оксалиплатин 1 |
100–130 мг/м² в/в |
1 |
||
|
Капецитабин |
2000 мг/м² в сутки внутрь в 2 приема |
1–14 |
||
|
T-mFOLFOX6² |
Трастузумаб |
4 мг/кг (нагрузочная доза 6 мг/кг) в/в |
1 |
Каждые 2 нед. |
|
Оксалиплатин |
85 мг/м² в/в |
1 |
||
|
Кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
mDCF |
Доцетаксел |
40 мг/м 2 в/в |
1 |
Каждые 2 нед. |
|
Кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
Цисплатин |
40 мг/м 2 в/в |
1 |
||
|
FLOT |
Доцетаксел |
50 мг/м² в/в |
1 |
Каждые 2 нед. |
|
Оксалиплатин |
85 мг/м² в/в |
1 |
||
|
Кальция фолинат |
200 мг/м² в/в |
1 |
||
|
5-фторурацил 3 |
2600 мг/м² в/в 24 3 часа |
1 |
||
|
FOLFIRINOX |
Иринотекан |
180 мг/м² в/в |
1 |
Каждые 2 нед. |
|
Оксалиплатин |
85 мг/м² в/в |
1 |
||
|
Кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
250–400 мг/м² в/в струйно + 2200–2400 мг/м² в/в 46–48 часов |
1 |
||
|
T-mDCF² |
Трастузумаб |
4 мг/кг (нагрузочная доза 6 мг/кг) в/в |
1 |
Каждые 2 нед. |
|
Доцетаксел |
40 мг/м 2 в/в |
1 |
||
|
Кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
Цисплатин |
40 мг/м 2 в/в |
1 |
|
Название режима |
Препараты |
Доза (мг/м²), способ введения |
Дни введения |
Цикличность |
|
T-FLOT² |
Трастузумаб |
4 мг/кг (нагрузочная доза 6 мг/кг) в/в |
1 |
Каждые 2 недели |
|
Доцетаксел |
50 мг/м² в/в |
1 |
||
|
Оксалиплатин |
85 мг/м² в/в |
1 |
||
|
Кальция фолинат |
200 мг/м² в/в |
1 |
||
|
5-фторурацил |
2600 мг/м² в/в х 24 часа |
1 |
||
|
T-FOLFIRI² |
Трастузумаб |
4 мг/кг (нагрузочная доза 6 мг/кг) в/в |
1 |
Каждые 2 недели |
|
Иринотекан |
180 мг/м² в/в |
1 |
||
|
Кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
T-FOLFIRINOX² |
Трастузумаб |
4 мг/кг (нагрузочная доза 6 мг/кг) в/в |
1 |
Каждые 2 недели |
|
Иринотекан |
180 мг/м² в/в |
1 |
||
|
Оксалиплатин |
85 мг/м² в/в |
1 |
||
|
Кальция фолинат |
400 мг/м² в/в |
1 |
||
|
5-фторурацил |
250–400 мг/м² в/в струйно + 2200–2400 мг/м² в/в 46–48 часов |
1 |
||
|
N + XELOX (только при экспрессии PD-L1 CPS ≥ 10 или MSI) 4 |
Ниволумаб |
360 мг |
1 |
Каждые 3 нед. |
|
Оксалиплатин 1 |
100–130 мг/м² в/в |
1 |
||
|
Капецитабин |
2000 мг/м² внутрь в два приема |
1–14 |
||
|
N + mFOLFOX6 (только при экспрессии PD-L1 CPS ≥ 10 или MSI) |
Ниволумаб |
240 мг |
1 |
Каждые 2 нед. |
|
Оксалиплатин |
85 мг/м 2 в/в |
1 |
||
|
Кальция фолинат |
400 мг/м 2 в/в |
1 |
||
|
5-фторурацил |
400 мг/м 2 в/в струйно + 2400 мг/м 2 в/в 46–48 часов |
1 |
||
|
P + XELOX (только при PD-L1 CPS ≥ 10 или MSI) |
Пембролизумаб |
200 мг |
1 |
Каждые 3 недели |
|
Оксалиплатин |
130 мг/м² в/в |
1 |
||
|
Капецитабин |
2000 мг/м² в сутки внутрь в два приема |
1–14 |
||
|
Монотерапия (только для пожилых и ослабленных больных) |
||||
|
– |
5-фторурацил |
800 мг/м²/сут. в/в 24 часа |
1, 2, 3, 4, 5 |
Каждые 3–4 нед. |
|
– |
Кальция фолинат |
200 мг/м² в/в |
1 |
Каждые 2 нед. |
|
5-фторурацил |
400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1 |
||
|
– |
Капецитабин |
2000–2500 мг/м² в сутки внутрь в два приема |
1–14 |
Каждые 3 нед. |
|
– |
Иринотекан |
250 мг/м² в/в |
1 |
Каждые 3 нед. |
|
Название режима |
Препараты |
Доза (мг/м²), способ введения |
Дни введения |
Цикличность |
|
– |
Иринотекан |
150–180 мг/м² в/в |
1 |
Каждые 2 нед. |
|
– |
Доцетаксел |
60–75 мг/м² в/в |
1 |
Каждые 3 нед. |
|
– |
Паклитаксел |
80 мг/м² в/в |
1, 8, 15 |
Каждые 4 нед. |
1 При диссеминированном РЖ возможно применение разовой дозы 100 мг /м 2 .
-
2 Только для HER2-позитивных вариантов.
-
3 Возможно увеличение времени инфузии до 48 часов.
-
3.1.5.4. Особые клинические ситуации
-
3.1.5.4.1. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
-
|
Препарат |
Доза в мг/м², способ введения |
Дни введения |
Цикличность |
|
Монотерапия |
|||
|
Иринотекан |
250–300 мг/м² в/в |
1 |
Каждые 21 день |
|
Иринотекан |
150–180 мг/м² в/в |
1 |
Каждые 14 дней |
|
Доцетаксел |
60–75 мг/м² в/в |
1 |
Каждые 21 день |
|
Паклитаксел |
80 мг/м² в/в |
1, 8, 15 |
Каждые 28 дней |
|
Рамуцирумаб |
8 мг/кг в/в |
1 |
Каждые 14 дней |
|
Пембролизумаб |
2 мг/кг или 200 мг в/в |
1 |
Каждые 21 день |
|
Пембролизумаб |
400 мг в/в |
1 |
Каждые 6 недель |
|
Ниволумаб |
3 мг/кг или 240 мг в/в |
1 |
Каждые 14 дней |
|
Ниволумаб |
480 мг в/в |
1 |
Каждые 28 дней |
|
Ниволумаб |
360 мг в/в |
1 |
Каждые 21 день |
|
Трастузумаб-дерукстекан |
6,4 мг/кг в/в |
1 |
Каждые 21 день |
|
Комбинированные режимы |
|||
|
Рамуцирумаб Паклитаксел |
8 мг/кг в/в 80 мг/м² в/в |
1, 15 1, 8, 15 |
Каждые 28 дней |
|
Рамуцирумаб Иринотекан |
8 мг/кг в/в 150–180 мг/м² в/в |
1, 15 1, 15 |
Каждые 28 дней |
|
Рамуцирумаб Иринотекан Кальция фолинат 5-фторурацил |
8 мг/кг в/в 150–180 мг/м² в/в 400 мг/м² в/в 400 мг/м² в/в струйно + 2400 мг/м² в/в 46–48 часов |
1, 15 1, 15 1, 15 1, 15 |
Каждые 28 дней |
|
Препарат |
Доза в мг/м², способ введения |
Дни введения |
Цикличность |
|
Иринотекан Цисплатин |
60 мг/м² в/в 30 мг/м² в/в |
1, 8 1, 8 |
Каждые 21 день |
|
Иринотекан Капецитабин |
200 мг/м² в/в 1600 мг/м² в сутки внутрь в 2 приема |
1 1–14 |
Каждые 21 день |
|
Доцетаксел Капецитабин |
60–70 мг/м² в/в 1600 мг/м² в сутки в 2 приема |
1 1–14 |
Каждые 21 день |
XИМИОТЕРАПИЯ (HIPEC) И ВНУТРИБРЮШИННАЯ АЭРОЗОЛЬНАЯ ХИМИОТЕРАПИЯ ПОД ДАВЛЕНИЕМ (PIPEC)
Рутинно не рекомендуются. Допускаются только в рамках клинических исследований.
Отличается крайне неблагоприятным прогнозом, характеризуется меньшей чувствительностью к ХТ и ХЛТ. Лечение назначают в соответствии со стандартными рекомендациями, отдельных рекомендаций не разработано.
с обезболивающей целью в случае поражения костей. Режим ЛТ и объём облучения определяются в зависимости от локализации поражения и, соответственно, располагающихся в зоне облучения органов риска.
III и последующие линии
том /vol. 14(3s2) 2024
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


