Рак желудка у пациентов моложе и старше 50 лет: характеристики опухолевого процесса, анализ выживаемости
Автор: Коваленко Н.В., Жаворонкова В.В., Иванов А.И., Постолов М.П., Толстопятов С.Е., Джафаров Д.Д., Павловская П.М., Суворов В.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.21, 2022 года.
Бесплатный доступ
Цель исследования - изучить особенности рака желудка у больных моложе и старше 50 лет, получивших противоопухолевое лечение с хирургическим компонентом, и установить предикторы прогноза общей выживаемости для каждой из групп. Материал и методы. Проведено ретроспективное исследование непосредственных и отдаленных результатов хирургического лечения пациентов с раком желудка в ООХМЛ 5 ГБУЗ «ВОКОД» за три года. Выборка разделена на две группы: основную (50 лет и моложе) и контрольную (51 год и старше). Результаты. Из 350 пациентов, вошедших в анализ, 34 (9,71 %) были отнесены к основной группе и 316 (90,29 %) к контрольной. Заболевание у более молодых пациентов чаще протекало бессимптомно (p
Рак желудка, возраст больных, прогностические модели, анализ выживаемости
Короткий адрес: https://sciup.org/140293896
IDR: 140293896 | УДК: 616.33-006.6
Текст научной статьи Рак желудка у пациентов моложе и старше 50 лет: характеристики опухолевого процесса, анализ выживаемости
Изучение РЖ у молодых пациентов, кроме социальной актуальности, вызывает интерес и из-за взаимосвязи заболевания в этом возрасте с генетическими синдромами, к которым относят наследственный диффузный РЖ, синдром Ли–Фраумени, семейный аденоматозный полипоз, синдром Линча и синдром Пейтц–Егерса [5, 6]. Механизмы развития, клинико-патологические черты, прогноз, методы профилактики и лечения РЖ у молодых пациентов недостаточно изучены. До сих пор не определено, нужны ли данным пациентам отдельные лечебные алгоритмы [7]. Это обусловлено не только малой процентной долей заболевания в данной возрастной группе, но и этно-географическими различиями. Последнее обстоятельство объясняет актуальность изучения особенностей РЖ у молодых пациентов в сравнительном аспекте со старшей возрастной группой.
Материал и методы
Проведено ретроспективное одноцентровое нерандомизированное исследование, в которое включены данные пациентов, оперированных в онкологическом отделении хирургических мето-
дов лечения № 5 (ООХМЛ № 5) ГБУЗ «ВОКОД» с 01.04.2018 по 01.04.2021. Критерии включения пациентов в исследование: гистологически верифицированный РЖ; наблюдение за пациентом в ГБУЗ «ВОКОД» как минимум в течение 3 мес после операции. Критерии исключения: пациенты, история болезни которых была недоступна для исследования.
Наблюдение за пациентами проводили 1 раз в 3 мес в течение первого года после операции, 1 раз в 6 мес в течение второго года, а начиная с третьего года – 1 раз в год, при отсутствии прогрессирования заболевания. В контрольное обследование входил осмотр врача-онколога, лабораторные
Таблица 1/table 1
Клиническая характеристика пациентов clinical characteristics of patients
Характеристики/Characteristics p-value
<50 лет/<50 years >50 лет/>50 years
(n=34, 9,7 %) (n=316, 90,3 %)
|
Пол/Gender |
|||
|
Мужчины/Men Женщины/Women |
16 (47,1 %) 18 (52,9 %) |
204 (64,6 %) 112 (35,4 %) |
0,045* |
|
Симптомы болезни/Symptoms of the disease |
|||
|
Бессимптомное течение/Asymptomatic disease Наличие симптомов/Evidence of symptoms |
23 (67,6 %) 11 (32,4 %) |
58 (18,4 %) 258 (81,6 %) |
<0,001* |
|
Длительность болезни до операции, мес/ Duration of the disease before surgery, months Me [Q1–Q3] |
2 [1–4] |
8 [5–10] |
<0,001* |
Информация о пациентах внесена в базу Microsoft Excel 2019. Статистический анализ проведен с помощью программы SPSS версии 26 (SPSS Inc, Chicago, IL). Для оценки нормальности распределения количественных данных использовали критерий Шапиро–Уилка (при числе исследуемых менее 50) или критерий Колмогорова–Смирнова
(при числе исследуемых более 50), а также показатели асимметрии и эксцесса. В случае описания нормально распределенных количественных показателей проводили расчет средних арифметических (M) и стандартных отклонений (SD), границ 95 % доверительного интервала (95 % ДИ). Количественные признаки, распределение которых отличалось от нормального, анализировали при помощи медианы (Me), нижнего и верхнего квартилей (Q1-Q3). Номинальные признаки описывали с указанием абсолютных значений и процентных долей. Для сравнения количественных признаков использовали U-критерий Манна–Уитни. Сравнение номинальных данных проводилось при помощи критериев χ2 Пирсона и точного теста Фишера. В случае анализа четырехпольных таблиц при ожидаемом явлении хотя бы в одной ячейке менее 10, рассчитывался критерий χ2 с поправкой Йейтса. При анализе многопольных таблиц использовали критерий χ2 Пирсона с поправкой Бенджамини– Хохберга. Анализировали общую выживаемость (ОВ) от даты операции до последней даты наблюдения или летального исхода. Оценку функции ОВ пациентов проводили по методу Каплан–Мейера. Различия ОВ в группах определяли с применением log-rank теста. Анализ факторов, влияющих на ОВ, проводили по методу регрессии Кокса.
Результаты
Прогрессирование заболевания установлено у 90 (25,7 % от всей совокупности) пациентов. Местный рецидив выявлен у 15 (4,3 %) пациентов, отдаленные метастазы – у 72 (20,6 %) больных. Сочетание местного рецидива и отдаленного мета- стазирования – у 13 (3,7 %) пациентов. При этом у пациентов моложе 50 лет случаев изолированных местных рецидивов не выявлено. Отдаленное метастазирование наблюдалось у 7 (87,5 %) больных. Сочетание местного рецидива и отдаленных метастазов зарегистрировано у 1 (12,5 %) пациента. У больных старше 50 лет местный рецидив выявлен в 15 (16,3 %) случаях, отдаленные метастазы – у 65 (70,7 %) больных, сочетание местного рецидива и отдаленного метастазирования – у 12 (13,04 %) пациентов.
За время наблюдения зафиксировано 87 (24,8 %) летальных исходов. Из них от прогрессирования опухолевого процесса – у 68 (19,4 %), от неонкологических заболеваний – у 19 (5,4 %) больных. Выбыли из-под наблюдения 64 (18,3 %) пациента. Среди пациентов основной группы за время наблюдения зафиксировано 2 (5,88 %) смерти от прогрессирования опухоли, выбыли из-под наблюдения 12 (35,29 %) пациентов. В контрольной группе от прогрессирования рака умерли 66 (20,89 %) пациентов, от неонкологического заболевания – 19 (6,01 %), выбыли из-под наблюдения 52 (16,46 %) больных. Медиана выживаемости за период наблюдения не достигнута. Средний срок развития исхода составлял 26,09 ± 0,88 мес (95 % ДИ 24,36–27,82 мес).
Нами проведена оценка вероятности смерти пациентов в зависимости от времени, прошедшего от операции (табл. 5). Риск смерти у пациентов, проживших 27 мес после операции, достигал 41,37 ± 4,3 %, после чего данный показатель не демонстрировал тенденции к изменению в течение всего оставшегося периода наблюдения. Однолетняя общая выживаемость пациентов составляла 79,93 ± 2,4 %, двухлетняя – 62,42 ± 3,7 %, а трехлетняя – 58,63 ± 4,3 %.
Анализ кривой Каплан–Мейера, построенной для всей совокупности пациентов, показал схожие результаты. Снижение общей выживаемости происходило в течение периода наблюдения относительно равномерно, выходя на условное плато после 24 мес. Среднее значение времени выживания для всей совокупности пациентов – 26,09 ± 0,88 мес (95 % ДИ 24,36–27,82) (рис. 1). При сравнении ОВ у пациентов основной и контрольной групп (рис. 2) установлены статистически значимые различия (p=0,002). Средний срок наступления летального исхода в основной группе был существенно выше – 34,93 ± 1,03 мес (95 % ДИ 32,91–36,95), чем в контрольной группе, – 25,11 ± 0,97 мес. (95 % ДИ 23,22–27,01). Для определения ОВ с учетом стадии процесса выполнено построение кривых Каплан–Майера для всей совокупности пациентов (рис. 3) и для сравниваемых групп в отдельности (рис. 4, 5).
Разработку прогностических моделей Кокса, позволяющих определить риск смерти пациентов, в зависимости от факторов риска при наблюдении
Таблица 2/table 2
|
Характеристики/Characteristics |
Группы/Groups |
p-value |
|
|
<50 лет/<50 years (n=34, 9,7 %) |
>50 лет/>50 years (n=316, 90,3 %) |
||
|
Гистотип опухоли/Histotype of tumors |
|||
|
1. Аденокарцинома кишечного типа/ Intestinal type adenocarcinoma |
3 (8,8 %) |
107 (30,6 %) |
общ.<0,001* |
|
2. Аденокарцинома диффузного типа/ Diffuse type adenocarcinoma |
13 (38,2 %) |
170 (48,6 %) |
(p1=0,004* |
|
3. Аденокарцинома с перстневидными клетками/ |
4 (11, %) |
17 (4,9 %) |
p3=0,049* |
|
Adenocarcinoma with signet-ring cells |
|||
|
4. Перстневидноклеточный рак/Signet-ring cancer |
11 (32,4 %) |
49 (14,0 %) |
p4=0,001* |
|
5. Смешанные и другие гистотипы/ |
3 (8,8 %) |
7 (2,0 %) |
|
|
Mixed and other gystologic types |
p5=0,003*) |
||
|
Стадия pTNM 7/Stage pTNM 7 |
|||
|
IA |
5 (14,7 %) |
16 (5,1 %) |
|
|
IB |
8 (23,5 %) |
50 (15,8 %) |
|
|
IIA |
3 (8,8 %) |
51 (16,1 %) |
|
|
IIB |
6 (17,6 %) |
47 (14,9 %) |
0,312 |
|
IIIA |
3 (8,8 %) |
40 (12,7 %) |
|
|
IIIB |
4 (11,8 %) |
60 (19,0 %) |
|
|
IIIC |
2 (5,9 %) |
29 (9,2 %) |
|
|
IV |
3 (8,8 %) |
23 (7,3 %) |
|
|
Стадия по TNM/TNM stage |
|||
|
T1a |
2 (5,9 %) |
9 (2,8 %) |
|
|
T1b |
8 (23,5 %) |
16 (5,1 %) |
|
|
T2 T3 |
7 (20,6 %) |
63 (19,9 %) |
0,001* (pT1b<0,001) |
|
5 (14,7 %) |
55 (17,4 %) |
||
|
T4a |
12 (35,3 %) |
109 (34,5 %) |
|
|
T4b |
– |
64 (20,3 %) |
|
|
Инвазия серозной оболочки или соседних структур (pT4a-b)/ Invasion of the serous membrane or neighboring anatomi- |
12 (35,3 %) |
173 (54,7 %) |
0,031* |
|
cal structures (pT4a-b) |
|||
|
N0 |
22 (64,7 %) |
165 (52,2 %) |
|
|
N1 |
2 (5,9 %) |
73 (23,1 %) |
0,121 |
|
N2 |
7 (20,6 %) |
61 (19,3 %) |
|
|
N3 |
3 (8,8 %) |
17 (5,4 %) |
|
|
N+ |
12 (35,3 %) |
151 (47,8 %) |
0,165 |
|
Количество л/у с метастазами)/ Number of metastatic regional lymph nodes Me [Q1-Q3] |
5 [4,5–7] |
2 [1–5] |
0,003* |
|
M0 |
31 (91,2 %) |
293 (92,7 %) |
0,729 |
|
M1 |
3 (8,8 %) |
23 (7,3 %) |
|
|
G1 |
4 (11,8 %) |
35 (11,1 %) |
|
|
G2 |
10 (29,4 %) |
102 (32,3 %) |
0,81 |
|
G3 |
20 (58,8 %) |
167 (52,8 %) |
|
|
G4 |
– |
12 (3,8 %) |
|
|
LVI |
19 (55,9 %) |
179 (56,6 %) |
0,932 |
|
PNI |
20 (58,8 %) |
166 (52,5 %) |
0,485 |
Примечание: * – различия показателей статистически значимы (p<0,05).
Note: * – differences are statistically significant (p<0.05).
Всего/Total 34 (100 %) 316 (100 %)
Таблица 5/table 5
Срок дожития, характеризующий риск смерти в зависимости от времени, прошедшего с момента хирургического лечения survival period, characterizing the risk of death depending on the time elapsed since the surgical treatment
|
Время, мес/Time, months |
Число случаев смерти/ Deaths |
Накопленный риск смерти/ Accumulated risk of death % |
Общая выживаемость/ Overall survival % |
|
3 |
26 |
7,91 ± 1,5 |
92,09 ± 1,5 |
|
6 |
36 |
11,39 ± 1,8 |
88,61 ± 1,8 |
|
9 |
42 |
13,73 ± 2,0 |
86,27 ± 2,9 |
|
12 |
57 |
20,07 ± 2,4 |
79,93 ± 2,4 |
|
15 |
71 |
26,85 ± 2,8 |
73,15 ± 2,8 |
|
18 |
79 |
31,71 ± 3,1 |
68,29 ± 3,1 |
|
21 |
83 |
35,06 ± 3,4 |
64,94 ± 3,4 |
|
24 |
85 |
37,58 ± 3,7 |
62,42 ± 3,7 |
|
27 |
87 |
41,37 ± 4,3 |
58,63 ± 4,3 |
|
30 |
87 |
41,37 ± 4,3 |
58,63 ± 4,3 |
|
33 |
87 |
41,37 ± 4,3 |
58,63 ± 4,3 |
|
36 |
87 |
41,37 ± 4,3 |
58,63 ± 4,3 |
Таблица 6/table 6
Характеристика предикторов регрессионной модели (1) characteristics of regression model (1)
|
Предиктор/Predictor |
HR |
95 % CI |
p |
|
Метастазы в регионарные лимфоузлы/Metastases in regional lymph nodes |
2,64 |
1,35–5,18 |
0,05* |
|
Отдаленные метастазы/Distant metastases |
1,83 |
1,00–3,34 |
0,05* |
|
III/IV стадии по TNM/Stage III/IV, TNM |
2,01 |
0,95–4,27 |
0,07 |
|
Лимфоваскулярная инвазия/Lymphovascular invasion |
3,15 |
1,44–6,90 |
0,004* |
|
Периневральная инвазия/Perineural invasion |
2,46 |
1,13–5,35 |
0,023* |
|
Осложнения после операции/Postoperative complications |
2,12 |
1,27–3,55 |
0,004* |
|
Принадлежность пациента к изучаемым группам/ The patient's belonging to the groups studied |
12,71 |
1,69–95,18 |
0,013* |
|
Адъювантная химиотерапия/Adjuvant chemotherapy |
0,35 |
0,22–0,57 |
<0,001* |
Примечание: * – влияние фактора статистически значимо (p<0,05).
Note: * – influence of factor is statistically significant (p<0.05).
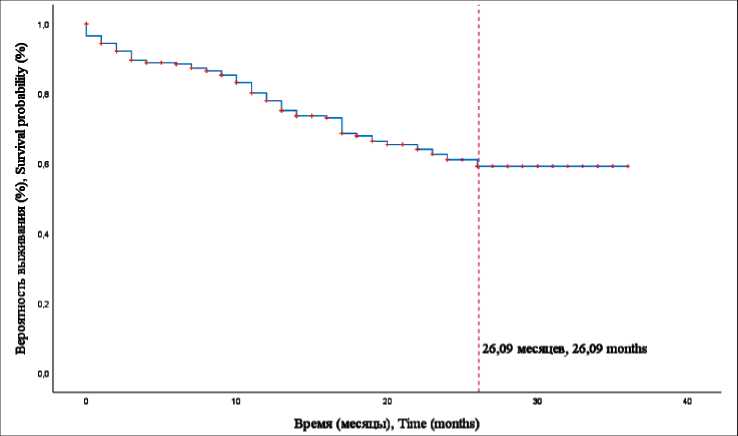
Рис. 1. Кривая Каплан–Майера для ОВ всей совокупности пациентов (красным пунктиром показано среднее значение срока выживания – 26,09 ± 0,88 мес)
Fig. 1. The Kaplan–Mayer curve for the entire patient population (the red timeline shows the average survival time, 26.09 ± 0.88 months)
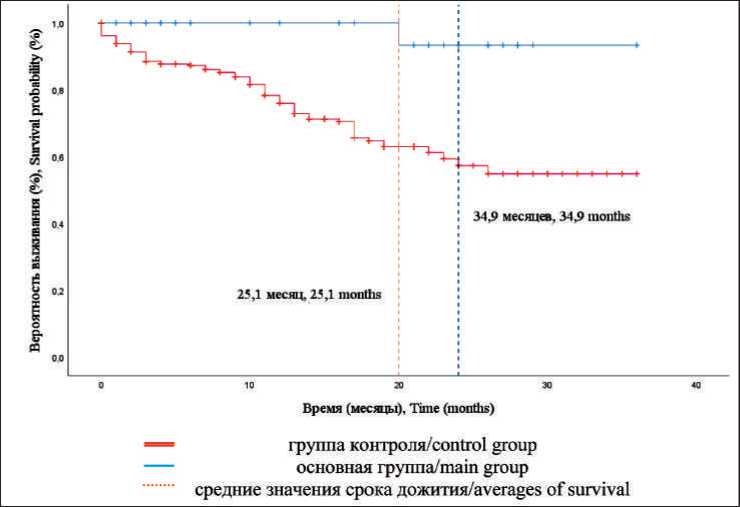
Рис. 2. Кривые Каплан– Майера для ОВ в основной и контрольной группах Fig. 2. Kaplan–Mayer curves for the overall survival of main and control group
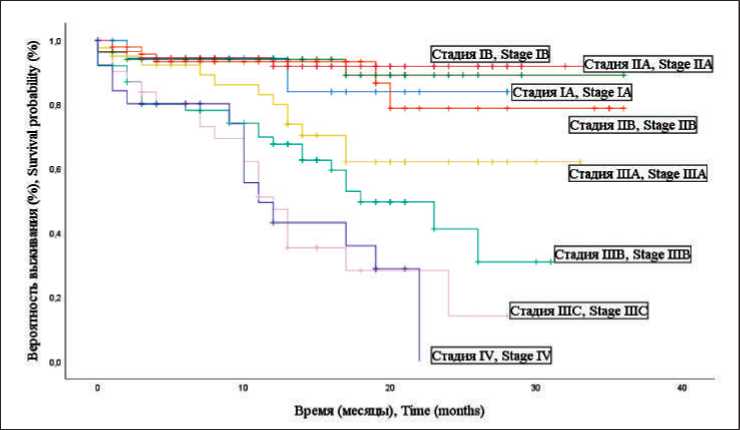
Рис. 3. Кривые Каплан–Майера для ОВ всей совокупности пациентов в зависимости от стадии Fig. 3. Kaplan–Mayer curves for the overall survival of the hole set of patients, dependent on stage
Гистологические характеристики и стадия
Histological characteristics and stage
в определенные временные сроки, проводили в 3 этапа. На первом этапе для всей совокупности пациентов в результате отбора факторов методом исключения по Вальду получена модель пропорциональных рисков (1):
hi(t) = h0(t) × exp (0,97×XN + 0,6×XM +
+ 0,7×XSt + 1,15×XLVI+ 0,9×XPNI + 0,75×XОСЛ +
+ 2,54×XГР – 1,05×XаПХТ),
где hi(t) – риск смерти у i-того пациента (%); h0(t) – базовый риск смерти при нулевом значении всех вошедших в модель предикторов ( %); XN – метастазы в регионарные л/у (0 – отсутствие, 1 – нали-
чие); XM – отдаленные метастазы (0 – отсутствие, 1 – наличие); XSt – III/IV стадии болезни по TNM (0 – I/II стадии, 1 – III/IV стадии), XLVI – лимфоваскулярная инвазия (0 – отсутствие, 1 – наличие); XLVI – периневральная инвазия (0 – отсутствие, 1 – наличие); XОСЛ – осложнения после операции (0 – отсутствие, 1 – наличие); XГР – принадлежность пациента к изучаемым группам (0 – основная группа, 1 – контрольная группа); XаПХТ – проведение адъювантной полихимиотерапии (0 – отсутствие, 1 – наличие).
Модель статистически значима (p=0,001). Характеристика отношения рисков для каждого предиктора в составе модели (1) представлена в табл. 6.
Рис. 4. Кривые Каплан– Майера для ОВ в основной группе в зависимости от стадии
Fig. 4. Kaplan–Mayer curves for the overall survival of the main group, dependent on stage
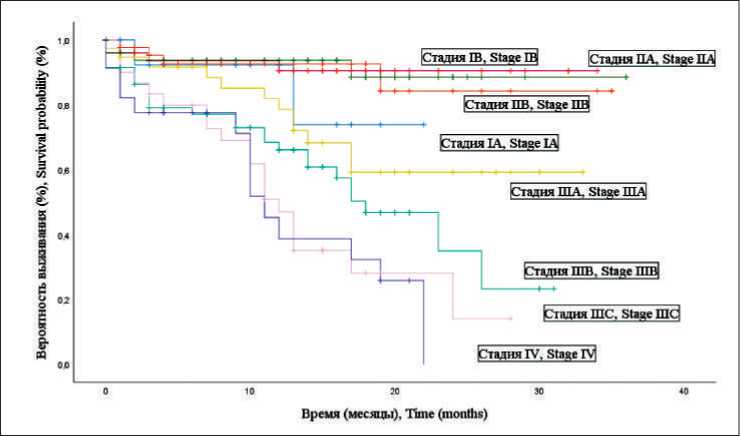
Рис. 5. Кривые Каплан– Майера для ОВ в контрольной группе в зависимости от стадии
Fig. 5. Kaplan–Mayer curves for the overall survival of the control group, dependent on stage
На втором этапе для основной группы пациентов получена модель пропорциональных рисков (2):
hi(t) = h0(t) × exp (1,24×XN + 1,14×XLVI+
+ 0,16×XPNI – 1,8×XаПХТ).
Данная модель статистически не значима (p=0,496). Характеристика отношения рисков для каждого предиктора в составе модели (2) представлена в табл. 7.
На третьем этапе для контрольной группы пациентов получена модель пропорциональных рисков (3):
hi(t) = h0(t) × exp (1,01×XN + 0,61×XM +
+ 0,79×XSt + 1,14×XLVI+ 0,87×XPNI +
+ 0,76×X ОСЛ – 1,11×X аПХТ ).
Модель статистически значима (p<0,001). Характеристика отношения рисков для каждого предиктора в составе модели (3) представлена в табл. 8.
Обсуждение
Таблица 7/table 7
Характеристика предикторов регрессионной модели (2) characteristics of predictors of the regression model (2)
|
Предиктор/Predictor |
HR |
95 % CI |
p |
|
Метастазы в регионарные лимфоузлы/Metastases in regional lymph nodes |
2,05 |
0,78–6,21 |
0,04 |
|
Лимфоваскулярная инвазия/Lymphovascular invasion |
1,14 |
0,32–7,63 |
0,78 |
|
Периневральная инвазия/Perineural invasion |
1,39 |
0,78–16,34 |
0,18 |
|
Адъювантная химиотерапия/Adjuvant chemotherapy |
0,78 |
0,23–1,64 |
0,89 |
Таблица 8/table 8
Характеристика предикторов регрессионной модели (3) characteristics of predictors of the regression model (3)
|
Предиктор/Predictor |
HR |
95 % CI |
p |
|
Метастазы в регионарные лимфоузлы/Metastases in regional lymph nodes |
2,72 |
1,35–5,18 |
0,004* |
|
Отдаленные метастазы/Distant metastases |
1,84 |
1,01–3,37 |
0,047* |
|
III/IV стадии болезни по TNM/Stage III/IV, TNM |
2,19 |
1,01–4,74 |
0,046* |
|
Лимфоваскулярная инвазия/Lymphovascular invasion |
3,11 |
1,42–6,83 |
0,005* |
|
Периневральная инвазия/Perineural invasion |
2,39 |
1,01–5,20 |
0,028* |
|
Осложнения после операции/Postoperative complications |
2,14 |
1,28–3,56 |
0,004* |
|
Адъювантная полихимиотерапия/Adjuvant chemotherapy |
0,33 |
0,20–0,54 |
<0,001* |
Примечание: * – влияние фактора статистически значимо (p<0,05).
Note: * – influence of factor is statistically significant (p<0.05).
(35,3/54,7 %, p=0,031), и реже выполнялись муль-тивисцеральные резекции (8,8/23,7 %, p=0,047).
Прогнозирование рисков неблагоприятных исходов лечения у пациентов молодого возраста пока не до конца изучено [12, 14, 16]. Такие данные нами найдены в единичных публикациях [11, 17]. В нашем исследовании медиана ОВ не была достигнута, 87 (24,8 %) летальных исходов произошли в течение 26,09 ± 0,88 мес. Риск смерти после рубежа 27 мес с момента операции выходил на условное плато в 41,37 ± 4,3 % и не демонстрировал тенденции к изменению. Наша выборка является гетерогенной: в ней есть больные как с I, так и с IV стадией РЖ. Снижение ОВ с последующей стабилизацией риска смерти говорит о летальном исходе большей части пациентов с запущенными формами в период до 27 мес. После этого под наблюдением остаются в основном пациенты с I/II стадиями, для которых риск смерти ниже. Мы планируем провести анализ выживаемости пациентов моложе и старше 50 лет в зависимости от стадии опухолевого процесса и в последующем опубликовать эти данные.
В литературе описаны основные прогностические факторы ОВ для РЖ [18, 19]. К предикторам негативного прогноза относят глубину инвазии первичной опухоли T3/T4, наличие метастазов в регионарные лимфоузлы, низкую дифференцировку опухоли, а также отдаленные метастазы, особенно указывается на негативный потенциал метастазов в печень и кости. Независимыми позитивными факторами признаются удовлетворительное состояние пациента на момент операции и проведение адъювантной химиотерапии [20]. B. Hultman et al. провели анализ результатов лечения 255 пациентов с местнораспространенным РЖ. Медиана ОВ составила 4,8 мес. Данный показатель отличался в подгруппах с отдаленным метастазированием – 4,7 и 5,1 мес соответственно. Методом одно- и многофакторной регрессии пропорциональных рисков Кокса авторы установили 2 положительных прогностических фактора у пациентов с местнораспространенным РЖ: удовлетворительный общий статус на момент диагно- стики и проведение химио- и/или химиолучевой терапии [20].
В литературе отсутствует единая концепция определения прогноза у пациентов с РЖ молодого возраста. По данным одних авторов, прогноз для лиц моложе 40–50 лет хуже в сравнении с более старшей возрастной группой [13, 21]. По другим данным, значимых различий в ОВ не выявлено или она превышает таковую для старшей возрастной группы [17, 22]. Бразильские авторы изучили данные 875 пациентов, прооперированных в период с 2008 по 2017 г. Из них к группе молодых (по определению авторов, до 45 лет) относились 84 (9,6 %), к более старшей группе – 791 (90,4 %). ОВ для обеих групп пациентов значимо не различалась (p=0,578). При многофакторном анализе установлено, что ОВ ухудшают три предиктора: выполнение гастрэктомии, pT3/T4 и диффузный типа роста по классификации Lauren. При этом возраст больных не оказывал значимого воздействия на уровень ОВ [11]. Авторы из США проанализировали результаты лечения 121 пациента 45 лет и моложе, сравнив их с выборкой из 121 более старшего пациента. У молодых больных чаще встречались III/IV стадии (86,8/57,9 %, p<0,0001), низкодифференцированные аденокарциномы (95,9/74,4 %, p<0,0001) или перстневидноклеточные опухоли (88,4/32,2 %, p<0,0001). В работе выявлены более низкие показатели медианы ОВ у молодых пациентов (11,7/41,0 мес, p<0,0001) [13]. Китайские авторы провели анализ результатов лечения двух групп пациентов с РЖ I–III стадий старше и моложе 45 лет, выборка в каждой из которых составляла 310 человек. Установлено, что среди более молодых пациентов преобладают женщины, чаще наблюдаются опухоли низкой дифференцировки, меньшая степень алиментарного истощения, чаще проводится периоперационная ХТ. При этом, несмотря на значимо лучшие показатели общей и безрецидивной выживаемости при I стадии у молодых пациентов, сам по себе возраст при построении многофакторных моделей Кокса не стал значимым фактором, влияющим на отдаленные результаты лечения [17].
В нашем исследовании ОВ у пациентов 50 лет и моложе была значимо выше, чем у более старших больных (p=0,002). При анализе прогностических факторов, влияющих на ОВ всей совокупности пациентов, нами выявлены 6 негативных предикторов: метастазы в регионарные лимфоузлы (p=0,05), отдаленные метастазы (p=0,05), LVI (p=0,004), PNI (p=0,023), осложнения после хирургического лечения (p=0,004) и принадлежность пациента к изучаемым группам (p=0,013). Позитивным предиктором оказалось проведение аПХТ (p<0,001), которая снижала риск смерти в 2,86 (1/0,35) раза во всей совокупности пациентов и в 3,03 (1/0,33) раза отдельно в группе старше 50 лет. При попытке построения прогностической модели ОВ для молодых пациентов статистически значимой функции получить не удалось, что мы связываем с малым объемом выборки и редкостью исхода в этой группе пациентов в изученный период. Выявленные закономерности свидетельствуют о том, что для молодых пациентов РЖ обосновано проведение дальнейших исследований по прогнозированию непосредственных результатов лечения и выживаемости для разработки специфических лечебных подходов.
Срок наблюдения за пациентами в нашем исследовании составил от 3 мес до 3 лет, что является достаточным для выявления основных закономерностей выживаемости и анализа их с помощью статистических методов. Однако данные о 5-летней выживаемости внесут определенную полноту в эту картину, в связи с чем наблюдение за пациентами из нашей выборки будет продолжено. Помимо этого, мы отметили выпадение из наблюдения 64 (18,3 %) пациентов, что обусловливает направление будущих организационных усилий для сохранения наблюдения за больными.
Заключение
Список литературы Рак желудка у пациентов моложе и старше 50 лет: характеристики опухолевого процесса, анализ выживаемости
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., JemalA. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018; 68(6): 394-424. doi: 10.3322/caac.21492.
- КапринА.Д., СтаринскийВ.В., Шахзадова А.О. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). М., 2020. 252 с. [Kaprin A.D., Starinskii V.V., ShakhzadovaA.O. Malignant neoplasms in Russia in 2019 (morbidity and mortality). Moscow, 2020. 252 p. (in Russian)].
- Абдуллаев А.Г., Аллахвердиев А.К., Бесова Н.С., Бяхов М.Ю., Горбунова В.А., Давыдов, М.И., Давыдов М.М., Ибраев М.А., Карсе-ладзеА.И., КувшиновЮ.П., Малихова О.А., Неред С.Н., СтилидиИ.С., Трякин АА. Клинические рекомендации МЗ РФ «Рак желудка». 2018. 1-34. [Abdullaev A.G., Allahverdiev A.K., Besova N.S., Byahov M.Y., Gorbunova V.A., Davidov M.I., Davidov MM, IbraevM.A., KarseladzeA.I., Kyvshinov Y.P., Malihova O.A., NeredS.N., Stilidi I.S., Tryakin A.A. Clinical Guidelines «Gastric Cancer». 2018. 1-34. (in Russian)].
- Kono Y., Kanzaki H., Iwamuro M., Kawano S., Kawahara Y., Okada H. Reality of Gastric Cancer in Young Patients: The Importance and Difficulty of the Early Diagnosis, Prevention and Treatment. Acta Med Okayama. 2020; 74(6): 461-6. doi: 10.18926/AM0/61204.
- Van Der Post R.S., Vogelaar I.P., Manders P., Van Der KolkL.E., Cats A., Van Hest L.P., Sijmons R., Aalfs C.M., Ausems M.G.E.M., Gómez Gar-cía E.B., Wagner A., Hes F.J., Arts N., Mensenkamp A.R., Van Krieken J.H., Hoogerbrugge N., Ligtenberg M.J.L. Accuracy of Hereditary Diffuse Gastric Cancer Testing Criteria and Outcomes in Patients With a Germline Mutation in CDH1. Gastroenterology. 2015. https://doi. org/10.1053/j.gastro.2015.06.003.
- Blair V.R., McLeodM., Carneiro F., Coit D.G., D'Addario J.L., van Dieren J.M., Harris K.L., Hoogerbrugge N., Oliveira C., van der Post R.S., Arnold J., Benusiglio P.R., Bisseling T.M., Boussioutas A., Cats A., CharltonA., Schreiber K.E.C., Davis J.L., PietroM., FitzgeraldR.C., Ford J.M., Gamet K., Gullo I., HardwickR.H., Huntsman D.G., Kaurah P., Kupfer S.S., Latchford A., Mansfield P.F., Nakajima T., Parry S., Rossaak J., Sugimura H., SvrcekM., TischkowitzM., Ushijima T., Yama-da H., Yang H.K., Claydon A., Figueiredo J., Paringatai K., Seruca R., Bougen-Zhukov N., Brew T., Busija S., Carneiro P., DeGregorio L., Fisher H., Gardner E., Godwin T.D., Holm K.N., Humar B., Lintott C.J., Monroe E.C., Muller M.D., Norero E., Nouri Y., Paredes J., Sanches J.M., Schulpen E., Ribeiro A.S., Sporle A., Whitworth J., Zhang L., Reeve A.E., Guilford P. Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol. 2020; 21(8): 386-97. https://doi.org/10.1016/ S1470-2045(20)30219-9.
- Волков Н.М. Рак у молодых: опухоли желудочно-кишечного тракта. Практическая онкология. 2017; 18(2): 197-205. [Volkov N.M. Gastric cancer in young patients: tumors of gastrointestinal tract. Practical oncology. 2017; 18(2): 197-205. (in Russian)].
- CharlsonM.E., PompeiP., AlesK.L., MacKenzie C.R. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987; 40(5): 373-83. doi: 10.1016/0021-9681(87)90171-8.
- Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer. 2021; 24(1): 1-21. doi: 10.1007/s10120-020-01042-y.
- Dindo D., Demartines N., Clavien P.A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004; 240(2): 205-13. doi: 10.1097/01. sla.0000133083.54934.ae.
- Ramos M.F.K.P., Pereira M.A., Sagae V.M.T., Mester M., Morrell A.L.G., Dias A.R., Zilberstein B., Ribeiro Junior U., Cecconello I. Gastric cancer in young adults: a worse prognosis group? Rev Col Bras Cir. 2019; 46(4). doi: 10.1590/0100-6991e-20192256.
- Takatsu Y., Hiki N., Nunobe S., Ohashi M., Honda M., Yamagu-chi T., Nakajima T., Sano T. Clinicopathological features of gastric cancer in young patients. Gastric Cancer. 2016; 19(2): 472-8. doi: 10.1007/ s10120-015-0484-1.
- Rona K.A., Schwameis K., Zehetner J., Samakar K., Green K., Samaan J., Sandhu K., Bildzukewicz N., Katkhouda N., Lipham J.C. Gastric cancer in the young: An advanced disease with poor prognostic features. J Surg Oncol. 2017; 115(4): 371-5. http://doi.wiley.com/10.1002/ jso.24533.
- Pisanu A., PoddaM., Cois A., Uccheddu A. Gastric cancer in the young: Is it a different clinical entity? A retrospective cohort study. Gastroenterol Res Pract. 2014. https://doi.org/10.1155/2014/125038.
- Lee J., Lee M.A., Kim I.H., Roh S.Y. Clinical characteristics of young-age onset gastric cancer in Korea. BMC Gastroenterol. 2016; 16(1): 110. doi: 10.1186/sl2876-016-0528-y.
- Schildberg C.W., Croner R., Schellerer V., Haupt W., Schild-bergF.W., SchildbergM., Hohenberger W., Horbach T. Differences in the treatment of young gastric cancer patients: Patients under 50 years have better 5-year survival than older patients. Adv Med Sci. 2012; 57(2): 259-65. https://doi.org/l0.2478/vl0039-0l2-0052-4.
- Liu W., QuanH., ChenX., Ouyang Y., XiaoH. Clinicopathological features and prognosis of young gastric cancer patients following radical gastrectomy: a propensity score matching analysis. Sci Rep. 2019; 9(l): 5943. doi: 10.1038/s41598-019-42406-4.
- Тер-ОванесовМ.Д., ГабоянА.С., КукошМ.Ю., Левицкий А.В., Леснидзэ Э.Э., Баксиян Г.А. Влияние гистологического строения опухоли на прогноз при хирургическом лечении рака проксимального отдела желудка. Альманах мировой науки. 2016; 2(1): 42-4. [Ter-Ovanesov M.D., Gaboyan A.S., Kukosh M.Y., Levitskiy A.V., Lesnidze E.E., Baksiyan G.A. The influence of hystologic structure of the tumor on prognosis in surgical treatment of proximal gastric cancer. Almanac of World Science. 2016; 2(l): 42-4. (in Russian)].
- Антонов Е.Ф., Риспаева Д.Э., СпиженкоН.Ю. Формирование факторов прогноза рака желудка. Евразийский онкологический журнал. 2018; 6(3-4): 690-7. [Antonov E.F., Rispaeva D.E., Spigenko N.Y. Creating factors of prognosis of gastric cancer. Eur J Oncol. 2018 6(3-4): 690-7. (in Russian)].
- HultmanB., Gunnarsson U., NygrenP., SundbomM., GlimeliusB., Mahteme H. Prognostic factors in patients with loco-regionally advanced gastric cancer. World J Surg Oncol. 2017; l5(l): 172. doi: 10.1186/ sl2957-0l7-l243-z.
- Smith B.R., Stabile B.E. Extreme aggressiveness and lethality of gastric adenocarcinoma in the very young. Arch Surg. 2009; 144(6): 506-10. doi: l0.l00l/archsurg.2009.77. PMID: 19528381.
- Kong X., Wang J.L., Chen H.M., Fang J.Y. Comparison of the clinicopathological characteristics of young and elderly patients with gastric carcinoma: a meta analysis. J Surg Oncol. 2012; 106(3): 346-52. doi: l0.l002/jso.23004.
- Hansford S., Kaurah P., Li-Chang H., Woo M., Senz J., Pinheiro H., SchraderK.A., SchaefferD.F., Shumansky K., Zogopoulos G., Santos T.A., Claro I., Carvalho J., Nielsen C., Padilla S., Lum A., TalhoukA., Baker-LangeK., Richardson S., Lewis I., LindorN.M., PennellE., MacMillan A., Fernandez B., Keller G., Lynch H., Shah S.P., Guilford P., Gallinger S., Corso G., RovielloF., Caldas C., Oliveira C., Pharoah P.D., HuntsmanD.G. Hereditary Diffuse Gastric Cancer Syndrome: CDHl Mutations and Beyond. JAMA Oncol. 2015; l(l): 23-32. doi: l0.l00l/jamaon-col.20l4.l68.


