Раковые тестикулярные антигены в иммунотерапии злокачественных опухолей
Автор: Водолажский Д.И., Кит О.И., Могушкова Х.А., Пушкин А.А., Тимошкина Н.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 2 т.16, 2017 года.
Бесплатный доступ
Низкая токсичность, онкоспецифичность, иммуногенность и относительно частая экспрессия во многих типах рака СТ-антигенов послужили основанием для их использования в иммунотерапии онкологических заболеваний. В настоящем обзоре представлены данные использования СТ-антигенов в новых клинических подходах контроля злокачественного процесса, развитых из представлений о механизмах противоопухолевого иммунитета. В частности, освещены результаты применения ингибиторов иммунных контрольных точек, коррекции иммунного ответа извне путем вакцинации культивированными ex vivo дендритными клетками, натуральными киллерами, Т-лимфоцитами; индукции и синхронизации экспрессии СТА с помощью ДНК гипометилирующих агентов для повышения иммуногенности раковых клеток и др. В итоге демонстрируется необходимость переосмысления современных клинических стратегий в отношении как выбора химиотерапевтических агентов, так и дизайна иммунотерапии, что в перспективе существенно повысит эффективность лечения рака.
Раковый тестикулярный антиген, канцерогенез, иммунотерапия
Короткий адрес: https://sciup.org/140254111
IDR: 140254111 | УДК: 616-006.04-08:576.8.097.2:615.37 | DOI: 10.21294/1814-4861-2017-16-2-71-81
Текст обзорной статьи Раковые тестикулярные антигены в иммунотерапии злокачественных опухолей
С открытием раковых тестикулярных антигенов (РТА) человека, или Cancer Testis Antigens (СТА), экспрессирующихся избирательно в опухолях различного гистологического происхождения, а в нормальных тканях – только в семенниках и плаценте, расширились возможности разработки новых специфических иммунотерапевтических подходов для лечения злокачественных новообразований. Более 20 лет назад Бун с соавт. сообщили о первом успешном клонировании антигена опухоли человека, который был назван антиген-1 меланомы (MAGE-1). MAGE-1 вызывал выраженный ответ аутологичных цитотоксических Т-лимфоцитов (ЦТЛ) у пациента с меланомой [1]. Термин «раковый тестикулярный антиген» был введен Old и Chen в 1998 г. [2]. В настоящее время известно более 200 белков этой группы, и их число постоянно растет [3].
В данном обзоре предпринята попытка систематизации информации о клинических перспективах
CTA в качестве терапевтических агентов в новых схемах лечения, потенциально способных улучшить прогноз для онкологических больных.
Краткие сведения о биологии СТА
В базу данных, созданную в Ludwig Institute for Cancer Research, внесено 70 семейств СТА [3]. Все CТ-антигены разделяют на два подкласса по месту хромосомной локализации кодирующих их генов [4].
Х-CT-антигены – самый многочисленный подкласс СТА, которые локализуются на Х-хромосоме и представляют собой мультигенные семейства (MAGE, GAGE, SSX, CT45 и др.), организованные в кластеры. Примечательно, что 10 % генов на Х-хромосоме принадлежат к семействам X-СТА. Экспрессия Х-СТА широко распространена в опухолях, однако она значительно варьирует в зависимости от гистотипа неоплазии (таблица).
Подкласс non-Х-CТА кодируется однокопий-ными генами, расположенными на аутосомах и
Экспрессия ста в разных типах злокачественных опухолей
распределенными по всему геному (BAGE, HAGE, SP17 и др.). non-Х-CТ-антигены обычно экспрессируются в мужских половых клетках на более поздних стадиях дифференцировки, например, в сперматоцитах на мейотических и постмейоти-ческих стадиях, и большинство антигенов этого подкласса реже экспрессируются в онкотранс-формированных клетках (таблица). Исключение составляет сперматозоид-ассоциированный антиген 9 (SPAG9), который, по-видимому, широко представлен в самых разных типах рака, что определило интенсивные исследования последних лет SPAG9 в качестве биомаркера и мишени для иммунотерапии [5–12].
Следует отметить, что некоторые СТА идентифицированы во вспомогательных тканях семенников, в поджелудочной железе, печени, матке и селезенке [13, 14]. Однако уровни мРНК генов СТА в соматических тканях составляют, как правило, <1 % от их экспрессии в семенниках [11, 13, 15]. Тем не менее остается спорным, как именно ограниченная экспрессия некоторых СТА в нормальных соматических тканях влияет на их антигенные свойства и потенциал в качестве терапевтических мишеней.
Всё больше данных об уровнях экспрессии СТА (таблица) и её регуляции [16] позволяют предполагать онкоспецифичные функции данной группы
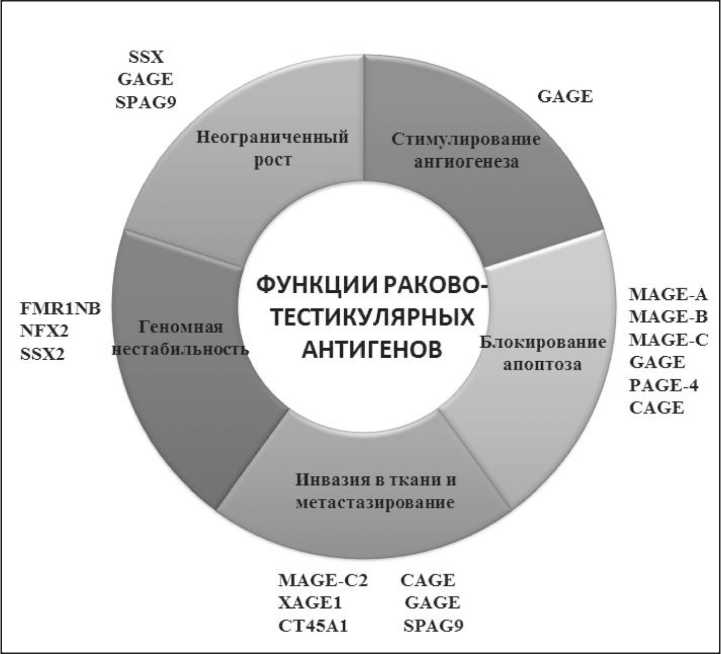
Рис. 1. Функции СТА в онкогенезе
антигенов (рис. 1), однако их биологическая роль в эмбриональных тканях и опухолях остается ещё малопонятной.
Терапевтический потенциал СТАИммуногенность СТА
СТА представляют собой антигенные пептиды, которые в сочетании с алло-специфичными HLA 1-го или 2-го класса презентируются иммунной системе, вызывая как цитотоксический, так и гуморальный иммунные ответы [17]. Как упоминалось выше, СТА широко представлены в опухолях (таблица), но не в нормальных тканях, за некоторыми исключениями. В тканях здорового взрослого человека экспрессирующиеся СТ-антигены не доступны для иммунной системы. Например, в семенниках взаимодействию иммунной системы с CTA-белками препятствует наличие гемато-тестикулярного барьера и отсутствие HLA класса I на поверхности герминальных клеток [18]. В многочисленных работах были продемонстрированы спонтанные гуморальный и клеточный иммунные ответы против экспрессирующихся CTA [9, 15]. Таким образом, с иммунологической точки зрения CT-антигены можно рассматривать как оптимальные опухоль-специфические мишени.
NY-ESO-1 представляется наиболее иммуногенным из подкласса Х-СТ антигенов, вызывая индукцию скоординированных спонтанного гуморального и клеточно опосредованного (цитотоксического) иммунного ответов у пациентов с опухолями, экспрессирующими NY-ESO-1. Антитела в сыворотке крови против NY-ESO-1 были обнаружены при раке щитовидной железы в 36 % случаев [19], раке яичников – в 7–13 %, раке молочной железы – в 16 %, раке мочевого пузыря – в 12,5 %, раке пищевода – в 13 % случаев [20, 21]. NY-ESO-1 экспрессируется у 16 % пациенток с трижды негативным раком молочной железы против 2 % у ER+/HER2-больных, что коррелировало с высоким уровнем гуморального иммунного ответа у значительной части (73 %) этих больных и более выраженным CD8+ Т-клеточным ответом [22]. Антиген SPAG9 (подкласс non-X-CTA) индуцирует гуморальный иммунный ответ в большинстве случаев эпителиального рака яичников (67 %), рака молочной железы (80 %), шейки матки (80 %), толстой и прямой кишки (74 %), а также почечноклеточного рака (77 %) [9]. В исследовании Kanojia et al. [23] продемонстрировано, что в 74 % образцов опухолей колоректального рака (КРР) присутствовала как генетическая, так и белковая экспрессия SPAG9 антигена, и почти у всех пациентов с экспрессией SPAG9 был отмечен гуморальный ответ (70 %).
Учитывая приведенные наблюдения, пациенты с опухолями, экспрессирующими СТ-антигены, могут получить существенную пользу от целевой иммунотерапии, направленной против СТА.
СТА-вакцинотерапия
Результаты обсуждаемых выше исследований дали основание для проведения нескольких клинических испытаний с использованием СТА в качестве вакцинирующих агентов. Такие вакцины, как правило, хорошо переносятся с формированием значимых иммунологических реакций, а также некоторых клинических ответов.
Моновакцинотерапия
Исторически раньше были идентифицированы и наиболее тщательно протестированы в клинике три СТ-антигена: MAGE-A3, MAGE-A1 и NY-ESO-1. В одном из первых клинических испытаний MAGE-A3-пептиды были использованы для лечения меланомы HLA-A1-положительных пациентов с опухолями, экспрессирующими соответствующий СТ-антиген. У 7 из 25 пациентов отметили значительную регрессию опухолей, в том числе наблюдали 3 полных ответа. Однако MAGE-А3-специфичные цитотоксичные лимфоциты не были обнаружены ни в одном случае [24].
Специфичная экспрессия NY-ESO-1 на поздних стадиях рака предстательной железы (РПЖ) и её отсутствие в образцах доброкачественной гиперплазии предстательной железы [25] стали основанием для клинического исследования иммунотерапии РПЖ. I фаза клинических испытаний вакцинации NY-ESO-1 при гормон-резистентном метастатическом РПЖ показала индукцию антител против NY-ESO-1; наличие CD4+ и CD8+ Т- клеточных ответов [26].
Вакцинация рекомбинантными СТА
Использование рекомбинантных белков предполагает ряд преимуществ, в том числе возможность индуцировать как CD8+, так и CD4+ Т-клеточные ответы; генерировать сопутствующие иммунные реакции против нескольких эпитопов; а также независимость от HLA типа больных.
Первый полноформатный СТА белок, используемый до настоящего времени для противоопухолевой вакцинации, был рекомбинантным MAGE-A3 с D-доменом Haemophilus influenza на N-конце и гистидином (His) на С-конце [27]. В исследовании Kruit et al. [28] после введения рекомбинантного белка MAGE-A3 наблюдали 1 частичный ответ и 4 смешанных ответа у 26 MAGE-A3-положительных пациентов с меланомой III или IV стадии.
Повысить иммуногенность вакцин не только в случае рекомбинантных антигенов призвано введение адъювантов. Так, вакцинация MAGE-A3-положительных больных немелкоклеточным раком легкого (НМРЛ) I или II стадии рекомбинантным белком MAGE-A3 в сочетании с адъювантом AS02B была более эффективной, чем вакцинация без адъювантов [29]. Следующий этап II клинического испытания вакцинирования белком MAGE-A3 на 182 MAGE-A3-положительных пациентах с
НМРЛ IB или II стадии выявил, что улучшение без рецидивной выживаемости было на 33 % выше у MAGE-A3-вакцинированных больных по сравнению с пациентами, получавшими плацебо [4]. В ходе клинического рандомизированного исследования II фазы (EORTC 16031–18032) на ранее не получавших лечения MAGE-A3-положительных пациентах с неоперабельной меланомой III–IV стадий объективные ответы наблюдали у 5 из 72 (6,9 %), долгосрочную стабилизацию заболевания (>16 нед) – у 11 из 72 пациентов (15,3 %) [30]. Тем не менее III фаза клинического испытания, в которую вошли 1345 MAGE-A3-положительных пациентов с меланомой, показала отсутствие значимых отличий выживаемости без признаков заболевания (DFS) в группе вакцинированных по сравнению с плацебо. Наиболее полное изучение возможностей вакцины с рекомбинантным белком MAGE-A3 в рандомизированном, слепом, плацебо-контролируемом клиническом исследовании III фазы у 2272 пациентов с НМРЛ (Magrit) также не выявило достоверных эффектов, и работа была досрочно прекращена в 2014 г. Отсутствие эффекта в двух крупных исследованиях поставило вопрос о более тщательном отборе используемого антигена, а также о модификации СТА-вакцин в целях увеличения иммуногенности и достижения более длительного эффекта блокады иммунной толерантности опухоли.
NY-ESO-1 His-меченый рекомбинантный полноразмерный белок, отдельно или с адъювантом сапониновой природы (ISCOMATRIX), был использован в первом клиническом испытании для вакцинирования NY-ESO-1-положительных пациентов с меланомой кожи. Все пациенты, вакцинированные NY-ESO-1 с ISCOMATRIX, продемонстрировали высокий титр анти-NY-ESO-1 антител в сравнении с пациентами, вакцинированными NY-ESO-1 без адъюванта. Вакцина также индуцировала циркулирующие CD4+ и CD8+ Т-клетки, специфические для широкого спектра NY-ESO-1 эпитопов, включая многие ранее неизвестные [31]. Только у 2 из 19 пациентов, вакцинированных NY-ESO-1 с добавлением ISCOMATRIX, проявились рецидивы опухолей по сравнению с 14 из 23 пациентов, получавших плацебо или только NY-ESO-1. Nicholaou et al. [32] в аналогичном исследовании клинической и иммунологической эффективности вакцины NY-ESO-1 в сочетании с ISCOMATRIX у пациентов с меланомой IV стадии или неоперабельной III стадии обнаружили, что, в отличие от минимальной остаточной болезни, пациенты с прогрессирующей меланомой не продемонстрировали клинического ответа на вакцинацию. При сравнении пациенты с прогрессирующей меланомой имели значительно большее количество циркулирующих регуляторных Treg-клеток, ингибирующих активность T-клеток. Таким образом, выявлена ассоциация между стадией развития меланомы, числом циркулирующих клеток Treg и клинической и иммунологической эффективностью вакцины против рака NY-ESO1-ISCOMATRIX [33]. Dhodapkar et al. [34] предложен интересный подход доставки NY-ESO1 в дендритные клетки путем слияния антигена с антителом, специфичным для CD205 – пептида клеточной поверхности дендритной клетки, что привело к стабилизации заболевания у 13 из 42 пациентов на фоне гуморального и Т-клеточного ответа.
Возможности мульти-СТА вакцин
Последние данные свидетельствуют об ещё одном способе увеличения клинической эффективности иммунотерапии – за счет использования нескольких антигенов [35]. На начальном этапе разработки мультивакцин предполагали, что их использование позволит предотвратить выживание опухолевых клеток, обусловленное селективной потерей отдельных антигенов-мишеней. Кроме того, комплексное использование онкогенных CTA не требует трудоемкого секвенирования генома для определения антигенов конкретного пациента и синтеза целевого антигена. Многопрофильные антигенные CTA-вакцины можно вводить на ранних сроках после постановки диагноза, предполагалось, что это позволит предотвратить дальнейшее прогрессирование опухоли. Немаловажно, что мультивакцины могут быть предпочтительными для видов рака с низким уровнем соматических мутаций [36].
Клинические исследования II фазы вакцины с использованием искусственно синтезированного пептида MAGE-A4 у больных метастатическим КРР продемонстрировали низкую токсичность вакцины, эффективное индуцирование MAGE-A4-специфических Т-клеточных реакций, экспрессию MAGE-A4-специфических IgG-антител и замедление роста опухоли [37]. В настоящее время завершены клинические испытания MAGE-A4, NYESO-1, PRAME, SSX пептидной вакцинотерапии пациентов с меланомой, лимфомой, миеломой и смешанными солидными опухолями (идентификаторы: NCT01333046, NCT02239861, NCT02291848).
Дендритно-клеточные вакцины (ДКВ)
Метод ДКВ, заключающийся во введении пациентам аутологичных дендритных клеток, выращенных и нагруженных антигенами вне организма, позволяет избежать влияния иммуносупрессивных факторов микроокружения опухоли и нарастить большее число клеток [38, 39]. В качестве антигенной нагрузки ДКВ могут быть использованы MAGE-пептиды (впрочем, как и любые другие). В результате иммунизации активированными таким образом ДКВ были получены частичные или полные клинические ответы, а также увеличение инфильтрации опухолей Т-клетками у пациентов с меланомой, НМРЛ и желудочно-кишечными карциномами [40–42].

А. Химиотерапия + онко-СТА иммунотерапия
Химиотерапия
СТА-таргетная иммунотерапия

Б. Ингибиторы ДНК метилтрансфераз + онко-СТА иммунотерапия
СТ А-экспрессирующие опухолевые клетки
репрессирующие СТА / опухолевые клетки
специфичностью
Ингибиторы DNMT метил трансферазы
Гибель СТА-п оложительных
СТА-таргетная иммунотерапия
Гибель опухолевых клеток, резистентных к химиотерапии
CTLA4 PD1
Больше опухоль-СП ецифичных
Т-клеток
Больше опухоль-специфичных инфильтрирующих Т-клеток
Нарушение иммунной толерантности
СТА-специфичные Т-клетют
Синхронизация экспрессии СТА
рецепторами Т-клеток и наращивание in vitro
Адоптивный
СТА - вакцинация
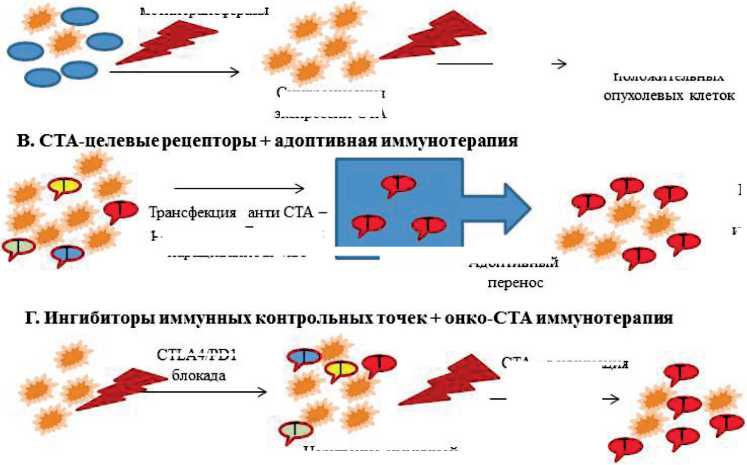
Рис. 2. Комплексная СТА-иммунотерапия: А. СТА-терапия угнетает химиорезистентные опухолевые клетки, получающие селективное преимущество после химиотерапии. Б. Синергизм действия ДНК деметилирующих агентов, стимулирующих СТА-экспрессию в опухолевых клетках, и СТА-специфичной иммунотерапии. В. Использование CT-антигенов для специфичности адоптивной иммунотерапии. Г. Блокада регуляторных точек иммунитета, снимая иммунную толерантность опухоли, повышает эффективность последующей CTA-вакцинации
В целом вакцинация вообще и с использованием СТ-антигенов в частности, показав в предварительных исследованиях обнадеживающие результаты [39], не стала самостоятельным методом иммунотерапии опухолей [43]. Однако существуют перспективы совместного использования вакцинации с другими методами, синергизм которых поможет преодолеть иммуносупрессивные факторы опухоли.
Комплексное использование СТА
Современные представления о биологии СТА, а также о традиционных способах лечения с данными о том, как эти процедуры влияют на популяцию Т-клеток и иммунную систему в целом, позволили разработать и оптимизировать новые схемы лечения онкологических заболеваний (рис. 2).
Химиотерапия и СТА-вакцинация
Действие цитотоксических противоопухолевых препаратов, например, связывающих микротрубочки или повреждающих ДНК (например, препараты платины), по существу направлено на индуцирование апоптоза в злокачественных клетках. Развивающаяся в ходе лечения устойчивость опухоли не только к применяемому средству, но и к препаратам с другим механизмом действия является основным лимитирующим фактором химиотерапии [44]. Известно несколько СТ-антигенов, связанных с нарушением апоптоза (рис. 1), что делает их главными кандидатами для иммунотерапии. Клинические исследования фазы I пептидной вакцины, включающей два СТА (RNF43, TOMM34) и последовательности рецепторов VEGFR1 и VEGFR2, в комплексе с терапией пероральными противоопухолевыми препаратами, проводили у 10 больных с неоперабельным раком ободочной и прямой кишки. После одного курса лечения у 1 пациента зафиксировали частичный ответ, у 7 – стабилизацию, у 2 – прогрессирование заболевания. У пациентов из групп с частичным ответом и стабилизацией заболевания отмечалось увеличение пептид-специфических ЦТЛ [45]. В идеальной комбинации традиционная терапия будет губительной для большинства раковых клеток, помимо клеток, которые экспрессируют высокие уровни CTА. Последние уязвимы для индуцированных СТА-специфичных Т-клеток (рис. 2A). Синергизм этих мер, следовательно, приведет к более эффективному лечению.
СТА и эпигенетические препараты
Хорошо охарактеризована роль метилирования промоторов в регуляции экспрессии СТА [16], что дает возможность терапевтически модулировать экспрессию СТА в неопластических клетках, посредством использования ДНК гипометилирующих агентов (ДГА), таких как ингибиторы ДНК-метилтрансфераз – 5-аза-2'-дезоксицитидин (5-аза-2'-СРВ) и 5-азацитидин. Одновременно ДГА способствуют восстановлению нормальных функций множества клеточных процессов, в том числе регуляции клеточного цикла, апоптоза и иммунного распознавания [46]. Исследования 5-аза-2-дезоксицитидина in vitro продемонстрировали его эффективность в индуцировании и/или существенном увеличении экспрессии нескольких членов различных СТА семейств в опухолевых клетках различных гистотипов [46]. Важно, что приобретенные фенотипические изменения он-котрансформированных клеток поддерживаются популяциями опухолевых клеток и функционально значимы, индуцируя или существенно усиливая их распознавание СТА-специфичными ЦТЛ [46, 47]. Fonsatti et al. [48] продемонстрировали, что после ДГА-терапии одного только изменения уровня антигенов HLA класса I и CD54 на поверхности клеток меланомы достаточно, чтобы существенно повысить их распознавание антиген-специфичными ЦТЛ.
Продемонстрированная индукция спонтанного анти-СТА иммунитета ДГА-агентами стала основанием одобрения 5-аза-2’-дезоксицитидина (5-аза-2’-СРВ) или 5-азацитидина для терапии гематологических злокачественных новообразований [49, 50]. Таким образом, сочетание ДГА с СТА-вакцинацией может оказаться полезным для выработки СТА-специфичных Т-клеток (рис. 2Б). Однако из-за онкогенных свойств некоторых СТ-антигенов возможны отрицательные эффекты использования ДГА, такие как индукция ЕМТ-перехода с последующим метастазированием.
СТА-вакцинация и адоптивная терапия
Метод адоптивной терапии с помощью инфильтрирующих опухоль Т-лимфоцитов стал развиваться с 1980-х годов, претерпевая многочисленные модификации с целью получения опухоль-специфичного эффекта. Одним из подходов получения большого пула аутологичных онкоспецифичных Т-лимфоцитов стала их трансфекция геном, кодирующим Т-клеточный рецептор, полученный из лимфоцитов пациента или иммунизированных трансгенных мышей (рис. 2В). Успешный опыт лечения Т-лимфоцитами (после трансфекции анти-NY-ESO-1 рецепторов) был продемонстрирован у больных синовиальной саркомой и меланомой [51]. И хотя выбранный подход не вызвал побочных цитотоксических реакций, в других клинических испытаниях, использовавших аутологичные модифицированные анти-MAGE-A3 в качестве рецептора Т-лимфоцитов, была поставлена под вопрос онкоспецифичность MAGE-A3, так как была продемонстрирована перекрестная реактивность использованного СТА с эпитопом MAGE-A12 нормальных клеток мозга и эпитопом сердечного белка тайтина [52, 53]. Другая стратегия комбинации адоптивной Т-клеточной терапии с эпигенетической модификацией ДГА у больных с лимфомой Ходжкина приводила к генерации
MAGE-А4-специфических Т-клеток и увеличению противоопухолевого репертуара Т-клеток без побочных эффектов [54].
СТА и ингибирование иммунных контрольных точек
Терапия ингибиторами иммунных «check-point», чаще ингибиторами PD-1 и CTLA-4, стала востребованной в алгоритме лечения НМРЛ (clinical Trials.gov идентификаторы NCT02453282, NCT02039674), лимфомы Ходжкина и неоплазий с микросателлитной нестабильностью [55]. Ряд результатов свидетельствует о дополнительном противоопухолевом эффекте, полученном путём объединения блокады иммунных контрольных точек с СТА-вакцинацией (рис. 2Г). Доказательства синергического эффекта терапии ипилимумабом (анти-CTLA-4 моноклональное антитело) и NY-ESO-1 вакцинации были получены у пациентов с метастатической меланомой, ранее проходивших химиотерапию [56]. Из 15 пациентов, получавших комплексную иммунотерапию, у 8 зарегистрировали полный или частичный ответ или стабилизацию процесса на фоне полифункционального NY-ESO-1-специфического Т-клеточного ответа. У 5 из 8 пациентов детектировали CD4+ и CD8+ Т-клетки против NY-ESO-1 после введения ипилимумаба.
В упомянутом выше исследовании рекомбинантного NY-ESO1 было предположено, что предварительная терапия с использованием СТА будет усиливать последующее действие CTLA-4 ингибитора [34]. Таким образом, СТА-вакцинация в сочетании с блокадой иммунных контрольных точек потенциально может улучшить терапевтические эффекты.
Заключение
Высокая онкоспецифичность, иммуногенность и относительно частая экспрессия во многих типах рака СТ-антигенов стали основанием для их широкого исследования как агентов вакцинации. Развитие представлений о механизмах противоопухолевого иммунитета стимулировало появление новых подходов для контроля над злокачественным процессом: нарушение иммунной толерантности с помощью ингибиторов иммунных контрольных точек, коррекция иммунного ответа извне путем вакцинации культивированными ex vivo дендритными клетками, натуральными киллерами, Т-лимфоцитами; индукция и синхронизация экспрессии онко-ассоциированных молекул с помощью ДГА для повышения иммуногенности раковых клеток и др. Последние достижения в области иммунной терапии обусловливают необходимость дополнения традиционных методов и переосмысления современных клинических стратегий как в отношении выбора химиотерапевтических агентов, так и дизайна иммунотерапии, что в перспективе существенно повысит эффективность лечения рака.
Список литературы Раковые тестикулярные антигены в иммунотерапии злокачественных опухолей
- van der Bruggen P., Traversari C., Chomez P., Lurquin C., De Plaen E., Van den Eynde B., Knuth A., Boon T.A. Gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma. Science. 1991; 254 (5038): 1643-7.
- Old L.J., Chen Y.T. New paths in human cancer serology. J. Exp. Med. 1998; 187: 1163-1167.
- Almeida L.G., Sakabe N.J., deOliveira A.R., Silva M.C., Mundstein A.S., Cohen T., Chen Y.T., Chua R., Gurung S., Gnjatic S., Jungbluth A.A., Caballero O.L., Bairoch A., Kiesler E., White S.L., Simpson A.J., Old L.J., Camargo A.A., Vasconcelos A.T. CTdatabase: a knowledge-base of high-throughput and curated data on cancer-testis antigens. Nucleic acids research. 2009; 37: 816-819.
- Brichard V.G., Lejeune D. GSK's antigen-specific cancer immunotherapy programme: pilot results leading to Phase III clinical development. Vaccine 25 (Suppl. 2). 2007; B61-71.
- Garg M., Kanojia D., Salhan S., Suri S., Gupta A., Lohiya N.K., Suri A. Sperm-associated antigen 9 is a biomarker for early cervical carcinoma. Cancer. 2009; 115 (12): 2671-2683. DOI: 10.1002/cncr.24293


