Ранние послеоперационные осложнения криоаблации клинически локализованного рака почки на криотерапевтической установке "МКС" с жидким азотом в качестве хладагента
Автор: Щекутеев Н.А., Носов А.К.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.21, 2022 года.
Бесплатный доступ
Работа посвящена структурной оценке частоты ранних послеоперационных осложнений и анализу прогностических факторов их развития. Цель исследования - выделить факторы риска развития послеоперационных осложнений после криоаблации локализованного рака почки. Материал и методы. В исследование включен материал 56 пациентов с клинически локализованным раком почки, которым в качестве лечебной опции была проведена криоаблация. Процедура криоаблации проводилась с использованием аппарата «МКС» (медицинская криотерапевтическая система) с жидким азотом в качестве подаваемого хладагента. Ранние послеоперационные осложнения, выявленные за период наблюдения в течение 30 дней, были определены в соответствии с классификацией Клавьен-Диндо. Результаты. В унивариантный анализ были включены 9 факторов-предикторов, априори влияющих на риск развития осложнений криоаблации рака почки. Однако только две были апостериорно ассоциированы с повышенным риском осложнений в раннем послеоперационном периоде: локализация опухоли в правой почке (отношение шансов 0,2619, 95 % доверительный интервал 0,08553-0,8020; р=0,019) и локализация в верхнем полюсе почки (отношение шансов 0,09955, 95 % доверительный интервал 0,01872-0,5292; р=0,0068). Заключение. Криоаблация клинически локализованного рака почки на криотерапевтической установке «МКС» с жидким азотом в качестве хладагента является эффективным и безопасным методом лечения с низкой частотой послеоперационных осложнений, требующих лишь консервативного ведения.
Локализованный рак почки, криоаблация, осложнения, унивариантный анализ
Короткий адрес: https://sciup.org/140293897
IDR: 140293897 | УДК: 616.61-006.6-089.168.1-06
Текст научной статьи Ранние послеоперационные осложнения криоаблации клинически локализованного рака почки на криотерапевтической установке "МКС" с жидким азотом в качестве хладагента
Опухоли почек, из которых 85 % составляет почечно-клеточный рак, ежегодно являются причиной смерти у 140 тыс. человек во всем мире. Статистические показатели заболеваемости и смертности от рака почки – самые высокие в развитых странах, причем заболеваемость в этих странах продолжает расти. Значительной движущей силой данного увеличения можно назвать широкое использование передовых методов визуализации, благодаря чему более половины вновь выявленных опухолей почек в настоящее время можно обнаружить на ранних стадиях [1]. Эпидемиологический сдвиг в сторону локализованных опухолей, а также демографические изменения (повышение возраста наступления старости) обусловили спрос на минимально инвазивные варианты лечения небольших образований почки [2–4].
Криоаблация относится к методам, которые включают повреждение тканей путем замораживания с помощью эффекта Джоуля–Томсона. Она является наиболее оправданной при лечении локализованного рака почки. В зарубежных источниках приводится только сравнение доступа при криоаблации [5] или описание всех аблативных методик [6], или преимущества той или иной навигационной техники [7, 8]. В качестве объективного инструмента для описания анатомической сложности локализации опухоли, предсказывающего потенциальный риск развития осложнений после минимально инвазивных вмешательств, в настоящее время рассматриваются различные системы нефрометрии. Чаще других используются предоперационные характеристики и размеры образования. Работ, посвященных основанному на принципах доказательной медицины поиску предикторов осложнений после криовоздействия на опухоль, на данный момент нет.
Цель исследования – выделить факторы риска послеоперационных осложнений, возникающих после криоаблации локализованного рака почки.
Материал и методы
Проанализирован материал 56 пациентов с раком почки, которым в качестве лечебной опции была проведена криоаблация на криотерапевтической установке «МКС» с жидким азотом в качестве хладагента. Критерием включения в исследования являлся клинически локализованный рак почки (сT1a-cT1bN0M0).
Процедура криоаблации проводилась с использованием аппарата «МКС» (медицинская криотерапевтическая система) с жидким азотом в качестве подаваемого хладагента (производство ООО «Международный институт криомедицины» (Россия), государственный регистрационный номер № РЗН 2014/2273 от 20 января 2015 г.). В устройстве использовались иглообразные зонды, в которых жидкий азот расширялся в большую камеру внутри зонда. Это быстрое расширение создавало температуру ниже -190 °C на зонде, который охлаждал окружающую ткань за счет пассивной диффузии. С целью максимального разрушения опухоли все сеансы криоаблации проводились по одной и той же методике с числом циклов «замораживание – оттаивание» от 1 до 3. Продолжительность цикла зависела от размеров опухоли и, как следствие, размеров ледяной сферы, формирующейся за пределами образования почки. Протокол оттаивания включал пассивное нагревание в течение 5–10 мин между двумя циклами замораживания.
Вследствие богатого кровоснабжения опухоли почек более устойчивы к холоду, расчетная летальная температура составляет -40 °C. Повреждение тканей во время криоаблации опосредуется прямым механическим ударом, осмотическим шоком и клеточной гипоксией, поскольку внутриклеточные кристаллы льда разрушают клеточную мембрану. По мере оттаивания нарушение микроциркуляции приводит к дальнейшему повреждению опухолевой ткани и после формированию локального фиброза.
Непосредственно перед началом процедуры криоаблации с целью морфологической верификации выполнялась трепанбиопсия образования. В исследование были включены только пациенты с подтвержденным онкологическим заболеванием. Для правильного позиционирования и монитори- рования иглы, зондов и ледяного шара в режиме реального времени использовались УЗИ или КТ-навигация.
Ранние послеоперационные, стационарные осложнения и осложнения, выявленные при последующем наблюдении (в интервале 30 дней), были определены в соответствии с классификацией Клавьен–Диндо. Анализированы факторы, которые были связаны с частотой осложнений процедуры: представляющие интерес переменные сравнивались с использованием точного критерия χ2 или Фишера для категориальных параметров, а также с помощью критерия Манна–Уитни или t-критерия Стьюдента для непрерывных переменных. Графически полученные результаты представляли с использованием пакетов «Statistica», версия 10, Microsoft ® PowerPoint 2000 (Windows 10). В исследовании проведена оценка влияния факторов на признак-результат, в качестве которого был представлен факт возникновения раннего послеоперационного осложнения. С помощью коэффициентов связи было определено качество модели взаимосвязей переменных и результирующего признака.
Исследование было разработано в соответствии с этическими стандартами, изложенными в Хельсинкской декларации, и одобрено локальным комитетом по этике. Все анамнестические, клинические и лабораторные данные, содержащие конфиденциальную информацию о пациентах, были деидентифицированы, чтобы обеспечить анализ только анонимных данных.
Суммарная характеристика пациентов представлена в табл. 1. Мужчин было 26 (46,4 %), женщин – 30 (53,6 %). Средний возраст – 66 ± 7,9 года. Максимальный размер опухоли – 73 мм (среднее значение – 26 ± 8 мм), в большинстве случаев (96,4 %) размеры опухоли почки не превышали 3 см. Образование локализовалось в правой почке – в 32 (57,1 %), в левой – в 24 (42,9 %) случаях. В верхней трети опухоль выявлена в 15 (26,8 %), в средней трети – в 28 (50 %), в нижней трети – в 13 (23,2 %) наблюдениях. По шкале RENAL была оценена степени сложности манипуляции. На долю низкой степень сложности выполнения аблации (оценка не-фрометрии – 4–6) пришлось 37 (66,1 %), умеренной степени сложности (оценка нефрометрии – 7–9) – 19 (33,9 %) клинических случаев (табл.).
Таблица/table
Характеристика пациентов, подвергшихся криоаблации локализованного рака почки characteristics of patients undergoing cryoablation for localized Kidney cancer
|
Показатель/Parameters |
Значение/Values |
|
Возраст, лет/Age, years |
|
|
Среднее значение ± SD (вариация)/Mean ± SD (variation) |
66 ± 7,9 (40–86) |
|
Медиана (межквартильный размах, Q1 – Q3)/Median (interquartile range, Q1 – Q3) |
66,5 (58,75–72) |
|
Пол/Gender |
|
|
Муж/Male |
26 (46,4 %) |
|
Жен/Female |
30 (53,6 %) |
|
Размер опухоли, мм/Tumor size, mm |
|
|
Среднее значение ± SD (вариация)/Mean ± SD (variation) |
26 ± 8 (8–73) |
|
Медиана (межквартильный размах, Q1 – Q3)/Median (interquartile range, Q1 – Q3) |
24 (18–29) |
|
T1a (≤ 40 мм) |
28 (50 %) |
|
T1a (≤ 20 мм) |
21 (37,5 %) |
|
T1a (˃ 20 мм) |
15 (26,8 %) |
|
T1b (≥ 40 мм) |
2 (3,6 %) |
|
Локализация опухоли/Tumor localization Правая почка/Right kidney Левая почка/Left kidney |
32 (57,1 %) 24 (42,9 %) |
|
Полюс почки/Kidney pole |
|
|
Верхний/Upper |
15 (26,8 %) |
|
Средняя треть/Middle third |
28 (50,0 %) |
|
Нижний/Lower |
13 (23,2 %) |
|
RENAL |
|
|
≤ 6 |
37 (66,1 %) |
|
˃ 6 |
19 (33,9 %) |
У большинства пациентов оперативное пособие производилось с использованием эндотрахеаль-ной анестезии – в 45 (80,4 %) случаях, реже – с применением местного обезболивания – у 11 (19,6 %) больных. Доступ для криоаблации был осуществлен перкутанным способом под УЗИ навигацией в 4 (7,1 %) случаях, под КТ навигацией – в 46 (82,1 %), лапароскопически – в 6 (10,7 %) наблюдениях. Количество зондов – от 1 до 4. Диаметр зондов варьировал от 1,5 до 3 см. Количество и диаметр зондов напрямую зависели от локализации и размеров опухоли почки. Число циклов «замораживание – оттаивание» колебалось от 1 до 3. Продолжительность операции составляла от 50 до 180 мин (среднее значение – 95,5 ± 17,5). Следует отметить, что у 17 (30,4 %) пациентов органосохраняющая операция проводилась на единственной почке (в анамнезе была нефрэктомия).
Результаты
В послеоперационном периоде подкапсульная гематома с максимальным объемом до 100 мл была диагностирована у 26 (46,4 %) пациентов, послеоперационный термический ожог кожи – у 2 (3,6 %) больных. Все осложнения были купированы консервативно. В одном наблюдении выявлен спонтанный пневмоторакс. Описанные осложнения классифицированы по системе Клавьен–Диндо как I–II степени тяжести. Средний срок госпитализации составил 3 дня (от 0 до 7 дней).
В унивариантный анализ были отобраны 9 факторов-предикторов, влияющих на риск развития осложнений криоаблации рака почки. Только 2 фактора были апостериорно ассоциированы с повышенным риском осложнений в послеоперационном периоде: локализация опухоли в правой почке (отношение шансов 0,2619, 95 % доверительный интервал 0,08553–0,8020; р=0,019) и локализация в верхнем полюсе почки (отношение шансов 0,09955, 95 % доверительный интервал 0,01872–0,5292; р=0,0068) (рис. 1).
Чрескожная термическая абляция является эффективным и безопасным методом лечения пациентов с небольшими опухолями почки [9, 10]. Рекомендации Американской урологической ассоциации включают чрескожную абляцию в качестве одного из вариантов лечения для пациентов с опухолями почек T1a (≤4 см) [11]. Исторически сложилось так, что чрескожная абляция проводилась у пациентов с небольшими экзофитными опухолями, локализующимися по задне-боковой поверхности почки. В последнее время метод используется при более крупных опухолях с центральным расположением [12], что сопряжено с увеличением количества осложнений после манипуляции [9].
По мере того, как использование чрескожной криоаблации почек становилось все более рутинным, у хирургов появилась необходимость индивидуализировать оценку риска ранних послеоперационных осложнений, основанную на факторах-предикторах. По данным F . Stacul et al., с риском осложнений по системе Клавьен–Диндо >I степени тесно коррелировали возраст пациента, размер опухоли и количество криозондов [13]. H.D. Aounet al. показано, что опухоли >3 см связаны с большей частотой серьезных осложнений [14], Z. Okhunov et al. продемонстрировали появление значительно более высокого риска серьезных осложнений при опухолях >4 см [15]. В противоположность предыдущему исследованию D.J. Breen et al. показали, что фактор «опухоль, имеющая размер в максимальном сечении >4 см», не был значимым для прогнозирования серьезных осложнений [16]. В нашей выборке пациентов средний диаметр образования составил 2,6 ± 0,8 см, что меньше по сравнению с другими сериями пациентов (2,9 см в публикации H.D. Aoun et al. (2017), 2,8 см – в серии Z. Okhunov et al. (2015), 3,3 см – в серии D.J. Breen et al. (2018)) [14–16]. Вероятно, именно по этой причине мы не нашли значимой связи между фактором размера опухоли и увеличенным риском развития послеоперационных осложнений.
Обсуждение
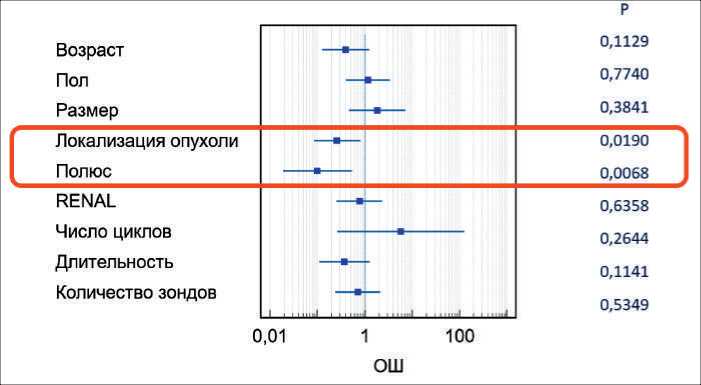
Рис. 1. Унивариантный анализ факторов риска осложнений криоаблации рака почки Fig. 1. Univariate analysis of risk factors for complications of cryoablation of kidney cancer
Такие анатомические особенности, как близость к мочеточниково-тазовому соединению, тонкой или толстой кишке и нервам, могут увеличить риск осложнений, сопровождающих криоаблацию. Стентирование мочеточника для ретроградной пиелоперфузии и гидродиссекция кишечника являются стратегиями, используемыми для предотвращения осложнений, связанных с ранением этих органов. К сожалению, высокая частота развития подкапсульных гематом – 25 (46,4 %) в настоящем исследовании – не дает нам полного права применять нефрометрические системы, используемые для стратификации результатов резекции почки, для прогнозирования технической осуществимости криоаблации. Действительно, факторы, влияющие на техническую осуществимость криоаблации, отличаются от факторов, оказывающих действие на осуществимость других нефрон-сберегающих операций. Были предложены две системы не-фрометрии: для прогнозирования риска развития осложнений, вызванных термической аблацией, и система анализа риска рецидива. Но обе оценки не имеют подтверждающих исследований, и, что примечательно, эти системы нефрометрии были разработаны для анализа популяций с небольшим числом пациентов и небольшим количеством негативных исходов [17, 18].
A.W.P. Maxwell et al., оценивая максимальный диаметр опухоли (категория Radius), показали, что этот фактор превосходил общий показатель нефрометрии RENAL в прогнозировании местного рецидива опухоли и повышенного риска осложнений [19]. Учитывая все недостатки не-фрометрических систем для термических аблаций, были созданы и протестированы альтернативные модели. Например, созданная в 2017 г. A.V. Man-silla et al. система оценки сложности чрескожной почечной абляции является упрощенной версией оценки нефрометрии RENAL и также учитывает потенциал ятрогенного повреждения близлежащих анатомических структур в модели риска. Данная система оценок, названная P-RAC, включает в себя максимальный диаметр опухоли, расстояние до ближайшей анатомической структуры, экзо- или эндофитный характер роста и неоднократность процедуры вблизи окружающих органов, которые подвергаются опасности повреждения [20]. Кроме того, были предложены и другие модифицированные системы (mRENAL) [21]. В этом способе ана- лиза оценок прогнозирования риска осложнений основную роль играет диаметр опухоли, и авторы обнаружили, что mRENAL несет большую диагностическую ценность в предсказании серьезных осложнений, чем исходная оценка нефрометрии.
Список литературы Ранние послеоперационные осложнения криоаблации клинически локализованного рака почки на криотерапевтической установке "МКС" с жидким азотом в качестве хладагента
- Capitanio U, Bensalah K., BexA., Boorjian S.A., Bray F., Coleman J., Gore J.L., Sun M., Wood C., Russo P. Epidemiology of Renal Cell Carcinoma. Eur Urol. 2019; 75(1): 74-84. doi: 10.1016/j.eururo.2018.08.036.
- RamanathanR., LeveilleeR.J. Ablative therapies for renal tumors. Ther Adv Urol. 2010; 2: 51-68. doi.org/10.1177/1756287210366708.
- Campbell S., Uzzo R.G., AllafM.E, Bass E.B., Cadeddu J.A., Chang A., Clark P.E., Davis B.J., Derweesh I.H., Giambarresi L., Gervais D.A., Hu S.L., LaneB.R., LeibovichB.C., PierorazioP.M. Renal Mass and Localized Renal Cancer: AUA Guideline. J Urol. 2017; 198(3): 520-9. doi: 10.1016/j.juro.2017.04.100.
- Chang X., Liu T., Zhang F., Ji C., Zhao X., Wang W., Guo H. Radiofrequency ablation versus partial nephrectomy for clinical T1a renal-cell carcinoma: long-term clinical and oncologic outcomes based on a propensity score analysis. J Endourol. 2015; 29(5): 518-25. doi: 10.1089/end.2014.0864.
- Cernic S., Marrocchio C., Ciabattoni R., Fiorese I., Stacul F., GiudiciF., RizzoM., CovaM.A. Percutaneous CT-Guided Renal Cryoab-lation: Technical Aspects, Safety, and Long-Term Oncological Outcomes in a Single Center. Medicina (Kaunas). 2021; 57(3): 291. doi: 10.3390/ medicina57030291.
- Abdelsalam M.E., Ahrar K. Ablation of Small Renal Masses. Tech Vasc Interv Radiol. 2020; 23(2): 100674. doi: 10.1016/j. tvir.2020.100674.
- Asayama Y., Nishie A., Ushijima Y., Okamoto D., Morita K., Takao S., Kakihara D., Ishimatsu K., Ishigami K., Fujita N., Honda H. Usefulness of a Pretreatment CT-Based Modified RENAL Nephrometry Score in Predicting Renal Function After Cryotherapy for T1a Renal Mass. Cardiovasc Intervent Radiol. 2019; 42(8): 1128-34. doi: 10.1007/ s00270-019-02238-1.
- De Marini P., Cazzato R.L., Garnon J., Dalili D., Leonard-Lorant I., Leclerc L., Autrusseau P.A., Auloge P., Weiss J., Tricard T., Lang H., Gangi A. Safety and oncologic efficacy of percutaneous MRI-guided cryoablation of intraparenchymal renal cancers. Diagn Interv Imaging. 2021; 102(9): 531-8. doi: 10.1016/j.diii.2021.04.002.
- Atwell T.D., FarrellM.A., LeibovichB.C., CallstromM.R., Chow G.K., Blute M.L., Charboneau J.W. Percutaneous renal cryoablation: experience treating 115 tumors. J Urol. 2008; 179(6): 2136-40. doi: 10.1016/j. juro.2008.01.144.
- Littrup P.J., Ahmed A., Aoun H.D., Noujaim D.L., Harb T., Nakat S., Abdallah K., Adam B.A., Venkatramanamoorthy R., Sakr W., Pontes J.E., Heilbrun L.K. CT-guided percutaneous cryotherapy of renal masses. J Vasc Interv Radiol. 2007; 18(3): 383-92. doi: 10.1016/j. jvir.2006.12.007.
- CampbellS.C., NovickA.C., BelldegrunA., BluteM.L., Chow G.K., Derweesh I.H., Faraday M.M., Kaouk J.H., Leveillee R.J., Matin S.F., Russo P., Uzzo R.G.; Practice Guidelines Committee of the American Urological Association. Guideline for management of the clinical T1 renal mass. J Urol. 2009; 182(4): 1271-9. doi: 10.1016/j.juro.2009.07.004.
- Ficarra V., Novara G., Secco S., Macchi V., Porzionato A., De Caro R., Artibani W. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery. Eur Urol. 2009; 56(5): 786-93. doi: 10.1016/j.eururo.2009.07.040.
- StaculF., Sachs C., GiudiciF., BertolottoM., RizzoM., PavanN., BalestreriL., Lenardon O., Pinzani A., PolaL., CiceroC., CeliaA., CovaMA. Cryoablation of renal tumors: long-term follow-up from a multicenter experience. Abdom Radiol (NY). 2021; 46(9): 4476-88. doi: 10.1007/ s00261-021-03082-z.
- Aoun H.D., Littrup P. J., Jaber M., Memon F., Adam B., Krycia M., PrusM., HeathE., PontesE. Percutaneous Cryoablation of Renal Tumors: Is It Time for a New Paradigm Shift? J Vasc Interv Radiol. 2017; 28(10): 1363-70. doi: 10.1016/j.jvir.2017.07.013.
- Okhunov Z., Juncal S., Ordon M., George A.K., Lusch A., del Junco M., NguyentatM., Lobko I.I., Kavoussi L., Landman J. Comparison of outcomes in patients undergoing percutaneous renal cryoablation with sedation vs general anesthesia. Urology. 2015; 85(1): 130-4. doi: 10.1016/j.urology.2014.09.013.
- Breen D.J., King A.J., Patel N., Lockyer R., Hayes M. Image-guided Cryoablation for Sporadic Renal Cell Carcinoma: Three- and 5-year Outcomes in 220 Patients with Biopsy-proven Renal Cell Carcinoma. Radiology. 2018; 289(2): 554-61. doi: 10.1148/radiol.2018180249.
- Rosevear H.M., Gellhaus P.T., Lightfoot A.J., Kresowik T.P., Joudi F.N., Tracy C.R. Utility of the RENAL nephrometry scoring system in the real world: predicting surgeon operative preference and complication risk. BJU Int. 2012; 109(5): 700-5. doi: 10.1111/j.1464-410X.2011.10452.x.
- Simhan J., SmaldoneM.C., TsaiK.J., CanterD.J., Li T., KutikovA., ViterboR., ChenD.Y.T., GreenbergR.E., UzzoR.G. Objective measures of renal mass anatomic complexity predict rates of major complications following partial nephrectomy. Eur Urol. 2011; 60(4): 724-30. doi: 10.1016/j. eururo.2011.05.030.
- Maxwell A.W.P., Baird G.L., Iannuccilli J.D., Mayo-Smith W. W, DupuyD.E. Renal Cell Carcinoma: Comparison of RENAL Nephrometry and PADUA Scores with Maximum Tumor Diameter for Prediction of Local Recurrence after Thermal Ablation. Radiology. 2017; 283(2): 590-7. doi: 10.1148/radiol.2016161225.
- Mansilla A.V., Bivins E.E. Jr., Contreras F., Hernandez M.A., KohlerN., PepeJ.W. CT-Guided Microwave Ablation of 45 Renal Tumors: Analysis of Procedure Complexity Utilizing a Percutaneous Renal Ablation Complexity Scoring System. J Vasc Interv Radiol. 2017; 28(2): 222-9. doi: 10.1016/j.jvir.2016.10.013.
- Mouli S.K., McDevitt J.L., Su Y.K., RaginA.B., Gao Y, Nemcek A.A. Jr., Lewandowski R.J., Salem R., Sato K.T. Analysis of the RENAL and mRENAL Scores and the Relative Importance of Their Components in the Prediction of Complications and Local Progression after Percutaneous Renal Cryoablation. J Vasc Interv Radiol. 2017; 28(6): 860-7. doi: 10.1016/j.jvir.2016.12.1224.
- McCaffertyB.J., Huang J.J., ElKhudariH., Macha V., BreadyE., Rais-Bahrami S., Gunn A.J. External Validation of the Renal Ablation-Specific (MC)2 Risk Scoring System in Predicting Complications from Percutaneous Renal Cryoablation. Cardiovasc Intervent Radiol. 2021; 44(11): 1763-8. doi: 10.1007/s00270-021-02929-8.
- Schmit G.D., Schenck L.A., Thompson R.H., Boorjian S.A., Kurup A.N., Weisbrod A.J., Kor D.J., Callstrom M.R., Atwell T.D., Carter R.E. Predicting renal cryoablation complications: new risk score based on tumor size and location and patient history. Radiology. 2014; 272(3): 903-10. doi: 10.1148/radiol.14132548.
- Oberweis B.S., Nukala S., Rosenberg A., Guo Y., Stuchin S., Radford M.J., Berger J.S. Thrombotic and bleeding complications after orthopedic surgery. Am Heart J. 2013; 165(3): 427-33. doi: 10.1016/j. ahj.2012.11.005.


