Ранние результаты лучевой терапии местнораспространённого рака органов головы и шеи в режиме ускоренного фракционирования
Автор: Гордон К.Б., Гулидов И.А., Семнов А.В., Раджапова М.У., Севрюков Ф.Е.
Рубрика: Научные статьи
Статья в выпуске: 2 т.27, 2018 года.
Бесплатный доступ
Целью исследования была оценка непосредственной эффективности и ранней токсичности лучевой терапии местнораспространённых форм плоскоклеточного рака органов головы и шеи III-IVB стадий в режиме ускоренного фракционирования (разовая очаговая доза 2,4 Гр) в самостоятельном варианте и в сочетании с радиосенсибилизирующей химиотерапией препаратами платины, таксанами и 5-фторурацилом. Материал представлен результатами лечения 69 пациентов с диагнозом плоскоклеточного рака органов головы и шеи III-IVB стадий. Мукозиты 3-4 степени развились у 7 (43,8%) пациентов, проходивших курс лучевой терапии в самостоятельном варианте, 9 (32,2%) пациентов в группе с индукционной химиотерапией, 8 (32,0%) пациентов в группе симультанного химиолучевого лечения. Непрерывный курс лечения провели 46 (66,6%) пациентам. Из-за тяжёлых ранних лучевых реакций 23 пациентам в лечении был сделан вынужденный перерыв. Все пациенты (100%), получившие курс лучевой терапии в самостоятельном варианте, перенесли его без перерыва. В группе с индукционной химиотерапией таковых оказалось 42,8%, симультанной - 20,8%. Объективный ответ опухоли на лучевую терапию был зарегистрирован у 63 (91,3%) пациентов. Значительно чаще объективный ответ был получен в группах с индукционной и симультанной химиотерапией. Выявлены значимые различия результатов лечения в пользу добавления в схему лечения местнораспространённых форм рака головы и шеи химиотерапии в любой из вариаций по сравнению с лучевой терапией в самостоятельном варианте (p
Рак органов головы и шеи, лучевая терапия, индукционная химиотерапия, симультанная химиотерапия, лучевые реакции, общая выживаемость, локальный контроль, результаты лечения, ускоренное фракционирование, нетрадиционное фракционирование
Короткий адрес: https://sciup.org/170170340
IDR: 170170340 | УДК: 617.51/.53-006.6-085.849.1-036.8 | DOI: 10.21870/0131-3878-2018-27-2-107-116
Текст научной статьи Ранние результаты лучевой терапии местнораспространённого рака органов головы и шеи в режиме ускоренного фракционирования
Рак органов головы и шеи (ОГИШ) – это гетерогенная группа заболеваний, включающая в себя злокачественные новообразования носа, гортани, глотки, придаточных пазух и слюнных желез. Ежегодно в мире выявляется около 550 тыс. новых случаев рака ОГИШ [1]. В России опухолями ОГИШ каждый год заболевает более 20 тыс. человек. Это составляет 7,1% в структуре злокачественных новообразований [2]. Обращает на себя внимание средний возраст пациентов с раком ОГИШ. Вероятность развития данной патологии многократно возрастает к 50-55 годам. Около 60-70% пациентов на момент постановки диагноза находятся в активном трудоспособном возрасте.
По данным статистики, лишь одна треть больных начинает лечение на I-II стадиях заболевания (T1-2N0) [3]. Согласно ряду современных рекомендаций комбинированное лечение является стандартом в лечении местнораспространённых форм рака ОГИШ [4, 5]. При операбель-
Гордон К.Б .* – н.с., к.м.н.; Гулидов И.А. – зав. отд., д.м.н., проф.; Семёнов А.В . – м.н.с.; Раджапова М.У . – в.н.с., к.м.н.; Севрюков Ф.Е. – зав. отд., к.м.н. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
ном процессе рекомендовано хирургическое вмешательство с дальнейшей адъювантной терапией. При нерезектабельных опухолях или отказе пациента от операции вариантами лечения являются лучевая терапия, химиотерапия или сочетание этих двух методов. Но чаще всего больные получают симптоматическое лечение [6].
Обращают на себя внимание и неудовлетворительные результаты терапии местнораспространённых форм заболевания: локальный рецидив при неоперабельном раке III-IV стадий при проведении только консервативного лечения происходит в 50-60% случаев в течение 2 лет. Регионарный рецидив заболевания выявляется у 20-30% пациентов в течение этого же срока. Общая пятилетняя выживаемость в случае рецидива после консервативного лечения составляет 25% [7].
Основными путями возможного повышения эффективности лучевой терапии являются эскалация суммарной дозы на опухоль и/или сокращение общего времени лечения для противодействия эффекту репопуляции опухолевых клеток [8, 9]. Budach et al. продемонстрировали увеличение показателя общей выживаемости в среднем на 12 месяцев при одновременной хи-миолучевой терапии местнораспространённых форм рака ОГИШ по сравнению с самостоятельным лучевым лечением [10]. Имеется также российский опыт, демонстрирующий преимущество одновременного химиолучевого лечения по сравнению с лучевой терапией местнораспространённого рака ОГИШ [11].
В работе Bourhis et al. [12] было доказано, что изменение режима фракционирования может являться путём повышения эффективности лучевой терапии. Нетрадиционные режимы фракционирования продемонстрировали увеличение 5-летней общей выживаемости на 3% (p=0,003), а режим гиперфракционирования повышал общую выживаемость на 8,2% (по сравнению с конвенциональным облучением, p=0,02).
В работах российских авторов также существуют предпосылки к дальнейшему изучению проблемы применения нетрадиционных режимов фракционирования, в том числе при использовании современной протонной терапии [13-15].
Интенсификация лучевой терапии хоть и обладает доказанной эффективностью, однако зачастую сопряжена с увеличением частоты развития явлений ранней и поздней токсичности. Большие объёмы облучения и близкое расположение критических структур не всегда оставляют возможность для эскалации суммарной очаговой дозы. Однако высокий риск локорегионар-ного рецидива у пациентов с местнораспространённым раком ОГИШ направляет специалистов на поиск оптимальной методики лучевой терапии, обеспечивающей высокий уровень локоре-гионарного контроля при допустимых уровнях ранней и поздней токсичности лечения.
Цель исследования: оценить непосредственную эффективность и раннюю токсичность лучевой терапии местнораспространённых форм плоскоклеточного рака органов головы и шеи III-IVB стадий в режиме умеренного гипофракционирования (с разовой очаговой дозой 2,4 Гр) в самостоятельном варианте и в сочетании с радиосенсибилизирующей химиотерапией.
Материалы и методы
Клинический материал представлен результатами лечения 69 больных с впервые выявленным, морфологически верифицированным диагнозом рака органов головы и шеи III-IVB стадий. В 100% случаев это был плоскоклеточный рак различной степени дифференцировки. Соотношение мужчин и женщин составило 4,3:1. Средний возраст – 52,2±3,53 лет. Перед началом лечения общее состояние больных оценивали по шкале Карновского. Среднее значение составило 80 баллов.
Стадию заболевания устанавливали в соответствии с международной классификацией TNM (7-е издание) [16].
Таблица
Распределение больных в зависимости от стадии заболевания
|
Стадия заболевания |
Число больных |
|
III |
33 |
|
IVA |
16 |
|
IVB |
20 |
|
Всего: |
69 |
У 49 (70,0%) пациентов имелось метастатическое поражение регионарных лимфатических узлов. У 20 (30,0%) пациентов местнораспространённая форма заболевания была обусловлена размерами первичного очага.
Лучевую терапию в самостоятельном варианте получили 16 (23,2%) пациентов, лучевую терапию с индукционной химиотерапией (от одного до трёх циклов) – 28 (40,5%) пациентов. Одновременное химиолучевое лечение проведено 25 (36,3%) пациентам.
Были использованы методики конформного облучения, трёхмерного планирования, трёхмерной визуализации мишени (рис. 1). Разовая очаговая доза на первичный опухолевый очаг составляла 2,4 Гр. Облучение проводилось один раз в день, 5 дней в неделю, до суммарной очаговой дозы 60-62,4 Гр, что соответствует 64,5-67 Гр (EQD2), подведённым в режиме конвенционального облучения. Профилактическое облучение лимфатических коллекторов шеи проводилось до суммарной очаговой дозы 46-48 Гр (эквивалентно 49,4-51,6 Гр в режиме традиционного фракционирования). При этом выигрыш в сроках проведения облучения по сравнению с традиционным режимом составил 5-6 дней.
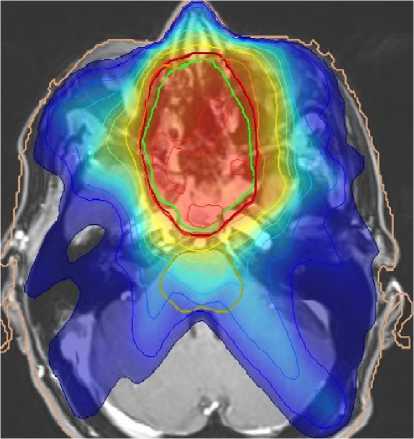
Рис. 1. Пример дозного распределения 3D-конформной терапии по поводу плоскоклеточного рака носоглотки. Оценку лучевых нагрузок на органы риска при изменённом режиме фракционирования проводили по линейно-квадратичному уравнению.
Через 4 недели после окончания курса лучевой терапии проводили оценку степени регрессии опухоли и поражённых лимфатических узлов. При неполной регрессии регионарных метастазов через 4-6 недель после окончания лучевого лечения больным выполняли лимфодис-секцию, при неполной регрессии первичного опухолевого очага и операбельном процессе – хирургическое вмешательство, при неоперабельных опухолях была применена системная химиотерапия.
В качестве системной химиотерапии использовали сочетание препаратов платины и 5-фторурацила; 4 пациента получили сочетание препаратов платины, 5-фторурацила и таксанов.
Пациентам проводили сопроводительную симптоматическую терапию, при снижении нутритивного статуса – энтеральную нутритивную поддержку.
Оценку состояния слизистых оболочек верхних дыхательных путей для определения степени мукозита в зоне облучения проводили в соответствии со шкалой RTOG/EORTC. При развитии острого лучевого мукозита (RTOG 3-4) в лечении делали вынужденный перерыв до стихания реакций слизистой оболочки. В рамках исследования фиксировали время перерыва и суммарную дозу, на которой в лечении делали перерыв.
Полученные данные были обработаны с применением общепринятых методов вариационной статистики с использованием стандартных пакетов программ статистического анализа Statistica.
Результаты
Непосредственную эффективность лучевой терапии оценивали спустя 4 недели после окончания курса лучевой терапии и стихания ранних лучевых реакций согласно рекомендациям RECIST 1.1. Для оценки регрессии опухоли, согласно рекомендациям Всемирной организации здравоохранения, использовали эндоскопические, ультразвуковые и рентгенологические методы исследования. Всем пациентам проводили оценку состояния слизистых оболочек верхних дыхательных путей и кожных покровов. Лучевые реакции разной степени выраженности по окончании курса лучевой терапии были зарегистрированы у 100% пациентов.
Мукозиты 3-4 степени развились у 7 (43,8%) пациентов, получивших курс лучевой терапии в самостоятельном варианте, 9 (32,2%) пациентов в группе с индукционной химиотерапией, 8 (32,0%) пациентов в группе симультанного химиолучевого лечения. Однако эти данные не позволяют утверждать, что химиолучевое лечение по уровню ранней токсичности сравнимо с самостоятельной лучевой терапией. Лучевая терапия в самостоятельном варианте, как правило, применялась в случаях обширного опухолевого поражения, выраженного болевого синдрома, изначально ослабленного соматического статуса пациента. По нашему мнению, данные факторы послужили причиной развития столь частых лучевых реакций тяжёлой степени в группе самостоятельной лучевой терапии.
У 46 (66,6%) пациентов был проведён непрерывный курс лечения. 23 пациентам из-за развившихся лучевых реакций (мукозит 3-4 степени, присоединение инфекции, общее ухудшение самочувствия) в лечении был сделан вынужденный перерыв. Средняя продолжительность перерыва составила 16 дней. 100% пациентов, прошедших курс лучевой терапии в самостоятельном варианте, перенесли его без перерыва. В группе с индукционной химиотерапией таковых оказалось 42,8%, симультанной – 20,8%.
Объективный ответ опухоли на лучевую терапию был зарегистрирован у 63 (91,3%) пациентов. Обращает на себя внимание тот факт, что полная регрессия опухолевого очага чаще наблюдалась в группах с индукционной и симультанной химиотерапией (63,2% против 37,0% в группе самостоятельной лучевой терапии). Выявлены значимые различия в пользу добавления в схему лечения местнораспространённых форм рака головы и шеи химиотерапии в любой из вариаций по сравнению с лучевой терапией в самостоятельном варианте (p<0,05).
Время наблюдения за группой больных варьируется от 1 до 20 месяцев, медиана наблюдения составляет 5,5 месяца, средний срок наблюдения – 7,3 месяца. Однолетняя общая выживаемость (рис. 2) при этом составляет 71,8±7,0%. Уровень локального контроля (рис. 3) в течение 12-месяцев – 66,1±8,3%.
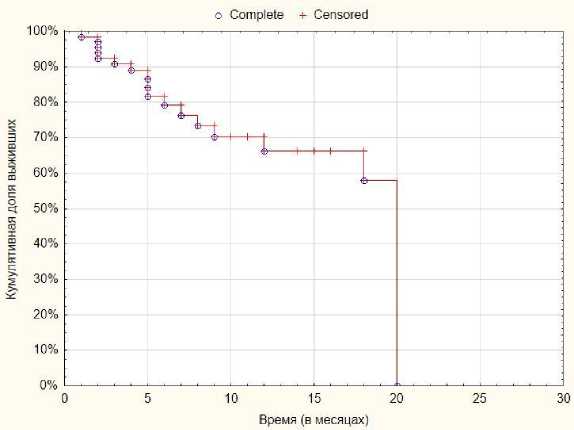
Рис. 2. Показатели общей выживаемости.
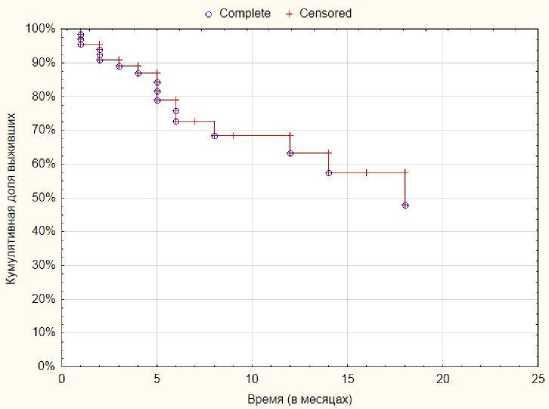
Рис. 3. Показатели локорегионарного контроля.
Обсуждение
Имеющиеся на сегодняшний день данные указывают на необходимость изучения эффективности и целесообразности применения нетрадиционных режимов фракционирования в лучевой терапии рака ОГИШ. Режим ускоренного фракционирования значительно снижает время пребывания больного в стационаре при сохранении приемлемого уровня токсичности лечения и достаточно высокой эффективности. Известно, что на радиорезистетность рано реагирующих на облучение опухолей, к которым относится плоскоклеточный рак, оказывает влияние скорость клеточной репопуляции. Под репопуляцией понимают процесс регенерации тканей вскоре после облучения. С увеличением общего времени облучения радиоустойчивость тканей увеличивается. Данные литературы указывают на повышение риска локорегионарного рецидива при пролонгированном лечении [17]. По данным Suwinski et al. [18], каждый день перерыва свыше 6 дней увеличивает вероятность рецидива заболевания на 2%. Следует отметить, что даже в течение коротких промежутков между облучениями, например выходными днями, клеточная популяция продолжает расти. Однако радиорезистентность ткани остаётся на прежнем уровне [19].
Вынужденные перерывы в лечении плоскоклеточного рака ОГИШ, как правило, приходятся на 3-4 недели курса в связи с развитием тяжёлых лучевых мукозитов. Данный период совпадает с увеличением скорости пролиферации опухолевых стволовых клеток [20]. Следовательно, перерыв в лечении может привести к значительному снижению уровня локорегионарного контроля.
Изменённые режимы фракционирования, как и проведение одновременного химиолуче-вого лечения, являются дополнительными факторами агрессии. Следовательно, они увеличивают вероятность вынужденного перерыва. Мы считаем, что схема применения симультанной химиотерапии вместе с лучевой терапией в режиме ускоренного фракционирования требует тщательного отбора больных. Внимательное отношение к предлучевой подготовке (санация полости рта, удаление съёмных металлических конструкций) и качеству сопроводительной терапии – два других фактора, способных уменьшить число вынужденных перерывов в данной группе больных.
Заключение
Лучевая терапия плоскоклеточного рака головы и шеи в режиме ускоренного фракционирования с разовой очаговой дневной дозой 2,4 Гр (в самостоятельном варианте и в сочетании с химиотерапией) является эффективным методом с приемлемым уровнем ранней токсичности. 100% пациентов, начавших курс, закончили его, получив запланированную дозу лучевой терапии. Суммарная очаговая доза составляла 60,0-62,4 Гр, эквивалентных 64,5-67,1 Гр в конвенциональном режиме фракционирования. Интенсификация лучевого лечения позволяет значительно сократить его продолжительность при отсутствии вынужденного перерыва. Радикальный курс лучевой терапии в режиме ускоренного фракционирования занимает 5-6 недель против 7-8 недель в режиме традиционного фракционирования. Это позволяет говорить о том, что метод является экономически целесообразным. Однако требуются чёткие показания к применению данного метода, особенно при проведении одновременного химиолучевого лечения. Необходимо дальнейшее наблюдение за группой пациентов для оценки рисков развития поздних осложнений лучевой терапии, получения данных общей выживаемости и локорегионарного контроля при длительных сроках наблюдения.
Список литературы Ранние результаты лучевой терапии местнораспространённого рака органов головы и шеи в режиме ускоренного фракционирования
- Jemal A., Bray F., Center M.M., Ferlay J., Ward E., Forman D. Global cancer statistics//CA Cancer J. Clin. 2011. V. 61, N 2. P. 69-90.
- Состояние онкологической помощи населению России в 2014 году/под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена -филиал ФГБУ «НМИРЦ» Минздрава России, 2015. C. 31-32.
- Locally Advanced Squamous Carcinoma of the Head and Neck. Review of Cancer Medicines on the WHO List of Essential Medicines, 2014. P. 1-8. . URL: http://www.who.int/selection_medicines/committees/expert/20/applications/HeadNeck.pdf (дата обращения 19.05.2018).
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Head and neck cancer. Version 2.2017. . URL: https://education.nccn.org/node/81262 (дата обращения: 19.05.2018).
- Практические рекомендации по лечению злокачественных опухолей головы и шеи RUSSCO. Версия 2016 DOI: 10.18027/2224-5057-2016-4s2-55-63
- Гордон К.Б., Рожнов В.А., Гулидов И.А., Андреев В.Г., Курпешев О.К. Роль радиомодификации в лучевом лечении нерезектабельного рака гортани//Онкология. Журнал им. П.А. Герцена. 2015. Т. 4, № 6. С. 13-19.
- Denaro N., Russi E.G., Merlano M.C. Strategies for non-resectable head and neck cancer//Curr. Treat. Options Oncol. 2013. V. 14, N 4. P. 492-504.
- Overgaard J., Hansen H.S., Specht L., Overgaard M., Grau C., Andersen E., Bentzen J., Bastholt L., Hansen O., Johansen J., Andersen L., Evensen J.F. Five compared with six fractions per week of conventional radiotherapy of squamous-cell carcinoma of head and neck: DAHANCA and 7 randomised controlled trial//Lancet. 2003. V. 362, N 9388. P. 933-940.
- Saunders M.I., Rojas A.M., Parmar M.K., Dische S.; CHART Trial Collaborators. Mature results of a randomized trial of accelerated hyperfractionated versus conventional radiotherapy in head-and-neck cancer//Int. J. Radiat. Oncol. Biol. Phys. 2010. V. 77, N 1. P. 3-8.
- Budach W., Hehr T., Budach V., Belka C, Dietz K. A meta-analysis of hyperfractionated and accelerated radiotherapy and combined chemotherapy and radiotherapy regimens in unresected locally advanced squamous cell carcinoma of the head and neck//BMC Cancer. 2006. V. 6. P. 28.
- Панкратов В.А., Андреев В.Г., Мардынский Ю.С., Рожнов В.А., Курпешев О.К., Акки Э.Д. Современные возможности консервативного и комбинированного лечения местнораспространённого рака гортани//Сибирский онкологический журнал. 2013. № 2. С. 36-40.
- Bourhis J., Overgaard J., Audry H., Ang K.K., Saunders M., Bernier J., Horiot J.C., Le Maître A., Pajak T.F., Poulsen M.G., O'Sullivan B., Dobrowsky W., Hliniak A., Skladowski K., Hay J.H., Pinto L.H., Fallai C., Fu K.K., Sylvester R., Pignon J.P.; MARCH Collaborative Group. Hyperfractionated or accelerated radiotherapy in head and neck cancer: a meta-analysis//Lancet. 2006. V. 368, N 9538. P. 843-854.
- Гордон К.Б., Гулидов И.А., Рожнов В.А., Подлесных Н.И., Панкратов В.А. Лучевая терапия нерезектабельного рака гортани//Сибирский онкологический журнал. 2016. Т. 15, № 3. С. 72-77.
- Мардынский Ю.С., Гулидов И.А., Иванова И.Н. Результаты применения режима ускоренного гиперфракционирования в лечении немелкоклеточного рака лёгкого//Сибирский онкологический журнал. 2010. № 2. С. 11-14.
- Гулидов И.А., Мардынский Ю.С. Новые возможности для протонной терапии в России//Вопросы онкологии. 2016. Т. 62, № 5. С. 570-572.
- Атлас по классификации стадий злокачественных опухолей (TNM): пер. с англ., 2-е изд./под ред. А.Д. Каприна, А.Х. Трахтенберга. М.: Практическая Медицина, 2014. 650 с.
- Cannon D.M., Geye H.M., Hartig G.K., Traynor A.M., Hoang T., McCulloch T.M., Wiederholt P.A., Chappell R.J., Harari P.M. Increased local failure risk with prolonged radiation treatment time in head and neck cancer treated with concurrent chemotherapy//Head Neck. 2014. V. 36, N 8. P. 1120-1125.
- Suwinski R., Sowa A., Rutkowski T., Wydmanski J., Tarnawski R., Maciejewski B. Time factor in postoperative radiotherapy: a multivariate locoregional control analysis in 868 patients//Int. J. Radiat. Oncol. Biol. Phys. 2003. V. 56, N 2. P. 399-412.
- Джойнер М.С., Когель О.Д. Основы клинической радиобиологии: пер. с англ. И.В. Филиповича/под ред. Е.Б. Бурлаковой, Е.В. Кижаевой. М.: БИНОМ ЛЗ, 2013. 250 с.
- Ярмоненко С.П., Вайнсон А.А., Календо Г.С., Рампан Ю.И. Биологические основы лучевой терапии опухолей. М.: Медицина, 1976. 272 с.


