Ранняя послеоперационная реабилитация (fast track) при лапаро-торакоскопических резекциях проксимального отдела желудка и грудного отдела пищевода при кардиоэзофагеальном раке
Автор: Аллахвердян А.С., Овезов А.М., Анипченко Н.Н., Анипченко А.Н.
Журнал: Московский хирургический журнал @mossj
Статья в выпуске: 4 (56), 2017 года.
Бесплатный доступ
Препятствием к использованию малоинвазивных видеоэндоскопических доступов при радикальных хирургических операциях по по- воду кардиоэзофагеального рака служит необходимость выполнения резекции и лимфаденэктомии в двух анатомических зонах. Решение проблемы травматизма хирургических доступов актуализирует проблему оптимального послеоперационного ведения данной категории больных.В 2015-16 гг. было выполнено 27 резекций проксимального отдела желудка и ниж-не-грудного отдела пищевода с одномоментной внутриплев- ральной эзофагогастропласти-кой комбинированным лапароскопическим и правосторонним торакоскопическим досту-пом. Преобладали больные в III стадии заболевания - 14 (51,9 %) больных. В 4 (14,8 %) случаях была выявлена IV стадия. Резекция R0 была выполнена 24 (88,9%) больным, R1 - 3 (11,1 %). При гистологическом исследовании в среднем исследовалось 42±3 лимфатиче-ских узла. Преимущества радикальных операций при кардиоэзофагеальном раке комби-нированным лапароскопическим и правосторонним торакоскопическим доступом: чет-кость визуализации, хо- роший контроль гемостаза, удобство мобилизации желудка и пи-щевода, ранняя активизация больных в послеоперационном периоде (на 4-е сутки), со-кращение сроков стационарного лечения (7,3 суток). Применение технологии ранней по-слеоперационной реабилитации (fast-track ) позволяет уменьшить сроки госпитализации, ускорить выздоровление и восстановление трудоспособности больных.
Кардиоэзофагеальный рак, лапаро-торакоскопический доступ, ранняя реабилитация
Короткий адрес: https://sciup.org/142212761
IDR: 142212761 | УДК: 616.33-073.75
Текст научной статьи Ранняя послеоперационная реабилитация (fast track) при лапаро-торакоскопических резекциях проксимального отдела желудка и грудного отдела пищевода при кардиоэзофагеальном раке
Внедрение эндоскопических методов лечения привело к уменьшению сроков госпитализации, скорейшему выздоровлению и восстановлению трудоспособности оперируемых пациентов. Однако использование малотравматичных доступов не уменьшает объем операции и предполагает решение комплекса задач, направленного на ускорение ранней реабилитации больных.
Уменьшение травматичности онкологических операций больших объемов ставит перед хирургами целый комплекс сложных задач. Это особенно значимо при лечении карди-оэзофагеального рака (КЭР), которое представляет трудности даже в «открытой» хирургии. Они обусловлены необходимостью выполнения резекции и лимфаденэктомии в двух анатомических зонах [1, 2, 3]. До сих пор остаются спорными вопросы целесообразных объемов резекции и выбора «открытого» хирургического доступа. Чаще всего используются трансторакальные (левосторонний торакоабдоминальный по Осаве-Гэрлоку, комбинированный ла-паротомный с правосторонней торакотомией по Льюису) и трансхиатальный абдоминоцервикальный доступы [1, 4, 5, 6, 7]. Бесспорна необходимость расширенной лимфодис-секции в средостении и брюшной полости при радикальном удалении опухоли с резекцией и желудка, и пищевода [2, 3,
4, 6]. Подобные вмешательства также сопровождаются реконструкцией пищеварительного тракта. Трансторакальные доступы, позволяющие достичь большего радикализма и выполнить реконструкцию оптимальным образом, наиболее травматичны и затрудняют последующую реабилитацию больных, осложняя тем самым проведение комбинированного лечения. Реже используемый абдоми-но-медиастинальный доступ позволяет достичь меньшего травматизма даже по сравнению со стандартным трансхиатальным абдоминоцервикальным [6]. В то же время он существенно ограничивает уровень резекции пищевода и объем медиастинальной лимфодиссекции, что определяет целесообразность его применения при распространении опухоли не выше наддиафрагмального сегмента пищевода.
Поиски, направленные на снижение травматизма доступов и выполнения малоинвазивных хирургических операций, неизбежно привели к использованию возможностей видеоэндоскопической хирургии. При этом хирурги также столкнулись с трудностями, обусловленными необходимостью выполнения массивных операций в двух анатомических зонах. По-прежнему ключевую роль играют доступ и способ реконструкции, включающий особенности формирования пищеводного анастомоза. Очевидно, что хирургический доступ, при малой травматичности, должен обеспечить возможность полноценного выполнения резек- ционного и реконструктивного этапов. В нашем арсенале лишь два малоинвазивных доступа, позволяющих решить поставленные задачи. Это лапароскопический и торакоскопический доступы в различных комбинациях.
Есть публикации, посвященные лапароскопическим операциям у данной категории больных [8, 9]. Однако, оценка радикальности подобных операций не внушает оптимизма. Ряд авторов выполняют лапароскопические трансхиатальные эзофагэктомии при КЭР 1 типа, когда нет необходимости обширной проксимальной резекции желудка, и существует возможность формирования желудочного трансплантата достаточной длины, формируя пищеводный анастомоз на шее [8, 10, 11]. В похожих случаях используется также комбинация лапароскопического и правостороннего торакоскопического доступов с формированием пищеводного анастомоза третьим, шейным, доступом [12]. При невозможности формирования пищеводного анастомоза на шее, выполнялась торакотомия. Авторы отмечают значительное снижение числа послеоперационных, в первую очередь легочных и сердечно-сосудистых, осложнений после малоинвазивных вмешательств.
Тем не менее, следует отметить, что малоинвазивная хирургия в этом разделе осуществляется путем использования комбинации малоинвазивных, видеоэндоскопических, и открытых доступов. И это, в первую очередь, связано с трудностями, которые представляет восстановление целостности пищеварительного тракта после резекции и пищевода и желудка. Длина формируемого желудочного стебля не всегда позволяет вывести анастомоз на шею, и в такой ситуации чаще всего возникает необходимость резекции пищевода на уровне среднегрудного его отдела. Кроме того, в случаях, когда одномоментная эзофагогастрэктомия не показана, механический пищеводно-желудочный анастомоз сформировать на указанном уровне технически невозможно. Формирование «ручного» пищеводно-желудочного анастомоза на уровне грудного отдела может решить проблему мало-инвазиных операций по поводу кардиоэзофагеального рака.
В результате поиска эффективных методов лечения хирургических больных с минимальным риском возникло новое понятие — fast track хирургия («быстрый путь в хирургии», «хирургия быстрого пути», ускорение различных этапов лечебного процесса), или ERAS (early rehabilitation after surgery — ранняя реабилитация после операции). Подбор методов анестезии, минимально инвазивных способов оперативного лечения, опти-мального контроля боли и активного послеоперационного восстановления (в том числе ранние пероральное питание и мобилизация) в fast track хирургии уменьшает стрессовые реакции и дисфункцию органов, значительно сокращая время, необходимое для полного восстановления. Принципам fast track хирургии полностью соответствует применение видеоэндоскопиче-ских технологий [13].
Цель работы
Уменьшение травматизма и ранняя реабилитация больных после хирургического лечения кардиоэзофагеального рака путем выполнения малоинвазивных видеоэндоскопи-ческих радикальных операций с использованием методики ранней реабилитации.
Материалы и методы
В Московском областном центре «Видеоэндоскопиче-ская и малоинвазивная хирургия», функционирующем на базе хирургического торакального отделения ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, разработана методика резекций проксимального отдела желудка и нижнегрудного отдела пищевода с одномоментной внутриплевральной эзофагогастропластикой комбинированным лапароскопическим и правосторонним торакоскопическим доступом. В течение 2015-16 гг. по данной методике было выполнено 27 операций (М/Ж=21/6; средний возраст 64,4 года).
У трёх (11,1 %) больных была выявлена I стадия, у шестерых (22,2 %) - II стадия. Преобладали больные в III стадии заболевания – 14 (51,9 %) больных. В 4-х (14,8 %) наблюдениях была выявлена IV стадия. Чаще встречались опухоли II типа по J. Siewert – у 16 (59,3 %) больных. У 6 (22,2 %) больных была опухоль I типа. В 5-и (18,5 %) случаях – III типа. В 5 (18,5 %) случаях опухоль распространялась на абдоминальный отдел пищевода, в 7 (25,9 %) – на диафрагмальный. У 9 (33,3 %) больных проксимальный край опухоли определялся на уровне наддиафрагмального сегмента, у 6 (22,2 %) – на уровне ретроперикардиального.
Лапароскопический этап включал мобилизацию желудка и кардии (в 2-х случаях с резекцией ножек диафрагмы), удаление обоих сальников, абдоминальную лимфодиссекцию D2. После мобилизации абдоминального и нижнегрудного отделов пищевода в нижнем средостении выполняли лимфо-диссекцию. Завершался лапароскопический этап резекцией проксимального отдела желудка с формированием узкого желудочного трансплантата. Как правило, пищевод резецировали трансдиафрагмально непосредственно над опухолью в нижнегрудном отделе. Это позволяло удалялить препараты через силиконовый рукав, введенный через расширенный до 3 см лапаропорт. у четырёх больных таким способом удалили из брюшной полости только клетчатку с лимфатическими узлами и большой сальник, а основной гистопрепарат – через расширенное до 3 см отверстие для торакопорта в 8-м межреберье. Второй этап операции выполняли путем видеоторакоскопии справа в положении больного на левом боку. Выполняли мобилизацию грудного отдела пищевода и медиастинальную лимфодиссекцию, включающая лимфатические узлы пара-эзофагеальных, паратрахеальных и бифуркационных групп. После ререзекции пищевода на 6-8 см выше проксимального края опухоли формировали двухрядный пищеводно-желудочный анастомоз узловыми швами (Рисунок 1).
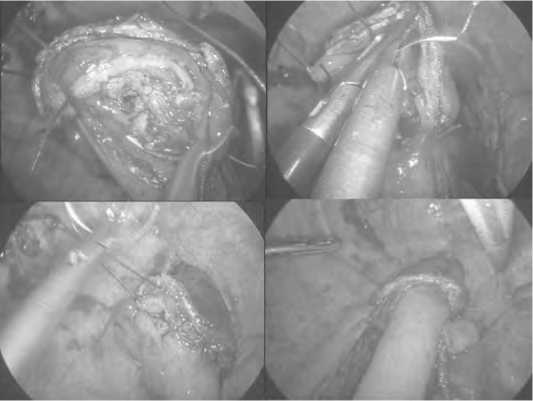
Рис. 1. Формирование «ручного» двухрядного пищеводно-желудочного анастомоза на торакоскопическом этапе операции
Нами использовались принципы ранней реабилитации больных («fast track»), которая охватывает все фазы периоперационной терапии: предоперационную, интраоперационную и послеоперационную.
Предоперационная стратегия
-
1. Обучение пациента – объяснение и реальная информация о предстоящих медицинских процедурах, операции, послеоперационном периоде, преимуществах программы fast track.
-
2. Отсутствие ограничения питания до операции. Учитывая, что удлинение периода голодания со снижением рН желудочного содержимого увеличивает риск аспирации, пациенту в течение ночи разрешают пить до 400 мл прозрачной жидкости, так как данный объём не увеличивает риск аспирационных осложнений во время интубации. С применением принципов доказательной медицины продемонстрировано, что дооперационное голодание существенно снижает резервы гликогена в печени и вызывает послеоперационную устойчивость к инсулину. Результатом этого является уменьшение восстановительных ресурсов организма. Вследствие этого обосновано применение 150 мл декстрозы (глюкозы) за 2 ч до операции, что также способствует уменьшению чувства голода, жажды, дискомфорта, утомления, а, следовательно, и стрессовой реакции. Уменьшение выраженности страха в результате выброса эндогенных опиоидов в свою очередь приводит к снижению интраоперационной потребности в анестетиках.
-
3. Согласно результатам рандомизированных исследований, необходимость механической подготовки кишечника к операции не считают обоснованной.
Интраоперационная стратегия
-
1. Анестезиологическое обеспечение с применением со-
- временных анестетиков (пропофол, десфлуран), миорелаксантов (рокурония бромид), сугаммадекса, протективной ИВЛ, мультимодального обезболивания (НПВС, парацетамол, 0,2 % раствор ропивакаина) позволяет экстубировать всех пациентов после резекций проксимального отдела желудка и нижнегрудного отдела пищевода с одномоментной внутриплевральной эзофагогастропластикой комбинированным лапароскопическим и правосторонним торакоскопическим доступом.
-
2. Использование минимально агрессивной видеоэндо-скопической хирургической методики уменьшает воспалительный компонент стрессового ответа, существенно не влияя на нейроэндокринный и метаболический ответ.
-
3. Оптимизированная инфузионная терапия (directed goal therapy) во время оперативного вмешательства предполагает предупреждение интраоперационной гиповолемии и чрезмерной инфузии кристаллоидов, которые могут привести к отёкам, ухудшению оксигенации тканей и замедлению заживления. Возможность же употребления жидкости ночью и отказ от подготовки кишечника приводит к отсутствию гиповолемии в начале операции и снижению интраоперационной инфузии. В связи с вышеизложенным, интраоперационно придерживались рестриктивной стратегии инфузионной терапии.
-
4. Обеспечение интраоперационной нормотермии. Развитие интраоперационной гипотермии влечёт за собой ухудшение гемостаза с увеличением внутри- и послеоперационной кровопотери, усиление послеоперационной дрожи с повышенным потреблением кислорода и повышение риска ишемии миокарда. Интраоперацинно нормотермию обеспечивали согреванием инфузионных сред и использованием подогревающего матраца.
Послеоперационная стратегия
-
1. Эффективное купирование боли. Послеоперационная боль – важнейший фактор, влияющий на длительность послеоперационного пребывания пациента в стационаре. Анальгезию обеспечивали введением НПВС, парацетамола и по показаниям трамадола.
-
2. Ранняя пероральная гидратация.
-
3. Раннее восстановление энтерального питания. При наличии тошноты и рвоты показана фармакологическая терапия (дексаметазон, ондансетрон).
-
4. Ранняя вертикализация (1-е сутки после операции) и мобилизация пациента.
Результаты
Резекция R0 была выполнена 24 (88,9%) больным, R1 – 3 (11,1 %). При гистологическом исследовании в среднем исследовалось 42±3 лимфатических узла.
Средняя продолжительность операции составила 6 ч 21 мин. В 100 % случаев перевод на самостоятельное дыхание осуществлялся непосредственно после операции, в опера- ционной. Средняя продолжительность нахождения больных в реанимации составила 17 часов. Мобилизация больного – в первые сутки после операции. Начало энтерального питания осуществлялось на 4-е сутки. Послеоперационные осложнения были отмечены всего у одного больного – левосторонняя плевропневмония. Он был выписан на 12-е сутки для долечивания в терапевтическом отделении по месту жительства.
Среднийпослеоперационныйкойко-деньсоставил7,3су-ток соответственно.
Заключение. Преимущества радикальных операций при кардиоэзофагеальном раке комбинированным лапароскопическим и правосторонним торакоскопическим досту-пом очевидны: четкость визуализации, хороший контроль гемостаза, удобство мобилизации желудка и пищевода, ранняя активизация больных в послеоперационном периоде, сокращение сроков стационарного лечения. Применение технологии ранней послеоперационной реабилитации (fast track) позволяет уменьшить сроки госпитализации, ускорить выздоровление и восстановление трудоспособности больных.
Список литературы Ранняя послеоперационная реабилитация (fast track) при лапаро-торакоскопических резекциях проксимального отдела желудка и грудного отдела пищевода при кардиоэзофагеальном раке
- Черноусов А.Ф., Черноусов Ф.А., Хоробрых Т.В., Вычужа-нин Д.В. Хирургиче-ское лечение больных кардиоэзофагеальным раком.//Вестник хирургической гастроэнтерологии. -2009 -№2 -С. 67-77
- Давыдов М.И., Туркин И.Н., Стилиди И.С. и др. Кардиоэзо-фагеальный рак: классификация, хирургическая тактика, основные факторы прогноза.//Вестник РОНЦ им. Н.Н. Блохина РАМН. -2003 -№1 -С. 82-89
- Siewert J.R., Feith M., Stein H.J. Biologic and clinical variations of adenocarcinoma at the esophago-gastric junction: relevance of a topo-graphic-anatomic subclassification. J Surg Oncol. 2005 Jun 1; 90(3): 139-46
- Orringer M.B., Marshall B., Chang A.C., et al. Two thousand tran-shiatal esophagectomies: changing trends, lessons learned. Ann Surg. -2007-V 246 -p. 363-372
- Sasako M., Sano T., Yamamoto S. et al. Left thoracoabdominal approach versus abdominal-transhiatal approach for gastric cancer of the cardia or subcardia: a randomized controlled trial.//Lancet Oncol. -2006-№7 -р. 644-651
- Стилиди И. С., Рябов А. Я., Бохян В. Ю. и др. Оптимизированный абдомино-медиастинальный доступ в хирургии рака желудка с переходом на пищевод.//Вестник РОНЦ им. Н.Н. Блохина РАМН. -2006 -т. 17, № 4 -С. 47-51
- ыхно Ю.А., Самотесов П.А., Батухтина Ю.В. Топографо-анатомическое обос-нование хирургического доступа при кардио-эзофагеальном раке в зависимости от типа телосложения//Сибирский онкологический журнал -2004-№4 (12) -С. 42-47
- Esquivel C.M., Ampudia C., Fridman A. et al. Technique and outcomes of laparoscopic-combined linear stapler and hand-sutured side-to-side esophagojejunostomy with Roux-en-Y reconstruction as a treatment modality in patients undergoing proximal gastrectomy for benign and malignant disease of the gastroesophageal junction.//Surg Laparosc Endosc Percutan Tech. -2014 -Feb; 24(1) -p. 89-93
- Израилов Р.Е., Васнев О.С., Кошкин М.А. с соавт. Возможности лапароскопиче-ской хирургии в лечении раков кардиоэзофагеального перехода.//«Альманах Института хирургии имени А.В. Вишневского». Тезисы докладов xVIII съезда Общества эндоскопических хирургов России. 17-19 февраля 2015г -г. Москва 2015 -№1-С. 494
- Montenovo M.I., Chambers K., Pellegrini C.A., Oelschlager B.K. Outcomes of lapa-roscopic-assisted transhiatal esophagectomy for adeno-carcinoma of the esophagus and esophago-gastric junction.//Dis Esophagus. -2011 -Aug;24(6) -р. 430-436
- Maas K.W., Biere S.S., Scheepers J.J. et al. Laparoscopic versus open transhiatal esophagectomy for distal and junction cancer.//Rev Esp Enferm Dig.-2012 -Apr;104(4)-p. 197-202
- Liu Hong, Yujie Zhang, Hongwei Zhang, Jianjun Yang, Qingch-uan Zhao The Short-Term Outcome of Three-Field Minimally Invasive Esophagectomy for Siewert Type I Esophagogastric Junctional Adenocarcinoma.//Ann Thorac Surg-2013 -V. 96 -p. 1826-1832
- Gemmill E.H., Humes D.J., Catton J.A. Systematic review of enhanced recovery after gastro-oesophageal cancer surgery.//Ann R Coll Surg Engl. -2015 -Apr;97(3)-p.173-179


