Расчет блока каталитической очистки
Автор: Машукаев Б.Н.
Журнал: Форум молодых ученых @forum-nauka
Статья в выпуске: 6-2 (22), 2018 года.
Бесплатный доступ
В данной статье был произведен расчет блока каталитической очистки, а также кинетики процесса. Определены константы скорости.
Реакция, горение, расчет, объем, газ, процесс, температура
Короткий адрес: https://sciup.org/140283535
IDR: 140283535
Текст научной статьи Расчет блока каталитической очистки
При горении углеводородного топлива в топочной камере, образуются продукты неполного сгорания такие как NOx и CO, являющиеся опасными загрязнителями атмосферы и окружающей среды в целом. Для предотвращения попадания токсичных веществ в атмосферный воздух, в работе принято спроектировать блок каталитической очистки дымовых газов от указанных веществ. Данный блок представляет собой химический реактор идеального вытеснения с расположенной внутри сотовой конструкцией с нанесенным на нее палладием, и располагающимся после камеры сгорания. Выбор палладиевого катализатора обусловлен тем, что данный катализатор подходит как для окислительных реакций с участием диоксида углерода (CO), так и для восстановительных реакций оксидов азота (NO).
Реакция восстановления NO на палладиевом катализаторе выглядит следующим образом:
NO + CO = N2 + C02. (1)
Как видно из реакции (1) оксиды азота восстанавливаются диоксидом углерода, что позволяет одновременно преобразовывать оба загрязнителя.
Кроме того, на палладиевом катализаторе возможна реакция окисления CO по следующей реакции:
CO + 02 = C02, (2)
что так же увеличивает степень очистки.
Целью расчета является нахождение геометрических размеров химического реактора, а также реакционного объема катализатора.
Исходные данные для расчета:
температура выброса: T в = 600°С;
концентрация оксида углерода: CO = 10%;
концентрация оксида азота: NO = 12,4;
концентрация кислорода: O 2 = 9,6%;
концентрация азота: N 2 = 68%;
объем газовых выбросов: W г = 15500 м 3 /ч;
энергия активации процесса: E a = кДж/моль.
Кинетика процесса
Для реактора, работающего в режиме идеального вытеснения, справедливо выражение:
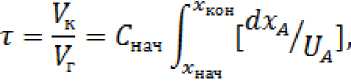
где τ – время контакта газа с реакционным веществом, с; Vк– реакционный объем катализатора, м3;
V г – объем смеси газа, подвергшегося очистке, м3/ч;
С нач – начальная концентрация исходного вещества, моль/л;
x нач , x кон – начальная и конечная степени превращения;
xa– степень превращения исходного вещества; UA– скорость реакции.
Скорость реакции восстановления оксида азота на палладиевом катали заторе можно определить по уравнению Борескова:
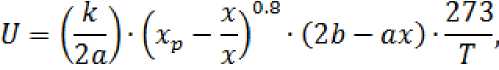
где G a – начальная концентрация NO в газе, %; b – начальная концентрация CO в газе, %; T – температура дымовых газов на слое катализатора; x – степень превращения; k – константа скорости химической реакции.
Подставив значение скорости из уравнения (4) в уравнение (3), получаем:
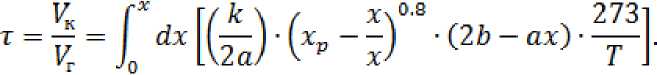
Определение константы скорости
Константа скорости процесса при температуре 600 °C вычисляется по формуле:
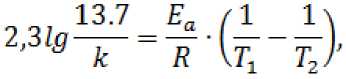
где E a – энергия активации процесса восстановления, кДж/моль; T 1 – температура до начала реакции, K;
T2– температура окончания реакции, K; R = 8,31 – газовая постоянная.
Принимаем,T 2 = 973 K, тогда:
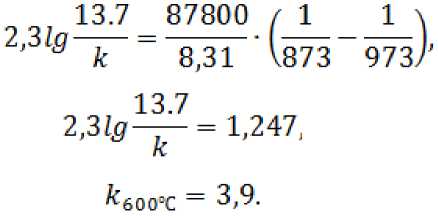
Список литературы Расчет блока каталитической очистки
- Боресков Г.К. Гетерогенный катализ. - М.: Наука, 1986. - с. 1-42
- Газ природный топливный компримированный для двигателей внутреннего сгорания. Технические условия: ГОСТ 27577-2000. - М.: Изд- во стандарты, 2001.
- Духанин Г.П. Термодинамические расчеты химических реакций// Учебное пособие - 2010. - 96 с.
- Соколов В.А., Бестужев М.А., Тихомолова Т.В. Химический состав нефтей и природных газов в связи с их происхождением. - М.: Недра, 1972.-273 с.


