Расчет физико-химического взаимодействия титановых сплавов с материалами литейной формы
Автор: Ганеев Альмир Амирович, Деменок Анна Олеговна, Бакерин Сергей Васильевич, Кулаков Борис Алексеевич, Мухамадеев Ильшат Рифкатович, Гарипов Альберт Ринатович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Литейное производство
Статья в выпуске: 3 т.16, 2016 года.
Бесплатный доступ
Термохимическая инертность форм - одно из основных условий получения качественных отливок из титановых сплавов. Применяемые в литейном производстве огнеупорные формовочные и связующие материалы активно взаимодействуют с титаном. Поэтому термохимическая стойкость форм может быть повышена выбором наиболее инертных по отношению к титану исходных формовочных и связующих материалов и разработкой оптимального технологического процесса. Для оценки возможности взаимодействия титана при заливке в формы с формовочными материалами Al2O3, ZrO2, Y2O3 и связующими на основе SiO2 рассмотрены основные вероятные реакции и рассчитаны изменения изобарно-изотермического потенциала (энергия Гиббса). Рассматривалось протекание реакций при температуре 1700 °С (температура плавления 1668 °С), при условии, что титан находится в жидком состоянии. Исходя из расчетных значений ΔZ (ΔG) рассмотренных реакций показано, что реакция восстановления титаном оксида иттрия, циркония и алюминия термодинамически невозможна. В условиях России экономически неоправданно использование в качестве формовочных материалов окислов иттрия и циркония для получения оболочковых форм при литье титановых сплавов. Появление же альфированного слоя на отливках титановых сплавов при использовании связующего на основе SiO2 вызвано, как показали термодинамические расчеты, протеканием реакций с образованием алюмосиликатов, ухудшающих химическую стойкость формы и ее огнеупорность. Для получения качественных отливок из титановых сплавов экономически целесообразно использование оболочковых форм на основе электрокорунда с обязательной заменой связующих на основе SiO2 на алюмозоли.
Фасонные отливки, оболочковые формы, выплавляемые модели, химическая активность, инертные материалы, термохимическая инертность форм, формовочные материалы, связующие материалы, вероятность реакции, изобарно-изотермический потенциал
Короткий адрес: https://sciup.org/147157046
IDR: 147157046 | УДК: 621.742.4 | DOI: 10.14529/met160310
Текст научной статьи Расчет физико-химического взаимодействия титановых сплавов с материалами литейной формы
В настоящее время перед литейщиками поставлена задача разработки технологии литья тонкостенных крупногабаритных фасонных отливок из титановых сплавов. Благодаря уникальному сочетанию физических и механических свойств этих сплавов, а именно: высокой удельной прочности, малой плотности, жаростойкости, высоким антикоррозионным свойствам, хорошему сопротивлению усталостному разрушению и ползучести, они много лет сохраняют свои позиции в разряде перспективных для авиационной промышленности и двигателестроения.
Освоение такого вида отливок связано с рядом трудностей, обусловленных, во-первых, разработкой технологии плавки и литья, во-вторых, наличием специфического оборудования на стадии изготовления моделей, изготовления форм, плавки и заливки сплавов на основе титана.
Производство деталей из сплавов на основе титана отличается высокой трудоемкостью, энергоемкостью и стоимостью. Поэтому, с целью эко-
номии материалов и удешевления конечной продукции, заготовки из них должны быть максимально приближены по конфигурации и размерам к готовой детали. В то же время из-за усложнения конструкций и условий работы современных технических систем требования к качеству отливок постоянно возрастают. С этих позиций наиболее рациональным во многих случаях способом получения заготовок является литье в оболочковые формы по выплавляемым моделям. Однако получение высококачественных отливок осложняется высокими температурами заливки и высокой химической активностью титановых сплавов, что приводит к интенсивному взаимодействию металла с литейной формой и, как следствие, к снижению служебных свойств литых изделий.
Малая толщина стенки отливки предопределяет необходимость предварительного подогрева формы перед заливкой до 900…1000 °С, что в свою очередь резко повышает требования к инертности материала формы к жидкому титановому сплаву и в
предельной степени ограничивает возможный выбор материалов основы формы и связующего.
Термохимическая инертность форм – одно из основных условий получения качественных отливок из титановых сплавов. Применяемые в литейном производстве огнеупорные формовочные и связующие материалы активно взаимодействуют с титаном. Поэтому термохимическая стойкость форм может быть повышена выбором наиболее инертных по отношению к титану исходных формовочных и связующих материалов
и разработкой оптимального технологического процесса.
Для оценки возможности взаимодействия титана при заливке в формы с формовочными материалами Al 2 O 3 , ZrO 2 , Y 2 O 3 и связующими на основе SiO 2 рассмотрены основные вероятные реакции и рассчитаны изменения изобарно-изотермического потенциала (энергия Гиббса).
Рассмотрим протекание реакций при температуре 1700 °С (температура плавления 1668 °С), при условии, что Ti находится в жидком состоянии [1].
Реакция 1
SiO2 + 2Ti = 2TiO + Si
A H 298 = 2 - ( - 542 ) + 0 - ( - 910,7 ) - 2 ■ 0 = - 173,3 кДж/моль;
A S 2 0 98 = 2 ■ 34,79 + 18,81 - 41,46 - 2 ■ 30,72 =- 14,51 Дж/(моль ■ К);
A G 2 0 98 =- 173,3 - 10 3 - ( - 14,51 ) - 298 =- 1168,98 кДж/моль.
С помощью следующих формул (1.1) найдем энтальпию и энтропию реакций при различных температурах [2]:
T 2
А Н т 2 = A H ^ + J A C p dT ;
T 1
T 2 dT
-
AAT2 = ASt + J A Cp —;
-
T 1 T
A GT = A HT -A ST .
C p ( TiO ) = 44,22 + 15,06 ■ T ■ 10 - 3 + ( - 7,78 ) - T - 2 ■ 105 Дж/(моль ■ К);
C p ( Si ) = 24,02 + 2,58 ■ T ■ 10 - 3 + ( - 4,23 ) ■ T " 2 ■ 10 5 Дж/(моль ■ К);
C p ( SiO 2 ) = 46,94 + 34,31 * T ■ 10 - 3 + ( - 11,3 ) " T - 2 ■ 105 Дж/(моль ■ К);
C p ( Ti ) = 22,09 + 10,04 ■ 10 - 3 ■ T Дж/(моль ■ К).
ACp = 2Cp (TiO) + Cp (Si) - Cp (SiO2)- 2Cp (Ti)
A C p = 2 ■ ( 44,22 + 15,06 ■ T ■ Io - 3 - 7,78 ■ T - 2 ■ Io5 ) + ( 24,02 + 02,58 ■ T ■ Io - 3 - 4,23 ■ T - 2 ■ Io5 ) -
-
- ( 46,94 + 34,31 " T ■Ю- 3 - 11,3 ■ T " 2 ■Ю 5 ) - 2 ■ ( 22,09 + 10,04 ■ Io - 3 ■ T ) =
= 21,34 - 21,69 ■ T ■Ю- 3 - 8,49 ■ T - 2 ■Ю 5 Дж/(моль ■ К).
A H 10973 =- 173,3 ■Ю 3 + J ( 21,34 - 21,69 ■ T ■ Io - 3 - 8,49 ■ T " 2 ■Ю 5 ) dT = 298
C T2 7’ 1 ^
= -173,3 ■Ю3 + 21,34 ■ T - 21,69 ■Ю-3---8,49 ■Ю5
( 2
= - 173,3 ■Ю3 + ( 42103,82 - 42 216,65 + 430,31 - 6359,32 + 963,08 - 2849 ) = - 181,23 кДж/моль. 1973
A S 0 973 =- 14,51 + J ( 21,34 - 21,69 ■ T ■ Io - 3 - 8,49 ■ T '4 0 5 ) — =
T -2 9
= (21,34■ lnT-21,69■io-3 ■ T-8,49■Ю5
-
-2 J
= - 14,51 + ( 161,91 - 42,79 + 0,11 - 121,58 + 6,46 - 4,78 ) =- 15,18 Дж/(моль ■ К);
A G 0 973 =- 181,23 ■Ю3 - 1973 ■ ( - 15,18) = - 151,28 кДж/моль.
Реакция 2
SiO2 + Ti = TiO 2 + Si
A H 298 = - 944 + 0 - ( - 910,7) - 2 ■ 0 = - 33,3 кДж/моль;
A S 2 0 98 = 50,62 + 18,81 - 41,46 - 30,72 = - 2,75 Дж/(моль ■ К);
A G 2 0 98 = - 33,3 ■ 10 3 - ( - 2,75) ■ 298 = - 32,48 кДж/моль.
C p (TiO2) = 71,71 + 4,1 ■ T ■Ю - 3 + ( - 14,64) ■ T " 2 ■ 105 Дж/(моль ■ К);
C p (Si) = 24,02 + 2,58 ■ T ■ 10 - 3 + ( - 4,23) ■ T - 2 ■ 105 Дж/(моль ■ К);
C p (SiO2) = 46,94 + 34,31 ■ T ■ 10 - 3 + ( - 11,3) ■ T " 2 ■ 10 5 Дж/(моль ■ К);
C p (Ti) = 22,09 + 10,04 ■ 10 - 3 ■ T Дж/(моль ■ К).
A C p = C p (TiO) + C p (Si) - C p (SiO 2 ) - C p (Ti)
A C p = ( 71,71 + 4,1 - T ■Ю - 3 - 14,64 ■ T - 2 ■Ю5 ) + ( 24,02 + 2,58 ■ T ■Ю - 3 - 4,23 ■ T " 2 ■Ю5 ) -
- ( 46,94 + 34,31 - T ■Ю - 3 - 11,3 ■ T " 2 ■Ю5 ) - ( 22,09 + 10,04 ■Ю- 3 ■ T ) =
= 26,7 - 37,67 ■ T ■Ю- 3 - 7,57 ■ T 2 ■Ю 5 Дж/(моль ■ К).
A H 10973 =- 33,3 ■Ю 3 + J ( 26,7 - 37,67 ■ T ■Ю- 3 - 7,57 ■ T - 2 ■ 105 ) dT = 298
f T 2 T - 1 ^
= -33,3 ■io3 + 26,7 ■ T - 37,67 ■Ю-3---7,57 ■Ю5--=
( 2 -1 J
= - 33,3 ■ io3 + ( 52 679,1 - 73 319,55 + 383,68 - 7956,6 + 1672,62 - 2540,27 ) = - 62,38 кДж/моль.
dT T
A 5 0,73 =- 2,75 + J ( 26,7 - 37,67 ■ T ■ Io - 3 - 7,57 ■ T - 2 ■ 105 298
f a < Г-2 )
= - 2,75 + 26,7 ■ In T - 37,67 ■Ю- 3 ■ T - 7,57 ■Ю 5-- =
I -2 I
= - 2,75 + ( 202,58 - 74,32 + 0,097 - 152,11 + 11,23 - 4,26 ) = - 19,53 Дж/(моль ■ К);
A G 1973 =- 62,38■Ю3 - 1973 ■ 65,56 =- 23,85 кДж/моль.
Реакция 3
Al2O3 + 3Ti = 3TiO + 2Al
A H 2 0 98 = 3 ■ ( - 542 ) + 2 ■ 0 - ( - 1675,7 ) - 3 ■ 0 = 49,7 кДж/моль;
A S 2 0 98 = 3 ■ 34,79 + 2 ■ 28,35 - 50,92 - 3 ■ 30,72 = 17,99 Дж/(моль ■ К);
A G 2 0 98 = 48,7 ■ 10 3 - 17,99 ■ 298 = 44,34 кДж/моль.
C p ( TiO ) = 44,22 + 15,06 ■ T ■ 10 - 3 + ( - 7,78 ) ■ T " 2 ■ 105 Дж/(моль ■ К);
C p ( Al ) = 20,67 + 12,39 ■ T ■ 10 - 3 Дж/(моль ■ К);
C p ( Al2O3 ) = 114,56 + 12,89 ■ T ■ 10 - 3 + ( - 34,31) ■ T - 2 ■ 105 Дж/(моль ■ К);
C p ( Ti ) = 22,09 + 10,04 ■ 10 - 3 ■ T Дж/(моль ■ К).
ACp = 3Cp (TiO) + 2Cp (Al) - Cp (A12O3) -3Cp (Ti)
A Cp = 3 ■ ( 44,22 + 15,06 ■ T ■Ю - 3 + ( - 7,78 ) - T " 2 ■Ю 5 ) + 2 ■ ( 20,67 + 12,39 ■ T ■Ю - 3 ) -- ( 114,56 + 12,89 ■ T ■Ю- 3 + ( - 34,31 ) - T " 2 ■Ю5 ) - 3 ■ ( 22,09 + 10,04 ■Ю- 3 ■ T ) = = - 6,83 + 26,95 ■ T ■Ю- 3 + 10,97 ■ T - 2 ■ 105 Дж/(моль ■ К).
A H 10973 = 49,7 . 10 3 + J ( - 6,83 + 26,95 . T . 10 - 3 + 10,97 . T - 2 . 10 5 ) dT = 298
f T2
= 49,7-103 + -6,83 ■ T + 26,95-10-3 --+10,97-105
( 2
= 49,7 . 103 + ( - 13 475,59 + 52 454,52 - 556 + 2035,34 - 1196,63 + 3 681,2 ) = 92,64 кДж/моль. 1973
A S 10973 = 17,99 + J ( - 6,83 + 26,95 . T Л0 - 3 + 10,97 . T '4 0 5) — =
(
I-
= 17,99 + ( - 51,82 + 53,17 - 0,14 + 38,91 - 8,03 + 6,18 ) = 56,26 Дж/(моль . К);
A G 1 0 973 = 92,64 . 10 3 - 1973 . 56,26 = - 18,36 кДж/моль.
Реакция 4
2Al2O3 + 3Ti = 3TiO2 + 4Al
A H 2 0 98 = 3 . ( - 944) + 4 . 0 - 2 . ( - 1675,7) - 3 . 0 = 519,4 кДж/моль;
A S 2 0 98 = 3 . 50,62 + 4 . 28,35 - 2 . 50,92 - 3 . 30,72 = 71,26 Дж/(моль . К);
A G 2 0 98 = 519,4 . 10 3 - 71,26 . 298 = 498,16 кДж/моль.
C p ( TiO 2 ) = 71,71 + 4,1 . T . 10 - 3 + ( - 14,64 ) . T - 2 . 10 5 Дж/(моль . К);
C p ( Al ) = 20,67 + 12,39 . T . 10 - 3 Дж/(моль . К);
C p ( Al2O3 ) = 114,56 + 12,89 . T . 10 - 3 + ( - 34,31 ) . T " 2 . 105 Дж/(моль . К);
C p ( Ti ) = 22,09 + 10,04 . 10 - 3 . T Дж/(моль . К).
A C p = 3 C p (TiO 2 ) + 4 C p (Al) - 2 C p (Al^) - 3 C p (Ti)
A C p = 3 . ( 71,71 + 4,1 . T . 10 - 3 + ( - 14,64 ) . T ~2 . 10 5 ) + 4 . ( 20,67 + 12,39 . T Л0 - 3 ) -
- 3 . ( 114,56 + 12,89 . T . 10 - 3 + ( - 34,31 ) . T " 2 . 10 5 ) - 3 . ( 22,09 + 10,04 Л0 - 3 . T ) =
= 2,42 + 5,96 . T . 10 - 3 + 24,7 . T 2 . 10 5 Дж/(моль . К).
A H 1 0 973 = 519,4 . 10 3 + J ( 2,42 + 5,96 . T Л0 - 3 + 24,7 . T - 2 . 105 ) dT = 298
f т 2 т - 1 ^
= 519,4.103 + 2,42. T + 5,96 Л0-3 --+ 24,7.105
| 2
= 519,4 . 10 3 + ( 4774,66 + 11 600,33 - 1251,9 - 721,16 - 264,64 + 8288,6 ) = 541,83 кДж/моль. 1973
A S j^ = 71,26 + J ( 2,42 + 5,96 . T Л0 - 3 + 24,7 . T 210 5 ) — =
f
I-
= 71,26 + ( 18,36 + 11,76 - 0,32 - 13,79 - 1,78 + 13,9 ) = 99,39 Дж/(моль . К);
A G 1 0 973 = 541,83 . 10 3 - 1973 . 99,39 = 345,73 кДж/моль.
Реакция 5
ZrO2 + 2Ti = 2TiO + Zr
A H 098 = 2 ■ ( - 542 ) + 0 - ( - 1100,3 ) - 2 ■ 0 = 16,3 кДж/моль;
A A 098 = 2 ■ 34,79 + 38,98 - 50,39 - 2 ■ 30,72 = - 3,27 Дж/(моль ■ К);
A G 0 98 = 16,3 ■ 103 - ( - 3,27 ) ■ 298 = 17,27 кДж/моль.
C p ( TiO ) = 44,22 + 15,06 ■ T ■ 10 - 3 + ( - 7,78 ) ■ T " 2 ■ 105 Дж/(моль ■ К);
C p ( Zr ) = 28,58 + 4,69 ■ T ■ 10 - 3 + ( - 3,81 ) ■ T " 2 ■ 105 Дж/(моль ■ К);
C p ( ZrO2 ) = 69,62 + 7,53 ■ T ■ 10 - 3 + ( - 14,06 ) ■ T " 2 ■ 10 5 Дж/(моль ■ К);
C p ( Ti ) = 22,09 + 10,04 ■ 10 - 3 ■ T Дж/(моль ■ К).
A C p = 2 C p (TiO) + C p (Zr) - C p (ZrO 2 ) - 2 C p (Ti)
A C p = 2 ■ ( 44,22 + 15,06 ■ T ■Ю- 3 + ( - 7,78 ) - T - 2 00 5 ) + ( 28,58 + 4,69 ■ T ■Ю- 3 +
+ ( - 3,81 ) - T - 2 ■Ю 5 ) - ( 69,62 + 7,53 ■ T ■Ю- 3 + ( - 14,06 ) ' T " 2 ■Ю 5 ) -
- 2 ■ ( 22,09 + 10,04■Ю - 3 ■ T ) = 3,22 + 7,2 ■ T ■ 10 - 3 - 5,31 * T - 0 ■ 1O5 Дж/(моль ■ К).
A H 0 973 = 16,3 ■Ю 3 + J ( 3,22 + 7,2 ■ T ■Ю- 3 - 5,31 " T - 0 ■ 1O5 ) dT = 298
Л 7'2 T -1 ^
= 16,3 ■Ю3 + 3,22 ■ T - 7,2 ■10-3---5,31■105
( 2
= 16,3 ■Ю3 + ( 6353,06 + 14 013,82 + 269,13 - 959,56 - 319,69 - 1781,88 ) = 33,87 кДж/моль.
A A 0 973 =- 3,27 + J ( 3,22 + 7,2 ■ T ■ 10 - 3 - 5,31 ' T '405 ) — =
T - 2 ^
= -3,27 + 3,22■ InT + 7,2■10-3 ■ T-5,31■105
-
-2 J
= - 3,27 + ( 24,43 + 14,21 + 0,07 - 18,34 - 2,15 - 2,99 ) = 11,96 Дж/(моль ■ К);
A G 0973 = 33,87■Ю3 - 1973 ' 11,96 = 10,27 кДж/моль.
Реакция 6
ZrO2 + Ti = TiO2 + Zr
A H 098 = - 944 + 0 - ( - 1100,3) - 2 ■ 0 = 156,3 кДж/моль;
A A 0 98 = 50,62 + 38,98 - 50,39 - 30,72 = 8,49 Дж/(моль ■ К);
A G 058 = 156,3 ■Ю3- 8,49 ■ 298 = 153,77 кДж/моль.
C p ( TiO2 ) = 71,71 + 4,1 ■ T ■ 10 - 3 + ( - 14,64 ) ■ T - 2 ■ 105 Дж/(моль ■ К);
C p ( Zr ) = 28,58 + 4,69 ■ T ■ 10 - 3 + ( - 3,81 ) ■ T - 2 ■ 105 Дж/(моль ■ К);
C p ( ZrO2 ) = 69,62 + 7,53 ■ T ■ 10 - 3 + ( - 14,06 ) ■ T - 2 ■ 105 Дж/(моль ■ К);
C p ( Ti ) = 22,09 + 10,04 ■ 10 - 3 ■ T Дж/(моль ■ К).
ACp = Cp (TiO2) + Cp (Zr) - Cp (ZrO2) - Cp (Ti)
A Cp = ( 71,71 + 4,1 ' T ■ 10 - 3 + ( - 14,64 ) ' T " 2 00 5 ) + ( 28,58 + 4,69 ■ T ■ 10 - 3 +
+ ( - 3,81 ) ' T - 2 00 5 ) - ( 69,62 + 7,53 ■ T ■ 10 - 3 + ( - 14,06 ) ■ T - 2 00 5 )
-
- ( 22,09 + 10,04 ■ 10 - 3 ■ T ) = 8,58 - 8,78 ■ T ■ 10 - 3 - 4,39 ■ T - 0 ■ 1O5 Дж/(моль ■ К).
AH 10973 = 156,3 - 10 3 + J ( 8,58 - 8,78 ■ T - IO - 3 - 4,39 ■ T - 2 ■ 105 ) dT = 298
f T2 T — 1 A
= 156,3■Ю3 + 8,58 ■ T - 8,78 ■Ю- 3 ---4,39 ■Ю 5 -- =
( 2 - 1 J
= 156,3 - 103 + ( 16 928,34 - 17 089,08 + 222,5 - 2556,84 + 3 89,85 - 1473,15 ) = 152,72 кДж/моль.
dT T
A 5 10973 = 8,49 + J ( 8,58 - 8,78 ■ T ■Ю- 3 - 4,39 ■ T - 2 ■ 105 298
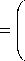
T - 2 A
8,58 ■ In T - 8,78 ■ 10 - 3 ■ T - 4,39■Ю5-- =
-
- 2 J
= 8,49 + ( 65,1 - 17,32 + 0,06 - 48,88 + 2,62 - 2,47 ) = 7,6 Дж/(моль ■ К);
A G 0 973 = 152,72 ■Ю3 - 1973 ■ 7,6 = 137,73 кДж/моль.
Реакция 7
Y2O3 + 3Ti = 3TiO + 2Y
A H 2 0 98 = 3 ■ ( - 542 ) + 2 ■ 0 - ( - 1905 ) - 3 ■ 0 = 279 кДж/моль;
A 5 2 0 98 = 3 ■ 34,79 + 2 ■ 44,43 - 99,16 - 3 ■ 30,72 = 1,91 Дж/(моль ■ К);
A G 2 0 98 = 279 ■Ю3 - 1,9b 298 = 44,34 кДж/моль.
C p ( TiO ) = 44,22 + 15,06 ■ T ■ 10 - 3 + ( - 7,78 ) ■ T - 2 ■ 105 Дж/(моль ■ К);
C p ( Y ) = 25,52 Дж/(моль ■ К);
C p ( Y2O3 ) = 102,42 Дж/(моль ■ К);
C p ( Ti ) = 22,09 + 10,04 ■ 10 - 3 ■ T Дж/(моль ■ К).
A C p = 3 C p ( TiO ) + 2 C p ( Y ) - C p ( Y 2 O 3 ) - 3 C p ( Ti )
A C p = 3 ■ ( 44,22 + 15,06 ■ T T0 - 3 + ( - 7,78 ) ■ T " 2 T05 ) + 2 ■ 25,52 - 102,42 -
-
- 3 ■ ( 22,09 + 10,04■Ю - 3 ■ T ) = 15,01 + 15,06 ■ T ■Ю - 3 - 23,34 ■ T - 2 ■ 105 Дж/(моль ■ К). 1973
A H 0 973 = 279 ■Ю 3 + J ( 15,01 + 15,06 ■ T T0 - 3 - 23,34 ■ T - 2 ■ 105 ) dT = 298 f yr2 rp - 1
= 279 ■Ю3 + 15,01 ■ T + 15,06 T0 - 3 ---23,34 ■Ю5--
( 2
= 279 ■Ю3 + ( 29 614,73 + 29 312,25 + 1182,97 - 44 729,8 - 668,69 - 7832,21 ) = 285,88 кДж/моль. 1973
A50973 = 1,91 + J (15,01 +15,06■ T■Ю-3 -23,34■ T-2■Ю5) — = 298
f
= 1,91 + 15,01*lnT +15,06■Ю-3 ■ T + 23,34■Ю5
-
3 3 3 3о
I-
= 1,91 + ( 113,89 + 29,71 + 0,3 - 85,51 - 4,49 - 13,14 ) = 42,67 Дж/(моль ■ К);
A G 0 973 = 285,88 ■Ю3 - 1973 ■ 42,67 = 201,69 кДж/моль.
Реакция 8
2Y 2 O 3 + 3Ti = 3TiO2 + 4Y
A H 098 = 3 ■ ( - 944 ) + 4 ■ 0 - 2 - ( - 1905 ) - 3 ■ 0 = 978 кДж/моль;
A S 2 0 98 = 3 ■ 50,62 + 4 ■ 44,43 - 2 ■ 99,16 - 3 ■ 30,72 = 39,1 Дж/(моль ■ К);
A G 0 98 = 978 ■ 10 3 - 39,1 " 298 = 966,35 кДж/моль.
C p ( TiO2 ) = 71,71 + 4,1 ■ T ■ io - 3 + ( - 14,64 ) ■ T - 2 ■ 105 Дж/(моль ■ К);
C p ( Y ) = 25,52 Дж/(моль ■ К);
C p ( Y2O3 ) = 102,42 Дж/(моль ■ К);
C p ( Ti ) = 22,09 + 10,04 ■ 10 - 3 ■ T Дж/(моль ■ К).
ACp = 3Cp (TiO2) + 4Cp (Y)- 2Cp (Y^) - 3Cp (Ti)
A C p = 3 ■ ( 71,71 + 4,1 ' T ■Ю- 3 + ( - 14,64) ■ T - 2 ■Ю 5 ) + 4 ■ 25,52 - 2 ' 102,42 -
-
- 3 ■ ( 22,09 + 10,04■Ю - 3 ■ T ) = 46,1 - 17,82 ■ T ■ Io - 3 - 43,92 ■ T - 2 ■ 105 Дж/(моль ■ К).
A H 0973 = 978 ■Ю 3 + J ( 46,1 - 17,82 ■ T ■ Io - 3 - 43,92 ■ T - 2 ■ 105 ) dT =
—
T - 1
43,92 ■Ю5--
- 1
I
= 978 ■io3 + 46,1' T -17,82 ■Io-3--
I
= 978 ■Ю3 + ( 90 955,3 - 34 684,22 + 2226,05 - 13 737,8 + 791,24 - 14 738,26 ) = 1008,81 кДж/моль. 1973
A S 10973 = 39,1 + J ( 46,1 - 17,82 ■ T TO - 3 - 43,92 ■ T '4 0 5) — =
I
= 39,1 + 46,1 ' ln T - 17,82 ■Ю- 3 ■ T - 43,92TO5--
I
= 39,1 + ( 349,78 - 35,16 + 0,56 - 262,64 + 5,31 - 24,73 ) = 72,22 Дж/(моль ■ К); A G 0973 = 1008,81 ■ 103 - 1973 ■ 72,22 = 866,32 кДж/моль.
Результаты вычислений
|
Реакция |
A H 1973 , Дж/моль |
0 A S 1973 , Дж/(моль ■ К) |
A G 1973 , кДж/моль |
|
SiO2 + 2Ti = 2TiO + Si |
–109,69 |
65,56 |
–151,28 |
|
SiO2 + Ti = TiO 2 + Si |
–62,38 |
–19,53 |
–23,85 |
|
Al2O3 + 3Ti = 3TiO + 2Al |
92,64 |
56,26 |
–18,36 |
|
2A1 2 O 3 + 3Ti = 3TiO2 + 4Al |
541,83 |
99,39 |
345,73 |
|
ZrO2 + 2Ti = 2TiO + Zr |
33,87 |
11,96 |
10,27 |
|
ZrO2 + Ti = TiO2 + Zr |
152,72 |
7,6 |
137,73 |
|
Y2O3 + 3Ti = 3TiO + 2Y |
285,88 |
42,67 |
201,69 |
|
2Y 2 O 3 + 3Ti = 3TiO2 + 4Y |
1008,81 |
72,22 |
866,32 |
Расчетные значения A Z ( A G ) рассмотренных реакций показали, что реакция восстановления титаном оксидов иттрия, циркония и алюминия термодинамически невозможна.
В условиях России экономически неоправданно использование в качестве формовочных материалов окислов иттрия и циркония для получения оболочковых форм при литье титановых сплавов.
Появление же альфированного слоя на отливках титановых сплавов при использовании связующего на основе SiO 2 вызвано, как показали термодинамические расчеты, протеканием следующих реакций с образованием алюмосиликатов:
A1 2 O 3 + SiO2 = Al 2 SiO 5 .
Расчетное значение изобарного потенциала при температуре T = 1600 K составляет
G = 43 224 МДж/моль .
В свою очередь алюмосиликаты вступают в реакцию
Al2SiO 5 + 2Ti = 2TiO + Al2O3 + Si.
Расчетные значения изобарного или G потенциала при T = 1073 К составляет
G = - 28 017 МДж/моль.
Поэтому при использовании в качестве формовочного материала электрокорунда для исключения альфированного слоя необходимо использовать алюмозоли.
Анализ результатов термодинамических расчетов позволяет прийти к выводу об отрицательном влиянии SiO 2 , содержащегося в связующем, при литье титановых сплавов в электрокорундо-
вых формах, ухудшая их вследствие возможного образования алюмосиликатов, менее огнеупорных и химически стойких.
Выводы
-
1. Рассмотрены возможные термодинамические реакции при литье титановых сплавов с использованием различных формовочных материалов и связующих на основе SiO2.
-
2. Рассчитаны изобарные потенциалы (энергия Гиббса) термодинамических реакций.
-
3. Показано, что формовочные материалы на основе оксидов иттрия, циркония и электрокорунда термодинамически устойчивы к титановым сплавам.
-
4. Методом термодинамических расчетов доказано, что при использовании SiO 2 в качестве связующих, в электрокорундовых формах образуются алюмосиликаты, ухудшающие химическую стойкость формы и огнеупорность.
-
5. Для получения качественных отливок из титановых сплавов экономически целесообразно использование оболочковых форм на основе электрокорунда с обязательной заменой связующих на основе SiO 2 на алюмозоли.
Список литературы Расчет физико-химического взаимодействия титановых сплавов с материалами литейной формы
- Краткий справочник физико-химических величин/под ред. А.А. Равделя и А.М. Пономаревой. -Изд. 8-е, перераб. -Л.: Химия, 1983. -232 с.
- Основы физической химии. Теория и задачи: учеб. пособие для вузов/В.В. Еремин, С.И. Каргов, И.А. Успенская и др. -М.: Изд-во «Экзамен», 2005. -480 с.


