Расчет параметров структуры и энтальпии образования хромишпинелей
Автор: Рощин А.В., Рябухин А.Г., Рощин В.Е., Дрозин А.Д.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 10 (65), 2006 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156537
IDR: 147156537 | УДК: 669.046:536.75
Текст обзорной статьи Расчет параметров структуры и энтальпии образования хромишпинелей
Хромшпинелиды, представляющие собой минералы переменного состава группы шпинели 2-3 (МеО-Ме2О3), являются главными промышленными минералами хромовых руд [1,2]. Близость кристаллохимических свойств катиона Сг3+ и свойств катионов Feo+ и А13+определяет возможность широкого изоморфного замещения трехзарядных катионов. Кроме того, близость свойств и возможность широкого изоморфного замещения двухзарядных катионов Mg2+ и Ре2+ , присутствующих чаще других в промышленных рудах хрома, а также возможность окисления двухзарядного катиона железа до трехзарядного с последующим замещением части катионов хрома делают состав природных шпинелидов весьма разнообразным. Изменение состава соединения влечет за собой изменение свойств, в том числе важных с технологической точки зрения. В частности, термодинамическую устойчивость соединения характеризует энтальпия его образования, и чем боле отрицательна энтальпия образования, тем устойчивее соединение и тем больше энергии необходимо затратить на восстановление металлов из этого соединения. Исследовать экспериментально структурные и термохимические свойства хромшпинелидов всей гаммы возможных составов представляется чрезвычайно большой и трудновыполнимой задачей. До сих пор отсутствуют и расчетные методы определения структурных и термохимических констант соединений переменного состава, какими являются природные хромшпинелиды.
Разработанная и использованная ранее [3-5] для определения структурных и термохимических констант низших оксидов алюминия математическая модель расчета позволяет определять эффективные радиусы простых и сложных ионов, нейтральных аддендов, структурных фрагментов, параметров кристаллических решеток соединений, формирующихся в кубической сингонии, а также энтальпию их образования. В модели принято и обосновано деление сложных веществ на фрагменты. В частности, нормальные оксидные шпинели типа 2-3 представляются в виде Ме2+[Мео+2О4]. В случае комплексных шпинелей, в частности хромшпинелидов, образованных катионами нескольких металлов, нормальные шпинели можно представить в виде Me/Me/n[MexIIIMe/vCrzO4]. В соответствии с принятой в химии комплексных соединений практикой компоненты, заключенные в скобки [ ], рассматриваются как составляющие внутреннюю сферу, а находящиеся за этими скобками - как компоненты внешней сферы.
Согласно разработанной модели межструктурное расстояние гр (расстояние между центрами фрагментов шпинели) определяется по формуле гр = ad, (1)
где а - геометрический фактор, который включает в себя структурные константы, характерные для октаэдрической (1/4) и тетраэдрической( 8/зТз ) структур, d - параметр кристаллической решетки.
С учетом этих величин г = — —• d = 0,3849 • d, Р 4 3^3
откуда d = r? /0,3849.
Чтобы рассчитать межструктурное расстояние гр, сначала по формуле
/ _\ о
г[} = г^ +
I и __у I . У
\ ОМе^ DMe„2* / Ф»> \ О2" / необходимо определить размер внутренней сферы Г[ ]. В этой формуле г - средний радиус катионов во внутренней сфере г
г°2_ - минимальный радиус аниона О2 = 1,35806 А, гКи и гп„ - дебаевские радиусы экранирования иона внутренней сферы и наружного катиона. Для нормальной шпинели со структурой сфалерита ZnS радиус экранирования наружного иона Ме2+ г„ = -3V2 = 17,581767 -3^2 = 74,59312 А, а внутреннего гю„ = г^ • 2(1 + V3) = 17,581767 ■ 2(1 + V3) =
= 96,06856 A.
После определения г( рассчитываем
Г=Р„ = ^ +Ле2»
(здесь гср - средний радиус катиона во внешней сфере) и по уравнению
ОМе 2+ Ф= [ 1
^ = Г Н---------------
находим межструктурное расстояние, а затем и параметр решетки.
Результаты расчета геометрических констант, в свою очередь, позволяют оценить энтальпию образования кристаллических оксидов и энтальпию их кристаллических решеток.
По определению энергия (энтальпия) кристаллической решетки представляет собой разность энтальпии образования газообразных ионов компонентов с соответствующими коэффициентами и энтальпии образования химического соединения в кристаллическом виде
Ар^(МепАт) = п- AXCMe”^) + т- A/rf(A'"T) -
-Ду^МеЛшкр). (4)
Энтальпии образования газообразных ионов определены с известной точностью. Поэтому для определения энтальпии образования кристаллического соединения - Д/^Ме^т^,) требуется найти энтальпию кристаллической решетки.
Согласно [3] энтальпию кристаллической решетки можно представить в виде суммы двух слагаемых
АрН(МехАу) = АН0 + АНЮ. (5)
Здесь АЯ0 - энтальпия нулевого уровня, от которого идет отсчет. Величина Айо постоянна для данного типа кристаллической структуры, зарядов частиц и их электронного строения. ДЯВЗ - энтальпия взаимодействия, учитывающая взаимодействие частиц, которое зависит от величины их зарядов, строения и определяет структуру кристаллической решетки.
Примем, что отсчет ведется от простейших атомов водорода. Тогда [4]
AH0=N,—10s-10-3-./;(Z), где Na = 6,022045T02j моль"1 - число Авогадро, е = 4,803242-10"10 CGSE (г1/2см3/2с"1), 108 и 10"3 -численные коэффициенты перевода единиц в систему СИ, «о = 0,52912-10"8 см - боровский радиус атома водорода, /i(Z) - функция структуры и заряда (включает в себя произведение Z^ -Z2).
^H^=Na-— ^108-10-3-/2 (z), где Ам - число Маделунга (для структуры ZnS Ам =1,63806),/2(Z) - функция структуры и заряда (включает в себя произведение
-ifz-'4t^Jкч'
где КЧ - координационное число). Для шпинелей, включающих ^-элементы, после подстановки чис ленных величин получим
АЯ° (Ме„А„) = 114,1741 (2-3)2 +
1087,4125
Г, U + 1J
= 4110,268 +
49670,9255
АХ(Ме^и) = zAy//°(Mg2+r) +;AX(Fe2+r) +
+ xAX(Fe3+r) +yAX(Al3+r) + z ^(С?\) +
+ 4Дг^(О2-г) - АХ(МеиА» кр), (7) находим энтальпию образования кристаллической хромишпинели.
Таким образом, для проведения расчетов по изложенной методике необходимо знать ионные радиусы и энтальпию образования ионов элементов, входящих в состав шпинели. Ионные радиусы компонентов и энтальпия образования иона О2" определены ранее [3, 4], энтальпию образования остальных ионов заимствовали из литературы [6,7]:
|
Ионы Радиус, А -АуЯ°, кДж/моль |
Mg2+ 0,71864 2347,235 |
Or 0,70102 5634,978 |
Fe2" 0,75152 2946,662 |
|
Ионы |
Fe3+ |
Al3" |
О2" |
|
Радиус, А |
0,72510 |
0,58917 |
1,35806 |
|
-АН0, кДж/моль |
5703,913 |
5473,387 |
1069,128 |
В качестве примера в таблице приведены результаты расчета параметров структуры и энтальпии образования нормальной шпинели (Mg,2''Fe/")[(Fe/+Alv3+CrA)2O4^ при значениях / = 1 и у = 0. Значения параметров х, у и z в расчетах изменяли таким образом, чтобы составы располагались по сечениям треугольника Fe3+-Al3+- Сг3+ вдоль линий Fe3+-B, А13+- А и Cr3+- С (рис. 1).
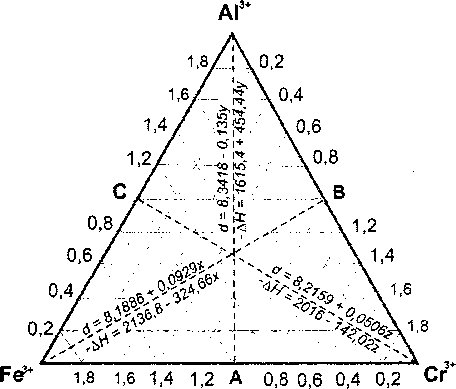
Рис. 1. Составы шпинели Mg2t[(Fe/*Aly3*Cr/+)2O4], для которых в таблице приведен расчет структурных и термохимических констант, и уравнения параметра решетки и энтальпии образования кристаллической шпинели соответствующего состава
Из результатов расчета следует, что вдоль каждого из выбранных сечений треугольника составов параметр кристаллической решетки и энтальпия образования шпинели изменяются по линейному закону, хотя уравнения (2) и (3) не являются строго линейными. Вместе с тем, математический анализ показал, что изменение структурных и термических характеристик при изменении состава
Результаты расчета параметров структуры и энергии образования магнохромишпинели состава Mg[Fe,AlyCrzO4]
|
Mg[FexAlvCr2O4] |
rP A |
a A |
^V-^fras) ■ |
^nH 1 |
^fH (шпинели) |
|
|
Система магнохромпикатитит - магноферрихромпикатит - магноферрит (линия В -Fe3+) |
||||||
|
1 |
Mg[Fe0 Al i,oCrLo04] |
3,15245 |
8,19031 |
17732,11 |
19866,55 |
2134,44 |
|
2 |
Mg[Fe0 05 А1о,975СГо,97504] |
3,15411 |
8,19462 |
17739,59 |
19858,25 |
2118,65 |
|
3 |
Mg[Fe01 Alo.95Cro.95O4] |
3,15578 |
8,19896 |
17747,08 |
19849,92 |
2102,84 |
|
4 |
Mg[Fe02 Alo.9Cro.9O4] |
3,15914 |
8,20769 |
17762,05 |
19833,19 |
2071,13 |
|
5 |
Mg[Fe0 3 Alo.85Cro.85O4] |
3,16252 |
8,21649 |
17777,03 |
19816,34 |
2039,313 |
|
6 |
Mg[Fe0,4 А10.8Сго.804] |
3,16594 |
8,22537 |
17792,00 |
19799,39 |
2007,38 |
|
7 |
Mg[Feo,5 Alo.75Cro.75O4] |
3,16939 |
8,23432 |
17806,97 |
19782,33 |
1975,35 |
|
8 |
Mg[Fe06 Alo.7Cro.7O4] |
3,17286 |
8,24335 |
17821,95 |
19765,17 |
1943,22 |
|
9 |
Mg[Fe0,7 A1q 65Cro.6s04] |
3,17636 |
8,25244 |
17836,92 |
19747,92 |
1910,99 |
|
10 |
Mg[Fe0.8 А10.бСго.б04] |
3,17989 |
8,26161 |
17851,89 |
19730,57 |
1878,67 |
|
11 |
Mg[Feo,9 Alo.55Cro.55O4] |
3,18344 |
8,27084 |
17866,86 |
19713,13 |
1846,26 |
|
12 |
Mg[Fe10 Alo.5Cro.5O4] |
3,18702 |
8,28014 |
17881,84 |
19695,60 |
1813,76 |
|
13 |
Mg[Fei.2 А1о.4Сго404] |
3,19426 |
8,29895 |
17911,78 |
19660,29 |
1748,50 |
|
14 |
Mg[Fei.5 Alo.25Cro.25O4] |
3,20530 |
8,32763 |
17956,77 |
19606,73 |
1650,02 |
|
15 |
Mg[FeL8 Alo.Ao.A] |
3,21656 |
8,35687 |
18001,62 |
19552,51 |
1550,88 |
|
16 |
Mg[Fe20 Alo Cr0O4] |
3,22417 |
8,37666 |
18031,57 |
19516,03 |
1484,45 |
|
Система магноферрихромит - магноферрихромпикатит - магнопикатит (линия А - А13+) |
||||||
|
17 |
Mg[FeL0 Al0Cr10O4] |
3,21274 |
8,34697 |
17962,63 |
19570,83 |
1608,19 |
|
18 |
Mg[Fe0.95 Alfl.10Cr0.95O4] |
3,20695 |
8,33190 |
17943,03 |
19598,78 |
1655,75 |
|
19 |
Mg[Fe0 9AI о.2Сго.904] |
3,20120 |
8,31698 |
17923,42 |
19626,57 |
1703,14 |
|
20 |
MgfFeo.ssAl 0.3СГ0.85О4] |
8,30221 |
17903,82 |
19654,17 |
1750,35 |
|
|
21 |
Mg[Feo,gAl 0.4СГ0.8О4] |
3,18989 |
8,28760 |
17884,21 |
19681,58 |
1797,37 |
|
22 |
Mg[Fe0 75AI fl.5Cro.75O4] |
3,18433 |
8,27314 |
17864,60 |
19708,80 |
1844,19 |
|
23 |
Mg[F eg,? Al о.бСго,704] |
3,17883 |
8,25884 |
17845,00 |
19735,80 |
1890,80 |
|
24 |
Mg[Feo.65Al fl.7Cro.65O4] |
3,17339 |
8,24471 |
17825,39 |
19762,58 |
1937,18 |
|
25 |
Mg[Fe0.6Alo.8Cro.604] |
3,16801 |
8,23075 |
17805,79 |
19789,13 |
1983,34 |
|
26 |
Mg[Feo.55Al fl.9Cro.55O4] |
3,16271 |
8,21696 |
17786,18 |
19815,44 |
2029,25 |
|
27 |
Mg[Fe0,5Al i,oCr0,504] |
3,15747 |
8,20336 |
17766,57 |
19841,49 |
2074,91 |
|
28 |
Mg[Feo4Al 1.2Сго,404] |
3,14721 |
8,17670 |
17727,36 |
19892,78 |
2165,41 |
|
29 |
Mg[Fe0.3Al 1.4Сго.з04] |
3,13725 |
8,15082 |
17688,15 |
19942,88 |
2254,73 |
|
30 |
Mg[Feo.2Al 1,бСг0 2O4] |
3,12760 |
8,12576 |
17648,94 |
19991,70 |
2342,76 |
|
31 |
Mg[Feo,iAl 1.8оСгод04] |
3,11830 |
8,10159 |
17609,73 |
20039,10 |
2429,36 |
|
32 |
Mg[Fe0Al 2,оСго04] |
3,10935 |
8,07834 |
17570,52 |
20084,93 |
2514,41 |
|
Система магнохромит - магноферрихромпикатит - магноферрипикатит (линия Crj+ - С) |
||||||
|
33 |
Mg[Feo,o Alo.oCr2,o04] |
3,20153 |
8,31782 |
17893,70 |
19625,01 |
1731,31 |
|
34 |
Mg[Fe0 05 Al0.05Cr1.9O4] |
3,19950 |
8,31257 |
17889,07 |
19634,81 |
1745,74 |
|
35 |
Mg[Fe01 А1одСг18O4] |
3,19749 |
8,30733 |
17884,43 |
19644,59 |
1760,15 |
|
36 |
Mg[Feo2 Alfl,2Cri 6O4] |
3,19348 |
8,29692 |
17875,17 |
19664,08 |
1788,91 |
|
37 |
Mg[Fe0.3 Alo.3Cr1.4O4] |
3,18951 |
8,28659 |
17865,90 |
19683,47 |
1817,56 |
|
38 |
Mg[Fe04 А1о.4СГ1.204] |
3,18556 |
8,27634 |
17856,64 |
19702,76 |
1846,12 |
|
39 |
Mg[Feo.5 Alo 5Cri.o04] |
3,18165 |
8,26617 |
17847,37 |
19721,94 |
1874,57 |
|
40 |
Mg[Fe0.6 А1о.бСго.804] |
3,17776 |
8,25608 |
17838,10 |
19741,02 |
1902,91 |
|
41 |
Mg[Feoj Alo.7Cro.6O4] |
3,17391 |
8,24608 |
17828,84 |
19759,99 |
1931,14 |
|
42 |
Mg[Fe0 8 А10 8СГ0.4О4] |
3,17009 |
8,23616 |
17819,57 |
19778,84 |
1959,26 |
|
43 |
Mg[Feo,9 Alo.9Cro.2O4] |
3,16631 |
8,22632 |
17810,31 |
19797,57 |
1987,26 |
|
44 |
Mg[Fe! 0 Ali оСго,о04] |
3,16256 |
8,21658 |
17801,04 |
19816,17 |
2015,13 |
описываются линейными уравнениями с высокой точностью (рис. 2). Это означает, что в трехмерном пространстве «состав (Fe/’Al/'Cr? J2 - свойство» изменение свойств (межцентренное расстояние фрагментов, параметр решетки, энтальпия взаимодействия, энтальпия решетки, энтальпия образования кристаллической шпинели) можно также с высокой степенью достоверности описать уравнениями плоскости. Для нахождения уравнения соответствующей плоскости достаточно знать значения свойства в вершинах треугольника составов, что не представляет труда определить по
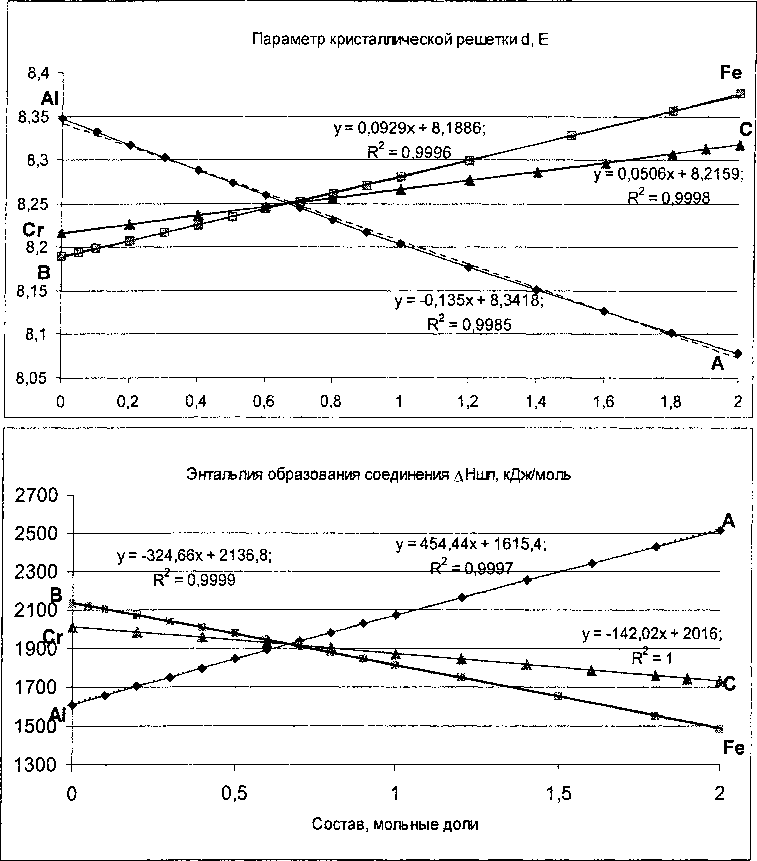
Рис. 2. Изменение параметра кристаллической решетки и энтальпии образования кристаллической шпинели Nlg2+KFex3*Aly3*Cr/+)2O4] при изменении состава по линиям Fe3+- В, А13+- А и Сr3t- С треугольника составов (рис. 1)
изложенной выше методике. Определив свойства в этих точках, из уравнения плоскости можно определить проекцию одинаковых значений свойства (параметра решетки или энтальпии) на треугольник составов.
На рис. 3 приведены проекции сечений плоскости свойств (параметра решетки и энтальпии образования) плоскостями сечений с одинаковым значением этих свойств на треугольник составов. С использованием приведенных на рис. 3 данных можно определить эти свойства хромишпинелей состава Mg[FexAl jCr^OJ при любом соотношении трехзарядных катионов.
Аналогичные расчеты параметров структуры и энтальпии образования шпинели состава (Mg23Te/+)[(Fex3+Aly3+Crz3+)2O4] при других значениях z и j показали, что замена во внешней сфере катиона Mg2+ катионом Fe2+ ведет к изменению свойств соединения также по линейному закону. На рис. 4 приведены проекции сечений плоскости свойств шпинели на треугольник составов при z = 0 и у = 1. Из сравнения данных, представленных на рис. 3 и 4 следует, что характер изменения свойств магношпинелей Mg[Fe2AlyCrz04] и феррошпинелей Fe[Fe2AlvCr,04] аналогичен, однако линии проекций одинаковых значений свойств при z = 1 и у = 0 на треугольник составов (FeI3+Al/+Cr23+)2 не параллельны. Это означает, что свойства (параметр решетки, энтальпию решетки, энтальпию образования соединения и др.) шпинелей (Mg^Fe/^^Fe^Aly^Cr/^C^] можно отобразить в виде непараллельных плоскостей, положение и наклон каждой из которых определяется соотношением количества катионов Mg2'и Fe2+ во внешней сфере, т.е. значениями / и j. Совокупность плоскостей складывается в косую трехгранную призму, опирающуюся на треугольник составов (Fex3+Al/'Cr/')2. На рис. 5 приведена развёртка боковой поверхности таких призм, описывающих в пространстве совокупность соответствующих
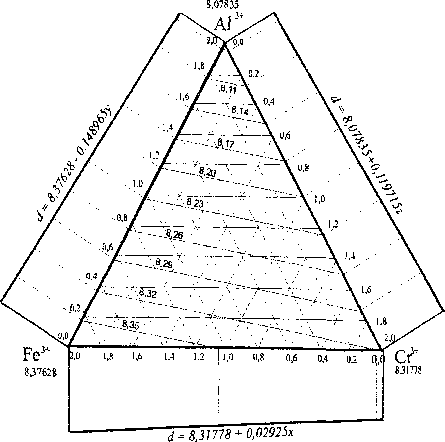
Рис. 3. Проекции уровней параметра решетки и энтальпии образования шпинели Mg[FexAlyCrzO4] на плоскость составов
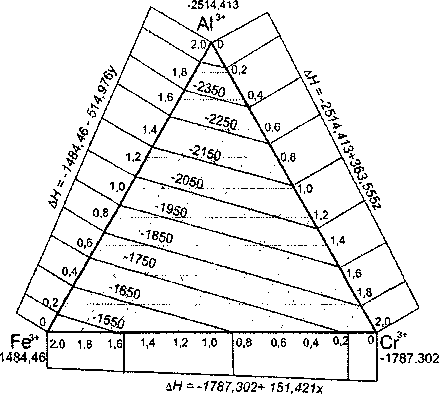

Рис. 4. Проекции уровней параметра решетки и энтальпии образования шпинели Fe[Fe,AlyCr2O4] на плоскость составов
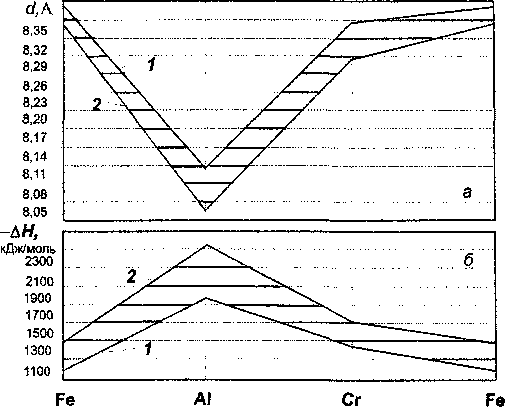
Рис. 5. Развертка боковой поверхности призм состав - параметр решетки (а) и состав - энтальпия образования кристаллической шпинели (Мд,2*Ре/*)[(Ее,3*А1у3*Сг?*)2О4] (6): 1 - при / = 0;
2 - при / = 0
параметров для всех значений переменных коэффициентов z, j, х, у и z комплексной шпинели состава (Mg^Fe/^KFe^^Al/^r/^jOJ.
Как уже отмечалось, базовые расчетные формулы 2 и 3, полученные на основе физических представлений о структуре шпинелей, в принципе не являются уравнениями первого порядка. Поэтому интерпретация свойств плоскостью вносит некоторую ошибку в построение рис. 3 и 4. Математический анализ погрешности, вызванной отклонением изменения свойств при изменении состава от линейных зависимостей, показал, что обусловленная этим ошибка при определении структурных параметров не превышает 1,8 % (относительных), а накопленная ошибка при расчете энтальпии образования кристаллической решетки не превысит 19,3 %. По нашему мнению, это позволяет с приемлемой точностью определять параметры структуры и термохимические свойства хромишпинелей даже без проведения трудоемких расчетов.
Выводы:
-
1. Показана применимость методики расчета структурных и термохимических параметров химических соединений по разработанной ранее модели применительно к комплексным хромишпинелям.
-
2. Рассчитаны межструктурное расстояние и параметр решетки, а также энтальпия решетки и энтальпия образования комплексных шпинелей ряда составов.
-
3. Установлен линейный характер изменения анализируемых параметров с изменением состава.
-
4. Построены диаграммы состав - параметр решетки и состав - энтальпия образования комплексных хромишпинелей состава (Mg2+Fe/2+)[(Fex3+A^+Cr?l2O4].
Список литературы Расчет параметров структуры и энтальпии образования хромишпинелей
- Павлов Н.В., Кравченко Г.Г., Чупрынина И.И. Хромиты Кемпирсайского плутона. -М.: Наука, 1968. -197 с.
- Теоретические основы процессов производства углеродистого феррохрома из уральских руд/В.П. Чернобровин, И.Ю. Пашкеев, Г.Г. Михайлов и др. -Челябинск: Изд-во ЮУрГУ, 2004. -346 с.
- Рябухин А.Г. Эффективные ионные радиусы структурных составляющих шпинелей//Высокотемпературные расплавы. ЧНЦ УрО РАН ЧГТУ. 1996. -№ 1. -С. 39-41.
- Рябухин А.Г. Эффективные ионные радиусы. Энтальпия кристаллической решетки. Энтальпия гидротации ионов: Монография. -Челябинск: Изд-во ЮУрГУ, 2000. -115 с.
- Рябухин А.Г., Рощин В.Е., Рощин А.В. Расчет структурных и термохимических констант низших оксидов алюминия//Вестник ЮУрГУ. Серия «Металлургия». -2005. -Вып. 6. -№ 10(50). -С. 27-33.
- Термодинамические константы веществ: Справочник в 10 вып./Под ред. В.П. Глушко. -М.: АН СССР, 1972. -Вып. VI. -369 с.
- Термодинамические константы веществ: Справочник в 10 вып./Под ред. В.П. Глушко. -М.: АН СССР, 1974. -Вып. VII. -343 с.


