Расчет параметров структуры и энтальпии образования кристаллических оксидов кремния
Автор: Рябухин А.Г., Рощин А.В., Рощин В.Е.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 13 (85), 2007 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156561
IDR: 147156561 | УДК: 669.046:
Текст статьи Расчет параметров структуры и энтальпии образования кристаллических оксидов кремния
Результаты экспериментов по твердофазному восстановлению вкрапленных руд показали, что восстановление металлов в рудных зернах, заключенных в невосстанавливаемую силикатную оболочку, происходит путем перемещения в объеме оксидов отрицательно заряженных кислородных вакансий, которые образуются в местах контакта руды с восстановителем [1-5]. По ходу реакции восстановления в оксиде непрерывно меняется соотношение ионов кислорода и металла, а в его кристаллической решетке постепенно накапливаются «лишние» электроны, понижающие заряд отдельных катионов вплоть до нуля [4-6]. При медленном восстановлении многозарядных катионов в исходном оксиде удается обнаруживать одновременное присутствие неодинаково заряженных катионов одного и того же металла, а также формирование кристаллов низших оксидов [5, 6]. Поскольку многие низшие оксиды являются неустойчивыми, определение типа и параметров их решетки, межъядерных расстояний, а также термохимических констант - энтальпии решетки, теплоемкости, энтальпии, энтропии, энергии Гиббса образования соединения затруднены и для многих оксидов такие данные отсутствуют. Тем более они отсутствуют для оксидов промежуточного состава, что делает целесообразным определение структурных и термохимических констант для них расчетным путем.
Такие расчеты особенно важны для системы кремний-кислород, поскольку постепенное уменьшение заряда четырехзарядного катиона кремния может привести к образованию нескольких стехиометрических и множества промежуточных оксидов кремния. В соответствии с электронной структурой кремния (ls22s22/>63s23p>2) возможны степени его окисления 1+ (3s23p'); 2+ (3s2); 3+ (3s1); 4+ (2s22p6). Таким степеням окисления могут отвечать оксиды состава Si2O, SiO, Si2O3, Si3O4 и SiO2, возможность существования которых в кристаллическом состоянии обсуждается в работах [7-17].
Для кремния и его высшего оксида SiO2 известны и структурные, и кристаллохимические параметры. Для монооксида SiO приводятся некоторые структурные константы [9-11], а для остальных оксидов необходимые данные отсутствуют. Однако приводимые в литературе структурные параметры и для SiO недостаточно надежны, поскольку получены они либо методом электронной дифракции, что предопределяет невысокую точность [9], либо для возможных смесей разных оксидов с недостаточной дифференциацией фаз [10, 11].
Целью данной работы является определение расчетным путем структурных и некоторых термохимических констант низших и промежуточных кристаллических оксидов кремния, что могло бы способствовать последующему их экспериментальному определению и идентификации.
Структурные параметры
Расчеты проводили по методике, ранее использованной в работе [18] для определения ионных радиусов разных катионов алюминия и параметров кристаллической структуры низших оксидов алюминия и в работе [19] - для определения параметров комплексных шпинелей, содержавших до пяти разных катионов. Методика расчета обоснована и изложена в работах [20-22].
Радиус катиона гк в кубических структурах с одним катионом можно определить из уравнения
где гр - межъядерное расстояние; г® - минимальный радиус аниона О2 равный 1,35806 [19,20]; rD - дебаевский радиус экранирования rD =13,73718-7а7 -<Р^\ где Ам - число Маделунга; ф(г) - функция зарядов ионов.
В шпинелях, образованных катионами с разной величиной заряда, гр - расстояние между центрами фрагментов шпинели. При этом нормальные оксидные шпинели типа 2-3 представляются в виде Ме2+[Ме3+2О4], а обращенные как Ме3+[Ме2+Ме3+О4]. Чтобы рассчитать межструктурное расстояние гр шпинели, сначала по формуле
^ДМе,„3+
VV7-- г-- Yr -У >= @ ^ПМе,„3+ ГДМе„2'' ГсРт 'О2-2 необходимо определить размер внутренней сферы г (фрагмента. [Ме3+2О4]2“ или [Ме2Ме3'О4]2’ соответственно). Здесь гср.п - средний радиус катионов во внутренней сфере, г 3+ и г 2+ -дебаевский радиус экранирования внутренней и внешней сфер.
Зная радиус катиона и тип решетки, из соотношения rp= аа, (3)
можно рассчитать параметр решетки а или, наоборот, зная параметр и тип решетки, можно рассчитать радиус иона. В уравнении (3) а - структурная константа, определяемая типом решетки.
Как уже отмечалось, в системе кремний-кислород известны все структурные характеристики только кремния и диоксида кремния SiO2. В литературе [9-11] приведены некоторые сведения о структуре монооксида SiO, однако методика получения объектов исследования не исключает, что препарат содержал не один низший оксид кремния, а несколько. Поэтому приведенные в этих источниках рентгенографические и электронографические данные подвергли теоретическому анализу и обработке в предположении, что в препарате могли присутствовать разные низшие оксиды кремния - Si2O, SiO, Si2O3, Si3O4.
Результаты расчета параметров решетки оксидов кремния, присутствие которых можно было предполагать в исследованных препаратах, приведены в табл. 1.
Из результатов расчета следует, что в исследованных препаратах не исключено присутствие кремния, которому соответствует а = 5,439±0,0030 А, и четырех оксидов, кристаллические решетки которых имеют параметры 4,3645±0,0005; 4,9943±0,0016; 7,8910±0,0020 и 9,2473±0,0014 А.
Рассмотрим последовательно эти соединения кремния.
Кремний Si
Кремний, как и алмаз, кристаллизуется в кубической структуре типа сфалерита ZnS (F43m-4). Структурная константа такой решетки а = Тз/4, параметр решетки а = 5,43077±0,00008А [12-17].
Отсюда межъядерное расстояние rp=a-d = = 2,35159±0,00003 А и радиус атома = Vrrp = = 1,175795±0,000015 А.
Сравнение с данными табл. 1 свидетельствует, что в нашем эксперименте параметр решетки больше. Возможно, это обусловлено присутствием в решетке кремния примеси кислорода, что не исключается условиями эксперимента.
Гемиоксид кремния Si2O
Подобному составу могут отвечать две структуры - куприт (Си2О) и антифлюорит (анти-СаР2).
Молекула Si2O образуется в результате гибридизации двух /2-электронов атома кислорода и по одному />-электрону атомов кремния. В трехатомных молекулах (одна двухзарядная и две однозарядные частицы) при образовании sp- или рр- гибридных связей реализуются равнобедренные плоские или линейные конфигурации. В обоих случаях размер молекулы Si2O будет больше размера двухатомной молекулы SiO, состоящей из тех же атомов. Поэтому из двух обнаруженных относительно малых параметров кристаллических решеток а = 4,3646±0,0004 А и а = 4,994±0,002 А предпочтение следует отдать второму.
Рассмотрим возможность кристаллизации Si2O в структуре куприта. Для этой структуры характерны структурные константы
3>/2
а= ---= О,5эОЗЗ.
Поэтому rD = Ъгпз 'б(7з-1) = 17,581767-6(V3 -1) =
= 77,22448 А; гр = 0,53033-4,994 = 2,64847.
После подстановки полученных значений в уравнение (1) получим
Таблица 1
Параметры решетки (А) предполагаемых оксидов кремния поданным [9-11]
|
Межплоскостное расстояние, а |
Индексы плоскостей, hkl |
Параметр решетки, d |
Межплоскостное расстояние, d |
Индексы плоскостей, hkl |
Параметр решетки, а |
|
2,52 [9-11] |
111 |
4,365 |
1,64 [10] |
311 |
5439 |
|
1,543 [11] |
220 |
4,364 |
1,36 [10] |
400 |
5,440 |
|
1,316 [11] |
311 |
4,363 |
1,11 [Ю] |
422 |
5,438 |
|
1,091 [11 |
400 |
4,363 |
1,087 [9] |
500 |
5,435 |
|
0,891 [9,11] |
422 |
4,365 |
0,96 [10] |
440 |
5,431 |
|
0,84 [9] |
333,511 |
4,365 |
0,92 [10] |
531 |
5,443 |
|
среднее |
4,3645±0,0005 |
0,86 [10] |
620 |
5,439 |
|
|
0,999 [11] |
430 |
4,995 |
0,83 [10] |
533 |
5,443 |
|
0,832 [11] |
600 |
4,992 |
среднее |
5,439±0,003 |
|
|
0,79 [9] |
620 |
4,996 |
1,541 [9] |
442 |
9,246 |
|
среднее |
4,9943±0,0016 |
||||
|
2,79 [10] |
220 |
7,891 |
1,321 [9] |
632 |
9,250 |
|
2,63 [10] |
300 |
7,890 |
0,92 [9] |
764 |
9,246 |
|
2,496 [11] |
310 |
7,893 |
0,79 [9] |
883 |
9,247 |
|
0,729 [11] |
872 |
7,890 |
среднее |
9,2473±0,0014 |
|
|
среднее |
7,8910±0,0020 |
||||
2,64847 -1,35806 + 0,02388 г =------------------------+
-
51 2
+70,431841-0,063253 =01,26426 Е.
Эта величина радиуса катиона Si1+ больше экспериментально определенного радиуса кремния, чего быть не может. Следовательно, оксид Si2O кристаллизоваться в структуре куприта не может.
По аналогии рассмотрим возможность кристаллизации Si2O в структуре антифлюорита. Для этой структуры характерны константы а = — = 0,4714045;
rD = Госаг2 -^— = 34,99597-2,276145 =
2 3(72-1)
= 79,65587 А;
гр = 0, 4714045-4,994 = 2,35419 А.
Отсюда
2,35419-1,35806 + 0,023154 г -_1--------’----------------+
-
51 2
+70,259735 - 0,054509 = 0,96266 А.
Эта величина радиуса катиона Si1+ меньше экспериментально определенного радиуса кремния rS1 = 1,175795+0,000015А, следовательно, оксид Si2O может кристаллизоваться в структуре антифлюорита.
Монооксид кремния SiO
Такому составу могут соответствовать две структуры - галенита (NaCl) и сфалерита (ZnS). Проведем проверку аналогично приведенным для Si2O рассуждениям и сравним с приведенным в табл. 1 значением параметра решетки а = 4,3645+0,0005.
Рассмотрим возможность кристаллизации SiO в структуре галенита (Fm3m-4). Для этой структуры характерны константы а= 0,5;
/•р = 2,18230;
Го = Гойза " (1 + Vz2-1) = 31,45393 ■ (1 + 7з ) =
= 85,933735 А [20].
Расчет по уравнению (1) дает гс 2+ = 0,78623 А.
Аналогично, допуская возможность кристаллизации SiO в структуре сфалерита (Fd3m-4) получим следующее. Для этой структуры характерны константы а = 72/3 = 0,4714045;
гр = 2,05749 А;
Го =roZnS-672=17,581767-672 =
= 149,18624 А [20].
Расчет по уравнению (1) дает rSj2+ = 0,66476 А.
Расхождения между рассчитанными значе ниями rSj2+ достаточно велики, однако отсутствие надежных данных по этой величине не позволяет отвергнуть ни одну из них. Это можно будет сделать позднее по результатам расчета термохимических величин.
Сесквиоксид кремния Si2O3
Составам типа Ме2О3 отвечает одна кубическая структура Мп2О3 (1аЗ-16) [12]. Для этой структуры характерны константы а = 2/9;
г0 = 38,281201 А [20];
в табл. 1 ему соответствует значение параметра решетки а = 9,2473+0,0014 А.
Расчеты по аналогичной методике приводят к величине rs.3+ = 0,57190 А.
Проверкой правильности расчетов радиусов двух- и трехзарядного ионов кремния могут служить:
-
1. Расчет параметра решетки шпинели Si3O4, содержащей оба катиона, и сравнение результатов расчета с экспериментальными данными табл. 1.
-
2. Расчет энтальпии кристаллической решетки АрЯ (Si2O3) и \рН (Si3O4) с использованием вычисленных значений радиусов ионов, энтальпии разрушения (образования) SiO, Si2O3 и Si3O4.
Оксид кремния Si3O4 (SiO-Si2O3)
Методика расчета параметров кристаллических решеток нормальных и обращенных шпинелей изложена в работах [20-22]. Из сочетания в структуре 2-3 шпинелей тетраэдров и октаэдров следует структурная константа а = 8 .1 =0,3 84900(21,22];
В табл. 2 приведена схема расчета межструктурного расстояния гр нормальных и обращенных шпинелей.
Примем rSj2+ = 0,66476 А и нормальный тип шпинели. Исходя из rSj3+= 0,57190 А, средний радиус катиона в шпинели Гф = 0,61833А.
Расчет эффективного радиуса внутренней сферы г^ ]
„ ™аа 21,47544-0,57190-1,35806
г = 0,57190-1--=
1 1 21,47544-0,57190-1,844327
= 0,57190 + 1,59803 = 2,16993 А.
Расчет параметра решетки нормальной шпинели
74,59312-0,64476-2,16993
г = о, 64476 +---------------------------= р 74,59312-0,64476-4,708596
= 0,64476 + 2,39760 = 3,06236 А.
Отсюда при этих допущениях параметр решетки нормальной шпинели а = 2,598077-3,06236 = 7,95625 А.
Таблица 2
Уравнения для расчета параметров нормальной и обращенной шпинелей Si3O4
|
Определяемая величина |
Нормальная шпинель Si2+[Si3+2O4] |
Обращенная шпинель Si3+[Si2+Si3+O4] |
|
гех |
rSi2+ |
rSi3* |
|
гт |
rSi3+ |
|
|
ГОех |
^•372 = 74,59312 |
rDZnS-6-(73-l) = 77,22448 |
|
ГА„ |
^zns’2'(1 + 73) = 96,06856 |
rDZnS • 3/4 • (3 + 7з ) ■ ^ = 98,66047 |
|
rDa ~^„ |
21,47544 |
21,43599 |
|
П] |
(^-^J^cp^o2" |
|
|
ГР |
ГП ex г i у J--U-- / \2 uex \ [ 1 / |
Г J--LJ--- ex / \2 Uex \ [ 1 / |
Здесь гю (/-,„) - эффективный радиус катиона во внешней (внутренней) сфере.
Аналогичный расчет обращенной шпинели при допущении rsj2+ = 0,66476 А:
Расчет эффективного радиуса внутренней сферы г
21,43599-0,61833-1,35806 г = 0,61833+------------------------------
' 1 21,43599-0,61833-1,844327
= 0,61833 + 1,57758 = 2,19591 А. Расчет параметра решетки обращенной шпинели г 0 57190 1 77’22448 0^57190-2.19591 р ’ 77,22448-0,57190-4,882021
= 0,57190 + 2,46505 = 3,03695 А.
Отсюда параметр решетки обращенной шпинели при этих допущениях а = 2,598077-3,03695 = 7,89023 А.
Аналогичные расчеты, исходя из допущения радиуса rs.2+ = 0,78623 А, приводят к значениям а = 8,17246 А для нормальной и а = 8,02998 А для обращенной шпинели. Из экспериментальных данных определено значение а = 7,8910+0,0020.
Исходя из этих результатов, следует, что в экспериментах наблюдали именно обращенную шпинель Si3O4, так как рассчитанный из ионных радиусов параметр обращенной шпинели а = 7,89023 А практически точно совпадает с величиной а = 7,8910+0,0020 А , определенной из рентгеноструктурных данных (см. табл. 1). Это подтверждает также правильность расчета радиусов ионов кремния г$]2+ = 0,66476 А и rsj3+ = 0,57190 А, выполненного по данным работ [9-11].
Результаты расчета характеристик кристаллических структур в системе кремний-кислород приведены в табл. 3.
Таблица 3
Параметры кристаллической структуры (А) в системе кремний-кислород
|
Вещество |
Si |
Si2O |
SiO |
Si2O3 |
51зОд |
SiO2 |
|
Структура |
ZnS F43m-4 |
анти-СаР2 Fm3m-4 |
ZnS Fd3m-4 |
Mn2O3 Ia3-16 |
MgAl2O4 |
0-крист. |
|
Заряд катиона |
0 |
1+ |
2+ |
3+ |
(cp.) 2,5+ |
4+ |
|
Радиус катиона |
1,7715 ±0,00065 |
0,96266 ±0,00094 |
0,66476 ±0,00024 |
0,57190 ±0,00022 |
(cp.)0,61833 ±0,00077 |
0,48124 ±0,00080 |
|
Структурная константа, а |
Тз/4 |
72/3 |
72/3 |
(^/з)2 |
1/4-(2/Тз)2 |
1/2-372/8 |
|
Дебаевский радиус экранирования, гD |
79,65587 |
149,18624 |
38,28120 |
- |
96,89932 |
|
|
Межъядерное расстояние, гр |
2,35429 ±0,00130 |
2,35419 ±0,00094 |
2,05745 ±0,00024 |
2,05489 ±0,00022 |
3,03725 ±0,00077 |
1,89460 ±0,00080 |
|
Параметр решетки, а |
5,437 ±0,003 |
4,994 ±0,002 |
4,3645 ±0,0005 |
9,247 ±0,001 |
7,891 ±0,002 |
7,145 ±0,003 |
Энтальпия образования кристаллических оксидов и энтальпия образования (разрушения) их кристаллических решеток
Результаты расчета структурных констант позволяют, в свою очередь, рассчитать энтальпию образования кристаллических оксидов и энтальпию их кристаллических решеток. Методика расчета изложена ранее в работе [20].
Согласно [20] энтальпию кристаллической решетки можно представить в виде суммы двух слагаемых
Д^МеА) = ДЯо + АЯВЗ- (4)
Здесь ДЯ0 - энтальпия нулевого уровня, от которого ведется отсчет. Величина ДЯ0 постоянна для данного типа кристаллической структуры, зарядов частиц и их электронного строения; АЯВЗ - энтальпия взаимодействия, которая зависит от величины зарядов частиц и, в свою очередь, определяет структуру кристаллической решетки.
Примем, что отсчет ведется от простейших атомов водорода. Тогда е2 к 3
ДЯ0 = na —.10-8-10-3-/i(Z)-/i(CTp).
а0
где МА = 6,022045ТО23 моль'1 - число Авогадро; е = 4,803242-1010 CGSE (г1/2см3/2с'!); Ю8 и 10"3 -численные коэффициенты перевода единиц в систему СИ; п0 = 0,52912-Ю'8 см - боровский радиус атома водорода; /(Z) - функция заряда, которая включает в себя произведение ZK2 -Za2 (ZK и Za - величина зарядов катиона и аниона соответственно); /цстр) ~ структурная константа.
После подстановки численных значений получим АЯ0= 114,174-/^-/1(стр) .
Энтальпия взаимодействия
АЯЮ = Na — Лм - КЧ - 1 СТ8 -10"3 - /2 (Z) - /2(стр), яг • Гр где гр = a a - межъядерное расстояние; a - геометрическая константа; a - параметр кристаллической решетки; А - число Моделунга; КЧ - координационное число (КЧ = 6);/2(Z) - функция зарядов, которая включает в себя произведение ZK-Za;
/2(стР) - структурная константа.
После подстановки численных величин для соединения получим
Д^ = 114,174 ./i(Z)-^(стр) +
103,7074 , ,
‘-^М "У? (-^J'^CTp) (5)
ГР или для конкретных оксидов:
Оксид Si2O
A^ = 114,174-l2-22 -1 +
103,7074-1,2597-1-2-6 2,35419
= 3916,874 + 1,382.
Оксид SiO
\рН = 114,174■ 22 -22-|^22+1 +
( 103,7074-1,63 806-2-2-4 ^_ 2,05745 ’ ~
= 4330,591±0,267.
Оксид Si3O4
А_Я = 114,174-32 -2,52 ---fl + — L
Р 2 I 4 J
ЮЗ,7074-1,63806-3-2,5-8-6-к/3-1)-™
+ V ’ 4^ 3,03725
= 20922,262 ±3,403.
Оксид Si2O3
■22 ■ 1
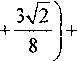
•3V3 =
Д/,Я = 114,174-32
103,7074 -1,63 806 -3-2 -4
ла. Это уравнение используем для расчета h анализируемых оксидов.
Зависимость h от состава х (х - мольная доля кислорода, приходящаяся на 1 моль кремния непрерывных квазиравновесных соединений) можно отобразить линейным уравнением [20]
h = а + к-х, (8)
где а и к- константы.
Все поле диаграммы состав - свойство разбивается на области твердых растворов, в которых выделяются кристаллообразующие компоненты. В первой области твердых растворов кристаллообразующим всегда является металл. Поскольку для металла Д/Я = 0, то для любой системы зависимость h = /(х) начинается с нуля. В других областях твердых растворов кристаллообразующим может быть принят любой устойчивый оксид, для которого известны состав, структура, энтальпия образования. Поскольку в каждой области к имеет разное численное значение, определяемое сочетанием структурных констант и координационных чисел сопрягаемых на границе областей решеток, то координаты самих границ определяются совместным решением уравнений (8) для соответствующих областей.
Из анализа структур (см. табл. 3) следует, что диаграмма кремний-кремнезем состоит из двух областей твердых растворов с границей при х = 1. Первая от кремния область включает оксиды с родственной структурой типа ZnS и СаГ2, вторая область образована более сложными оксидами. В табл. 4 приведены исходные данные и результаты расчетов по уравнениям (7) и (8).
Первая область твердых растворов SiO, (х = 0..,1)
По определению Д/Я°(81кр) = 0. Вследствие этого уравнение (6) приобретает вид
Я] = кух. (9)
Объемная структурная константа кх отражает переход от тетраэдрической структуры кремния с Кх =4 к структуре сфалерита с Л'2=з(72-1). Координационное число этих структур КЧ = 4. Отсюда кх = Х1-Х2-КЧ = 4-з(72-1)-4 = 19,8822.
Таким образом, в аналитической форме уравнение (7) принимает вид:
Их = 19,8822-х. (10)
Вторая область твердых растворов SiO, (х= 1...2). "
Квазиравновесному переходу по мере увеличения в оксидах кислорода от структуры сфалерита с Я2 = 3(72-1) к структуре /3-кристобалита с 7з
= -у- —г и КЧ = 6 соответствует объемная 3(72-1)
структурная константа
^=Х2-Х3-КЧ=з(^-1)—г-6 = 10,3923. v ; 3(72-1)
Используя Д/Я°(8Ю2 кристоб.) = -908,263+1,548, из уравнения (8) можно определить значение константы а = 9,4908. С учетом этого уравнение (8) этой области приобретает форму:
Л2 = 9,4908+ 10,3923-х. (11)
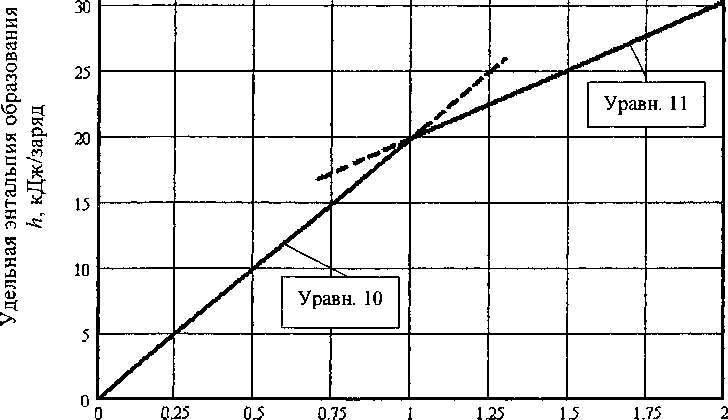
Совместное решение уравнений (10) и (11) позволяет определить границу областей х= 1,00009. Это позволяет уточнить ДуЯ°(8Юкр)=-437,450+0,042. Результаты расчетов по уравнениям (10) и (11) приведены в табл. 5 и на рисунке.
Хорошее согласие расчетов ДрЯ оксидов кремния по уравнению математической модели (ур. 4) и уравнению определения (ур. 6) позволяет считать, что рентгеноструктурные и электронографические данные идентифицированы правильно.
С использованием литературных рентгеноструктурных и электронографических данных рассчитаны эффективные ионные радиусы разнозарядных катионов кремния, параметры решеток, межъядерные расстояния в оксидах кремния и энтальпии их кристаллических решеток, а также стандартные энтальпии образования кристаллических оксидов кремния. Полученные значения стандартной энтальпии образования кристаллических оксидов Si2O, SiO, Si3O4, Si2O3 и их кристаллических решеток свидетельствуют о достаточной устойчивости этих оксидов в кристаллическом состоянии при стандартных условиях.
Энергия решеток ДРН (кДж/моль) оксидов кремния
Таблица 4
|
Параметр |
Si2O |
SiO |
Si3O4 |
Si2O3 |
SiO2 |
|
Ат [23] |
1,25970 |
1,63806 |
1,63806 |
1,63806 |
1,25970 |
|
КЧ |
6 |
4 |
4 |
4 |
6 |
|
/1(стр) |
1 |
-•722+1 2 |
i Г1+з7з) 2 U 4 J |
8 |
2Тз 3 |
|
У2(стр) |
зТз |
7з |
А Я ^73 |
зТз |
6'('Н7| |
|
АрЯ (ур. 4) |
3 916,874+1,3 82 |
4330,591+0,267 |
20922,262 ±3,403 |
16599,713+1,104 |
13453,689+2,118 |
Таблица 5 Стандартная энтальпия образования кристаллических оксидов кремния и энтальпий их кристаллических решеток (кДж/моль)
|
Параметр |
S12O |
SiO |
Si3O4 |
Si2O3 |
Sio2 |
|
EZ |
18 |
22 |
24,6667 |
26 |
30 |
|
-А/7° [23, 27] |
- |
437,940 ±4,184 [23] |
- |
- |
908,263 ±1,548 [27] |
|
h (ур. 7) |
- |
19,9064 ±0,1902 |
- |
- |
30,2754 ±0,0516 |
|
А(ур. 10, И) |
9,9411 (10) |
19,8822(10) 19,8831 (И) |
23,3126(11) |
25,0793 (11) |
30,2754(11) |
|
-АХ (ур. 7) и на 1 атом Si |
357,880 178,940 |
437,408 437,428 |
1725,1317 575,043 |
1304,122 652,061 |
908,263 |
|
Д/7(ур. 4) |
3916,874 ±1,382 |
4330,591 ±0,267 |
20922,262 ±3,403 |
16599,713 ±1,104 |
13453,689 ±2,118 |
|
Д/7 (ур. 6) |
3916,222 ±6,392 |
4328,205 ±66392 |
20929,002 ±12,900 |
16600,111 ±12,900 |
13454,922 ±6,508 |
|
А (АЛ) |
0,652 |
2,386 |
6,740 |
0,397 |
1,233 |
Мольная доля кислорода, приходящаяся на 1 моль кремния, х
Зависимость удельной энтальпии образования оксидов в системе Si - SiO2 от состава
Список литературы Расчет параметров структуры и энтальпии образования кристаллических оксидов кремния
- Твердофазное восстановление хрома из бедных хромовых руд/В.Е. Рощин, Н.В. Мальков, А.В. Рощин, А. В. Речкалова//Электрометаллургия. -1999. -№ 11. -С. 22-30.
- Рощин В.Е. Электрохимический механизм пирометаллургического восстановления вкрапленных хромитовых руд/В.Е. Рощин, А.В. Рощин, Н.В. Мальков//Электрометаллургия. -2000. -№ 6. -С. 38-44.
- Рощин А.В. Химическое взаимодействие твердого углерода с твердыми вкрапленными рудами/А.В. Рощин, В.Е. Рощин//Металлы. -2003. -№ 4. -С. 3-10.
- Рощин В.Е. Электрическая проводимость и перенос массы в кристаллических оксидах/В.Е. Рощин, А.В. Рощин, А.Г. Рябухин//Металлы. -2006. -№ 3. -С. 8-16.
- Рощин А.В. Термовосстановительные диссоциация и сублимация -этапы перестройки решетки оксидов в решетку металлов/А.В. Рощин, В.Е. Рощин//Металлы. -2006. -№ 1. -С. 3-10.
- Рощин А.В. Кристаллохимические превращения в оксидах алюминия при восстановительном нагреве/А.В. Рощин, Ю.Н. Гойхенберг, А.Г. Рябухин//Известия ВУЗов. Черная металлургия. -2006. -№ 8. -С. 6-9.
- Лунев В.В. Неметаллические включения в сталях, чугунах и ферросплавах/В.В. Лунев, В.П. Пирожкова, С.Г. Грищенко. -Запорожье: Днепровский металлург, 2006. -384 с.
- Диаграммы состояния силикатных систем: справочник/Под ред. Н.А. Торопова. -Л.: Наука. -1970. -Вып. 2. -371 с.
- Об образовании субокислов алюминия и кремния при раскислении расплавов железа/В.Е. Рощин, Д.Я. Поволоцкий, А.В. Речкалова и др.//Известия АН СССР. Металлы. -1974. -№ 6. -С. 5-10.
- Powder Diffraction File International Centre for Diffraction Data (PDF-2, ICPDS, 30-1127. Kurdyumov et al. Silicon Oxide. Inorg. Mater. № 2. 1966, p. 1539).
- Powder Diffraction File International Centre for Diffraction Data (PDF-2, ICPDS, 27-1884. Hoebbel, Wieker. Silicon Oxide. Z. Anorg. Allg. Chem. № 384. 1971. S. 43).
- Миркин Л.И. Справочник по рентгеноструктурному анализу поликристаллов/Л.И. Миркин. -М.: Физматгиз. 1961. -863 с.
- Нарита К. Кристаллическая структура неметаллических включений в стали/К. Нарита; пер. с японского. -М.: Металлургия. 1969. -190 с.
- Физико-химические свойства окислов: справочник/Под ред. Г.В. Самсонова. -М.: Металлургия, 1978. -471 с.
- Химическая энциклопедия. -М.: Советская энциклопедия, 1990. -Т. 2. -671 с.
- Химическая энциклопедия. -М.: БСЭ, 1995. -Т. 4. -639 с.
- Физический энциклопедический словарь. -М.: Советская энциклопедия, 1983. -928 с.
- Рябухин А.Г. Расчет структурных и термохимических констант низших оксидов алюминия/А.Г. Рябухин, В.Е. Рощин, А.В. Рощин//Вестник ЮУрГУ. Серия «Металлургия». -2005. -Вып. 6, № 10. -С. 27-33.
- Расчет параметров структуры и энтальпии образования хромишпинелей/А.Г. Рябухин, А.В. Рощин, В.Е. Рощин, А.Д. Дрозин//Вестник ЮУрГУ. Серия «Металлургия». -2006. -Вып. 7. -№ 10. -С. 32-37.
- Рябухин А.Г. Эффективные ионные радиусы. Энтальпия кристаллической решетки. Энтальпия гидротации ионов: монография. -Челябинск: Изд-во ЮУрГУ, 2000. -115 с.
- Рябухин А.Г. Нормальные и обращенные шпинели/А.Г Рябухин//Материалы XI международной конференции «Современные проблемы электрометаллургии стали». -Челябинск: Изд-во ЮУрГУ, 2001. -С. 55-58.
- Рябухин А.Г. Эффективные ионные радиусы структурных составляющих шпинелей/А.Г. Рябухин//Высокотемпературные расплавы. ЧНЦ УрО РАН-ЧГТУ. -1996. -№ 1. -С. 39-41.
- Мелвин-Хьюз Э.А. Физическая химия/Э.А. Мелвин-Хьюз; пер. с англ. -М.: ИЛ, 1963. -Кн. I. -519 с.
- Термические константы веществ: справочник: в 10 вып./Под ред. В.П. Глушко. -М.: Изд-во АН СССР. -1970. -Вып. IV. -509 с.
- Рябухин А.Г Математическая модель расчета энтальпии образования оксидов/А.Г. Рябухин//Известия ЧНЦ УрО РАН. -2005. -Вып. 4 (30). -С 31-35.
- Рябухин А.Г. Расчеты стандартных энтальпий и энергий Гиббса образования карбидов хрома произвольного состава/А.Г. Рябухин, О.Н. Груба//Вестник ЮУрГУ. Серия «Металлургия». -2005. -Вып. 6. -№ 10. -С. 9-13.
- Физико-химические свойства окислов: справочник/Под ред. Г.В. Самсонова. -М.: Металлургия, 1978. -471 с.


