Расчет структурных и термохимических констант низших оксидов алюминия
Автор: Рябухин А.Г., Рощин В.Е., Рощин A.B.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 10 (50), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156493
IDR: 147156493 | УДК: 669.046:
Текст обзорной статьи Расчет структурных и термохимических констант низших оксидов алюминия
Разработанная ранее математическая модель расчета эффективных ионных радиусов [1] позволила создать их систему [2], согласующуюся с рентгеновскими измерениями параметров кристаллических решеток бинарных и сложных соединений. Модель позволяет определять эффективные радиусы простых и сложных ионов, нейтральных аддендов, структурных фрагментов, параметров кристаллических решеток соединений, формирующихся в кубической сингонии. Адекватность модели экспериментальным (справочным) данным подтверждена согласием с параметрами решеток многочисленных сложных соединений - нормальных и обращенных оксидных, сульфидных, смешанных шпинелей типа 2-3 и 2-4, перовскитов типа 2-4, комплексных аммиакатов с простыми и сложными анионами, комплексов типа K2PtCl6 - всего 164 вещества [3-12].
В модели принято и обосновано деление сложных веществ на фрагменты. В частности, оксидные шпинели типа 2-3 представляются в виде Ме2+[Ме3+2О4] для нормальных и Ме3+[Ме2+Ме3+О4] - для обращенных. Это дает возможность, используя известные значения радиуса иона А13+ и параметры решетки шпинели А13О4, по предложенной методике рассчитать радиус иона А12+. Для получения достоверных результатов расчета необходимо использовать надежные данные о параметре решетки шпинели.
В литературе [13, 14] для шпинели А13О4, полученной восстановлением смеси А1 + А12О3 углеродом, приводятся значения параметра d = 7,93 и d= 7,915. В то же время путем восстановления корунда монооксидом углерода и последующей конденсации газообразных продуктов восстановления нами получено достаточное количество кристаллического конденсата для проведения разнообразных исследований [15, 16]. В составе конденсата выделены и надежно идентифицированы низшие оксиды алюминия А12О, АЮ и А13О4, а также оксиды переменного состава. В частности, анализ изотропных кристаллов с коэффициентом преломления N= 1,7300 ±0,0005 показал, что это шпинель (структурный тип MgAl2O4 - Fd3m-8) состава А13О4. По последним 5 линиям рентгенограммы рассчитан параметр кристаллической решетки шпинели d= 8,0827 ±0,0029. Учитывая, что для восстановления был использован газ, а конденсация из газовой фазы позволяет получать наиболее чистые вещества, считаем эти данные более точными и в расчетах использовали величину d (А13О4) = 8,0827 ±0,0029. ________________________ Серия «Металлургия», выпуск 6
В расчетах линейные размеры (d, гр г,) выражаются в ангстремах (10“8см), термические характеристики ^рН, АД й) - в кДж.
Согласно [5, 12] межструктурное расстояние гр (расстояние между центрами фрагментов) шпинели определяется по формуле гР= ad, (1)
где а - геометрическая константа, которая включает в себя структурные константы, характерные для октаэдрической (1/4) и тетраэдриче-ской(8/3л/з ) структур.
Поэтому r„ =a-d =---■= d = 0,3849 d.
р 4 3V3
Принимая d= 8,0827±0,0029, получаем
Гр = ad= 0,3849(8,0827±0,0029) = =3,11103±0,00112.
С другой стороны, согласно модели [6]
, Ъд!2* 2А12+ ■Г[А12О4]2-
- Га,2+ + 2 ’
,ОА12+ ‘ГА12+ Z[A12O4]2^
причем для нормальной шпинели минимальный радиус комплексного иона [А13+2О4]2~ равен 2,17897 [5, 12]. Дебаевский радиус экранирования наружного иона Ме2+ в шпинели г^, r^ = roznS -3>/2 =17,581767-3V2 =74,59312.
Подставляя в уравнение (2) численные значения г, „ 2- , г„,,2+ , г„ и решая его относительно [А12О4] DM 1
г 2+, получим
74,59312 тА12+ -2,17897
3,11103 = г,2+ +----------^----------,
" 74,59312-^-4,74791
откуда г 2+ = 0,72110 ±0,00112.
Таким образом, исходя из уточненного параметра кристаллической решетки нормальной шпинели d (А13О4) = 8,0827 ± 0,0029 радиус иона ^2+= 0,72110 ±0,00112.
Радиус А12+ может быть рассчитан также, исходя из параметра решетки монооксида АЮ. В [17] приведен параметр кубической решетки АЮ d= 5,67. Согласно [11, 12] радиус катиона А12+ в оксиде с кубической решеткой можно определить из уравнения
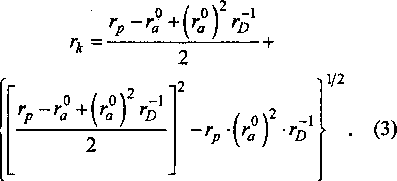
Здесь r^ - минимальный радиус аниона О2'= 1,35806 [1,2,12].
Структурная константа а для АЮ включает в
, - 8
себя тетраэдрическую константу —•=, что позво-3V3
ляет предположить формирование оксида в структурном типе ZnS (сфалерит). В этом случае струк турная константа а = —=--= 0,375; дебаев ский радиус экранирования
- о R _ rD -^DZaS " ‘ ~
= 17,581767-272—^ = 76,56241, зТз а гр = a -d = 0,375-5,67 = 2,12625.
После подстановки в уравнение (3) численных величин и решения его относительно гк получим г 2+= 0,72127.
Таким образом, определенная из разных исходных данных величина г 2+ хорошо согласуется - разница составляет 0,00017 или 0,02%, однако предпочтение следует отдать значению, полученному из параметра решетки шпинели как более надежно определенной исходной величины. По этому значению г г+ и используя уравнение (2) можно скорректировать параметр решетки АЮ.
1()+.....О^НО-?^!.^
р 0,72110-76,56241-1,844327
Отсюда параметр решетки АЮ d=2,12610 / 0,375 = 5,66960.
Зная величину радиуса А12+ и определив размер аниона [А12+А13+О4]3' из выражения
_ (^Двн ^Ьн)" ^ср "^а
можно рассчитать [5,6] параметр решетки обращенной шпинели А13+[А12+А13+О4].
Радиус иона А13+ равен 0,58917 [12]. Для внутренней сферы [А12+А13+О4] [5, 6,12]:
г„ =-‘к,2+ +Л|3+) =—-(0,72110 + 0,58917) = 0,65514.
СР 2 ' ' 2
Заряд комплексного иона
Zcp=l-(2 + 3) = 2,5;
поэтому
^вн = ^ZnS~(3+73)-T^5= 98,66047.
Для наружного катиона ^=^•3-2(73-1) = 77,22448.
Подставляя в уравнение (4) численные значения ^ф . ^ви» Гон и г° определим г[д]2+д]3+О4]з-
Г[А12+А13+о4]3- =0’ 65514 +
(98,66047-77,22448)-0,65514-1,35806 = 21g52 (98,66047 - 77,22448) -0,65514-1.358062 ’’
Межструктурное расстояние гр согласно уравнению (2)
■'rA]2+A13+o4f-
Гр = ?А13+ + 1^2
^2^3^ J-=0,58917+2^22^^
77,22448-0,58917-2,218522
Отсюда d= гр/а = 3,07679 / 0,3849 = 7,99374.
Полученный для обращенной шпинели А13О4 параметр d= 7,99374 также больше приводимого в литературе (<7 = 7,93 и <7=7,915 [17]). Это, возможно, свидетельствует о том, что в шпинели, полученной восстановлением смеси А1 + А12О3 углеродом, присутствовали примеси, сходные по структуре, но с меньшими параметрами решетки, например АЮ.
Результаты расчета геометрических констант кристаллических структур позволяют определить энтальпию образования кристаллических оксидов А/7° и энтальпию их кристаллических решеток &рН. В работе [12] изложена методика расчета, подтвержденная экспериментальными (справочными) данными для 98 соединений (галиды, оксиды, халькогениды, нитраты металлов различных зарядов и кристаллических структур). Согласно этой модели энтальпия образования кристаллических решеток ^рН
A^(MenAm) = АЯ0 + АЯ^. (6)
Здесь А/70 - энтальпия нулевого уровня, от которого идет отсчет. Величина Айо постоянна для данного типа кристаллической структуры, зарядов частиц и их электронного строения. \НЮ - энтальпия взаимодействия, которая учитывает взаимодействие частиц, их заряд, строение и структуру кристаллической решетки.
Примем, что отсчет ведется от простейших атомов водорода. Тогда
№0=Na— -ю-Чо'3-/^).
«о где Na = 6,022045-1023 моль'1 - число Авогадро, е = 4,803242-10'10 CGSE (г1/2см3/2с'’), Ю'8 и 10'3 -численные коэффициенты перевода единиц в систему СИ, а0 = 0,52912-1О'8 см - боровский радиус атома водорода,/^ - функция структуры и заря- да, которая включает в себя структурную константу ^2.........-- и произведение ZK2- Z2, "Z.K и Za- величина зарядов катиона и аниона соответственно.
После подстановки численных значений получим АН0 = 114,174.
Энтальпия взаимодействия
АНЮ = Na---А^ КЧ-10”8 • КГ3 ■ /2 (Z), где гр = ad - межъядерное расстояние, а - геометрическая константа, d - параметр кристаллической решетки, Ам - число Моделунга, КЧ - координационное число (КЧ= 6),f2(Z) - функция структуры и зарядов, которая включает в себя структурную константу ^(V3+ 1^ и произведение ZK ZQ.
После подстановки численных величин для одно-одно зарядного соединения получим
АЛ = 114Д74-/1® + 1087’4125. Ам - /2(Z). (7) ГР .
В то же время по определению
ЛрН°(МеЛт) = п- A^fMe^) + т- Д//0^”-,) -
-Д^ГМе^кр). (8)
Уравнения (7) и (8) можно использовать для расчета различных величин. Используем их для определения А/^АЮкр).
Как уже отмечалось, АЮ кристаллизуется по типу ZnS (сфалерит). Следовательно, приведенное число Моделунга для этой структуры Лм = 1,63806 [18]; гр = 2,12625. Уравнение (7) в этом случае принимает форму:
ДХ(АЮ) = 114,174-3-
-J087^.1)63^
г г р р
После подстановки это дает
ДХ(АЮ)= =811,9032 + 3350,9642 = 4162,8674.
Известно, что ДуН°(А12+г) = 2728,683 ±4,184 [19]; aX(O2\) = 1069,128 ±0,116 [12]. После подстановки в уравнение (8) численных величин АЛ°(МепАш), Д2Д°(Ме'”+г) и АЛ°(А”~Г) получаем
Д/ЛАЮкр) = 2728,683 + 1069,128 - 4162,867 = = -365,056.
Возможен и другой метод расчета энтальпии образования кристаллических соединений [20]. При разработке этой модели расчета стандартной энтальпии образования оксидов из работ [21-23] заимствована идея ее зависимости от удельной (на единицу величины заряда ядра) энтальпии Л и от состава, а из оправдавших себя моделей расчета теплоемкости и энтропии [24-25] - идеи о делении поля «состав-свойство» на области твердых растворов, о введении понятия кристаллообразующего компонента и объемной структурной постоянной К.
В модели принимается, что на каждый ядер-ный заряд кристаллического вещества приходится одинаковая энтальпия. Поэтому удельная энтальпия является эффективной величиной и определяется как
-АЛ Ь =—±—
Zz
где ZZ - сумма ядерных зарядов (порядковых номеров элементов) с учетом состава оксида. Это уравнение используется для расчета h анализируемых веществ.
Зависимость h от состава х (х - мольная доля кислорода, приходящаяся на 1 моль металла) можно отобразить линейным уравнением [20]:
h = a + KK4x. (11)
Все поле диаграммы состав - свойство разбивается на области твердых растворов, в которых выделяются кристаллообразующие компоненты. В первой области твердых растворов кристаллообразующим всегда является металл. Поскольку для металла А// =0, то для любой системы зависимость h =f(x) начинается с нуля. В других областях твердых растворов кристаллообразующим может быть принят любой устойчивый оксид, для которого известны состав, структура, энтальпия образования. Поскольку в каждой области К имеет разное численное значение, определяемое сочетанием структурных констант и координационных чисел сопрягаемых на границе областей решеток, то координаты самих границ определяются совместным решением уравнений (11) для соответствующих областей.
В работах [24-25] показано, что в системе Al-О существуют две области твердых растворов, на границе которых находится монооксид алюминия АЮ. Это подтверждается и результатами анализа кристаллических структур оксидов алюминия. Алюминий кристаллизуется в структуре ГЦК (типа Си), А12О - антифлюорит (анти-СаГ2), АЮ имеет кубическую структуру (типа ZnS), А13О4 -типичная 2-3 шпинель (типа MgAl2O4), А12О3 имеет ромбическую (типа а-А12О3 - корунд) или ГПУ упаковку. Граница должна проходить при перестройке структур ZnS в более сложные упаковки, то есть по АЮ.
Анализ зависимостей h-x целесообразно начать со второй области твердых растворов, так как ее внешней границей является хорошо изученный корунд. В работе [25] показано, что в объемную структурную постоянную К входят структурные константы к ГЦК, тетраэдрической и примитивной структур.
В рассматриваемом случае
= —+1 (V6-1) =2,7048.
I 2 ) Х
Координационное число рассматриваемой структуры КЧ= 12. Поэтому во второй области твердых растворов (прих = 1...1,5) уравнение (11) принимает вид:
й2 = а2+К2- 12-х = а2+ 32,4576-х.
Учитывая, что h(Al2O3) = 33,5138 ± 0,0251, из последнего уравнения следует, что а2 = - 15,1726 ±0,0251. И тогда окончательно уравнение (11) можно записать в виде й2=-15,1726+32,4576-х. (12)
Результаты расчетов по этому уравнению приведены в табл. 1 и на рисунке.
Определение энтальпии АЮ по уравнению (12) позволяет представить уравнение (11) в области твердых растворов х = 0... 1,0 в виде уравнения й, = 17,285-х. (13)
Отсюда /^(АЮкр) = - 362,985.
Таким образом, двумя независимыми методами расчета получены практически одинаковые значения энтальпии образования монооксида АЮ: - 362,985 кДж/моль и - 362,606 кДж/моль. Поэтому можно принять АуН°(АЮч,) = - 362,796.
Зная А//°(АЮЧ,), можно определить Ар7/0(АЮкр) по уравнению (8), которое в этом случае принимает вид:
A^CAIO,,) = АХ(А12+г) +А2Д0(О2"г) - А^АЮкр).
После подстановки численных значений получим
А^АЮкр) = 2728,683+1069,128+362,796= 4160,796.
Хорошее согласие величины Ауй°(А1О1ф), полученной из независимых моделей, позволяет рассчитать гДАЮ^,) и сДАЮкр), решая совместно уравнения (8) и (9):
АрЯ°(А1Ожр) = 817,151 + 7108,6202 / гр откуда гр = 2,12613 и d = 5,66968. Отличие рассчитанного параметра кристаллической решетки АЮ от приведенного в [17] составляет 0,00032.
Расчет радиуса А12+ по уравнению (3) с использованием уточненной величины тр дает г 2+ = 0,72114. Исходя из вычисленных независимыми способами трех значений г 2+ 0,72110; 0,72127 и 0,72114, можно считать, что ^2+ = =0,72117+0,00011; а «/(АЮ^) = 5,66976+0,00011. Численные значения А//°(АЮ,р), ^(АЮ^) и г 2+ можно использовать в качестве справочных, поскольку они взаимно согласованы.
Таблица 1
Стандартные энтальпии образования кристаллических оксидов алюминия (кДж/моль)
|
Вещество |
Структура |
Известные значения |
EZ |
Результаты расчета |
|
|
h |
|||||
|
А1 |
ГЦК(Си) |
0 по определению |
13 |
0 |
0 |
|
А12О АЮо.5 |
Анти-СаЕ2 |
Отсутствуют |
34 |
8,6425 |
293,845 |
|
АЮ |
ZnS (сфалерит) |
364 [26] . |
21 |
17,285 |
362,985 |
|
А13О4 АЮ1.333 |
2-3 шпинель (MgAl2O4) |
Отсутствуют |
71 |
28,1042 |
1995,398 |
|
А12О3 аю15 |
ГПУ (корунд) |
1675,692+1,255 [19] |
50 |
33,5138 |
1675,690 |
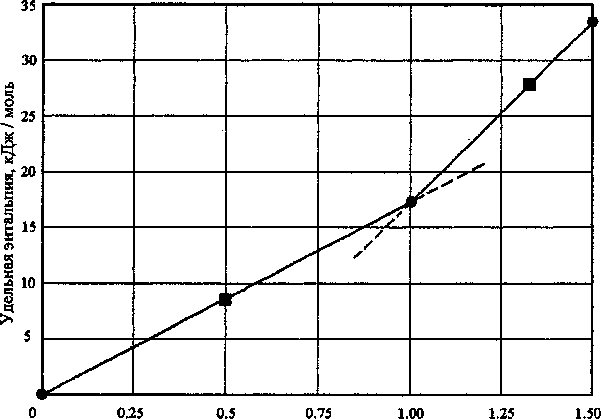
Доля кислорода на один ион металла
Удельная энтальпия h образования кристаллических оксидов алюминия:
• - справочные данные, ■ - результаты расчета
Таблица 2
Результаты расчета ионных радиусов (г) и параметров (d) кристаллических решеток (А), энтальпии образования оксидов и их кристаллических решеток (кДж/моль)
|
Вещество |
r,d |
-A/7(Mez+r), -ДДА1ОХЧ>) (справочные данные) |
-ДДА1ОХКр) |
-^pH |
|
А1 |
1,43175 [12] |
— |
— |
|
|
АГ |
0,93036+0,00126 ур.(З) 0,93014+0,00396 ур.(З) |
911,991+4,184 [19] |
— |
— |
|
А12+ |
0,72110+0,00012,ур.(2) 0,72127, ур. (3) 0,72114, ур.(З) |
2728,683+4,184 [19] |
— |
|
|
А13+ |
0,58917+0,00001 [12] |
5473,387+4,184 [19] |
— |
|
|
А12О |
4,9894+0,00784 ур(1) 4.9798 ур.(1) 4,98 [14] |
Отсутствуют |
293,845 ур.(14) |
3185,955+4,184 УР-(9) 3191,2309 УР-(17) |
|
АЮ |
5,66960+0,00090 ур.(4) 5,67[17] |
364 [26] |
365,056 ур.(9) 362,985 ур.(14) |
4161,811+4,300 [26] 4160,796 Ур(9 и 13) 4162,867 ур.(10) |
|
А13О4 |
8,08264 +0,00019 7,93 [13] 7,915[14] |
Отсутствуют |
1995,398 2004,884 УР-(9) |
19947,367 ±4,532 ур.(14) 19956,853 УР.(7) |
|
А12О3 |
1675,692+0,209 [19] |
1675,692 |
15829,850 ±8,816 |
Полученная величина г 2+ позволяет уточнить параметр кристаллической решетки А13О4. Решение по уравнению (2) дает d = 8,08264; что практически совпадает с экспериментальным значением, но существенно сужает доверительный интервал, доводя его до ±0,00019 вместо ±0,00029.
Помимо этого, величины г 2+ и дХ(А13о4ч>) позволяют уточнить и величину энтальпии образования решетки шпинели АрЯ°(А13О4). Исходя из уравнения (8) можно записать аХ(а13о4)=ду/^А!2^) + за/Ла^,) + +4Ау^(О2~г)-Ду/УА^О^) (14) или после подстановки численных значений Д^(А13О4) = 2728,683 + 2-5473,387 + 4 1069,128 --Ау/°(А13О4кр) = 17951,969 - Ау/°(А1зО4ч,).
Из уравнения (12) А//°(А13О4 „) = - 1995,398 (см. табл. 1).
Тогда
ДУ7°(А13О4) = 17951,969 - (-1995,398) = 19947,367.
С другой стороны, энтальпию образования решетки шпинели А13О4 [А12+(А13+2О2"4)] можно определить, используя уравнение (7). В соответствии с моделью [12] объемная структурная посто янная К шпинели 2-3 складывается из координационного числа КЧ= 6, структурных констант ZnS
V3 г kx =—,NaCl к2 =n2, и примитивной к3 = 1. Она численно равна К = (^ + 1)(А2 - ly’-l/S-THT = =6,91920. Тогда по уравнению (8)
аХ(А1зО4)= 114,174-9-4 +
+ 1087,4125-1,63 806- 4 =
3,11103
=4110,264 + 15846,599 = 19956,853.
Расхождение величин Ау/°(А13О4), полученных по уравнениям (14) и (7), составляет менее 0,05%, что свидетельствует об их достаточно высокой надежности.
Из значения А^ получаем Ду7°(А13О4кр) = =17951,969 - 19956,853 = -2004,884. Полученная величина Ду/°(А13О4 ^ отличается от рассчитанной по другой методике величины АуТ°(А13О4 кр) менее чем на 0,5%.
Используем изложенную методику и для расчета геометрических и термохимических констант оксида А12О. Оксид А12О кристаллизуется с образованием решетки типа антифлюорит и парамет- ром d = 4,98 [17]. Отсюда межъядерное расстоя ние гр = a-d =
V2
— -4,98 = 2,34759. Дебаевский ра диус экранирования для структуры флюорита
15,418081-3,0792 = 47,475377
После подстановки соответствующих численных величин в уравнение 3 получаем г + = 0,93036. Если принять, что параметр (А12О) экспериментально определен с точностью ±0,0025, то г + = = 0,93036 ±0,00126.
Межъядерное расстояние л-^А^О) может быть рассчитано и по уравнениям модели энтальпии кристаллической решетки ЕрН [12]. По уравнению (8) рассчитаем Дрй°(А12О)
ДрД°(А12О) = 2Д/7°(А1+Г) + Д^°(О2-Г) - Д/7°(А12О .р) или после подстановки численных значений из [19, 12,26]
ДХ(А12О) = 2-911,991 + 1068,128 + 293,845 = = 3185,954.
Уравнение (7) с учетом Ам(СаЕ2) = 1,259695 и fj® = 2 • 2 - 2 V2 = 1,171573 принимает форму
Д^= 114,174-1-4 + 1087,412^2596^ ,1Д71573= гр
= 456,696 + 6419,3207/^. (16)
Отсюда с учетом доверительных интервалов определения компонентов для Дрй°(А12О) Д = ±4,300 получаем гДА12О) = 2,35204 ±0,00370. Следовательно, в соответствии с уравнением (1) d(Al2O) = 4,9894 ±0,00784, а из уравнения (3) г^ = 0,93014 ±0,00396.
Из двух значений = 0,93036 ±0,00126 и г^ = 0,93014±0,00396, полученных независимыми расчетами, получаем г^ = 0,93025 ±0,00043. Используя эту величину, из уравнения (2) получим гр(А12О) = 2,3475, следовательно, t/(Al2O) = 4,9798.
Эти данные позволяют уточнить ЕрН (А12О);
ЕрН (А12О) = 456,696 + 6419,3207 / 2,3475 = =3191,2309.
Отличие от ДрЯ (А12О), полученной из Д// компонентов, менее 0,2%.
Выводы
-
1. Использование уравнений математических моделей расчета эффективных ионных радиусов и энтальпии кристаллической решетки позволили уточнить и согласовать между собой рентгеновские и термохимические данные кристаллического оксида А12О, рассчитать эффективный радиус катиона АГ.
-
2. Вычисления по разработанным ранее моделям расчета эффективных ионных радиусов, энтальпии кристаллической решетки и ■ стандарт
-
3. Совпадение результатов расчета одних и тех же характеристик по разным методикам и из различных исходных данных свидетельствует об их надежности и достоверности.
ной энтальпии образования кристаллических соединений позволили определить эти характеристики оксидов алюминия А12О, АЮ и А13О4. Полученные данные взаимно согласованы.
Список литературы Расчет структурных и термохимических констант низших оксидов алюминия
- Ryabukchin A. G. Effective ionic radii//Высокотемпературные расплавы. -Челябинск: ЧНЦ УрО РАН. ЧГТУ. -1996. -№1. -С. 33-38.
- Рябухин А.Г. Система эффективных ионных радиусов//Известия ЧНЦ УрО РАН. -2000. -Вып. 4.-С. 74-76.
- Рябухин А.Г., Стерлигова И. В. Эффективные ионные радиусы аммиакатных катионов//Известия ЧНЦ УрО РАН. -1998. -Вып. 1. -С. 34-38.
- Рябухин А.Г. Эффективные ионные радиусы сложных анионов//Известия ЧНЦ УрО РАН. -1998. -Вып. 1. -С. 23-26.
- Рябухин А.Г. Эффективные ионные радиусы структурных составляющих шпинелей//Высокотемпературные расплавы. ЧНЦ УрО РАН-ЧГТУ. -1996. -№1-С. 39-41.
- Рябухин А.Г. Нормальные и обращенные шпинели//Материалы XI международной конференции. 2001 г. -Челябинск: Изд-во ЮУрГУ. -С. 55-58.
- Рябухин А.Г. Оксид-шпинели типа 2-4//Известия ЧНЦ УрО РАН -2002. -Вып. 1(14). -С. 26-28.
- Рябухин А.Г. Смешанные оксид-шпинели (тип 2-3)//Известия ЧНЦ УрО РАН. -2002. -Вып. 1(14). -С. 29-31.
- Рябухин А.Г. Сульфид-шпинели типа 2-3//Вестник ЮУрГУ. Серия «Металлургия». 2002. №2. С. 39-41.
- Рябухин А.Г. Сульфид-шпинели типа 2-3//Известия ЧНЦ УрО РАН. -2002. -Вып. 2(15). -С. 23-27.
- Рябухин А.Г. Перовскиты (типа 2-4)//Известия ЧНЦ УрО РАН. -2002. -Вып. 2(15). -С. 28-31.
- Рябухин А.Г. Эффективные ионные радиусы. Энтальпия кристаллической решетки. Энтальпия гидратации ионов. Монография. -Челябинск: Изд. ЮУрГУ, 2000. -115 с.
- Филоненко Н.Е., Лавров И.В., Андреева С.В., Певзнер Р.Л. О глиноземистой шпинели АlO-А12O3.//Докл. АН СССР. -1957. -115. №3. -С. 583-584.
- Верт Ж.Л., Каманцев М.В., Кудрявцев В.И., Сохор М.И. К вопросу о восстановлении А12O3углеродом//Докл. АН СССР. -1957. -116. №5. -С. 834-836.
- Об образовании субокислов алюминия и кремния при раскислении расплава железа/В.Е. Рощин, Д.Я. Поволоцкий, A.B. Речкалова и др.//Известия АН. Металлы. -1974. -№6. -С. 5-10.
- Рощин A.B., Гойхенберг Ю.Н., Рябухин А.Г. Кристаллохимические превращения в оксидах алюминия при восстановительном нагреве//Известия вузов. Черная металлургия (в печати).
- Диаграммы состояния силикатных систем. Спр./Под ред. H.A. Торопова. -Ленинград: Наука, 1970. -Вып. 2.-372 с.
- Мелъвин-Хъюз Э.А. Физическая химия. В 2 кн.-M: ИЛ, 1962. -Кн. 1. -519 с.
- Термические константы веществ. Спр. в 10 вып./Под ред. В.П. Глушко. -М.: АН СССР, 1974. -Вып. V-530 с.
- Рябухин А.Г. Математическая модель расчета энтальпии образования оксидов//Известия ЧНЦУрОРАН.-2005. -Вып. 4(30). -С. 31-35.
- Ватолин H.A., Моисеев Г.К., Трусов Б.Г. Термодинамическое моделирование в высокотемпературных неорганических системах. -М.: Металлургия, 1994. -352 с.
- Моисеев Г.К., Ватолин H.A. О возможности согласования стандартных энтальпий образования (СЭО) родственных, бинарных и квазибинарных неорганических систем//Доклады РАН. Том 367. -1999. -№2. -С. 206-214.
- Моисеев Г.К., Ивановский А.Л. Стандартные энтальпии образования родственных соединений в системах металл-бор//Известия ЧНЦ УрО РАН. -Челябинск: Изд-во ЮУрГУ, 2005. -Вып.3 (29). -С. 5-9.
- Рябухин А.Г., Рощин A.B. Расчет стандартной теплоемкости кристаллических оксидов алюминия А12O, АЮ и А13O4//Известия вузов. Черная металлургия. -2005. -№12. -С. 3-4.
- Рябухин А.Г., Рощин A.B. Расчет стандартной энтропии кристаллических оксидов алюминия Al2O, АЮ и А13O4//Известия вузов. Черная металлургия (в печати).
- Реми Г. Курс неорганической химии в 2 томах. -М.: ИЛ, 1963. -Т. 1.-920 с.


