Расчеты стандартных энтальпий и энергий Гиббса образования карбидов хрома произвольного состава
Автор: Рябухин А.Г., Груба О.Н.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 10 (50), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156507
IDR: 147156507 | УДК: 536.75
Текст обзорной статьи Расчеты стандартных энтальпий и энергий Гиббса образования карбидов хрома произвольного состава
В технической и теоретической термодинамике, наряду с теплоемкостью и энтропией, важнейшими характеристиками являются энтальпия и энергия Гиббса. В связи с этим необходимость создания математических моделей расчета стандартной энтальпии образования Д ^Я^ и стандартной энергии Гиббса образования AyG°98 бинарных веществ произвольного состава очевидна.
Несостоятельность моделей, в которых используется прямая аддитивность свойств компонентов или их инкрементов, обоснована в работах [1,2].
Любое бинарное соединение может быть представлено как АВ,. При стандартных условиях основной компонент А находится в кристаллическом состоянии, а компонент В - либо газ (О, N, Н, С1 и др.), либо кристалл (С, Si, Р, В и т.п.).
Для первого варианта разработана математическая модель расчета ДуЯ^, обоснованная согласием со справочными данными для оксидов [3, 4] и нитридов.
Во втором случае компонент В может сам выступать в роли кристаллообразующего, то есть -конкурента компонента А (металла). В связи с этим аналитические выражения модели отличаются от первого варианта. В качестве объектов изучения выбраны карбиды хрома.
Соединения СгСх имеют большое практическое значение в металлургии, так как карбиды и карбонитриды (комплексные соединения на их основе) являются основными фазами-упрочнителями в сталях. Природа и свойства этих фаз во многом определяют их поведение в стали. Прочность связи между атомами металла и неметалла в соединении можно охарактеризовать стандартной энтальпией образования и свободной энергией Гиббса образования карбида, температурой плавления.
Диаграмма состояния Сг - С [5] показывает наличие трех прочных карбидов: Сг23С6 (содержащий 6,026 % (мае.) С), Сг7С3 (9,900 % (мае.) С) и Сг3С2 (15,400 % (мае.) С), имеющих температуру плавления 1520, 1780 и 1890 °C соответственно. По данным ряда исследователей [6] при температуре выше 2270 °C существует еще один карбид - СгС (18,765 % (мае.) С), разлагающийся при охлаждении на Сг3С2 и углерод, однако его существование экспериментально не подтверждено.
Температура начала восстановления оксида хрома углеродом до карбида равна ИЗО °C, а до элементарного хрома 1240 °C, поэтому при восстановлении оксида хрома углеродом невозможно избежать науглероживания сплава вследствие образования карбидов.
Карбид хрома Сг7С3 образуется чаще всего в конструкционных сталях с относительно невысоким содержание хрома (до 3-4 %). Этот карбид имеет сложную гексагональную решетку с 80 атомами на одну элементарную ячейку: 56 атомов металла и 24 атома углерода. Обычно такой карбид обозначают как (Сг, Fe)7C3 или Ме7С3.
Карбид Сг23С6 образуется в высоколегированных хромистых сталях при высоком содержании хрома (выше 5-8 %). Элементарная ячейка содержит 116 атомов: 92 атома металла и 24 атома углерода, выстроенных в сложную ГЦК решетку. В сталях данный карбид в чистом виде не встречается, а часть атомов металла замещается элементами, входящими в состав стали (Fe, Mo, W). В общем виде такой карбид в сталях принято обозначать формулой (Сг, Fe)23C6 или Ме23С6.
Карбид Сг7С2 - основная составляющая смеси карбидов (~96,4 %), образующихся при карбонизации смеси оксида хрома углеродом при высоких температурах в атмосфере водорода [6]; кристаллизуется в орторомбической системе.
Модель расчета стандартной энтальпии образования АуЯ°
С начала прошлого века предпринимались многочисленные попытки связать те или иные свойства веществ с зарядами ядер атомов. При этом были получены эмпирические уравнения для решения различных частных задач. Обычно в уравнение вводится «эффективный» заряд ядра -порядковый номер элемента с переменной, как правило, не обоснованной, произвольной поправкой. Так или иначе, все сводится к энергии (энтальпии) взаимодействия частиц. При этом не учитываются атомно-молекулярные связи, которые определяют пространственное расположение взаимодействующих частиц [7-9]. Именно они определяют кристаллические сингонии с характерными параметрами.
В работе [3] предложена математическая модель расчета энтальпии образования кристаллических оксидов, адекватность которой подтверждается экспериментальными (справочными) данными стехиометрических и нестехиометрических оксидов титана (22 оксида), созданы предпосылки для расчетов k^H других оксидов, нитридов, карбидов и иных бинарных соединений d-элементов.
Согласно предложенной модели энтальпия образования Ау/7(Л5Л) выражается как удельная величина h (удельная энтальпия)
Коэффициент Zz равен сумме ядерных зарядов (порядковых номеров элементов) с учетом стехиометрического состава оксида:
£z = z(?i) + xz(S). (2) h - эффективная величина, так как принимается, что на каждый ядерный заряд приходится одинаковая доля энтальпии.
Зависимость h от состава можно отобразить линейным уравнением
Ъ = а+Кх, (3) где К - объемная структурная постоянная, включающая в себя линейные структурные постоянные и координационное число (кКч) кристаллообразующего вещества.
Все поле диаграммы «свойство-состав» разбивается на области твердых растворов, в каждой из которых выделяются кристаллообразующие (КО) компоненты. В первой ОТР кристаллообразующим всегда является металл (kjH =0 - по определению). В других ОТР в качестве КО может быть принят любой устойчивый оксид, для кото рого известны структура, состав, энтальпия образования, то есть h.
. Для любой системы зависимость h - х начинается с нуля (первая ОТР). Так как для каждой ОТР объемная структурная постоянная К имеет свое численное значение, определяемое сочетанием структурных констант веществ на границах ОТР, то координаты самих границ определяются совместным решением соответствующих уравнений (3) для областей. Во всех случаях kjH измеряется в кДжмоль*.
В ур. (3) К выражается в единицах удельной энтальпии h [кДж-моль"1]. Коэффициент а определяется для каждой ОТР экстраполяцией зависимости h —х на х = 0, либо аналитически.
Анализ зависимостей С~х-х и ДК~пх-х [10] показывает, что в системе Сг - С существует две ОТР, граница между которыми проходит через состав Сг5С2 (СгС0,4). Это соответствует переходу от кубических структур к более сложным (ГПУ и ромбической).
Для случая, когда свойство - это энтальпия образования, диаграмма так же должна содержать две ОТР с той же границей или близкой к ней. В табл. 1 приведены справочные значения [11-15] стандартных энтальпий образования для трех карбидов.
ОТР-1 (х = 0^0.4). КО - Сг
В этой ОТР по мере внедрения углерода происходит переход от структуры ОЦК (Сг) к струк-
Таблица 1
Зависимость энтальпии образования карбидов хрома СгС,от состава
=^оцк'^гпу "Ккч =(V2-1)-4л/(Г4 = 16,2338 .
По определению эта область начинается с х = О, следовательно, ур. (3) упрощается:
й = 16,2338х. (4)
Расчеты по ур. (4) приведены в табл. 1 и на
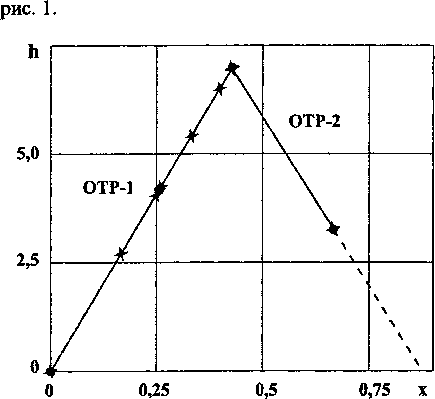
Рис. 1. Зависимость удельной энтальпии образования от состава карбидов хрома (• - эксперимент, х - расчет)
ОТР-2 (х = 0,4^0,66667). КО - Сг7С2
В этой области в качестве КО используем Сг7С3 как хорошо изученный. При переходе от структуры ГПУ ( кту = Зл/2 ) к ромбической ^кромб= ~^ объемная структурная постоянная второй области К2 = кгпу ■ крт,б ■ кКЧ =
г
= 3V2---6 = 15,5885 (координационное число
ККЧ~ 6).
Ур. (3) принимает вид:
h = a -15,5885 х.
Используя справочную величину Ду Я для соединения Сг3С2, располагающегося в ОТР-2 (h = 3,250±0,112), экстраполяцией на х = 0 определим значение коэффициента a = 13,6638.
Таким образом, для ОТР-2 ур. (3) окончательно примет следующий вид:
h = 13,6638-15,5885 х. (5)
Расчеты по ур. (5) также представлены в табл. 1 и на рис. 1.
Совместное решение ур. (4) и (5), позволяет определить границу между областями ОТР-1 и
ОТР-2: х = 0,4294. Граница областей смещена в сторону большего содержания углерода - от соединения Сг5С2 к Сг7С3; различие между реальным составом карбида (СгСо,42857) и расчетным (СгС014294) составляет 0,19 %. Средняя рассчитанная величина АуЯ(Сг7С3) = 185,208±0,342. Полученный результат согласуется со справочным, но доверительный интервал существенно сужен.
Модель расчета энтропии образования AyS0
В термодинамических расчетах большая роль отводится согласованию числовых значений величин. Одним из способов внутреннего (термические константы индивидуального вещества) и внешнего (термические константы различных веществ) согласований является использования свойств Р- потенциала.
Впервые понятие о Пи-потенциале Р и примеры использования его свойств было введено проф. А.Г. Рябухиным в 1977 г. [17]. По определению -это разность между стандартной энтропией образования и абсолютной энтропией вещества
P = kjS°-S°.
Отсюда стандартную энтропию образования можно выразить как
AyS°=P + S°. (6)
Для простых веществ ур. (6) переходит в Р=-8°.
В последующих работах [18, 19] автором были проанализированы его свойства.
-
1. Аддитивность (P-потенциал сложного вещества равен сумме P-потенциалов элементов с учетом стехиометрических коэффициентов)
-
2. P-потенциал процесса равен нулю.
-
3. P-потенциал не является функцией структуры, то есть не зависит от агрегатного состояния вещества.
Р(Р>4) = УР(Б) + ХР(Л) =
= -у8(В)-х5(Я). (7)
Использование ур. (6) для определения AyS позволяет согласовать величины АуЯ и AyG данного вещества. Так как наиболее точно известны энтропии простых веществ (особенно газов), а величина P-потенциала не зависит от агрегатного состояния, то это позволяет рассчитывать AyS с точностью экспериментальных данных 8. :
Таким образом, предложенная методика может использоваться для согласования термических постоянных простых и сложных веществ независимо от их агрегатного состояния.
Результаты расчетов Пи-потенциалов карбидов хрома и их AyS приведены в табл. 2.
|
№ |
Вещество |
AyG°, [12,13] |
-Р, УР-(7) |
S, [10] |
AyS° УР-(6) |
-kjH°, табл. 1 |
AzG |
AyG°, УР-(8) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
1 |
С |
5,740 |
5,740+0,126 |
0 |
0 |
0 |
0 |
|
|
2 |
Сг |
23,603 |
23,603+0,209 |
0 |
0 |
0 |
0 |
|
|
3 |
Сг4С СгС0,25 |
100,152 |
105,426 |
5,274 |
103,491 |
4,1201 |
-105,063 |
|
|
4 |
Сг23С6 СгСо,26О87 |
-119,441 |
577,309 |
609,891+2,924 |
32,582 |
108,266 |
4,6114 |
-117,891 |
|
5 |
СГ5С2 СгСо,4 |
129,495 |
144,72+1,255 |
15,225 |
171,429 |
6,6654 |
-175,966 |
|
|
6 |
СГ7СЗ СгСо, 42857 ' |
-189,501 |
182,441 |
202,097 |
19,656 |
185,550 |
7,2035 |
-191,408 |
|
7 |
СГ3С2 CrC0j66667 |
-87,585 |
82,289 |
84,945+0,412 |
2,656 |
91,600 |
3,3000 |
-92,391 |
|
8 |
Сг6С СгСо, 16667 |
147,358 |
151,585 |
4,227 |
67,642 |
2,7561 |
-68,902 |
|
|
9 |
Сг3С СгС0;ззззз |
76,549 |
83,151 |
6,602 |
140,691 |
5,4869 |
-42,658 |
|
|
10 |
СгС |
29,343 |
37,463 |
8,12 |
-57,741 |
-1,8440 |
+55,321 |
Модель расчета стандартной энергии Гиббса образования A/G®
Энергия Гиббса (свободная энергая) AG является одной из важнейших термодинамических характеристик. Особая роль ей отводится в химической термодинамике, так как величина и знак AG позволяют судить о состоянии системы - о ее положении относительно равновесия. Изменение интенсивных параметров системы позволяет управлять химическими процессами.
Созданные математические модели расчета S, \jH позволяют определить A jG веществ, а Ср- температурные зависимости этих термодинамических характеристик.
В физической химии часто используется соотношение
AGr = А/7 - 7* AS. ■
Применительно к стандартным условиям образования сложного вещества:
A/?0 = AfH° - TQ AyS°. (8)
По этому уравнению с использованием полученных S и А ^Н рассчитаны A yG карбидов хрома, приведенные в табл. 2.
Совершенно естественно, что удельная энер-AyG гия Гиббса g = —-—, как и удельная энтальпия Sz
-
h, образует две ОТР в функции состава х. Так как h(x), AS"1^) внутри ОТР являются линейными
функциями состава, следовательно, и зависимость g(x) должна иметь аналогичный характер. В табл. 2 даны величины удельной энергии Гиббса g, а на рис. 2 представлена ее зависимость от состава g - х.
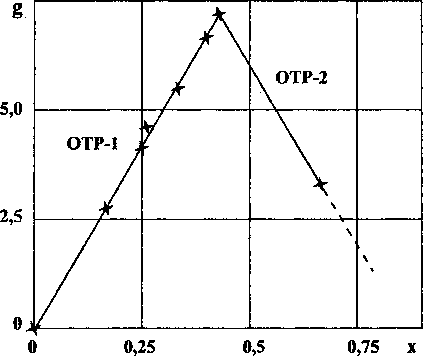
Рис. 2. Зависимость удельной энергии Гиббса от состава карбидов хрома (СгОх)
Расчетные точки ложатся на соответствующие пересекающиеся прямые. Однако в зависимости h-x во второй ОТР объемная структурная постоянная К имеет физическое обоснование. К как геометрическая величина не является функцией температуры. В зависимости g-x тангенс угла наклона, являясь комбинацией Ка(А-х) и
KsTyESinl -xj , фактически представляет собой полуэмпирический коэффициент, так как включает температуру. Таким образом, для каждой температуры необходимо рассчитывать Kh - KST.
С другой стороны, если известно, что вещество, для которого имеется зависимость AyG, расположено в ОТР-1, то могут быть рассчитаны AyG для любых веществ, лежащих по составу в этой области. Важным следствием является линейная зависимость удельной энергии Гиббса от состава.
Выводы
-
1. Разработаны математические модели расчетов стандартной энтальпии образования и стандартной энергии Гиббса образования для бинарных кристаллических соединений металлов с компонентами, являющимися кристаллическими в стандартных условиях (С, В, Si, Р, S, Ge, As, Sb, Bi и др.).
-
2. Адекватность модели справочным данным подтверждена расчетами энтальпии и свободной энергии Гиббса карбидов хрома.
-
3. Математические уравнения модели позволяют рассчитать стандартные величины энтальпии, энтропии и энергии Гиббса образования соединений произвольного состава
-
4. Модель обладает предсказательностью. С помощью модели доказана невозможность образования карбида хрома СгС при стандартных условиях, так как расчетное значение AyG (СгС) = +55,321 кДж моль-1 - величина положительная.
Список литературы Расчеты стандартных энтальпий и энергий Гиббса образования карбидов хрома произвольного состава
- Рябухин А.Г., Стенников М.А. Теплоемкость кристаллических оксидов. Монография. -Челябинск: Изд. ЮУрГУ, 2004. -84 с.
- Рябухин А.Г., Груба О.Н. Сравнительный анализ приближенных методов расчета абсолютной энтропии на примере оксидов d-элементов IV периода//Изв. ЧНЦ УрО РАН. -2005. -Вып. 4(30). -С. 41-45.
- Рябухин А.Г. Математическая модель расчета энтальпии образования оксидов//Изв. ЧНЦ УрО РАН. -2005. -Вып. 4(30). -С. 31-35.
- Рябухин А.Г., Груба О.Н. Расчет стандартной энтальпии кристаллических оксидов хрома.//Изв. ЧНЦ УрО РАН (в печати).
- Хансен М., Андерко К. Структура двойных сплавов. -М.: Металлургиздат, 1962. -217 с.
- Григорьева В.В., Клименко В.Н. Свойства карбидов хрома и металлокерамических сплавов на их основе. Исследования жаропрочных сплавов. -T. IV. -М.: Изд. АН СССР, 1959. -С. 79-82.
- Ватолин H.A., Моисеев Г.К., Трусов Б.Г. Термодинамическое моделирование в высокотемпературных неорганических системах. -М.: Металлургия, 1994. -352 с.
- Моисеев Г.К., Ватолин H.A. О возможности согласования стандартных энтальпий образования (СЭО) родственных, бинарных и квазибинарных неорганических систем.//Доклады РАН, 1999.-Т.2.; 367/2. -С. 208-214.
- Моисеев Г.К., Ивановский А.Л. Стандартные энтальпии образования родственных соединений в системах металл -бор//Изв. ЧНЦ УрО РАН. -2005. -Вып. 3(29). -С. 5-9.
- Груба О.Н, Рябухин А.Г. Стандартные теплоемкости и энтропии карбидов хрома переменного состава/I Вестник ЮУрГУ. Серия «Металлургия». -2005. -Вып. 6. -№ 10(50). -С. 3-8.
- Химическая энциклопедия в 5 т.-М.: БРЭ, 1998. -Т.5. -783 с.
- Термические константы веществ: Справочник в 10 вып./Под ред. В.П. Глушко. -М.: АН СССР. ВИНИТИ, 1967-1977.
- Плинер Ю.Л., Игнатенко Г. Ф., Лаппо СИ. Металлургия хрома. -М.: Металлургия, 1965. -183 с.
- Уикс К.Е., Блок Ф.Е. Термодинамические свойства 65 элементов, их окислов, галогенидов, карбидов и нитридов/Пер. с англ. -М.: Металлургия, 1965. -240 с.
- Киреев В.А. Методы практических расчетов в термодинамике химических реакций. -М.: Химия, 1970. -519 с.
- Латимер В.М. Окислительные состояния элементов и их потенциалы в водных растворах. Пер. с англ./Под ред. проф. К.В. Астахова. -М.: Изд-во иностр. лит., 1954. -400 с.
- Рябухин А.Г. Стандартная энтропия электрона в водном растворе.//ЖФХ. -1977. -T. П. -№4.-С. 968-969.
- Рябухин А.Г. Р-потенциал.//Изв. ЧНЦ УрО РАН. -1999. -Вып. 3. -С. 23-25.
- Рябухин А.Г. Способ согласования термических свойств веществ.//Изв. ЧНЦ УрО РАН. -2000.-Вып. 2.-С. 29-31.


