Расчёт пространственных распределений поглощённой энергии ионизирующего излучения в биологической ткани для протяжённых биоструктур при внутреннем облучении альфа-частицами, электронами и фотонами с различными энергиями: унифицированный подход для применения в ядерной медицине
Автор: Степаненко В.Ф., Богачева В.В., Дорохов А.В., Петухов А.Д., Кучеров В.В., Крылов В.В., Петросян А.П., Кочетова Т.Ю., Шуринов А.Ю., Иванов С.А., Шегай П.В., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 1 т.34, 2025 года.
Бесплатный доступ
Цель исследования - разработать унифицированный подход для расчётов пространственных распределений поглощённой энергии ионизирующего излучения в пределах и вне биоструктур различной формы и размеров при внутреннем облучении альфа-частицами, электронами и фотонами разных энергий с целью упрощения процедур и сокращения объёма расчётов для дозиметрического обеспечения гарантий качества применения радиофармпрепаратов в ядерной медицине. В исследовании использованы базы данных ФГБУ «НМИЦ радиологии», содержащие информацию о пространственных распределениях в биологической ткани поглощённой энергии, излучаемой точечными изотропными источниками корпускулярного и фотонного излучения. Получены численные данные, характеризующие величины поглощённых долей энергии ионизирующего излучения в пределах и вне объёмов биологических структур, моделируемых сферами и слоями различных размеров при внутреннем облучении альфа-частицами, электронами и фотонами в диапазонах энергий 0,01-10; 0,0005-10 и 0,015-4,0 МэВ соответственно, что охватывает энергетические спектры практически всех радионуклидов, используемых в ядерной медицине. Установлено, что числовые последовательности расчётных значений поглощённых долей энергии (Ф), выраженные в виде зависимостей Ф от отношений размеров биологических структур или расстояний вокруг них к, так называемым, «радиусам 99% поглощения энергии вокруг точечных источников», приобретают унифицированный вид, применимый к биоструктурам различных размеров и форм при внутреннем облучении как корпускулярным, так и фотонным излучением различной энергии. Предложенный подход является универсальным инструментом для расчётов поглощённых доз в пределах и вне объёмов органов и опухолевых образований, на уровне их микроструктур, а также на клеточном и субклеточном уровнях при внутреннем облучении альфа-частицами, электронами и фотонами различных энергий. Данный подход сокращает объём требуемых расчётов и упрощает процедуры, необходимые для дозиметрического сопровождения доклинических/клинических испытаний и применения радиофармпрепаратов в ядерной медицине.
Дозиметрия, внутреннее облучение, радионуклиды, радиофармпрепараты, ядерная медицина, радиобиология, радиология, альфа-частицы, электроны, фотоны, дозовые функции, поглощённая доза, поглощённые доли энергии
Короткий адрес: https://sciup.org/170209555
IDR: 170209555 | УДК: 539.122:504.055 | DOI: 10.21870/0131-3878-2025-34-1-82-94
Текст научной статьи Расчёт пространственных распределений поглощённой энергии ионизирующего излучения в биологической ткани для протяжённых биоструктур при внутреннем облучении альфа-частицами, электронами и фотонами с различными энергиями: унифицированный подход для применения в ядерной медицине
Одним из важнейших элементов радиотерапии является планирование и верификация поглощённых доз ионизирующего излучения в очагах (опухолевых образованиях), а также в окружающих опухоль нормальных органах/тканях (органах риска). Дозиметрическое планирование необходимо для обеспечения как эффективности методов радиотерапии, так и их безопасности.
Степаненко В.Ф.* – зав. лаб., д.б.н., проф.; Богачева В.В .– в.н.с., к.б.н.; Дорохов А.В. – инж.-иссл.; Петухов А.Д. – с.н.с., к.б.н.; Кучеров В.В. – зав. отд., к.м.н.; Крылов В.В. – зав. отд., д.м.н.; Петросян А.П. – врач, к.м.н.; Кочетова Т.Ю. – врач-радиолог; Шуринов А.Ю. – с.н.с., к.м.н.; Иванов С.А. – директор, чл.-корр. РАН, д.м.н., проф. кафедры РУДН. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Шегай П.В. – зам. ген. директора, к.м.н.; Каприн А.Д. – ген. директор, директор МНИОИ им. П.А. Герцена, зав. каф. РУДН, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
Этим вопросам уделяется большое внимание не только в соответствующих регулятивных документах международного уровня (ВОЗ, МКРЕИ [1-5]), но и в национальных руководствах РФ [6, 7].
Вместе с тем, применение радиофармпрепаратов (РФП) в ядерной медицине достаточно длительное время, начиная с первых попыток использования РФП, не сопровождалось соответствующим дозиметрическим обеспечением. Это было связано с тем, что методы дозиметрии внутреннего облучения организма человека существенно сложнее методов дозиметрии внешнего облучения и весьма затратны по времени, что усложняло их применение в клинической практике. В результате сложилась парадоксальная ситуация, когда принципы клинической радиобиологии, заключающиеся в том, что терапевтические эффекты и безопасность воздействия на человека ионизирующего излучения непосредственно зависят от поглощённой дозы этого излучения, измеряемого в единицах Гр, замещались в радионуклидной терапии (РНТ) на суррогатный подход, когда вместо поглощённых доз при планировании РНТ использовались так называемые «стандартные введённые активности РФП», измеряемые в единицах МБк. Однако, введение «стандартных активностей РФП» совершенно не означает, что поглощённая доза (в Гр) в очаге или органе риска будет определяться только введённой активностью РФП (в МБк) [8, 9]. Величина поглощённой дозы внутреннего облучения (в Гр) в очаге или органе риска при одной и той же введённой активности РФП существенно зависит также от объёма биологической структуры, в которую поступил РФП, и от динамики его накопления и выведения [8-10].
В последние годы, как это следует из Публикации Европейской ассоциации ядерной медицины [8], Публикации МАГАТЭ 2024 г. [9], Публикации 140 Международной комиссии по радиологической защите [11], Доклада 96 Международной комиссии по радиационным единицам и измерениям [12], подходы к обеспечению эффективности и безопасности РНТ существенно изменились – происходит смена парадигмы в этой области: от введения пациентам эмпирически установленных активностей РФП к индивидуальному дозиметрическому планированию, основанному на оценках доз внутреннего облучения опухолевых образований и органов риска пациентов.
Общий подход к расчётам поглощённых доз внутреннего облучения при использовании РФП в ядерной медицине был рекомендован Медицинским комитетом по дозам внутреннего облучения (Medical Internal Radiation Dose Committee или MIRD) [13]. В соответствии с подходом MIRD, одним из важнейших параметров, используемых при расчётах распределений поглощённых доз внутреннего облучения радионуклидами, является величина «поглощённой доли энергии» (Ф). Величина Ф представляет собой отношение энергии ионизирующего излучения, поглощённой некоторой биоструктурой «мишенью», к энергии, излучаемой некоторой биоструктурой «источником», в объёме которой распределён излучающий радионуклид. Рассматриваются две типичные ситуации внутреннего облучения: а) «самооблучение», когда биоструктуры «источник» и «мишень» совпадают и б) – «взаимное облучение», когда «источник» и «мишень» не совпадают. Как правило, расчёт величин Ф для биоструктур различных размеров и форм, представляемых с помощью соответствующих геометрических моделей, выполняется методами стохастического моделирования взаимодействия с веществом ионизирующего излучения различного вида и разной энергии, что требует значительных объёмов вычислений и больших затрат времени. Как правило, они публикуются в виде соответствующих обширных справочных материалов (см., например, [14]), т.к. в большинстве случаев оперативный расчёт величин Ф весьма затруднён из-за большого объёма необходимых вычислений. В связи с рекомендациями международных организаций [9, 11, 12] о необходимости дозиметрического планирования РНТ в клинической практике с целью обеспечения дозиметрических гарантий безопасности и эффективности РНТ, возрастает актуальность разработок методов дозиметрических расчётов поглощённых доз внутреннего облучения, позволяющих, при сохранении валидности дозиметрических оценок, упростить процедуры и сократить объёмы необходимых вычислений. Унификация и упрощение процедур дозиметрии внутреннего облучения является ключевыми позициями для внедрения в клиническую практику методов дозиметрического обоснования/обеспечения применения РФП с терапевтическими и диагностическими целями [8, 9, 12].
Материалы и методы
Использованы программные средства и базы данных ФГБУ «НМИЦ радиологии» Минздрава России, имеющие государственную регистрацию [15-18]. Расчёт пространственных распределений поглощённых долей Ф для альфа-частиц, электронов и фотонов различной энергии внутри и вне биоструктур в виде сфер и слоёв разных размеров проведён путём аналитического интегрирования изоэнергетических функций точечных изотропных источников ионизирующего излучения (см. рис. 1 со схематической иллюстрацией точечного изотропного источника) по объёмам протяжённых биоструктур с равномерно распределёнными в них точечными источниками в пределах окружающих эти объёмы конгруэнтных поверхностей в биологической ткани (рис. 2 и 3).
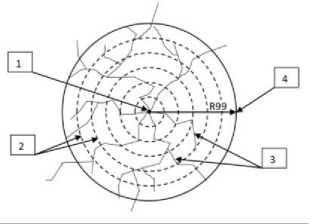
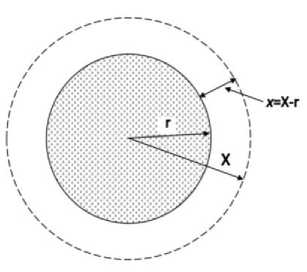
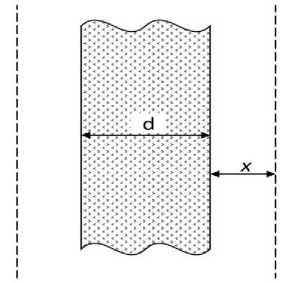
Рис. 3. Биоструктура, моделируемая объёмом в идее слоя в виде слоя, с равномерно распределёнными в объёме точечными источниками, и окружающая биоструктуру конгруэнтная изоэнергетическая поверхность в биологической ткани. d – толщина биоструктуры в виде слоя с равномерно распределёнными в её объёме точечными источниками ионизирующего излучения; x –толщина слоя биологической ткани, прилегающего к излучающей биоструктуре.
Рис. 1. Схематическая иллюстрация размена и поглощения энергии ионизирующего излучения в объёмах биологической ткани, заключённых в пределах сферических изоэнергетических поверхностей, окружающих расположенный в их центре точечный изотропный источник излучения; 1 – точечный изотропный источник ионизирующего излучения; 2 – объёмы биологической ткани, заключённые в пределах изо-энергетических поверхностей различных радиусов (пунктирные линии);
-
3 – схематические изображения траекторий размена и поглощения излучения точечного изотропного источника;
-
4 – изоэнергетическая поверхность (сплошная линия) с радиусом R99, в пределах которой поглощается 99% энергии, излучаемой точечным изо-
Рис. 2. Биоструктура, моделируемая сферическим объёмом, с равномерно распределенными в объёме точечными источниками ионизирующего излучения и окружающая биоструктуру конгруэнтная изоэнергетическая поверхность. r – радиус сферической биоструктуры с равномерно распределенными в её объёме точечными источниками ионизирующего излучения; X – радиальное расстояние от центра излучающей сферической биоструктуры до окружающей её изоэнергетиче-ской поверхности; x=X-r – толщина сферического слоя биологической ткани, окружающего излучающую биоструктуру.
тропным источником.
Плотность и состав биологической ткани соответствует данным, приведённым в Публикации 89 МКРЗ [19]. Нелинейная аппроксимация результатов расчётов аналитическими функциями выполнена с использованием программы Microcal Origin 6.1.
Результаты и обсуждение
Величины поглощённых долей энергии при внутреннем облученииальфа-частицами
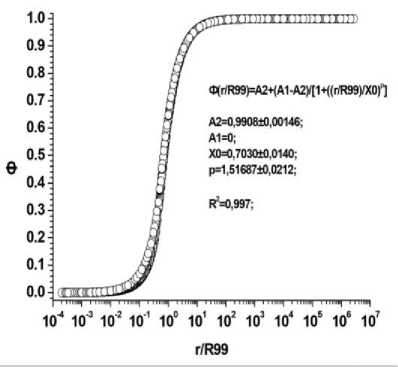
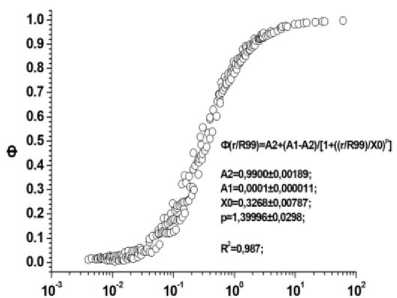
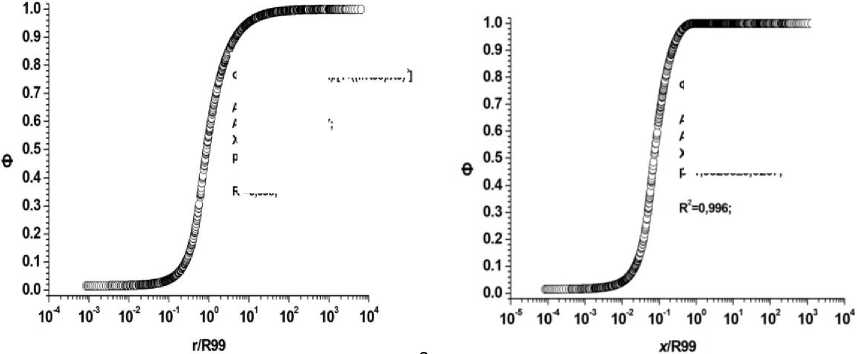
На рис. 4 в графическом виде показаны результаты расчётов поглощённых в биологической ткани долей энергии (Ф) при внутреннем облучении альфа-частицами различных энергий, излучаемыми источниками, представляющими скими объёмами разных радиусов.
собой биоструктуры,
моделируемые сфериче-
O(x/R99)=A2+(A1 •A2)/[1+((x/R99,J/X0)p]
<4r/R99)^+(A1-«MWRWWl
A2=0,9999+0,00168;
A1 =0,0001 ±0,000007:
X0=0,9050+0,0176;
p=1,60458+0.0241;
^=0,998;
42=1,0000+0,00132;
A1=0,0001 ±0,000008;
X0=0,075010,00128;
0=1,9828610,0267;
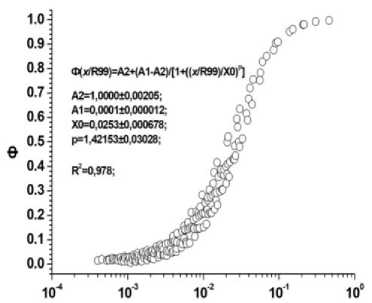
б Рис. 4. Результаты расчётов величин Ф для биоструктур, моделируемых сферическими объёмами, и излучающими альфа-частицы в диапазоне энергий 0,01-10 МэВ. По оси ординат: а) Ф – отношения величин энергий, поглощённых внутри объёмов сфер различных радиусов (r), к энергиям, излучённым этими же источниками («самооблучение»); б) Ф – отношения величин энергий, поглощённых внутри окружающих источники слоёв биологической ткани с различной толщиной (x), к энергиям, излучённым источниками. По оси абсцисс: а) r/R99 – отношения радиусов (r) сфер, содержащих равномерно распределённые в объёмах точечные источники с разными энергиями, к соответствующим этим энергиям величинам R99; б) x/R99 – отношения толщины (x) сферических слоёв-«мишеней», окружающих сферы-источники равномерно распределёнными в объёмах точечными источниками с разными энергиями, к соответствующим этим энергиям величинам R99.
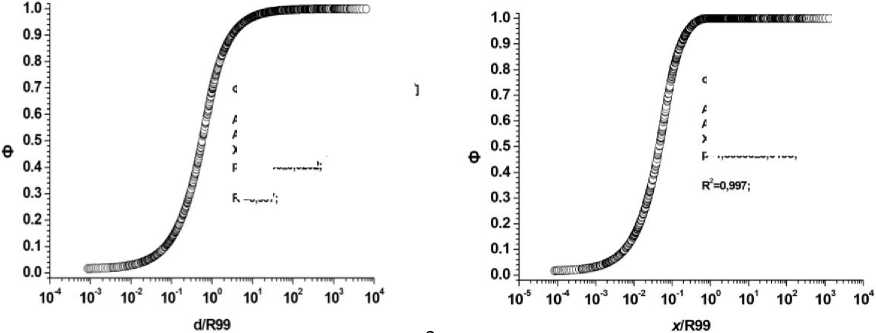
®( A2=0,990010,00143; A1=0: X0=0,4400+0.00796: p=1,3999610,0202; ^=0,997: A2=0,9999+0,00145; A1=0,0001 ±0.000004; X0=0,0440±0,000811; p=1,39600+0,0195; б
Рис. 5.
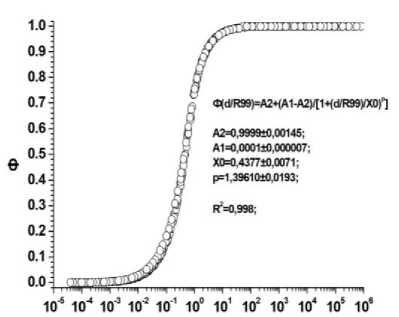
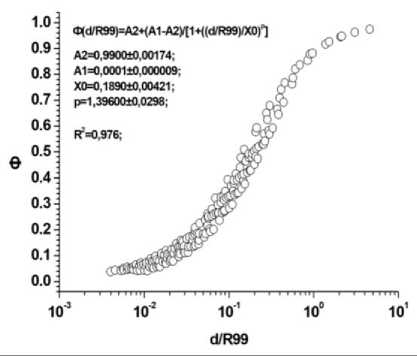
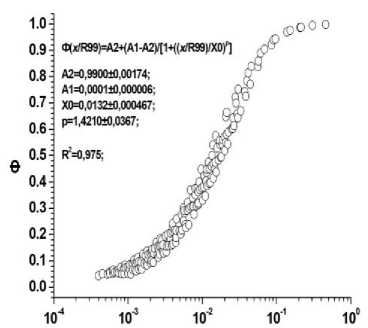
Результаты расчётов величин Ф для источников в виде слоёв из биологической ткани, излучающих альфа-частицы разных энергий. Диапазон энергий альфа-частиц: 0,01-10 МэВ. По оси ординат: а) Ф – отношения величин энергий, поглощённых внутри объёмов слоёв различной толщины (d), к энергиям, излучённым этими же источниками («самооблучение»); б) Ф – отношения величин энергий, поглощённых внутри прилегающих к источникам слоёв биологической ткани с различной толщиной (x), к энергиям, излучённым источниками. По оси абсцисс: а) d/R99 – отношения толщины (d) слоёв, содержащих равномерно распределённые в объёмах точечные излучатели альфа-частиц с разными энергиями, к соответствующим этим энергиям величинам R99; б) x/R99 – отношения толщины (x) слоёв биологической ткани, прилегающих к слоям, излучающим альфа-частицы различных энергий, к соответствующим этим энергиям величинам R99.
На рис. 5 показаны результаты расчётов поглощённых в биологической ткани долей энергии (Ф) при внутреннем облучении альфа-частицами различных энергий, излучаемыми источниками, представляющими собой биоструктуры, моделируемые слоями разной толщины. Величины поглощённых долей энергии при внутреннем облучении электронами На рис. 6 показаны результаты расчётов поглощённых в биологической ткани долей энергии (Ф) при внутреннем облучении электронами различных энергий, излучаемыми источниками, представляющими собой биоструктуры, моделируемые сферическими объёмами разных радиусов.
Рис. 6.
Результаты расчётов величин Ф для источников в виде сфер из биологической ткани, излучающих электроны различных энергий. Диапазон энергий электронов: 0,0005-10 МэВ. По оси ординат: а) Ф – отношения величин энергий, поглощённых внутри объёмов сфер различных радиусов (r), к энергиям, излучённым этими же источниками («самооблучение»); б) Ф – отношения величин энергий, поглощённых внутри окружающих источники слоёв биологической ткани с различной толщиной (x), к энергиям, излучённым источниками. По оси абсцисс: а) r/R99 – отношения радиусов (r) сфер, содержащих равномерно распределённые в объёмах точечные излучатели электронов с разными энергиями, к соответствующим этим энергиям величинам R99; б) x/R99 – отношения толщины (x) сферических слоёв, окружающих сферы, излучающие электроны различных энергий, к соответствующим этим энергиям величинам R99.
qxiRWu+iAHawi+iWROwn A2=0,9958+0.00158: AM; XO=O, 0500+0,0011; H ,7695310,00216; (^=0,997; б d/R99
Рис. 7.
Результаты расчётов величин Ф для источников в виде слоёв из биологической ткани, излучающих электроны разных энергий. Диапазон энергий электронов: 0,0005-10 МэВ. По оси ординат: а) Ф – отношения величин энергий, поглощённых внутри слоёв различной толщины (d), к энергиям, излучённым этими же источниками («самооблучение»); б) Ф – отношения величин энергий, поглощённых внутри прилегающих к источникам слоёв биологической ткани с различной толщиной (x), к энергиям, излучённым источниками. По оси абсцисс: а) d/R99 – отношения толщины (d) слоёв, содержащих равномерно распределённые в объёмах точечные излучатели электронов с разными энергиями, к соответствующим этим энергиям величинам R99; б) x/R99 – отношения толщины (x) слоёв биологической ткани, прилегающих к слоям, излучающим электроны различных энергий, к соответствующим этим энергиям величинам R99.
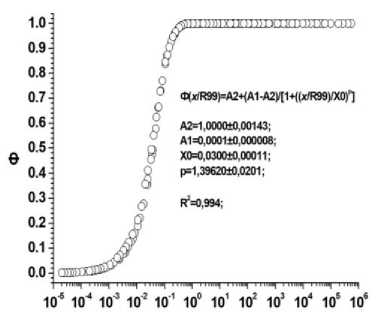
X/R99 а б На рис. 7 показаны результаты расчётов поглощённых в биологической ткани долей энергии (Ф) при внутреннем облучении электронами различных энергий, излучаемыми источниками, представляющими собой биоструктуры, моделируемые слоями разной толщины. Величины поглощённых долей энергии при внутреннем облучении фотонами На рис. 8 показаны результаты расчётов поглощённых в биологической ткани долей энергии (Ф) при внутреннем облучении фотонами различных энергий, излучаемыми источниками, представляющими собой биоструктуры, моделируемые сферическими объёмами разных радиусов. r/R99 X/R99 а б
Рис. 9.
Результаты расчётов величин Ф для источников в виде слоёв из биологической ткани, излучающих фотоны разных энергий. Диапазон энергий фотонов: 0,0015-4 МэВ. По оси ординат: а) Ф – отношения величин энергий, поглощённых внутри слоёв различной толщины (d), к энергиям, излучённым этими же источниками («самооблучение»); б) Ф – отношения величин энергий, поглощённых внутри прилегающих к источникам слоёв биологической ткани с различной толщиной (x), к энергиям, излучённым источниками. По оси абсцисс: а) d/R99 – отношения толщины (d) слоёв, содержащих равномерно распределённые в объёмах точечные излучатели фотонов с разными энергиями, к соответствующим этим энергиям величинам R99;
б) x/R99 – отношения толщины (x) слоёв биологической ткани, прилегающих к слоям, излучающим фотоны различных энергий, к соответствующим этим энергиям величинам R99. Рис. 8. Результаты расчётов величин Ф для источников в виде сферических объёмов из биологической ткани, излучающих фотоны разных энергий. Диапазон энергий фотонов: 0,015-4 МэВ. По оси ординат: а) Ф – отношения величин энергий, поглощённых внутри сферических источников различных радиусов (r), к энергиям, излучёнными этими же источниками («самооблучение»); б) Ф – отношения величин энергий, поглощённых внутри прилегающих к источникам сферических слоёв биологической ткани с различной толщиной (x), к энергиям, излучённым источниками. По оси абсцисс: а) r/R99 – отношения радиусов (r) сфер, содержащих равномерно распределённые в их объёмах точечные излучатели фотонов с разными энергиями, к соответствующим этим энергиям величинам R99; б) x/R99 – отношения толщины (x) сферических слоёв биологической ткани, прилегающей к источникам, излучающим фотоны различных энергий, к соответствующим этим энергиям величинам R99. а На рис. 9 показаны результаты расчётов поглощённых в биологической ткани долей энергии (Ф) при внутреннем облучении фотонами различных энергий, излучаемыми источниками, представляющими собой биоструктуры, моделируемые слоями разной толщины. В представленном на рис. 5-9 виде (нормировка радиусов сфер-источников (r), толщина слоёв-источников (d) или толщина слоёв-мишеней (x) на величины радиусов 99% поглощения энергии R99) зависимости величин поглощённых долей Ф от r/R99, d/R99 или x/R99 имеют унифицированный сигмоидальный вид и применимы для различных энергий альфа-частиц, электронов, фотонов и размеров биологических структур, моделируемых сферическими объёмами или слоями биологической ткани. Аналитические функции, аппроксимирующие зависимости Ф от d/R99 или x/R99, а также значения их параметров, приведены на полях рисунков. Величины R99 для электронов и фотонов c энергиями в диапазонах 0,0005-10 МэВ и 0,015-4 МэВ соответственно опубликованы нами ранее [20]. В табл. 1 приведены величины R99 для альфа-частиц с энергиями в диапазоне 0,01-10 МэВ. Расчёты выполнены с использованием данных, представленных в [21]. Таблица 1 Энергии альфа-частиц (E) и соответствующие им значения величин R99 в биологической ткани*
E, МэВ
0,010
0,025
0,050
0,080
0,15
0,30
R99, см
1,57x10
-5
3,53x10
-5
6,11x10
-5
8,62x10
-5
1,33x10
-4
2,11 x10
-4
E, МэВ
0,60
0,90
2,0
4,0
7,0
10
R99, см
3,43x10
-4
4,73x10
-4
1,06x10
-3
2,7x10
-3
6,4x10
-3
1,16x10
-2
Примечание: * – Величины R99 для энергий, не совпадающих с энергиями, представленными в табл. 1, можно определять методом линейной интерполяции между двумя ближайшими значениями R99, соответствующими двум соседним энергиям. Сравнение результатов расчётов величин поглощённых долей энергии с имеющимися в доступной литературе данными Сравнение результатов расчётов величин поглощённых долей энергии (Ф), полученных с помощью разработанного унифицированного подхода, с имеющимися в доступной литературе [22-24] величинами Ф, рассчитанными методом Монте-Карло, для биоструктур, излучающих моноэнер-гетические альфа-частицы, электроны и фотоны, показывает, что отношения рассчитанных нами значений (Фрасч) к соответствующим величинам, полученным на основе данных литературы (Флит) составляют:
-
Фрасч/Флит=1,08
±
0,11 для альфа-частиц (энергии - 5,304 МэВ, 6,05 МэВ, 8,75 МэВ, что соответствует энергиям альфа-частиц, излучаемых
210
Po,
212
Bi и
212
Po, радиусы сфер-источников – от 1 до 10 мкм, n=30);
-
Фрасч/Флит=1,06
±
0,09 для электронов (диапазон энергий - 0,1-4 МэВ, радиусы сфер -от 0,134 до 0,985 см, n=42);
-
Фрасч/Флит=1,12
±
0,21для фотонов (диапазон энергий - 0,015-2,75 МэВ, радиусы сфер – от 0,62 до 11,272 см, n=66).
В литературе [22-24] представлены результаты расчётов так называемых S-факторов, выраженных в Гр/(Бк
x
с). Величины S-факторов были пересчитаны в соответствующие величины поглощённых долей энергии Ф и сопоставлены с нашими данными – значениями Ф для соответствующих энергий излучения и сферических биоструктур с этими же радиусами.
Следует особо отметить, что величины поглощённых долей энергии (Ф) для альфа-частиц, рассчитанные с помощью разработанного подхода, были сравнены с имеющимися в доступной литературе немногочисленными данными, характеризующими поглощение энергии альфа-излучения в биологических микроструктурах сферической формы с радиусами, соответствующими объёмам клеток и ядер клеток. То, что при такого рода расчётах рассматриваются биоструктуры именно микрометрических размеров, обусловлено коротким пробегом альфа-частиц (от десятых долей до десятков микрометров - в диапазоне энергий альфа-излучения от 10 кэВ до 10 МэВ).
Следует также отметить, что при моделировании объёмов биологических структур эллипсоидами с объёмами V и площадями поверхностей S возможно использование сферической геометрии с эффективным радиусом сферы r=3
x
V/S [20].
Как было отмечено выше, сравнение проведено только для биоструктур, моделируемых сферическими объёмами. Результаты сравнения рассчитанных нами величин Ф для биоструктур, моделируемых слоями различной толщины, включая сравнение данных о распределениях поглощённой энергии вне протяжённых источников, не представлены из-за отсутствия соответствующих данных в доступной литературе. Заключение Получены численные данные, характеризующие пространственные распределения поглощённых долей энергии корпускулярного и фотонного излучения разной энергии в пределах и вне объёмов протяжённых биологических структур, моделируемых сферами и слоями различных размеров. Расчёты проведены для энергий альфа-частиц, электронов и фотонов в диапазонах 0,01-10 МэВ, 0,0005-10 МэВ и 0,015-4,0 МэВ соответственно, что охватывает энергетические спектры практически всех радионуклидов, используемых в ядерной медицине. Установлено, что числовые последовательности расчётных значений поглощённых долей энергии (Ф), выраженные в виде зависимостей Ф от отношений размеров биологических структур или расстояний вокруг них к так называемым «радиусам 99% поглощения энергии вокруг точечных источников», приобретают унифицированный вид, применимый к биоструктурам различных размеров и форм при внутреннем облучении как корпускулярным, так и фотонным излучением различной энергии. Предложенный подход является универсальным инструментом для расчётов поглощённых доз в пределах и вне объёмов органов и опухолевых образований, на уровне их микроструктур, а также на клеточном и субклеточном уровнях при внутреннем облучении альфа-частицами, электронами и фотонами различных энергий. Данный подход сокращает объём требуемых расчётов и упрощает процедуры, необходимые для дозиметрического сопровождения доклинических/клинических испытаний и применения радиофармпрепаратов в ядерной медицине.