Расчётно-экспериментальная оценка поглощённой дозы при фотонзахватной терапии с наночастицами золота на лабораторных животных с опухолевыми моделями
Автор: Финогенова Ю.А., Скрибицкий В.А., Липенгольц А.А., Шпакова К.Е., Смирнова А.В., Касьянов А.А., Созаев И.В., Климентов С.М., Григорьева Е.Ю.
Рубрика: Научные статьи
Статья в выпуске: 1 т.34, 2025 года.
Бесплатный доступ
Фотон-захватная терапия (ФЗТ) - метод лучевой терапии, основанный на взаимодействии дозоповышающего агента с внешним рентгеновским излучением. Перспективным дозоповышающим агентом являются наночастицы золота. Цель работы - по данным компьютерной томографии лабораторных мышей с опухолевыми моделями определить максимальную концентрацию золота в опухолевой ткани, достигаемую после внутривенного введения наночастиц, и рассчитать соответствующий фактор повышения дозы (ФПД), а также исследовать концентрацию золота в здоровых тканях и оценить риск их повреждения при облучении. Использованы мыши с подкожными сингенными опухолями: меланома B16F10 (n=5); аденокарцинома Са755 (n=5); EMT6 (n=5); 4T1 (n=5). Лазерно-аблированные наночастицы золота с диаметром 8,3 нм вводили мышам внутривенно в дозировке 1000 мг Au/кг веса тела. Компьютерную томографию выполняли до введения наночастиц, затем сразу после инъекции и через 1, 4, 24, 48 ч, 5 сут. Используя линейную калибровочную зависимость, по увеличению рентгеноплотности ткани рассчитывали концентрацию золота в ней. Локальное увеличение поглощённой дозы оценивали, используя аналитическую зависимость ФПД от концентрации наночастиц золота для рентгеновских лучей с максимальной энергией 140 кВ. Для 4 исследованных опухолевых моделей определена максимальная концентрация золота в опухоли. Расчётный ФПД составлял от 1,3±0,2 для меланомы B16F10 до 1,6±0,2 для аденокарциномы 4Т1. В течение 48 ч также отмечалась высокая концентрация золота в крови (ФПД для стенки сердца от 1,5±0,2) и в ткани печени (ФПД от 1,4±0,1). Аденокарцинома 4Т1 является оптимальной опухолевой моделью для дальнейших исследований ФЗТ in vivo . Высокая концентрация золота в камерах сердца и в ткани печени ограничивают применение ФЗТ для опухолей лёгких, средостения и брюшной полости. Наиболее вероятно применение ФЗТ для лечения опухолей головного мозга и конечностей.
Наночастицы золота, лазерно-аблированные наночастицы, фактор повышения дозы, лучевая терапия, компьютерная томография, опухолевые модели, подкожные опухоли, сингенные опухоли, меланома, аденокарцинома, мыши, радиобиология
Короткий адрес: https://sciup.org/170209546
IDR: 170209546 | УДК: 539.163:546.59-092.9 | DOI: 10.21870/0131-3878-2025-34-1-115-127
Текст научной статьи Расчётно-экспериментальная оценка поглощённой дозы при фотонзахватной терапии с наночастицами золота на лабораторных животных с опухолевыми моделями
Фотон-захватная терапия (ФЗТ) – перспективный метод бинарной лучевой терапии, основанный на локальном увеличении поглощённой дозы от внешнего рентгеновского излучения в присутствии дозоповышающих агентов (ДПА) [1, 2]. В качестве ДПА при ФЗТ может выступать любой элемент с высоким зарядом ядра атома (Z>52). Препарат, содержащий ДПА, предварительно накапливается в опухолевой ткани и при проведении лучевой терапии взаимодействует с внешним рентгеновским излучением ортовольтного диапазона преимущественно по механизму фотоэффекта. При этом образуются электроны фотопоглощения и сопутствующего Оже-каскада, что приводит к
Финогенова Ю.А .* – науч. сотр.; Скрибицкий В.А. – м.н.с.; Липенгольц А.А. – в.н.c., к.ф.-м.н.; Шпакова К.Е. – лаб.-исследователь; Смирнова А.В. – с.н.с., к.б.н.; Григорьева Е.Ю. – зав. лаб., д.б.н. НМИЦ онкологии им. Н.Н. Блохина Минздрава России. Касьянов А.А. – аспирант; Созаев И.В. – инженер; Климентов С.М. – зам. директора, к.ф.-м.н. НИЯУ МИФИ.
поражению клеток опухоли вторичным короткопробежным излучением. Таким образом, распределение поглощённой дозы при ФЗТ определяется распределением ДПА в объёме опухоли.
Клинические испытания ФЗТ опухолей головного мозга начались в 1990-х гг. [3]. Долгое время в качестве препаратов для ФЗТ использовали рентгеноконтрастные средства, содержащие атомы йода (Z=53), однако результативность технологии оставалась умеренной. Новая эра ФЗТ открылась с разработкой и активным внедрением металлсодержащих наночастиц: было показано, что их применение в сочетании с внешним рентгеновским излучением обеспечивает высокую противоопухолевую эффективность [4]. Два препарата на основе наночастиц в настоящее время успешно проходят клинические испытания: гафний-содержащий NBTXR3 [5] и гадолинийсодержащий AGuiX [6].
ФЗТ с наночастицами золота (НЧЗ) в настоящее время находится на стадии исследований на лабораторных животных. Перспективность данного направления обусловлена высоким зарядом атомного ядра золота (Z=79). В многочисленных экспериментах in vivo НЧЗ продемонстрировали биосовместимость, низкую токсичность и способность усиливать торможение роста опухоли при лучевой терапии [7]. При этом НЧЗ удобны в экспериментальной работе: для них существуют технологичные методы синтеза, позволяющие получать частицы необходимого размера и формы. Поверхность НЧЗ можно модифицировать с помощью различных лигандов, в том числе для создания таргетных препаратов, тропных к опухолевым рецепторам или маркерам. Поэтому можно с уверенностью утверждать, что продолжение исследований in vivo откроет для НЧЗ перспективу трансляции в клиническую онкологию.
Для планирования облучения при исследованиях противоопухолевого действия ФЗТ на лабораторных животных необходимо учитывать данные о содержании ДПА в опухолевой ткани на момент облучения. Эту информацию можно получить с помощью компьютерной томографии (КТ), т.к. КТ и ФЗТ основаны на аналогичных физических принципах: более интенсивном поглощении рентгеновского излучения элементами с более высоким Z. Возможность количественного определения ДПА с помощью КТ обоснована тем, что зависимость увеличения рентгеноплотно-сти участка КТ-изображения от концентрации ДПА в нём носит линейный характер [8].
Количественное определение содержания ДПА позволяет прогнозировать терапевтическую эффективность ФЗТ с помощью расчётного параметра - фактора повышения дозы (ФПД). ФПД - это отношение значений поглощённой дозы в объекте в присутствии и в отсутствии ДПА для одних и тех же параметров внешнего облучения:
ФПД = ^ ДП^ (1)
Do где Эдпа(О) - поглощённая доза в мишени, содержащей C мг/мл ДПА; Do - поглощённая доза в такой же мишени, не содержащей ДПА, облучённой тем же рентгеновским пучком.
Целью данной работы была количественная оценка накопления НЧЗ в сингенных солидных опухолях мышей методом КТ с последующим расчётом ФПД в условиях однократного облучения рентгеновским пучком ортовольтного диапазона (140 кВ). Для оценки вероятности повреждения здоровых тканей так же были определены ФПД для сердца и сосудов, печени и селезёнки.
Материалы и методы
Наночастицы золота. НЧЗ были получены с помощью одностадийного метода фемтосекундной лазерной абляции в 1 мМ растворе NaCl. В процессе синтеза использовали лазер Yb (длина волны 1030 нм, длительность импульса 250 фс, энергия импульса 30 мкДж, частота следования импульсов 100 кГц). Полученные НЧЗ покрывали полимером mPEG-SH 2 кДа (Sigma
Aldrich) по оригинальной методике. Средний размер и концентрацию наночастиц определяли с помощью спектрофотометра Cary 50 (Varian, Австралия) по описанной ранее методике [9]. По данным спектрофотометрических измерений размер золотого ядра частиц составлял 8,3±0,6 нм, концентрация золота в коллоидном растворе – 110±15 мг/мл.
Метод количественного определения золота. Для построения калибровочной зависимости выполняли КТ-сканирование пробирок, содержащих коллоидные растворы НЧЗ с известной концентрацией в диапазоне от 1 до 25 мг/мл. С помощью программы pmod (Pmod Technologies Inc) определяли рентгеноплотность содержимого каждой пробирки (HU) и вычитали из неё рентгеноплотность чистой воды (HU). Зависимость повышения рентгеноплотности ΔHU от концентрации золота аппроксимировали прямой линией.
Мыши c опухолевой моделью. Все исследования проводили в соответствии с правовыми и этическими нормами работы с лабораторными животными и были согласованы с комиссией по биоэтике Научно-исследовательского института экспериментальной диагностики и терапии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России (протокол № 01c/p-2024).
Для создания опухолевой модели мышам подкожно в область голени правой задней лапы вводили приготовленную ex tempore суспензию опухолевых клеток 1:6 (m:V) в растворе Хэнкса в объёме 60 мкл. В исследовании использованы:
-
• мыши линии C57Bl6 с подкожной меланомой B16F10 (n=5);
-
• мыши линии C57Bl6 с подкожной аденокарциномой Са755 (n=5);
-
• мыши линии Balb/C с подкожной аденокарциномой EMT6 (n=5);
-
• мыши линии Balb/C с подкожной аденокарциномой 4T1 (n=5).
Масса всех мышей составляла от 20 до 22 г на момент введения препарата НЧЗ.
Компьютерная томография животных. Перед введением препарата НЧЗ проводили КТ всего тела мышей с помощью томографа VECTor6 (MiLabs, Нидерланды) в режиме Accurate. Используя программу pmod, определяли нативную рентгеноплотность сердца, печени, селезёнки, опухолевого узла и мускулатуры контралатеральной (здоровой) лапы. Затем мышам вводили внутривенно НЧЗ в дозировке 1000 мг Au/кг веса тела, что соответствует 20-22 мг Au на одно животное (в зависимости от веса мыши). Повторное КТ-сканирование проводили сразу после инъекции, затем через 1, 4, 24, 48 ч, 5 сут. На всех полученных томограммах определяли среднюю рентгеноплотность опухолевого узла. Для дальнейших количественных расчётов брали временную точку, на которую увеличение рентгеноплотности опухолевого узла было максимальным. На выбранной томограмме определяли рентгеноплотность камер сердца, мускулатуры здоровой лапы, печени, селезёнки, стромального и паренхиматозного компонента опухоли. Из полученных значений вычитали нативную рентгеноплотность соответствующих тканей, таким образом, получали данные о повышении рентгеноплотности за счёт НЧЗ.
Расчёт фактора повышения дозы. Используя уравнение калибровочной прямой и данные о повышении рентгеноплотности, вычисляли концентрацию золота в целевых тканях: крови (по камерам сердца), здоровой мускулатуре, печени, селезёнке, опухолевой строме и паренхиме, опухоли в целом. Для всех перечисленных тканей определяли расчётный ФПД, используя калибровочную прямую (формула (2)). Данная зависимость получена путём аппроксимации графических данных зависимости ФПД от концентрации золота для источника рентгеновского излучения 140 кВ, приведённых в статье [10].
ФПД = 0,126 [Ди] + 1,003 . (2)
Результаты
На первом этапе работы по данным фантомных исследований была построена калибровочная прямая, связывающая изменение рентгеноплотности ΔHU с концентрацией золота (рис. 1). Уравнение полученной прямой:
AHU = 46,361 [Au] + 9,886 . (3)
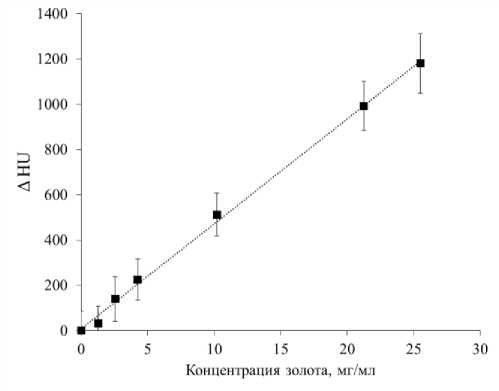
Рис. 1. Зависимость изменения рентгеноплотности (ΔHU) от концентрации золота.
В ходе исследований in vivo были проанализированы КТ-изображения 12 мышей с 4 различными опухолевыми моделями после внутривенного введения НЧЗ. Концентрация золота в крови, рассчитанная по изменению рентгеноплотности содержимого камер сердца, оценивалась как 12,1±1,8 мг/мл сразу после инъекции; впоследствии она постепенно снижалась (рис. 2). Расчётный ФПД для стенки сосудов составил 1,7±0,2 через 24 ч после инъекции и 1,5±0,2 через 48 ч (табл. 1). Через 5 сут рентгеноплотность камер сердца возвращалась к нативной, т.е. наночастицы выводились за пределы кровеносного русла (преимущественно за счёт перераспределения в пользу печени). Период полувыведения НЧЗ из кровотока был оценен как ~24 ч.
до введения 1ч 24 ч 48 ч
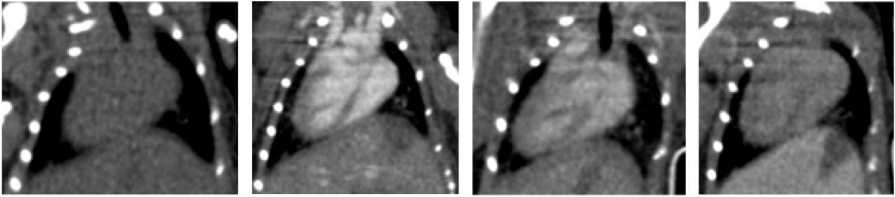
Рис. 2. КТ лабораторной мыши, корональный срез области сердца: до введения НЧЗ, через 1, 24 и 48 ч после инъекции.
В печени наночастицы накапливались со временем: от 2,8±0,7 мг/см3 через 1 ч после инъекции до 5,4±1,9 мг/см3 через 5 сут (рис. 3). Расчётный ФПД для печени составил 1,4±0,1 через 24 ч после инъекции и 1,5±0,2 через 48 ч. Активное накопление наночастиц наблюдали так же и в селезёнке (табл. 1).
до введения 1ч 24 ч 48 ч
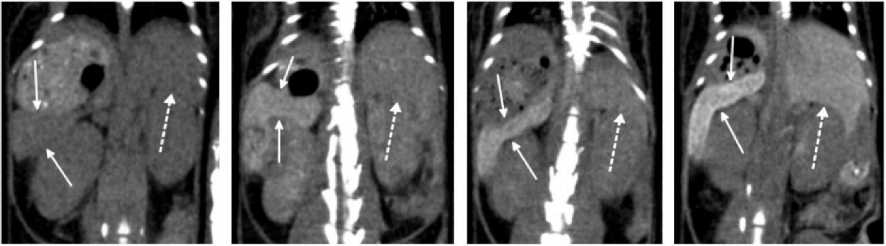
Рис. 3. КТ лабораторной мыши, корональный срез абдоминальной области: до введения НЧЗ, через 1, 24 и 48 ч после инъекции. Сплошные стрелки указывают на селезёнку, пунктирная – нижний край печени.
Таблица 1
|
Время после инъекции |
||||
|
1 ч |
24 ч |
48 ч |
5 сут |
|
|
Концентрация золота в крови (по камере сердца), мг/мл |
11,6±1,1 |
5,4±0,7 |
3,6±0,6 |
0,2±0,2 |
|
Концентрация золота в ткани печени, мг/см3 |
2,8±0,7 |
3,0±0,6 |
3,7±0,9 |
5,4±1,9 |
|
Концентрация золота в ткани селезёнки, мг/см3 |
3,4±0,3 |
4,4±0,9 |
5,8±1,4 |
7,4±1,7 |
|
ФПД для стенок сердца и сосудов |
2,5±0,3 |
1,7±0,2 |
1,5±0,2 |
1,02±0,02 |
|
ФПД для печени |
1,4±0,1 |
1,4±0,1 |
1,5±0,1 |
1,7±0,2 |
|
ФПД для селезёнки |
1,4±0,1 |
1,6±0,1 |
1,7±0,2 |
1,9±0,2 |
Концентрация золота и расчётный ФПД для внутренних органов мыши
Здоровая мускулатура контралатеральной конечности не демонстрировала активного накопления наночастиц. В интервале времени от внутривенной инъекции до 24 ч концентрация золота не превышала 0,3 мг/см3, расчётный ФПД не превышал 1,04. Через 48 ч рентгеноплотность здоровой мускулатуры окончательно возвращалась к нативной.
Всем мышам были подкожно привиты на заднюю правую конечность сингенные опухоли. На момент начала эксперимента размер опухолей составлял от 8x5x5 до 11 х7х8 мм. Компоненты структуры опухоли отчётливо различались по данным КТ, так как стромальный компонент присутствовал в виде псевдокапсулы, а также в виде сравнительно тонких прослоек между узлами роста опухоли (рис. 4). Соотношение стромы и паренхимы различалось в зависимости от опухолевой модели: наибольшее количество соединительнотканых прослоек отмечалось в структуре аденокарциномы Ca755, наименьшее – в структуре меланомы B16F10, промежуточное – в структуре опухолей 4T1 и EMT6. Для всех опухолей было характерно более интенсивное накопление золота в стромальном, а не паренхиматозном компоненте.
Данные о накоплении НЧЗ в модельных опухолях представлены в табл. 2. Указана концентрация золота в строме опухоли, в паренхиме, и средняя концентрация по объёму опухолевого узла, а также соответствующий ФПД. Наиболее интенсивное накопление НЧЗ из исследованных моделей демонстрировала аденокарцинома 4Т1. Максимальная средняя концентрация золота в опухолевом узле достигалась через 24 ч после внутривенной инъекции и составляла 4,7±0,6 мг/см3.
Расчётный ФПД составил 1,4±0,2 для опухолевой паренхимы, 2,4±0,3 для стромы, 1,6±0,2 для опухоли в целом. Наименее активное накопление НЧЗ наблюдали в меланоме B16F10. Наибольшая средняя концентрация золота в опухоли – 2,4±0,4 мг/см3 – отмечалась через 48 ч после введения. Расчётный ФПД составил 1,1±0,2 для опухолевой паренхимы, 2,3±0,2 для стромы, 1,3±0,2 для опухоли в целом. Опухоли EMT6 и Ca755 демонстрировали промежуточный уровень накопления НЧЗ (в среднем 3,8±0,6 и 3,2±0,5 мг/см3 соответственно), расчётный ФПД составлял 1,5±0,2 и 1,4±0,2 соответственно.
4T1 EMT6 Ca755 B16F10
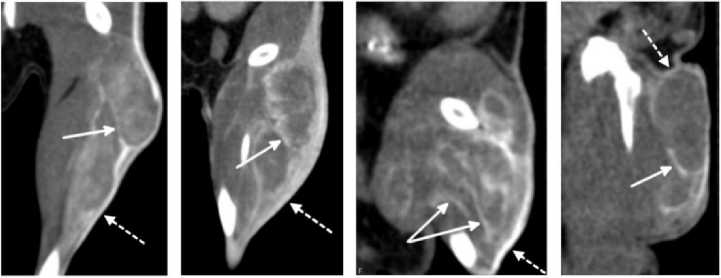
Рис. 4. КТ лабораторной мыши после внутривенного введения НЧЗ, корональный срез области опухоли. Временная точка соответствует максимальному накоплению НЧЗ в объёме опухоли: для 4Т1 и EMT6 – через 24 ч после инъекции, для Ca755 и B16F10 – через 48 ч после инъекции.
Стрелками указаны элементы стромального компонента опухоли: сплошными стрелками – прослойки соединительной ткани между узлами роста опухоли, пунктиром – псевдокапсула.
Таблица 2
Концентрация золота в строме и паренхиме модельных подкожных опухолей на момент максимального накопления наночастиц, и соответствующий расчётный ФПД
|
Опухолевая модель |
||||
|
4T1 |
EMT6 |
Ca755 |
B16F10 |
|
|
Время максимального накопления, ч |
24 |
24 |
48 |
48 |
|
Концентрация золота в строме опухоли, мг/см3 |
11,3±1,2 |
10,4±1,1 |
17,9±2,3 |
9,9±1,1 |
|
Концентрация золота в паренхиме опухоли, мг/см3 |
3,3±0,4 |
2,3±0,3 |
1,8±0,2 |
1,0±0,1 |
|
Средняя концентрация золота в опухоли, мг/см3 |
4,7±0,6 |
3,8±0,6 |
3,2±0,5 |
2,4±0,4 |
|
ФПД для стромы опухоли |
2,4±0,3 |
2,3±0,3 |
3,3±0,4 |
2,3±0,2 |
|
ФПД для паренхимы опухоли |
1,4±0,2 |
1,3±0,2 |
1,2±0,1 |
1,1±0,2 |
|
ФПД для опухоли в целом |
1,6±0,2 |
1,5±0,2 |
1,4±0,2 |
1,3±0,2 |
Через 5 сут после инъекции, по сравнению с 2 сут, для всех опухолей отмечали существенное снижение рентгеноплотности паренхимы, но не стромы. Строма демонстрировала длительное удержание наночастиц без признаков «вымывания» (рис. 5).
до введения 1ч 48 ч 5 сут
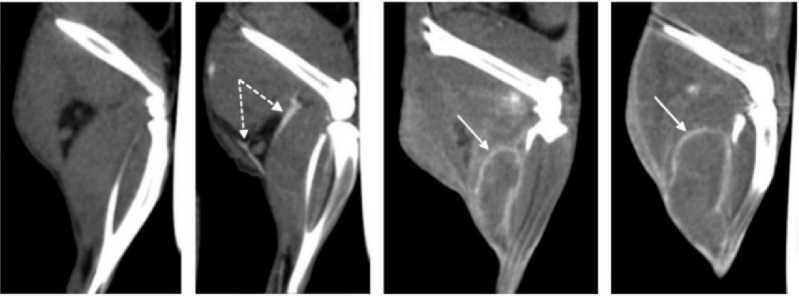
Рис. 5. КТ лабораторной мыши с подкожной опухолью EMT6, сагиттальный срез области опухоли: до введения НЧЗ, через 1, 48 ч и 5 сут после инъекции. Пунктирными стрелками указаны кровеносные сосуды, сплошными стрелками – элементы стромального компонента опухоли (прослойки соединительной ткани между узлами роста опухоли).
Обсуждение
На примере четырёх опухолевых моделей в данной работе было расчётно-экспериментально оценено локальное увеличение поглощённой дозы при взаимодействии внешнего рентгеновского излучения (140 кВ) с НЧЗ. Показано, что при проведении ФЗТ с НЧЗ можно достичь ФПД от 1,3±0,2 (для модели B16F10) до 1,6±0,2 (для модели 4Т1).
В работе [11] показано, что при однократном облучении подкожной меланомы B16F10 в дозе 11 Гр время до трёхкратного увеличения объёма опухоли составило 12,2±1,10 сут, а при облучении в дозе 15 Гр – 13,3±0,60 сут. То есть увеличение поглощённой дозы от внешнего облучения в 1,36 раза привело к задержке роста опухоли на 1 сут. На основании этих данных можно предположить, что повышение поглощённой дозы за счёт присутствия ДПА в объёме опухоли будет малозначимо с точки зрения терапевтического эффекта для данной модели.
Для модели Ca755 расчётный ФПД составил 1,4±0,2, т.е. при облучении в дозе 10 Гр фактическая средняя доза в объёме опухоли достигнет 14±2 Гр. В работе [12] показано, что при увеличении поглощённой дозы с 10 до 15 Гр торможение роста аденокарциномы Са755 увеличилось с 67 до 86%. Поэтому и увеличение поглощённой дозы при облучении в присутствии ДПА, предположительно, приведёт к заметному угнетению роста опухоли.
В данной работе количественную оценку содержания золота в опухолевой ткани проводили методом КТ. В большинстве опубликованных работ подобные исследования проводят методами ex vivo , для чего опухолевый узел извлекают из организма животного, растворяют в ходе пробо-подготовки, а затем оценивают концентрацию химического элемента в полученном образце с помощью масс-спектрометрии с индуктивно-связанной плазмой (ICP-MS) или атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой (ICP-AES). Эти методы позволяют получить представление о средней концентрации золота в исследуемой ткани. Преимуществом КТ является возможность визуализации гетерогенного распределения ДПА в объёме опухоли. Недостатком КТ по сравнению с ICP-MS или ICP-AES является относительно низкая чувствительность, однако в области концентраций, необходимых для ФЗТ, чувствительность КТ вполне достаточна.
Обнаруженная в данном исследовании гетерогенность распределения НЧЗ объясняется присутствием в солидной опухоли двух компонентов: паренхимы и стромы. Паренхима представлена собственно опухолевыми клетками. Строма состоит из соединительной ткани, в ней проходят питающие опухоль кровеносные сосуды [13]. В ходе исследования КТ проводили несколько раз, для последующей количественной оценки выбирали точку максимального накопления НЧЗ. Для опухолей 4Т1 и ЕМТ6 эта точка соответствовала 24 ч после внутривенной инъекции НЧЗ, а для Са755 и B16F10 – 48 ч. При этом с помощью КТ было показано, что в указанные временные точки в строме опухоли содержится существенно больше золота, чем в паренхиме. Поэтому при планировании терапевтического облучения в этом временном диапазоне существенный вклад в замедление роста опухоли вносит не только гибель собственно опухолевых клеток, но также повреждение опухолевых сосудов и опухоль-ассоциированных макрофагов [14]. Несмотря на то, что строма составляет относительно небольшой объём опухоли, известно, что увеличение дозы даже в небольшом объёме может привести к существенному торможению опухолевого роста вследствие запуска не только физических, но и радиобиологических механизмов [15].
Чтобы обеспечить максимальную противоопухолевую эффективность ФЗТ, терапевтическое облучение должно быть проведено во время наибольшего содержания ДПА в опухолевой ткани. На данный момент не существует какого-либо общепринятого протокола исследований ФЗТ с наночастицами, и вопрос оптимального временного интервала от инъекции до облучения решается каждой группой исследователей отдельно в каждом конкретном случае. Существует подход «раннего облучения» в срок до 1 ч после инъекции, до начала интенсивного накопления наночастиц в опухоли, когда они ещё не успели выйти за пределы кровеносного русла. В частности, группа Hainfeld J.F. и соавт. проводили облучение мышей с EMT6 через 2 мин после внутривенной инъекции и получили впечатляющие результаты [16]. В исследовании [17] НЧЗ вводили за 30 мин до облучения аденокарциномы Са755, у 4 мышей из 6 наступила полная регрессия опухоли. В обеих упомянутых работах высокая концентрация золота в крови подтверждалась рентгенологическим методом. Вероятно, положительный результат терапии в этом случае объясняется повреждением питающих опухоль сосудов.
Тем не менее, наиболее популярным вариантом является проведение терапевтического облучения через 24 ч после внутривенной инъекции НЧЗ [18, 19]. При сравнении подходов более позднее облучение приводит к лучшим результатам. Например, в работе [20] одной группе мышей с подкожной опухолью HeLa проводили терапевтическое облучение через 30 мин после введения НЧЗ, а другой – через 4 ч, во втором случае торможение роста опухоли было более выраженным. Эти данные подтверждают, что оптимальным вариантом является проведение облучения в момент содержания наибольшего количества ДПА в опухоли, а не в крови. При проведении дополнительных исследований в данной области, в том числе с расширением спектра опухолевых линий, целесообразно использование КТ для определения временной точки максимального накопления ДПА в опухолевом узле.
В результате проведённого исследования были также получены данные о концентрации золота во внутренних органах животного на момент предполагаемого облучения. В течение 48 ч после инъекции сохраняется высокая концентрация золота в крови, что может привести к ФПД до 1,5±0,2 при облучении сердца. Для печени уже через 1 ч после инъекции ФПД составляет
-
1,4±0,1, и далее до 5 сут ФПД возрастает. Таким образом, возможность проведения ФЗТ при лечении опухолей лёгких, средостения и брюшной полости ограничена вероятностью лучевых повреждений жизненно важных органов. Наиболее перспективным выглядит применение ФЗТ для лечения опухолей головного мозга и конечностей. Именно для этих локализаций в настоящее время проводятся клинические испытания лучевой терапии с металлсодержащими наночастицами [5, 6].
Заключение
В результате исследования динамики накопления НЧЗ в различных модельных опухолях было выявлено, что максимум содержания золота достигался через 24 ч (4Т1, EMT6) или через 48 ч после инъекции (Ca755, B16F10). При этом НЧЗ преимущественно накапливались в стромальном компоненте опухоли: псевдокапсуле и соединительнотканных прослойках. Интенсивность накопления золота в различных модельных опухолях варьировала. Для аденокарциномы Ca755 средняя концентрация золота в объёме опухоли достигала 3,2±0,5 мг/см3, а соответствующий расчётный ФПД составил 1,4±0,2, что позволяет прогнозировать значимое торможение роста опухоли при терапевтическом облучении. В связи с высоким расчётным ФПД для сердца и печени, наиболее вероятно применение ФЗТ при лечении злокачественных новообразований головного мозга и конечностей.
Исследование выполнено за счёт гранта Российского научного фонда № 24-25-00446,


