Распознавание опасных аритмий по скалограммам ЭКГ
Автор: Немирко А.П., Ба Махел А.С., Манило Л.А.
Журнал: Компьютерная оптика @computer-optics
Рубрика: Обработка изображений, распознавание образов
Статья в выпуске: 1 т.48, 2024 года.
Бесплатный доступ
Данная работа посвящена автоматической классификации шести классов опасных аритмий по коротким фрагментам ЭКГ длительностью 2 с. Эта задача чрезвычайно важна для обнаружения опасных для жизни аритмий при непрерывном мониторном контроле. Особенно опасны фибрилляция желудочков и высокочастотная желудочковая тахикардия. Своевременное выявление этих опасных нарушений в клинике позволяет врачам эффективно применять электрическую дефибрилляцию, что спасает жизнь больного. Особенностью нашего подхода является использование уникальной техники преобразования сигналов ЭКГ в изображения (скалограммы) с использованием непрерывного вейвлет-преобразования. Для классификации аритмии использована нейронная сеть AlexNet с хорошо известной архитектурой глубокого обучения, которая обычно используется в задачах классификации изображений. В экспериментах использованы данные из базы данных PhysioNet, а также синтезированные данные ЭКГ, полученные с использованием метода SMOTE. Полученные результаты экспериментальных исследований показывают, что предлагаемый подход позволяет достичь средней точности в 98,7 % для всех классов, что превышает ранее полученные другими исследователями оценки максимальной точности в 93,18 %.
Распознавание аритмий, глубокие нейронные сети, синтез данных, скалограммы
Короткий адрес: https://sciup.org/140303291
IDR: 140303291 | DOI: 10.18287/2412-6179-CO-1354
Текст научной статьи Распознавание опасных аритмий по скалограммам ЭКГ
Данная статья посвящена распознаванию опасных для жизни аритмий по электрокардиограмме. Наиболее важной функцией систем диагностики и наблюдения за состоянием кардиологических больных является оперативное распознавание аритмий, непосредственно угрожающих жизни пациента по ЭКГ. К таким катастрофическим аритмиям относятся: трепетание (ТЖ) и фибрилляция (ФЖ) желудочков сердца и желудочковая тахикардия высокой частоты (ЖТ). Задачи контроля их появления у пациентов, находящихся под непрерывным наблюдением, часто возникают в клинических условиях, в отделениях интенсивной терапии и реанимационных отделениях. Своевременное выявление этих опасных нарушений, особенно на ранних стадиях, позволяет врачам эффективно применять электрическую дефибрилляцию и восстанавливать сократительную функцию сердца. Надёжная индикация ранних форм опасных аритмий необходима также для работы вживляемых и носимых кардиовертеров-дефибрилляторов (КД), применяемых с целью предотвращения у пациентов летальных исходов. При ФЖ на ЭКГ отсутствуют выраженные комплексы зубцов и регистрируются беспорядочные волны с частотой от 400 до 600 мин –1, которые автоматически трудно идентифицировать. Начи- нается ФЖ, как правило, с трепетания желудочков сердца (ТЖ), представляющего собой частое (около 300 мин.–1) ритмичное возбуждение желудочков. На ЭКГ это проявляется в виде волн, близких по форме к синусоиде. При этом комплексы зубцов сливаются в единую волну большой амплитуды. Трепетание в большинстве случаев переходит в ФЖ.
К аритмическим предвестникам ФЖ чаще всего относят устойчивые и неустойчивые пароксизмы ЖТ, которые на ЭКГ проявляются в виде расширенных моно- или полиморфных QRS-комплексов, следующих с частотой 100–220 мин.–1. Наиболее опасными видами этого нарушения являются высокочастотная ЖТ (частота сокращений выше 160 мин.–1), а также двунаправленная и веретенообразная (пируэтная) формы ЖТ. При этом велика вероятность перехода этих нарушений в опасную форму ФЖ.
Таким образом, возникает задача распознавания целого класса жизнеугрожающих аритмий (ФЖ, ТЖ, ЖТ), которые во многих случаях могут приводить к остановке сердца. Также следует отметить проблему формирования альтернативного класса ЭКГ-сигналов, включающих разные виды нормы и нарушений ритма, которые не представляют непосредственной угрозы жизни пациента, но могут ошибочно приниматься за угрожающие жизни аритмии из-за их схожести с сигналами опасных аритмий. От поста- новки задачи распознавания, обоснованности включения сигналов ЭКГ в группу опасных/неопасных аритмий, а также полноты используемой выборки исходных данных во многом зависит качество оценки эффективности предлагаемых алгоритмов распознавания. Кроме того, существуют ограничения на время анализа ЭКГ, которое в разных исследованиях варьируется от 2 до 8 с. Фактор сокращения времени анализа представляется чрезвычайно важным, поскольку мгновенная индикация опасного нарушения, особенно в имплантированных КД, помогает пациенту сохранить жизнь.
В данной статье рассматривается задача классификации 6 классов опасных аритмий по коротким (2 с.) фрагментам ЭКГ. Эти классы различаются по степени опасности для жизни больного от C1 до C6. Самый опасный класс – C1, который требует срочной реанимации. Далее следует класс C2 – особая форма класса C1. Потом следуют опасные для жизни желудочковые аритмии C3, потенциально опасные желудочковые аритмии C4, наджелудочковые аритмии C5 и синусовый ритм C6. Все эти классы имеют свои подклассы, которые приведены в табл. 1. Записи по всем классам взяты из базы ЭКГ-данных [1], которая была создана в нашей группе для задач анализа опасных аритмий и включена в состав открытого ресурса PhysioNet. Примеры фрагментов ЭКГ для опасных аритмий приведены на рис. 1 –6.
Алгоритмы автоматического обнаружения сердечных нарушений на основе ЭКГ разрабатываются в течение многих лет. Они основаны на обнаружении желудочкового комплекса зубцов ЭКГ (PQRS-T) и анализе морфологических особенностей этого комплекса [2–4]. Применялись методы сравнения с эталонами при анализе ЭКГ плода, метод динамической пороговой обработки [2], вейвлет -преобразования [5] и др. Для анализа аритмий исследуются также особенности P- и T-волн [6], интервалы RR [7], интервалы между зубцами ЭКГ. Кроме анализа морфологии комплекса зубцов ЭКГ, применяют также спектральные составляющие сигнала [8], непрерывные вейвлет-преобразования и анализ независимых компонент. Все эти подходы, связанные с анализом формы сигнала и его частотным преобразованием, не очень подходят для нашей задачи из-за специфики формы ЭКГ для опасных для жизни аритмий.
В последние годы в связи с высокой эффективностью нейросетевых моделей машинного обучения, особенно при глубоком обучении, для анализа ЭКГ-сигналов применяют сверточные нейронные сети (CNN) [9, 10, 11]. Для анализа используются как одномерные фрагменты исходных временных отсчетов ЭКГ-сигнала (1D-CNN) [10, 12], так и двумерное представление временных фрагментов (2D-CNN) [9, 11]. Преобразование ЭКГ-сигнала в изображение используется в связи с большими успехами применения глубоких нейронных сетей к анализу изображений.
Для преобразования одномерного сигнала в двумерное изображение используются: кратковременное преобразование Фурье (STFT) – спектрограммы [13], непрерывное вейвлет-преобразование (CWT) – скало-граммы [9, 11], марковские переходные поля (MTF).
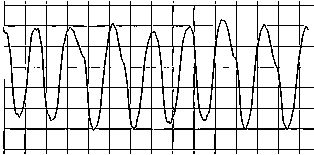
Рис. 1. Фрагмент опасных для жизни аритмий, требующих срочной реанимации (С1)
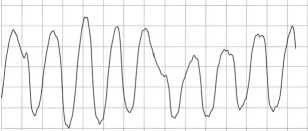
Рис. 2. Фрагмент особой формы опасных для жизни аритмий (C2)
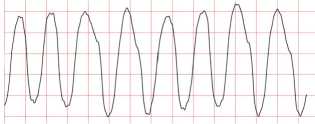
Рис. 3. Фрагмент опасных для жизни желудочковых аритмий (С3)
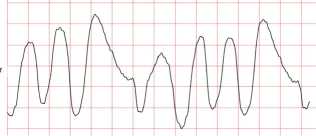
Рис. 4. Фрагмент потенциально опасных желудочковых аритмий (C4)
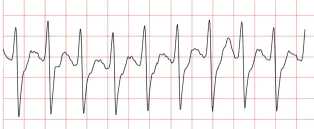
Рис. 5. Фрагмент наджелудочковых аритмий (C5)
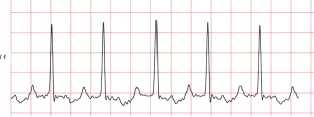
Рис. 6. Фрагмент синусового ритма (С6)
Ниже обсуждаются последние работы, в которых используются непрерывное вейвлет-преобразование (CWT) – скалограммы и сверточные нейронные сети (CNN). Эти работы наиболее близки к рассматриваемой теме.
В работе [12] предложен новый способ автоматической дифференциации шоковых и нешоковых желудочковых аритмий с использованием модели 1D-
CNN. Авторы обработали 2-секундные ЭКГ-фрагменты с помощью одиннадцатислойной модели CNN для идентификации опасных для жизни желудочковых аритмий. Их работа продемонстрировала эффективность предлагаемого подхода в точном выявлении шоковых и нешоковых желудочковых аритмий с использованием сигналов ЭКГ, обеспечивая перспективный инструмент для ранней диагностики и лечения опасных для жизни желудочковых аритмий. В их эксперименте достигнутая максимальная точность составляет 93,18%.
В исследовании [9] разработана модель с использованием CWT и глубокой нейронной сети CNN AlexNet для классификации некоторых сердечных аритмий и застойной сердечной недостаточности по ЭКГ. Их работа продемонстрировала эффективность предлагаемого подхода для точного прогнозирования распространенных сердечных заболеваний: аритмий и застойной сердечной недостаточности с использованием сигналов ЭКГ.
В опубликованной работе [14] предложен метод автоматической классификации ЭКГ, который использует CWT и CNN. Авторы, помимо скалограммы, используют также четыре признака интервала RR, которые извлекаются в процессе предобработки и объединяются с функциями CNN для ввода в полностью подключенный слой для классификации ЭКГ. Метод продемонстрировал эффективность предлагаемого подхода.
Работа [11] посвящена сравнительному анализу применения глубоких моделей машинного обучения в биометрии с использованием скалограмм ЭКГ. Авторы предложили биометрическую систему распознавания, в которой использовались скалограммы сигналов ЭКГ и модели глубокого обучения для достижения высокой точности в биометрическом распознавании. Их результаты показали, что предлагаемый метод превзошел обычные методы биометрического распознавания на основе ЭКГ, демонстрируя эффективность предлагаемого подхода.
Авторы работы [15] предложили метод классификации пяти классов сердечно-сосудистых заболеваний по ортогональным отведениям ЭКГ. В работе использована база данных PTB (Physikalisch-Technische Bundesanstalt), предобработка сигнала, сегментация и CWT. Для классификации использована предварительно обученная CNN AlexNet. На скалограммах длиной 3 с эта модель обеспечила превосходную точность классификации (не менее 98%) для выбранных классов. Предложенный подход продемонстрировал возможности этого направления исследований и был выбран нами в качестве основного в данном исследовании по классификации опасных для жизни аритмий.
В данной работе мы используем непрерывное вейвлет-преобразование 2-секундных фрагментов ЭКГ и трансферное обучение готовой сверточной нейронной сети AlexNet. Проведенные эксперименты показали среднюю точность классификации по всем классам, равную 98,7 %, что существенно больше полученных ранее [12] оценок максимальной точности в 93,18 % при использовании нейронной сети 1D-CNN на сходных классах ЭКГ-данных и 94,12 % [8] при использовании нейронной сети с долгой краткосрочной памятью (LSTM) на той же базе ЭКГ данных, что и в данной статье.
1. Описание ЭКГ-данных
В этом исследовании используется база данных фрагментов ЭКГ для исследования опасных аритмий, являющаяся ценным ресурсом для медицинских работников и исследователей, изучающих сердечные аритмии. Эта база данных [1] содержит набор 2секундных фрагментов ЭКГ с нарушениями ритма. Фрагменты сгруппированы в отдельные классы в соответствии со степенью угрозы, которую они представляют для жизни пациента. База данных предназначена для практического использования при разработке и тестировании эффективности алгоритмов обнаружения опасных аритмий для систем непрерывного мониторинга. Она содержит 1016 фрагментов ЭКГ, каждый из которых помечен одним из шести классов: угрожающие жизни аритмии, требующие срочной реанимации – С1, особая форма опасных для жизни аритмий – С2, опасные для жизни желудочковые аритмии – С3, потенциально опасные желудочковые аритмии – С4, суправентрикулярные аритмии – С5 и синусовый ритм – С6. Количественный состав различных типов аритмий представлен в табл. 1.
Табл. 1. Содержание базы данных ЭКГ
|
Kласс |
Типы аритмий |
Число фрагментов |
Итого в классе фрагментов |
|
С1 |
VFL |
97 |
337 |
|
VF |
240 |
||
|
C2 |
VTTdP |
72 |
72 |
|
C3 |
VTHR |
169 |
169 |
|
C4 |
VTLR |
6 |
132 |
|
B |
41 |
||
|
HGEA |
73 |
||
|
VER |
12 |
||
|
C5 |
AFIB |
46 |
106 |
|
SVTA |
39 |
||
|
SBR |
1 |
||
|
BI |
8 |
||
|
NOD |
12 |
||
|
C6 |
BBB |
53 |
200 |
|
N |
107 |
||
|
Ne |
40 |
В табл. 1 используются следующие сокращения: VFL – трепетание желудочков, VF – фибрилляция желудочков, VTTdP – пируэтная форма желудочковой тахикардии, VTHR – высокочастотная форма желудочковой тахикардии, VTLR – желудочковая тахикардия низкой частоты, B – желудочковая бигеминия, HGEA – высокая степень желудочковой эктопической активности, VER – желудочковый выскальзы- вающий ритм, AFIB – фибрилляция предсердий, SVTA – суправентрикулярная тахикардия, SBR – синусовая брадикардия, BI – блокада сердца первой степени, NOD – узловой (a-v) ритм, BBB – синусовый ритм с блокадой ножек пучка Гиса, N – нормальный синусовый ритм, Ne – нормальный ритм с одиночными экстрасистолами.
Кроме фрагментов из базы ЭКГ-данных, мы использовали также синтетические данные, полученные по методу SMOTE (Synthetic Minority Over-sampling Technique) , чтобы сбалансировать наш несбалансированный набор данных. Метод SMOTE — это метод увеличения данных, который был предложен Chawla et al. в 2002 году [16]. Этот метод используется для создания синтетических образцов класса меньшинств путем интерполяции между существующими образцами, тем самым увеличивая представление класса меньшинства в наборе данных. Этот метод особенно полезен при работе с несбалансированными наборами данных, где некоторые классы содержат значительно меньше выборок, чем другие. Генерируя синтетические данные, мы можем улучшить способность модели распознавать классы меньшинств, тем самым добиваясь более сбалансированной эффективности классификации.
SMOTE работает путем создания синтетических выборок класса меньшинства путем передискретизации существующих данных. Алгоритм SMOTE работает следующим образом:
• случайным образом выбирается элемент из класса меньшинств;
• идентифицируются его k ближайшие соседи (k – параметр, указанный пользователем);
• случайным образом выбирается один из k соседей и создается новая синтетическая выборка, как линейная комбинация исходной выборки и выбранного соседа;
• повторяются первые три шага до тех пор, пока не будет сгенерировано желаемое количество синтетических образцов.
2. Непрерывное вейвлет-преобразование
Полученные синтетические выборки затем добавляются в обучающий набор данных, чтобы сбалансировать распределение по классам. Генерируя синтетические выборки, SMOTE помогает увеличить представительность класса меньшинства в обучающем наборе данных и уменьшает смещение в сторону класса большинства. В целом, SMOTE – это полезный метод для решения проблем дисбаланса классов в машинном обучении и может быть особенно эффективным в сочетании с другими методами, такими как увеличение данных и обучение ансамбля.
В нашей работе мы использовали SMOTE для устранения дисбаланса классов в нашем наборе данных и повышения точности нашей модели машинного обучения. После его применения число элементов каждого класса стало равным 1000, как указано в табл. 2.
Табл. 2. Доля реальных и синтетических ЭКГ-данных
|
Данные Класс |
Реальные |
Синтезированные |
Всего |
|
C1 |
337 |
663 |
1000 |
|
C2 |
72 |
928 |
1000 |
|
C3 |
169 |
831 |
1000 |
|
C4 |
132 |
868 |
1000 |
|
C5 |
106 |
894 |
1000 |
|
C6 |
200 |
800 |
1000 |
|
Итого |
1016 |
4984 |
6000 |
Преобразование сигнала ЭКГ из временной области в частотно-временную с использованием непрерывного одномерного вейвлет-преобразования (CWT – Continuous 1D Wavelet Transform) может предоставить ценную информацию о лежащих в основе физиологических процессах, которые генерирует сигнал.
Сигнал ЭКГ – это изменяющийся во времени сигнал, который представляет электрическую активность сердца. Он состоит из нескольких компонент, включая P-волну, комплекс QRS и T-волну. Эти компоненты имеют разный частотный состав и продолжительность, что важно для диагностики различных заболеваний сердца.
CWT позволяет нам разложить сигнал ЭКГ на его частотные составляющие. Он может идентифицировать частотное содержание сигнала в различных временных масштабах. Это полезно для идентификации различных компонент сигнала ЭКГ, таких как P-волна, комплекс QRS и T-волна, а также для анализа их частотных характеристик. В дополнение к этим преимуществам преобразование сигнала ЭКГ из временной области в частотно-временную с использованием CWT также может обеспечить следующие достоинства:
-
1. Улучшенная визуализация: CWT можно использовать для создания частотно-временных графиков, которые позволяют лучше визуализировать частотный состав сигнала в разные моменты времени. Это может помочь в выявлении различных отклонений в сигнале ЭКГ, таких как аритмия, ишемия и инфаркт миокарда.
-
2. Улучшенное извлечение признаков: частотные компоненты, полученные с помощью CWT, могут быть использованы для извлечения различных характеристик сигнала ЭКГ, таких как частота сердечных сокращений, длительность комплекса QRS и интервал QT. Эти функции могут быть использованы для диагностики различных заболеваний сердца и для их мониторинга.
-
3. Улучшенная обработка сигнала: CWT можно использовать для фильтрации шума и артефактов в сигнале ЭКГ, что может повысить точность диагностики. Он также может быть использован для
-
4. Стандартизация: CWT широко используется при анализе сигналов ЭКГ, и существуют хорошо зарекомендовавшие себя методы его реализации и интерпретации. Это облегчает сравнение результатов различных исследований и разработку стандартных протоколов для анализа сигналов ЭКГ.
сжатия сигнала, что может снизить требования к хранению и времени передачи сигнала.
Математическая формулировка [17] семейства вейвлет-преобразования и CWT представлены в уравнениях (1) и (2) соответственно:
-
1 f t - b )
Va,b (t)=^Vl----- I .
-
V a I a )
Здесь a – параметр масштаба, b – параметр сдвига a, b e R, v ( t ) — материнский вейвлет (вейвлет-функция).
CWT (a, b ) = ' [/ (t )xvf — I dt,(2)
V a -L
3. AlexNet – использованная модель машинного обучения
здесь f ( t ) – данный сигнал.
Результаты CWT – множество вейвлет-коэффи-циентов, которые являются функцией масштаба a и сдвига b . В этом исследовании мы использовали коэффициенты CWT в виде скалограммы, которая может служить входом [15] в глубокую нейронную сеть AlexNet для классификации заболеваний. Размерность скалограммы, подаваемой на вход сети, равна 227×227, поскольку эти скалограммы подаются в глубокую модель AlexNet, которая принимает только изображения упомянутого размера. На рис. 7 а-б показан пример сегментированного ЭКГ-сигнала длиной 2 с и его ска-лограммы, полученной с помощью CWT.
Аритмия – это заболевание, характеризующееся нерегулярным сердцебиением, которое может привести к серьезным осложнениям со здоровьем, таким как сердечная недостаточность, инсульт или смерть. Таким образом, точное выявление классов аритмии имеет решающее значение для правильной диагностики и лечения. В этом параграфе обсуждается использование модели AlexNet для классификации шести классов опасных аритмий с использованием базы данных фрагментов ЭКГ [1] и преобразования 2секундных фрагментов сигнала в скалограммы с использованием CWT [9,11,15,18].
AlexNet – это глубокая сверточная архитектура нейронной сети, которая была представлена в 2012 году Алексом Крижевским, Ильей Сатскевером и Джеффри Хинтоном [19]. Она была разработана, чтобы конкурировать в крупномасштабном конкурсе визуального распознавания изображений ImageNet, в котором цель состояла в том, чтобы классифицировать изображения по одной из 1000 различных категорий.
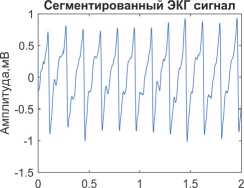
Время,C
а)
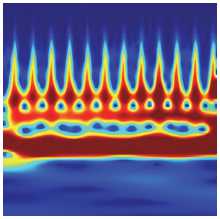
б)
Рис. 7. (а) Сегментированный ЭКГ-сигнал, (б) его скалограмма
Одним из ключевых нововведений AlexNet является использование выпрямленных линейных функций ReLU (rectified linear unit) в качестве функций активации. ReLU – это нелинейная функция, которая заменяет отрицательные значения на нули, что помогает смягчить проблему исчезающего градиента и ускоряет конвергенцию во время обучения.
AlexNet достиг самых лучших результатов в конкурсе ImageNet, значительно превосходя предыдущие подходы. AlexNet состоит из восьми слоев, включая пять сверточных слоев, два полносвязных слоя и один слой softmax. Вот краткое описание каждого слоя [19]:
• Сверточный слой 1: этот слой содержит 96 фильтров размером 11×11×3 и шагом 4. Он берет входное изображение и извлекает такие элементы, как края и углы.
• Максимальный уровень объединения 1: этот слой выполняет максимальное объединение с размером пула 3×3 и шагом 2. Это уменьшает пространственный размер выходных данных предыдущего слоя.
• Сверточный слой 2: этот слой содержит 256 фильтров размером 5×5×48 и шагом 1. Он извлекает более сложные объекты, чем первый слой.
• Максимальный уровень объединения 2: этот слой выполняет максимальное объединение с размером пула 3×3 и шагом 2. Это еще больше уменьшает пространственный размер выходных данных.
• Сверточный слой 3: этот слой содержит 384 фильтра размером 3×3×256 и шагом 1. Он извлекает еще более сложные объекты, чем предыдущие слои.
• Сверточный слой 4: этот слой содержит 384 фильтра размером 3×3×192 и шагом 1. Он продолжает извлекать сложные функции.
• Сверточный слой 5: этот слой содержит 256 фильтров размером 3×3×192 и шагом 1. Он извлекает высокоуровневые объекты из предыдущих слоев.
• Полносвязный слой 1: этот слой содержит 4096 нейронов и полностью подключен к выходу предыдущего уровня. Он выполняет нелинейное преобразование на входных данных.
• Полносвязный слой 2: этот уровень содержит 4096 нейронов и полностью подключен к выходу предыдущего уровня. Далее он выполняет нелинейное преобразование на входных данных.
• Слой Softmax: этот слой содержит 1000 нейронов, каждый из которых представляет класс в наборе данных ImageNet. Он выводит прогнозируемое распределение вероятностей по 1000 категориям.
4. Экспериментальные результаты
Количество фильтров в каждом слое варьируется: слой 1 содержит 96 фильтров, слой 2 имеет 256 фильтров, слой 3 имеет 384 фильтра, слой 4 имеет 384 фильтра и слой 5 имеет 256 фильтров.
Размер каждого фильтра также варьируется, причем первый слой имеет фильтры размером 11×11×3, второй слой имеет фильтры размером 5×5×48, а остальные сверточные слои имеют фильтры размером 3×3×N, где N – количество входных каналов.
В этом исследовании мы предложили модель машинного обучения для классификации набора данных, состоящую из шести категорий (угрожающие жизни аритмии, требующие срочной реанимации (C1), особая форма опасных для жизни аритмий (C2), опасные для жизни желудочковые аритмии (C3), потенциально опасные желудочковые аритмии (C4), суправентрикулярные аритмии (С5) и синусовый ритм (С6)), каждая из которых имеет 1000 образцов, в общей сложности 6000 образцов. При этом 80 % (4800 образцов) от общего объема данных использовались для обучения, 10 % (600 образцов) – для валидации и 10 % (600 образцов) – для тестирования модели. Модель была оценена на независимом наборе тестирования, состоящем из 600 образцов, причем каждый класс имел равное представление в тестовом наборе. Мы достигли общей средней точности распознавания в 98,7 % в тестовом наборе. Эта величина существенно больше полученных ранее оценок максимальной точности в 93,18 % [12] при использовании нейронной сети 1D-CNN на тех же классах ЭКГ и 94,12 % [8] при использовании нейронной сети с долгой краткосрочной памятью (LSTM) на той же базе ЭКГ-данных, что и в данной статье.
Для оценки производительности нашей модели использованы следующие показатели: точность, полнота и Fl-мера. Чтобы вычислить точность, полноту и Fl-меру , были применены следующие метрические уравнения:
TP
Точностьк ( preasionk ) = тр—^р- ,
Точность ср
Полнота ср
K
^ precision к=1___________________
K ,
Полнотак ( recallk ) =
TP k
TP k + FN k ’
K
^ recallk к=1
K
2 х Точность х Полнота F 1 - мера =----------------------
Точность™ + Полнота™ ср ср
В этих формулах K – число классов, TP k – число истинно положительных результатов классификации по классу k , FP k – число ложноположительных результатов классификации по классу k (ложное решение о принадлежности результата клаccу k ), FN k – число ложноотрицательных результатов (ложное решение о непринадлежности результата клаccу k ).
Наша модель достигла высоких показателей средней точности, полноты и F1-меры. Так, полученная средняя точность составила 98,7 % на наборе тестирования, что указывает на то, что она способна точно классифицировать данные. Высокая точность нашей модели связана с использованием передовых методов машинного обучения, таких как нейронные сети и глубокое обучение. Матрица ошибок для тестового набора показана на рис. 8.
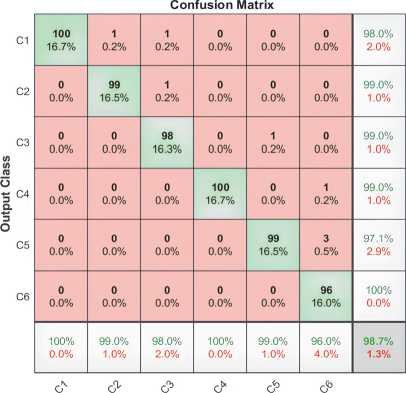
Target Class
Рис. 8. Матрица ошибок для тестового набора
Матрица ошибок показывает, что большинство образцов были правильно классифицированы. Небольшое число неправильно классифицированных образцов предполагает, что наша модель точно изучила признаки и шаблоны данных. Тем не менее, мы отмечаем, что в каждом классе неверно классифицировалось несколько образцов, что указывает на то, что наша модель не идеальна и может иметь некоторые ограничения. Дальнейшее исследование будет проведено для определения конкретных областей, где модель требует улучшения. Наша модель может быть полезна в различных приложениях, таких как медицинская диагностика. Например, наша модель может использоваться для классификации медицинских изображений на основе их контента.
Заключение
В данной работе впервые достигнута достаточно высокая точность при классификации опасных для жизни аритмий по ЭКГ. Для этого использован оригинальный подход распознавания 6 классов опасных сердечных аритмий по 2-секундным фрагментам ЭКГ. Данный подход включает непрерывное вейвлет-преобразование исходного временного сигнала и трансферное обучение нейронной сети AlexNet. Наш подход позволил достичь высокой средней точности 98,7% на тестовом наборе. Полученная точность существенно превышает максимальную точность в 93,18 %, полученную другими исследователями на тех же классах ЭКГ-данных. В совокупности с примененной технологией представления одномерных сигналов в виде двумерных изображений полученный нами впервые результат обладает существенной новизной. Он имеет также научную значимость, так как подтверждает эффективность использования непрерывного вейвлет-преобразования для автоматического распознавания одномерных сигналов. Практическая значимость полученного результата заключается в возможном совершенствовании кардиомониторных систем за счет применения в них нейросетевых архитектур для классификации ЭКГ.
Исследование выполнено за счет гранта Российского научного фонда № 23-21-00215,
Список литературы Распознавание опасных аритмий по скалограммам ЭКГ
- Nemirko A, Manilo L, Tatarinova A, Alekseev B, Evdakova E. ECG Fragment Database for the Exploration of Dangerous Arrhythmia (version 1.0.0). PhysioNet 2022. Source: https://physionet.org/content/ecg-fragment-high-risk-label/1.0.0/1_Dangerous_VFL_VF/. DOI: 10.13026/kpfg-xs25.
- Pandit D, Li Z, Chengyu L, Chattopadhyay S, Aslam N, Peng LC. A lightweight QRS detector for single lead ECG signals using a max-min difference algorithm. Comput Methods Programs Biomed 2017; 144: 61-75. DOI: 10.1016/j.cmpb.2017.02.028.
- Acharya UR, Fujita H, Oh SL, Hagiwara Y, Tan JH, Adam M, Tan RS. Deep convolutional neural network for the automated diagnosis of congestive heart failure using ECG signals. Appl Intell 2019; 49(1): 16-27. DOI: 10.1007/s10489-018-1179-1.
- Haberl R, Jilge G, Pulter R, Steinbeck G. Spectral mapping of the electrocardiogram with Fourier transform for identification of patients with sustained ventricular tachycardia and coronary artery disease. Eur Heart J 1989; 10(4): 316-322.
- Tuncer T, Dogan S, Pławiak P, Acharya UR. Automated arrhythmia detection using novel hexadecimal local pattern and multilevel wavelet transform with ECG signals. Knowledge-Based Systems 2019; 186: 104923. DOI: 10.1016/j.knosys.2019.104923.
- Madeiro JPV, Santos EMB, Cortez PC, Felix JHS, Schlindwein FS. Evaluating Gaussian and Rayleigh-based mathematical models for T and P-waves in ECG. IEEE Lat Am Trans 2017; 15(5): 843-853. DOI: 10.1109/TLA.2017.7910197.
- Kennedy A, Finlay DD, Guldenring D, Bond RR, Moran K, McLaughlin J. Automated detection of atrial fibrillation using RR intervals and multivariate-based classification. J Electrocardiol 2016; 49(6): 871-876. DOI: 10.1016/j.jelectrocard.2016.07.033.
- Nemirko AP, Popadina AO. Recognition of life-threatening arrhythmias by the spectral characteristics of a short electrocardiogram recording [In Russian]. Biotechnosfera 2022; 67(1): 3-8. DOI: 10.25960/bts.2022.1.3.
- Olanrewaju R, Ibrahim S, Asnawi AL, Altaf H. Classification of ECG signals for detection of arrhythmia and congestive heart failure based on continuous wavelet transform and deep neural networks. Indones J Electr Eng Comput Sci 2021; 22: 1520. SOI: 10.11591/ijeecs.v22.i3.pp1520-1528.
- Acharya UR, Fujita H, Oh SL, Hagiwara Y, Tan JH, Adam M, Tan RS. Deep convolutional neural network for the automated diagnosis of congestive heart failure using ECG signals. Appl Intell 2019; 49(1): 16-27. DOI: 10.1007/s10489-018-1179-1.
- Byeon YH, Pan SB, Kwak KC. Intelligent deep models based on scalograms of electrocardiogram signals for biometrics. Sensors 2019; 19: 935. DOI: 10.3390/s19040935.
- Acharya UR, Fujita H, Oh SL, Raghavendra U, Tan JH, Adam M, Gertych A, Hagiwara Y. Automated identification of shockable and non-shockable life-threatening ventricular arrhythmias using convolutional neural network. Future Generation Computer Systems 2018; 79(3): 952-959. DOI: 10.1016/j.future.2017.08.039.
- Gupta V, Mittal M. QRS complex detection using STFT, chaos analysis, and PCA in standard and real-time ECG databases. Journal of the Institution of Engineers (India): Series B 2019; 100(5): 489-497. DOI: 10.1007/s40031-019-00398-9.
- Wang T, Lu C, Sun Y, Yang M, Liu C, Ou C. Automatic ECG classification using continuous wavelet transform and convolutional neural network. Entropy (Basel) 2021; 23(1): 119. DOI: 10.3390/e23010119.
- Ba Mahel AS, Harold N, Solieman H. Arrhythmia classification using Alexnet model based on orthogonal leads and different time segments. 2022 Conf of Russian Young Researchers in Electrical and Electronic Engineering (ElConRus) 2022: 1312-1315. DOI: 10.1109/ElConRus54750.2022.9755708.
- Chawla NV, Bowyer KW, Hall LO, Kegelmeyer WP. smote: synthetic minority over-sampling technique. J Artif Intell Res 2002; 16: 321-357.
- Ozaltin O, Yeniay O. A novel proposed CNN–SVM architecture for ECG scalograms classification. Soft Comput 2023; 27: 4639-4658. DOI: 10.1007/s00500-022-07729-x.
- Li C, Zheng C, Tai C. Detection of ECG characteristic points using wavelet transforms. IEEE Trans Biomed Eng 1995; 42(1): 21-28.
- Krizhevsky A, Sutskever I, Hinton GE. ImageNet classification with deep convolutional neural networks. Commun ACM 2012; 60(6): 84-90. DOI: 10.1145/3065386.


