Распределение атомов меди и магния по катионным позициям в твердых растворах Bi2Mg1-xCuxNb2O9 со структурой пирохлора
Автор: Пийр И.В., Секушин Н.А., Белый В.А.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Химические науки
Статья в выпуске: 4 (8), 2011 года.
Бесплатный доступ
Осуществлен синтез и проведено исследование различными методами твер- дых растворов медь- и магнийсодержащих ниобатов висмута. Методами диф- ференциальной сканирующей калориметрии (ДСК), термической гравимет- рии (ТГ) и пикнометрии определено распределение катионов Cu2+ и Mg2+ по двум катионным подрешеткам структуры пирохлора. На основании получен- ных данных была рассчитана дефектность по кислороду.
Сложный ниобат висмута, структура пирохлора, дифференциальная сканирующая калориметрия, термогравиометрия
Короткий адрес: https://sciup.org/14992485
IDR: 14992485 | УДК: 544.6.018.462
Текст научной статьи Распределение атомов меди и магния по катионным позициям в твердых растворах Bi2Mg1-xCuxNb2O9 со структурой пирохлора
В последние десятилетия ведутся активные исследования сложных ниобатов висмута, которые благодаря набору ценных электрических и магнитных свойств представляют как практический интерес, так и теоретический – для химии и физики твердого тела. Особенностью этих соединений является разнообразие структурных типов при близком химическом составе. Известны флюоритоподобные структуры, пирохлор, слоистые перовскитоподобные соединения [1–4]. В бинарной системе Bi2O3-Nb2O5 при мольном отношении Bi/Nb≥1 формируется несколько оксидных соединений, имеющих различное кристаллическое строение. Среди них – орторомбический BiNbO4, Bi5Nb3O15 со структурой типа слоистого перовскита и флюоритоподобный Bi3NbO7 [1–3, 5, 6]. Структура типа пирохлора с общей формульной единицей А2В2О6О` в бинарной системе не реализуется. В случае добавления соизмеримых молярных количеств оксидов других металлов образуются соединения с общей брутто-формулой Bi2MNb2O9-δ, которые кристаллизуются по типу пирохлора, либо имеют структуру слоистого перовскита в зависимости от размеров атомов металла М [4]. В том случае, когда атомы М имеют большой ионный радиус (например, барий, стронций, ртуть), кристаллизация сложного оксида проходит с образованием слоистого перовскита, когда М – атомы 3d-металлов, а также магния или цинка, кристаллизация идет с образованием структуры типа пирохлора. Особенностью структуры пирохлора является независимое сосуществование двух решеток: А2О` и ВО6. А-позиции крупных катионов, например висмута, окружены атомами кислорода О` и обе (катионная и анионная) подрешетки могут быть дефектными [7]. Катионы, располагающиеся в В-позициях, находятся в октаэдрической координации из атомов кислорода О (второй анионной подрешетки), и эти катионная и анионная позиции полностью заселены атомами металлов и кислорода. Атомы металлов –М– в структуре типа пирохлора могут распределяться по двум катионным подрешеткам (позициям) [7]. Тогда брутто-формулу Bi2MNb2O9-δ можно преобразовать в вид формульной единицы пирохлора А2В2О6О` с неопределенным распределением атомов М – (Bi2M1-x)2/(2+x)(MxNb2)2/(2+x)O9-δ, что позволяет рассматривать подобные соединения как твердые растворы замещения.
Соединения Bi2Mg1-xCuxNb2O9-δ (х=0–1) при совместном присутствии меди и магния синтезированы и изучены нами впервые [8, 9]. Ранее исследованы условия образования и структура медьсодержащего ниобата висмута со структурой типа пи- рохлора [10] В недавно вышедшей работе [11] приведены результаты исследования структуры и импеданс-спектры упомянутых твердых растворов. Возможная ионная проводимость многокомпонентных ниобатов висмута со структурой пирохлора должна определяться дефектностью анионной или катионной подрешеток, что зависит от распределения металла (М) с меньшей степенью окисления по катионным подрешеткам.
В настоящей работе предложен оригинальный способ, позволяющий установить не только распределение катионов меди и магния по позициям в кристаллической структуре, но и определить концентрацию как катионных, так и анионных вакансий. Следует отметить, что прямыми физическими методами (рентгеновской дифракцией порошка с полнопрофильным анализом) эту задачу однозначно решить не удается, поскольку в висмутсодержащих пирохлорах, кроме структурного разупорядочения, возможно смещение атомов висмута и подвижного кислорода со своих позиций. При уточнении структуры наблюдается взаимная зависимость заселенности позиций, температурных параметров и смещений.
Разработанная методика в полном объеме применена для трех наиболее интересных с точки зрения электрофизики твердых растворов [10].
Экспериментальная часть
Синтез образцов осуществлялся керамическим методом в соответствии с химической реакцией:
Bi 2 O 3 + ( x –1)MgO + x CuO + Nb 2 O 5 = Bi 2 Mg 1-x Cu х Nb 2 O 9 , где x = 0,25; 0,75; 1.
Навески оксидов висмута, ниобия, магния и меди квалификации «ос.ч.» в соотношениях, соответствующих стехиометрии реакции, тщательно перемешивали в яшмовой ступке для получения однородной смеси и далее запрессовывали в таблетки диаметром 12 мм и толщиной 2.5 мм. Термообработку препаратов проводили в три стадии: предварительное прокаливание при 650оС в течение 6 ч и последующий обжиг при температурах (1000 ± 10) о С в течение 20 ч, а затем при (1100 ± 10) оС в течение 6 ч. Между обжигами осуществлялся рентгенофазовый анализ образцов с целью проверки результатов синтеза. После высокотемпературного прокаливания были получены практически однофазные материалы. Определение содержания висмута, ниобия, магния, меди в полученных после высокотемпературной обработки образцах проводили методом атомно-эмиссионной спектроскопии на спектрометре SPECTRO CIROS с индуктивно-связанной плазмой. Состав всех твердых растворов по катионам после синтеза соответствует заданной стехиометрии. Данные по рентгеновской дифракции порошков были получены с помощью дифрактометра Shimadzu на Cu Kα излучении в области 2 9 : 10-80 ° . Проведенный анализ показал, что все синтезированные материалы имели в своем составе единственную фазу со структурой типа кубического пирохлора Fd3m с постоянной решетки 10,60 Å [10].
Для порошкообразных образцов выполнено измерение пикнометрической плотности при постоянной температуре с использованием в качестве рабочей жидкости толуола. Экспериментальные значения плотности ( р п) сравнивались со значениями плотности, рассчитанными для определенной модели катионного распределения в конкретном твердом растворе ( р р).
Дифференциальная сканирующая калориметрия (ДСК) и термогравиометрия (ТГ) образцов твердых растворов проводились на приборе синхронного термического анализа STA 409 PC Luxx (ФРГ). Результаты термогравиметрического анализа представлены на рис. 1 и 2.
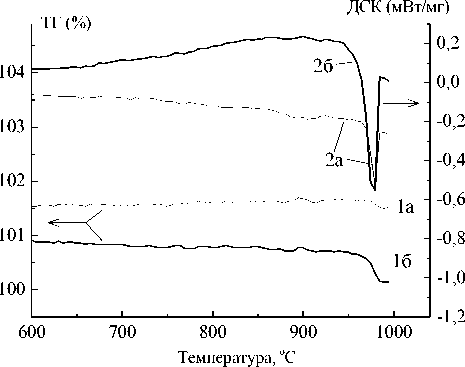
Рис. 1. Термическая гравиметрия (1) и дифференциальная сканирующая калориметрия (2) твердых растворов B i2Mg0,75 C u0,25Nb2 O 9- 8 (а) и Bi^Mg o^ Cu o^ Nb^ — s (б).
Время (мин)
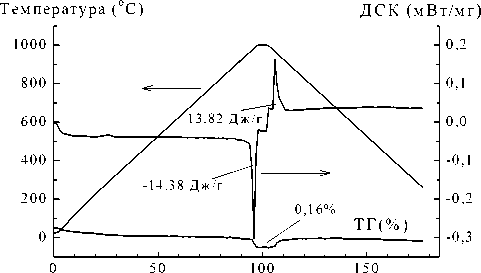
Рис. 2. Термическая гравиметрия и дифференциальная сканирующая калориметрия твердых растворов Bi2Mg0 , 75Cu0 , 25Nb2O10- 8 , выполненная в режиме «нагревание – охлаждение».
Результаты и обсуждение
Задачей настоящего исследования являлось экспериментальное определение распределения меди и магния по катионным подрешеткам в твердых растворах ниобата висмута со структурой типа пирохлора. Оба катиона при добавлении их к оксидам висмута и ниобия приводят к образованию и стабилизации структуры пирохлора после соответ- ствующей термообработки. По своим характеристикам и химическим свойствам они существенно отличаются. В табл. 1 приведены характеристики ионов меди и магния, входящих в состав исследуемых образцов.
Таблица 1 Электроотрицательность по Олреду – Рохову и радиус ионов
|
Ион |
Ионный радиус, Å |
Электроотрицательность |
|
Bi 3+ |
1,03 |
1,7 |
|
Nb5+ |
0,64 |
1,2 |
|
Mg2+ |
0,72 |
1,2 |
|
Cu2+ |
0,73 |
1,8 |
|
O 2- |
1,46 |
3,5 |
Распределение меди и магния по двум катионным позициям структуры пирохлора в исследуемых твердых растворах может осуществляться несколькими способами. Оба катиона занимают В-позиции (подрешетка ниобия) и тогда А-подрешетка (висмута) на треть вакантна. Дефектность А-подрешетки будет меньше, если некоторая доля магния и (или) меди займет А-позиции. Эта модель обуславливает существенно пониженную плотность соединений по сравнению с плотностью для идеальной структуры пирохлора. Другой вариант распределения предполагает полную заселенность обеих катионных позиций с равновероятным или хаотическим распределением меди и магния по позициям А и В.
Для медьсодержащих соединений может быть использована известная реакция разложения оксида меди (II) на кислород и оксид меди (I):
2CuO 1053 o C > Cu 2 o + 12 O 2 .
Стандартная энтальпия процесса Cu2+ ^ Cu+ равна: ΔH 298 = 75,5 кДж/моль. Процесс восстановления сопровождается уменьшением массы образца из-за потери кислорода. Очевидно, что температура восстановления зависит от прочности кристаллической решетки, длины и энергии связи «медь – кислород» и в случае структуры пирохлора – от подвижности атомов кислорода. Если предположить, что в медьсодержащих ниобатах висмута медь восстанавливается при температуре около 1000 ° С, то такая реакция наиболее вероятна для меди, распределенной в А 2 О`(висмутовой) подрешетке, поскольку анионы кислорода O` способны легко покидать эту подрешетку. Аналогичный процесс в более прочной ВО 6 (ниобиевой) подрешетке начинается при более высоких температурах и, по-видимому, будет сопровождаться разрушением структуры. Длины связи Bi–O`и Nb–O равны 2.280Å и 2.027Å, соответственно [10], и медь в позициях висмута менее прочно связана с кислородом.
На кривых ДСК при температуре T (табл. 2, столбец 3) наблюдается эндотермический пик. По площади пика была рассчитана энтальпия процесса А Н (табл. 2, столбец 6). При этой же температуре на кривой ТГ зарегистрировано уменьшение массы образца A m. В табл. 2 (столбец 5) приведено отно-
Таблица 2
Результаты синхронного термического анализа
На рис. 2 приведены результаты термического анализа образца Bi2Mg0 , 75Cu0 , 25Nb2O10- 8 , в режиме «нагревание – охлаждение». Из экспериментальных данных, представленных на рисунке, следует, что процесс восстановления меди является обратимым:
980oC
2CuO <—> Cu2O + 1/2 O2 .
При измерении ДСК в аргоне экзотермический пик не наблюдается, что можно объяснить малым парциальным давлением кислорода. Из данных ТГ и ДСК была рассчитана доля катионов меди ω, способных переходить в одновалентное состояние (восстанавливаться). Результаты расчетов приведены в табл. 2 (столбцы 7 и 8). Получены достаточно близкие значения. Таким образом, можно предположить, что при температуре 980 ° С вся медь в подрешетке А переходит в одновалентное состояние. Этот процесс сопровождается убылью кислорода О` в висмутовой подрешетке. Аналогичный процесс затруднен в подрешетке В ввиду её более высокой устойчивости (жесткости) и отсутствия кислородных вакансий. Зная распределение меди по двум типам позиций, можно определить дефектность в подрешетке висмута для соединения Bi 2 CuNb 2 O 9 , что и отражено в табл. 3 (последняя строка).
Если же твердый раствор содержит одновременно медь и магний, то данных ДСК и ТГ становится недостаточно для определения дефектности. В этом случае недостающую информацию дает сопоставление теоретической и пикнометрической плотностей образцов. Если подрешетка висмута имеет катионные вакансии, то это приведет к снижению плотности. В табл. 3 (столбец 2, первая строка) приведена брутто-формула соединения, а во второй её строке – преобразование к формульной единице пирохлора. Теоретическая (расчетная) плотность (столбец 4) определяется путем деления массы всех атомов, приходящихся на 8- формульных единиц пирохлора, входящих в элементарную ячейку, на объем элементарной ячейки. Соответствие экспериментальной (пикнометрической) и расчетной плотностей твердых растворов подтверждает правильность полученных термогравиметрическим методом данных по распределению атомов меди и магния по кристаллографическим позициям.
Таблица 3
Результаты расчета распределения меди и магния по подрешеткам пирохлора, дефектности и теоретической плотности для трех соединений
|
Соединения |
Формулы соединений, учитывающие позиции катионов и вакансии |
ρ р г/cм3 |
ρ п г/cм3 |
|
Bi 2 Mg 0,25 Cu 0,75 Nb 2 O 9 |
(Bi 2 Cu 0,5 )(Cu 0,25 Mg 0,25 Nb 2 )O 9 * (Bi 1,6 Cu 0,4 )(Cu 0,2 Mg 0,2 Nb 1,6 )O 7,2 ** |
6.46 |
6.40±0 15 |
|
Bi 2 Mg 0,75 Cu 0,25 Nb 2 O 9 |
(Bi 2 Cu 0,15 Mg 0,25 )(Cu 0,1 Mg 0,75 Nb 2 )O 9 * (Bi l,4 CU 0,1 Mg 0,2 ^ 0,3 )(CU 0,1 Mg 0,5 Nb l ,4 )О б,5 * |
6 30 |
6 18±0 10 |
|
Bi 2 CuNb 2 O 9 |
(Bi 2 Cu 0,14 )(Cu 0,86 Nb 2 )O 9 * (Bi i,4 CU 0,i ^ 0,5 )(CU 0,6 Nb i,4 )O 6,3 * |
6 49 |
6 40±0 11 |
Прмечания. * – формула, учитывающая распределение катионов по подрешеткам ниобия и висмута; ** – кристаллохимическая формула, нормированная к формульной единице пирохлора; ρ р – расчетная (теоретическая) плотность; ρ п – пикнометрическая плотность.
z = 4/3. В работе [11] были исследованы соединения с z = 1, 2 и 3. Для этих трех случаев δ = 1/5, –1/3 и – 5/7.
Таким образом, можно ожидать достаточно высокую кислородную проводимость у соединений с уровнем допирования z= 1 или 2, что и было подтверждено данными импеданс-спектроско-пии [11].
Так, образец Bi 2 CuNb 2 O 9 интересен тем, что имеет только один тип примеси, что позволяет определить дефектность как по синхронному термическому анализу, так и по плотности. В табл. 3 (столбец 2) приведена формульная единица этого соединения с указанием среднего количества дефектов в виде символа □ , используемого при составлении кристаллографических формул. Электронейтральность соединения обеспечивается убылью кислорода в кристаллической решетке. Знание формульной единицы Bi 2 CuNb 2 O 9 позволяет определить теоретическую плотность. Полученное значение 6,49 г/см3, рассчитанное с учетом дефектности (табл. 3), достаточно близко к пикнометрической плотности (6,40 ± 0,11) г/см3.
У соединений, имеющих оба типа катионов (меди и магния), распределение Mg по подрешеткам можно определить из анализа данных, полученных методами ДСК, ТГ и пикнометрии. Это связано с тем, что при перемещении Mg из одной подрешетки в другую изменяется дефектность висмутовой подрешетки, а следовательно, и пикнометрическая плотность образцов. Вместе с тем, введение двухвалентных катионов в структуру пирохлора увеличивает концентрацию вакансий во второй кислородной подрешетке – О`. Пусть количество катиона М2+ в формульной единице пирохлора равно z . В этом случае можно химическую формулу нио-бата висмута представить в следующем виде: (Bi z Mz )(Nb z Mz )O7 + δ . Из условия элек- 22 2 22 2
тронейтральности соединения можно определить параметр δ . Несложные расчеты дают следующую величину:
4 - 3 z δ = .
4 + z
Как указывалось выше, способностью к перемещению обладает один из семи ионов кислорода A 2 B 2 O 7 . Из теории перколяции следует, что наибольшая проводимость по кислороду возникает при одинаковой концентрации вакансий и носителей заряда (O2–), что соответствует δ = 0. В этом случае
Заключение
Применение методов ДСК, ТГ и пикнометрии, как показало проведенное исследование, позволяет в рассматриваемых твердых растворах со структурой пирохлора определять распределение катионов меди и магния по подрешеткам висмута и ниобия. В настоящее время неизвестны другие физические методы, способные решить эту задачу. Полученные данные свидетельствуют о том, что при синтезе ниобатов висмута могут формироваться как бездефектные структуры с равномерным распределением катионов меди и магния по двум подрешеткам, так и дефектные структуры с неравномерным распределением этих катионов. Это открывает новые возможности в исследовании влияния примесей и дефектности структуры на электрофизические свойства ниобатов висмута.
Список литературы Распределение атомов меди и магния по катионным позициям в твердых растворах Bi2Mg1-xCuxNb2O9 со структурой пирохлора
- Keve E.T., Skapski A.C. The crystal structure of triclinic -BiNbO4//J. Solid State Chem. 1973. Vol.8. P.159-165.
- Keve E.T., Skapski A.C. The structure of triclinic BiNbO4 and BiTaO4//Chem. Commun. 1967. No.2. P.281-283.
- Subramanian M.A., Calabrese J.C. Crystal structure of the low temperature form of bismuth niobium oxide//Mater. Res. Bull. 1993. Vol.28. P.523-529.
- Miida R., Tanaka M. Modulated structure in a fluorite-type fast-ion-conductor -(Bi2O3)1-x (Nb2O5)x//Jap. J. of Appl. Physics, 1990. Vol.29. No.10. P.1132-1138.
- The new oxygen-deficient fluorite Bi3NbO7: synthesis, electrical behavior and structural approach/A. Castro, E. Aguado, J. M. Rojo, P. Herrero, R. Enjalbert, J. Galy//Mater. Res. Bull. 1998. Vol.33. P.31-41.
- Valant M., Suvorov D. Dielectric properties of the fluorite-like BI2O3-Nb2O5 solid solution and the tetragonal Bi3NbO7//J. Amer. Ceramic Soc. 2003. Vol.86. P.939-944.
- Cann D.P., Randall C.A. Dielectric properties of Bismuth Pyrochlores//Solid State Commun. 1996. Vol. 100, No.7. P.529-534.
- Пийр И.В., Секушин Н.А., Трофимов А.Л. Структура и электрические свойства твердых растворов Bi2Mg(1-x)CuxNb2O9 (x=0-0.5)//Материалы Междунар. науч.-техн. конф. "Межфазная релаксация в полиматериалах". Ч. 2. М.: МИРЭА, 2003. С.129-131.
- Голдин Б.А., Жук Н.А., Пийр И.В., Секушин Н.А. Влияние температуры на реактивную составляющую проводимости сложных ниабатов висмута Bi2MgxCuyNb2O8+x+y (x+y=2,3)//15 Российское совещание по экспериментальной минералогии: Материалы совещания. Сыктывкар, 2005. С.226-228.
- Piir I.V. Prikhodko D.A., Ignatchenko S.V., Schukariov A.V. Preparation and structural investigation of mixed bismuth niobates, containing transition metals//Solid State Ionics, 1997. Vol.101-103. P.1141-1146.
- Секушин Н.А., Пиéр И.В. Синтез, структура и релаксационные процессы в ионопроводящей керамике Bi2Mg1-xCuxNb2O9//Электрохимия, 2011. Т. 47, № 6. С. 757-765.


