Распределение молекул межклеточной адгезии на лейкоцитах крови в зависимости от их морфологии
Автор: Шерстенникова Александра Константиновна, Кашутин Сергей Леонидович, Неклюдова Виктория Сергеевна, Калмин Олег Витальевич, Николаев Валентин Иванович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.27, 2019 года.
Бесплатный доступ
Физиологическое осмысление процессов миграции иммунокомпетентных клеток, а также условий, при которых может активизироваться или замедляться миграция, является особенно важным для интерпретации резервов стабильности и сохранения гомеостаза. Миграция лейкоцитов через эндотелий микроциркуляции регулируется молекулами адгезии. Цель исследования - изучение распределения молекул межклеточной адгезии на лейкоцитах в зависимости от их морфологии. Проведено обследование 50 практически здоровых лиц в возрасте от 20 до 60 лет, не имеющих хронической патологии в анамнезе. Венозную кровь для исследования брали утром натощак. На проточном цитометре FC-500 фирмы Beckman Coulter (США) определяли количество нейтрофилов, моноцитов и лимфоцитов венозной крови, содержащих молекулы L-селектина (CD62L), LFA-1 (CD11a), LFA-3 (CD58), ICAM-1 (CD54), PECAM-1 (CD31), при этом дифференцировали их в зависимости от морфологии. Результаты свидетельствуют, что более 50% нейтрофилов и 42% моноцитов готовы вступить в фазу скольжения, тогда как количество лимфоцитов, вступающих в данную фазу, сравнительно невелико - 11%...
Клетки крови, лейкоциты, молекулы адгезии, l-селектин
Короткий адрес: https://sciup.org/143177301
IDR: 143177301 | DOI: 10.20340/mv-mn.19(27).02.33-36
Текст научной статьи Распределение молекул межклеточной адгезии на лейкоцитах крови в зависимости от их морфологии
Шерстенникова А.К., Кашутин С.Л., Неклюдова В.С., Калмин О.В., Николаев В.И. Распределение молекул межклеточной адгезии на лейкоцитах крови в зависимости от их морфологии// Морфологические ведомости.- 2019.- Том 27.- № 2.- С. 33-36. (27).02.33-36
Sherstennikova AK, Kashutin SL, Neklyudova VS, Kalmin OV, Nikolaev VI. The distribution of molecules of the intercellular adhesion on blood leukocytes depending on their morphology. Morfologicheskie Vedomosti – Morphological Newsletter. 2019 August 5;27(2):33-36. (27).02.33-36
Введение. Миграция лейкоцитов через эндотелий микроциркуляции регулируется молекулами адгезии. Процесс миграции лейкоцитов в ткани представляет собой трехступенчатый процесс, включающий скольжение – «роллинг» лейкоцитов по поверхности эндотелия с последующей фазой прочной адгезии и заканчивающийся фазой трансмиграции лейкоцитов через эндотелий [1-2]. Роллинг лейкоцитов опосредуется низкоаффинными рецепторами – селектинами, в том числе L-селектинами [3]. Фаза прочной адгезии реализуется с участием молекул ICAM-1, LFA-1, LFA-3 [4]. Собственно миграция лейкоцитов через эндотелий связана с экспрессией молекул PECAM [5]. Сведения о концентрациях молекул адгезии на нейтрофилах, моноцитах и лимфоцитах в условиях отсутствия антигенной нагрузки единичны и противоречивы [6-7]. В литературе нет сведений относительно уровня экспрессии молекул адгезии в зависимости от морфологических особенностей нейтрофилов, моноцитов и лимфоцитов. Таким образом, следует признать, что литературные данные по этому вопросу явно недостаточны, а сама проблема находится в стадии накопления фактов [8]. Учитывая значительную физиологическую роль процессов миграции лейкоцитов из русла микроциркуляции в ткани, сведения о концентрации молекул адгезии на нейтрофилах, моноцитах и лимфоцитах с учетом их морфологических особенностей представляют теоретический и практический интерес [9]. Физиологическое осмысление процессов миграции иммунокомпетентных клеток, а также условий, при которых может активизироваться или замедляться миграция, особенно важно для интерпретации резервов стабильности и сохранения гомеостаза [10-11]. Все перечисленное определяет актуальность, перспективность и практическую значимость научного поиска регуляции миграционной активности иммунокомпетентных клеток [12-14].
Цель исследования – изучение распределения молекул межклеточной адгезии на лейкоцитах в зависимости от их морфологии.
Материал и методы исследования. Проведено обследование 50 практически здоровых лиц (22 мужчин и 28 женщин) в возрасте от 20 до 60 лет, не имеющих хронической патологии в анамнезе. Обследование проводили с письменного согласия респондентов, с соблюдением основных норм биомедицинской этики в соответствии с документом «Этические принципы проведения медицинских исследований с участием людей в качестве субъектов исследования» (Хельсинкская декларация Всемирной медицинской ассоциации 1964 года с изменениями и дополнениями на 2008 год). Венозную кровь для исследования брали утром натощак. На проточном цитометре FC-500 фирмы Beckman Coulter (США) определяли количество нейтрофилов, моноцитов и лимфоцитов венозной крови, содержащих молекулы L-селектина (CD62L, FITC), LFA-1 – Lymphocyte Function-Assosiated antigen, 1 (CD11a, FITC), LFA-3 – Lymphocyte Function-Assosiated antigen, 3 (CD58, FITC), ICAM-1 – Intercellular Adhesion Molecule-1 (CD54, FITC), PECAM-1 – Platelet/Endothelium Cell Adhesion Molecule (CD31, FITC). На мазке крови, зафиксированном смесью Никифорова и окрашенном по Романовскому-Гимзе, определяли содержание нейтрофилов, эозинофилов, базофилов, моноцитов, лимфоцитов [15]. Цитоскопическое исследование нейтрофильных лейкоцитов проводили путем подсчета среднего количества фрагментов ядра у 100 клеток [16]. В соответствии с методом, предложенным Григоровой [17], проводили дифференцировку моноцитов по морфологии ядра на промоноциты, собственно моноциты и полиморфноядерные моноциты. При изучении лимфоцитограммы дифференцировали лимфоциты по величине клетки с учетом размеров цитоплазмы: малые лимфоциты – до 8 мкм, средние – от 8 до 12 мкм, большие – больше 12 мкм. Отдельно выделяли популяцию больших гранулярных лимфоцитов, которые являются морфологическими аналогами естественных киллеров [18]. Статистическую обработку результатов проводили с помощью SPSS 13.0 for Windows. Распределение параметров было ненормальным, в связи с чем описание выборок проводили с помощью подсчета медианы (Мe) и межквартильного интервала (25 и 75 процентили). Вероятность различий оценивали по непараметрическим критериям Колмогорова-Смирнова (Z) и Вилкоксона (W). Корреляционный анализ проводили с использованием коэффициента корреляции Спирмена ( ρ ).
Результаты исследования и обсуждение. В условиях отсутствия антигенной стимуляции общее содержание нейтрофилов в крови составило 3,9 · 109/л, моноцитов 0,35 · 109/л, лимфоцитов 2,56 · 109/л. Количество нейтрофилов, имеющих рецептор L-селектина составило – 65% (40,9; 87,32), моноцитов – 42,2% (14,82; 60,0), при этом лимфоцитов с данным рецептором был невелик и составил 11,42% (4,5; 23,38). Таким образом, в условиях отсутствия антигенной стимуляции более 50% нейтрофилов готовы вступить в фазу скольжения, тогда как количество лимфоцитов, вступающих в данную фазу, сравнительно невелико. Практически все нейтрофилы - 99,35% (93,56; 100,00) и моноциты - 99,72% (92,75; 100,0) содержали молекулу LFA-1. Количество лимфоцитов с данной молекулой составил 67,97% (44,71; 77,69). Наиболее часто молекулу ICAM-1 выявляли на моноцитах - 88,88% (61,33%; 96,83), в меньшей степени на нейтрофилах - 55,74% (31,45; 71,81) и только на 11,56% (4,37; 21,6) лимфоцитах. Уровень нейтрофилов и моноцитов с молекулой LFA-3 в периферической крови был одинаков и составил 94,11% (70,25; 98,29) и 94,11% (77,08; 100,0), соответственно. Только на 33,02% (12,66; 82,6) лимфоцитах определяли данную молекулу. Молекулу PECAM-1 практически одинаково часто выявляли на нейтрофилах и моноцитах: 98,72% (92,09; 99,53) и 97,5% (80,0; 98,75), соответственно. Только 12,56% (3,7; 28,6) лимфоцитов несли данный рецептор (рис. 1).
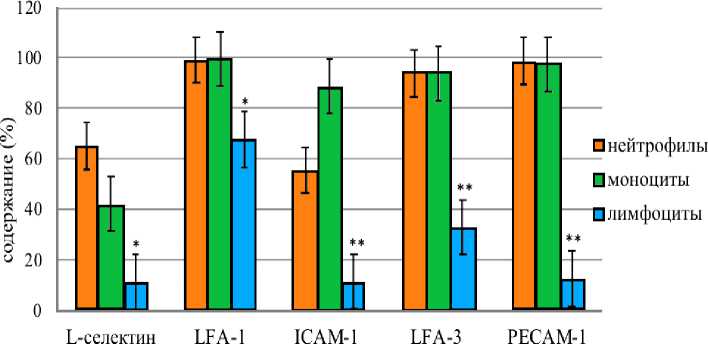
молекулы адгезии
Рис. 1. Распределение молекул адгезии на нейтрофилах, моноцитах и лимфоцитах % (Me). Статистически значимые различия *p<0,05 и при **p<0,001.
Таким образом, более чем 90% нейтрофилов и моноцитов в условиях отсутствия антигенной стимуляции готовы вступить в фазу прочной адгезии и трансмиграции. Содержание лимфоцитов в условиях отсутствия антигенной нагрузки, готовых к трансмиграции, не превышало 13%.
Анализ сегментации ядер клеток показал, что в венозной крови преобладали нейтрофилы с 3-мя (1,37·109/л; 1,04-1,81) и 4-мя (1,13·109/л; 0,9- 1,59) сегментами в ядре. Концентрации нейтрофилов с 1-м, 2-мя, 5-ю и более сегментами были сравнительно небольшие.
Корреляционный анализ между количеством нейтрофилов, несущих молекулы адгезии, и сегментацией их ядер показал наличие слабых и статистически недостоверных корреляций в случаях, когда нейтрофилы содержали 1, 2 и 3
сегмента в ядре. Статистически значимые корреляции были выявлены у 4-сегментных форм нейтрофилов: слабые - с нейтрофилами, содержащими молекулу L-селектина ( р =0,28; р=0,04), средней силы - с нейтрофилами, содержащими молекулы LFA-1 ( р =0,37; р=0,009), LFA-3 ( р =0,49; р=0,003) и сильные - при выявлении на нейтрофилах молекулы PECAM-1 ( р =0,52; р=0,01). В случаях с нейтрофилами, содержащими пять и более сегментов в ядре, все эти корреляции стали сильными и статистически значимыми: L-селектин (- р =0,51; р=0,003), LFA-1 (- р =0,55; р=0,0002), LFA-3 (- р =0,62; р=0,008), PECAM-1 (- р =0,60; р=0,002), ICAM-1 ( р =0,53; р=0,001).
Анализ структуры моноцитограммы показал, что количество промоноцитов составил 26,0% (20,0; 36,0), собственно моноцитов 40,0% (29,5; 47,0), полиморфно-ядерных моноцитов - 31,0% (24,5; 43,0) без существенных половых различий. Корреляционный анализ между содержанием моноцитов, несущих молекулы адгезии, и их различием по форме ядра показал, что в ходе дальнейшей дифференцировки ядра моноцитов появляются новые статистически достоверные корреляции. Если содержание промоноцитов коррелировало только с экспрессией молекул LFA-1 и ICAM-1 ( р =0,39; р=0,005 и р =0,43; р =0,002), то у собственно моноцитов появилась корреляция с концентрацией моноцитов, содержащих молекулу LFA-3 ( р =0,38; р=0,03), а у полиморфно-ядерных моноцитов еще и содержанием моноцитов с молекулой PECAM-1 ( р =0,45; р=0,03).
Малые лимфоциты в структуре лимфоцитограммы составили 26,0% (16,0; 37,0), средне-плазменные - 44,0% (36,0; 50,0), большие - 10,0% (5,0; 16,5), большие гранулярные лимфоциты - 16,0% (12,0; 23,5). Корреляционный анализ между содержанием лимфоцитов, несущих молекулы адгезии, и размером их цитоплазмы показал, что при увеличении размеров цитоплазмы лимфоцитов увеличивается количество статистически достоверных корреляций. Так, если содержание малых лимфоцитов коррелировало только с содержанием лимфоцитов с молекулой LFA-1 ( p =0,38; р=0,03), то концентрация среднеплазменных лимфоцитов была связаны с содержанием молекул LFA-1 ( p =0,57; р=0,001), LFA-3 ( p =0,43; р =0,016) и L-селектина ( р =0,35; р=0,013). Подобную ситуацию регистрировали также в отношении больших гранулярных лимфоцитов, тогда как между уровнем больших лимфоцитов и лимфоцитов, экспрессирующих изучаемые молекулы адгезии, статистически значимых корреляций не выявлено.
Если учитывать, что в сосудистом русле существуют два почти равных пула нейтрофилов - циркулирующий и пристеночный [19] и при заборе венозной крови считается только циркулирующий пул, можно полагать, что в условиях отсутствия антигенной стимуляции 65% нейтрофилов циркулирующего пула несут молекулы L-селектина, 99,35% - молекулы LFA-1, 55,74% - ICAM-1, 94,11% - LFA-3, 98,72% - PeCaM-1. Если учитывать, что L-селектин участвует в механизме формирования пристеночного пула, обеспечивая роллинг-эффект, можно полагать, что 65% циркулирующих нейтрофилов способны пополнить пристеночный пул [10]. Известно, что адгезия, вызванная селектинами, обратима, кратковременна и малоэффективна. Более прочную и необратимую адгезию нейтрофилов на эндотелии обусловливают В 2 -интегрины, к которым относится молекула LFA-1 [15, 19]. В соответствии с результатами исследования 99,35% нейтрофилов циркулирующего пула имели эту молекулу, что несколько больше, чем количество нейтрофилов с молекулой L-селектина (65%). Учитывая возможность протеолитического отщепления молекулы L-селектина при экспрессии на нейтрофилах 6 2 -интегринов на клеточной поверхности, что определяется как шеддинг-феномен, можно предполагать, что шеддинг молекул L-селектина проявляется среди нейтрофилов циркулирующего пула достаточно активно [16].
Циркулирующие нейтрофильные лейкоциты имеют на своей поверхности молекулы адгезии: ICAM-1, LFA-3, PECAM-1. Учитывая, что транс-эндотелиальная миграция нейтрофилов опосредована, в том числе этими молекулами, можно полагать, что у нейтрофилов циркулирующего пула имеются все необходимые возможности для трансмиграции [5, 14]. В соответствии с результатами исследования установлено отсутствие корреляций между концентрацией нейтрофилов, имеющих молекулы межклеточного взаимодействия с содержанием нейтрофилов с 1-, 2- и 3- сегментами в ядре. Наличие корреляций с 4-мя, а тем более с 5-сегментными формами, позволяет предполагать, что при отсутствии антигенной стимуляции молекулы адгезии начинают выявляться на 4-сегментных формах, тогда как в полной мере этот процесс проявляется у нейтрофилов с 5-ю и более сегментами в ядре.
В условиях отсутствия антигенной стимуляции 42,2% моноцитов имеют молекулы L-селектина, 99,72% молекулы LFA-1, 88,88% - ICAM-1, 94,11% - LFA-3, 97,50% - PECAM-1. В соответствии с результатами исследования практически все моноциты (99,72%) несли молекулу LFA-1, что в 2 раза больше, чем число моноцитов, содержащих молекулу L-селектина (42,2%). Можно полагать, что шеддинг молекул L-селектина среди моноцитов протекает достаточно активно, и значительно активнее, чем у нейтрофилов. С другой стороны, более низкая экспрессия молекул L-селектина на моноцитах при увеличении на них экспрессии молекулы ICAM-1 может быть связана с увеличением секреции TNF-a и активизации цитотоксичности моноцитов [13, 20].
Содержание моноцитов периферической крови, несущих молекулы адгезии ICAM-1, LFA-3, PECAM-1, был чрезвычайно высоким в сравнении с концентрацией нейтрофилов, несущих молекулы межклеточного взаимодействия, на основании чего можно полагать, что процессы трансмиграции, особенно полиморфно-ядерных моноцитов, в условиях отсутствия какой-либо антигенной стимуляции достаточно активны. Подтверждением этому может служить наличие статистически достоверных корреляций между содержанием полиморфно-ядерных моноцитов и уровнем моноцитов, имеющих молекулы адгезии, участвующих во всех этапах миграции, в фазе скольжения, прочной адгезии и трансмиграции.
В условиях отсутствия антигенной стимуляции 11,42% лимфоцитов содержали молекулы L-селектина, 67,97% молекулы LFA-1,11,56% - ICAM-1,33,02% - LFA-3,12,56% - PECAM-1. В соответствии с результатами исследования большая часть лимфоцитов (67,97%) экспрессировали молекулу LFA-1, что в 6 раз больше по сравнению с лимфоцитами, содержащими молекулу L-селектина (11,42%). Вероятно шеддинг молекул L-селектина среди лимфоцитов протекает достаточно активно, и значительно активнее, чем у нейтрофилов и моноцитов. Кроме того, учитывая статистически достоверные корреляции между уровнем средне-плазменных лимфоцитов, а также больших гранулярных лимфоцитов и концентрацией лимфоцитов, несущих молекулы LFA-1 и LFA-3, можно предполагать, что к миграции более предрасположены средне-плазменные лимфоциты и большие гранулярные лимфоциты, идентифицированные как естественные киллеры [18, 21]. С учетом того, что уровень больших лимфоцитов может свидетельствовать о лимфо-пролиферации, создается впечатление, что при лимфо-пролиферации лимфоциты обладают меньшей способностью к адгезии, а, следовательно, и трансмиграции [3, 11].
Заключение . Итак, в условиях отсутствия антигенной стимуляции наибольшая готовность к реализации фазы скольжения, прочной адгезии и непосредственно трансмиграции наблюдалась у нейтрофилов с 5-сегментами в ядре и полиморфно-ядерных моноцитов. Готовность к трансмиграции лимфоцитов была сравнительно невелика и касалась, в основном, средне-плазменных лимфоцитов и больших гранулярных лимфоцитов.
Список литературы Распределение молекул межклеточной адгезии на лейкоцитах крови в зависимости от их морфологии
- Smith CJ. Adhesion molecules and receptors. J Allergy Clin Immunol. 2008;3(2):375-379.
- Wallez Y, Huber P. Endothelial adherens and tight junction in vascular homeostasis, inflammation and angiogenesis. J Biochim Biophys Acta. 2008;1778(3):794-809.
- Vestweber D. Lymphocyte trafficking through blood and lymphatic vessels: more than just selectins, chemokines and integrins. J Eur J Immunol. 2003;33(5):1361-1364.
- Scheglovitova O, Scanio V, Fais S et al. Antibody to ICAM-1 mediates enhancement of HIV-1 infection of human endothelial cells. J Arch Virol. 1995;140(5):951-958.
- Murciano JC, Muro S, Koniaris L et al. ICAM-directed vascular immunotargeting of anti-thrombotic agents to the endothelial surface. J Blood. 2003;101(10):3977-3984.
- Cinkernagel' R. Osnovy immunologii.- M.: Mir, 2008.- 136s.
- Vestweber D. Endothelial cell contacts in inflammation and angiogenesis. J Int Congr Ser. 2007;1302:17-25.
- Filippova O.E., Popovskaya E.V., Shashkova E.YU., Shchegoleva L.S. Aktivnost' limfoidnyh receptorov limfoproliferacii i apoptoza v fiziologicheskoj regulyacii immunnogo gomeostaza pri adaptacii cheloveka k menyayushchimsya usloviyam sredy (obzor). Vestnik Severnogo (Arkticheskogo) federal'nogo universiteta. Seriya: Mediko-biologicheskie nauki. 2016;1;87-99.
- Pal'cev M.A. Mezhkletochnye vzaimodejstviya.- M.: Medicina, 1995.- 224s.
- Dolgushin I.I., Buharin O.V. Nejtrofily i gomeostaz.- Ekaterinburg, 2001.- 136s.
- Bajgil'dina A.A., Galieva A.T., Kamilov F.H. Patogeneticheskoe znachenie nekotoryh citokinov i belka kletochnoj adgezii VCAM*1 v razvitii vospalitel'nyh izmenenij ehndoteliya sosudov pri gemorragicheskoj lihoradke s pochechnym sindromom. Morfologicheskie vedomosti. 2008;3-4:158-161.
- Hayashida K, Bartlett AH, Chen Y, Park PW. Molecular and cellular mechanisms of ectodomain shedding. J Anat Rec (Hoboken). 2010;293(6):925-937.
- Reymond N. DNAM-1 and PVR regulate monocyte migration through endothelial junction. J Exp Med. 2004;199(10):1331-1341.
- Witkowska AM, Borawska MH. Soluble intercellular adhesion molecule-1 (sICAM-1): an overview. J Eur Cytok Netw. 2004;15(2):91-98.
- Pinegin B.V. Nejtrofily: struktura i funkciya. Immunologiya.- 2007;28(6):374-382.
- Todorov J.T. Klinicheskie laboratornye issledovaniya v pediatrii.- Sofiya, 1968.- 784s.
- Grigorova O. P. Rol' monocitarnoj sistemy v reaktivnosti organizma.- M.: Medgiz, 1958.- 105s.
- Zak K.P., Kindzel'skij L.P., Butenko A.K. Bol'shie granulosoderzhashchie limfocity i patologicheskie processy.- Kiev: Naukova dumka, 1992.- 205s.
- Garton KJ, Gough PI, Raines EW. Emerging role for ectodomain shedding in the regulation of inflammatory responces. J Leukem Biol. 2006;79(6):1105-1679.
- Rauert H, Wicovvsky A, Miller N et al. Membrane tumor necrosis factor (TNF) induces p100 processing via TNF receptor-2 (TNFR2). J Biol Chem Mar. 2010;285(10):7394-7404.
- Camagna A, Cedrone L, Care A et al. Polyclonal expansion of CD3(+)/CD4(+)/CD56(+) large granular lymphocytes and autoimmunity associated with dysregulation of Fas/FasL apoptotic pathway. Br J Haematol. 2001:112(1):204-207.


