Распространение бактерий, обладающих системами трансформации нитрилов и эфиров, в почвах умеренной и степной зоны
Автор: Кузнецова М.В., Максимова А.В., Ремезовская Н.Б., Максимов А.Ю.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
В почвенных образцах исследован состав бактерий, трансформирующих нитрилы и эфиры. Количество бактерий, трансформирующих нитрилы, в разных почвах колебалось от 1105 до 3,64107, эфиры - от 2,0104 до 8,21107. Показано, что большее количество бактерий, утилизирующих альдоксимы, нитрилы и амиды, содержится в дерново-луговых почвах, а эфиры - в степных почвах с повышенным засолением. Установлено, что большинство нитрилметаболизирующих изолятов устойчиво к высоким концентрациям исследованных субстратов (0,5 М и более). Токсичность для них возрастала в ряду ацетамид-ацетонитрил-ацетальдоксим. Эфирутилизирующие бактерии росли при высоких концентрациях этилацетата (более 1 М). Выделены культуры бактерий с высокой активностью ферментов нитрилгидратазы, амидазы и эстеразы, перспективные для биотехнологии комплексной очистки сточных вод и химическимодифицированной почвы.
Засоленные почвы, почвенные бактерии, учет численности, трансформация нитрилов, амидов и эфиров
Короткий адрес: https://sciup.org/147204908
IDR: 147204908 | УДК: 579.26:579.222.4
Текст научной статьи Распространение бактерий, обладающих системами трансформации нитрилов и эфиров, в почвах умеренной и степной зоны
Обширная группа почвенных микроорганизмов способна использовать в качестве углерода и/или азота такие синтетические вещества, как альдоксимы, нитрилы карбоновых кислот и сложные эфиры (Kato et al., 2000; Brandao, 2002; Bornscheuer, 2002). Физиологическая роль метаболических систем, участвующих в деградации данных соединений, до сих пор остается до конца не выясненной, однако они встречаются у микроорганизмов, выделенных из различных типов почв. У бактерий трансформация альдоксимов идет за счет альдоксимдегидратаз, нит-рильные вещества гидролизуются при помощи нит-рилгидратаз и нитрилаз, образующиеся амиды конвертируются амидазами до соответствующих карбоновых кислот. Эфиры утилизируются эстеразами.
альдоксимдегидратаза нитрилгидратаза R-CH=NOH --► R-CN + H 2O -- ► R-CONH 2
амидаза
R-CONH2 + H2O ---► R-COO– +NH4+ альдоксимдегидратаза нитрилаза R-CH=NOH --► R-CN + H2O --► R-COO– +NH4+ эстераза
R-COOR′ + H2O --► R-СОOH + HO-R′
Ранее нами показано, что штаммы бактерий, метаболизирующие нитрилы карбоновых кислот, ши- роко представлены в различных типах почв Западного Урала. Их численность значительно повышается при загрязнении среды акрилонитрилом (Кузнецова и др., 2007).
В данной работе изучено распространение бактерий, утилизирующих альдоксимы, нитрилы, амиды и эфиры в почвах естественной среды, в том числе с повышенным засолением.
Материалы и методы
Для изучения были использованы образцы почв естественной среды Пермского края, Челябинской и Волгоградской областей, представленные главным образом широко распространенными подзолистыми и каштановыми почвами, в том числе почвами с повышенным засолением (табл. 1).
Общее количество гетеротрофных бактерий в исследуемых почвах определяли методом питательных пластин (МПА) в сочетании с методом последовательных разведений (Методы…, 1991; Практикум…, 2004). Подсчет колоний производили на 3-ем, 4-ом и 5-ом разведении после инкубации чашек в течение трех суток при 30°С. Бактерии, метаболизирующие изучаемые вещества, подсчитывали, высевая почвенный экстракт в раз-
ведении 100, 10-1, 10-2 на минеральную солевую агаризованную среду следующего состава (г/л): KH2PO4 – 1,0, K2HPO4·3H2O – 1,6, NaCl – 0,5 (30,0 – для высева из почв с засолением), MgSO4·7H2O – 0,5, CaCl2·2H2O – 0,005, FeSO4 7H2O – 0,01, CoCl2·6H2O – 0,01, агар-агар – 6,0, рН 7,2–7,4. В среду предварительно добавляли один из субстратов в концентрации 10 мМ: ацетальдоксим (АцАд), ацетонитрил (АцН), ацетамид (АцА), этилацетат (ЭА) и бутилацетат (БА). Колонии под- считывали на 3–5-е сутки под малым увеличением (×10). Для подсчета грамположительных бактерий использовали богатую среду с полимиксином М (10 мг/мл), грамотрицательных – с метиленовым красным (150 мкг/мл). Для исключения грибковой микрофлоры в среды добавляли актидион (100 мкг/мл). Численность микроорганизмов определяли как количество клеток в пересчете на 1 г сухой почвы.
Таблица 1
Характеристика модельных образцов почв
|
Типы почв |
Обозначение образца |
Глубина отбора проб, см |
Примечание |
|
Техногенно-засоленная почва (соле-отвал) |
С1 |
10 |
г. Соликамск |
|
Солончак |
С2 |
10 |
Троицкий заказник, |
|
Солончак злостный с солевой коркой |
С3 |
10 |
Челябинская область |
|
Солонец |
С6 |
10 |
|
|
Солодь |
ризосфера |
10 |
|
|
Дерново-луговая с пониженным увлажнением |
П25 |
5 |
Краснокамский район |
|
Дерново-луговая с повышенным увлажнением |
П26 |
5 |
|
|
То же |
П27 |
20 |
|
|
Каштановая почва степной зоны |
НС |
10 |
Волгоградская область |
|
То же |
НО |
30 |
|
|
Иловые речные отложения |
ПО |
10 |
р. Волга-Ахтуба |
Для выделения и дальнейшего культивирования бактерий применялась минеральная безазотная солевая среда N, содержащая в качестве селективного фактора соответствующий субстрат (Watanabe et al., 1987; Layh et al., 1997). В качестве источника углерода использовали 0,1% глюкозу, источника азота – 10 мМ сульфат аммония.
Минимальные ингибирующие концентрации АцАд, АцН, АцА, ЭА и БА измеряли в суспензионном тесте на 96-луночных планшетах следующим образом. В каждую лунку планшета вносили по 100 мкл свежей питательной среды Луриа-Бертани (LB). В рядах планшета последовательно готовили серийные двукратные разведения тестируемых нитрила или амида в диапазоне концентраций от 65 мМ до 8 М; для ацетальдоксима – от 7,5 мМ до 1 М, для этилацетата – от 26 мМ до 2,55 М, для бутилацетата – от 20 мМ до 1,89 М. После этого в каждую лунку добавляли свежевы-ращенную культуру одного из исследуемых штаммов до рабочей концентрации 105 кл./мл. В отдельных лунках готовили контроли роста и стерильности среды. Учет результатов производили на планшетном спектрофотометре Benchmark Plus (Bio-Rad, США) через 24 часа инкубирования. Для определения МИК эфиров вводили дополнительную стадию: планшеты инкубировали в термостате при температуре 30°С, через 24 часа роста из каждой лунки отбирали по 10 мкл суспензии и высевали каплями на агаризованную среду LB (для контроля живых клеток). Учет проводили визуально. За минимальную ингибирующую концен- трацию принимали такую концентрацию субстратов, которая вызывала 50% гибель клеток.
Результаты исследований
Количество гетеротрофов варьировалось от 2,67×106 кл./г сух. почвы в районе солончака до 2,17×1010 в степной почве (нижний профиль). Во «влажных» почвах отмечено более высокое содержание грамотрицательных бактерий. Количество спорообразующих бактерий в почвах не превышало 105 кл./г сух. почвы (например: 1,87×104 – образец С1, 1,14×105 – образец НС).
Проанализировано распространение альдоксим-, нитрил- и амидконвертирующих микроорганизмов (рис. 1). В результате проведенных исследований установлено, что бактерии, способные к утилизации АцАд, АцН, АцА, достаточно часто встречаются в почвах естественной среды (П25, П26, П27, НС, НО, ПО), включая почвы с повышенным содержанием соли (С2, С6, ризосфера). В образце С3 не обнаружено ни одной из изучаемых групп микроорганизмов. Количество бактерий, трансформирующих альдоксимы, колебалось от 3×104 до 2,14×107, нитрилы – от 1×105 до 3,64×107, амиды – от 1,1×105 до 2,45×107. Показано широкое распространение утилизирующих АцАд, АцН, АцА бактерий в дерново-луговых почвах с повышенным увлажнением под богатой травянистой растительностью, отличающихся высоким содержанием органических веществ, обширным комплексом биологически активных веществ, набором микроэлементов. Такие бактерии широко распро- странены и в почвах с повышенным засолением. Более того, число альдоксимутилизирующих микроорганизмов из всех «солевых» почв было наибольшим в солончаковой (С2), а число конвертирующих амиды – в почвах с умеренным засолением. Количество бактерий, утилизирующих этилацетат, варьировало от 6,0×104 до 5,79×107, бутилацетат – от 2,0×104 до 8,21×107 (рис. 2).
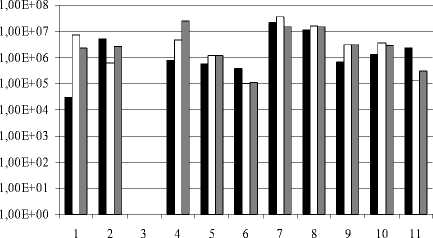
Рис. 1 . Содержание альдоксим- (■), нитрил-(□) и амидутилизирующих (■) бактерий в изучаемых почвах:
1 – С1; 2 – С2; 3 – С3; 4 – С6; 5 – ризосфера; 6 – П25; 7 – П26; 8 – П27; 9 – НС; 10 – НО; 11 – ПО
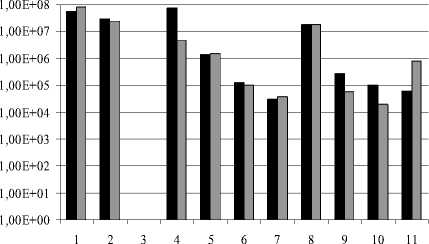
Рис. 2 . Содержание бактерий, утилизирующих этилацетат (■) и бутилацетат (□) в изучаемых почвах:
1 – С1; 2 – С2; 3 – С3; 4 – С6; 5 – ризосфера; 6 – П25; 7 – П26; 8 – П27; 9 – НС; 10 – НО; 11 – ПО
Отношение количества растущих на ацетальдоксиме бактерий к общему числу гетеротрофов в большинстве проб почв не превышало 1%, в основном составило 0,3–0,5%, а для засоленных почв – 0,05–0,1%, в том числе в солеотвале С1 – 0,01%. Обратная тенденция выявлена для эфиру-тилизирующих микроорганизмов: в засоленных почвах их доля была больше (рис. 3). Исключением стала дерново-луговая почва с пониженным увлажнением (П25), где удельный вес таких бактерий, выросших на этил- и бутилацетате, составил 4,68 и 3,74% соответственно.
Дальнейшая селекция была направлена на выявление штаммов с высокой ферментативной активностью к изучаемым субстратам. В результате из почвы выделено 47 изолятов, утилизирующих АцАд, 27 – АцН, 29 – АцА, 56 – ЭА и/или БА. Нужно отметить, что большая часть клонов с раз- личными ферментными системами изолирована из почв с повышенным засолением. Так, 46 эфирути-лизирующих штаммов (82,1% всех активных клонов) выделено из образца «ризосфера». Проведена первичная оценка видового разнообразия микрофлоры исследуемых объектов. Обращает на себя внимание то, что большая часть штаммов, хорошо утилизирующих АцАд, была отнесена к грамотри-цательным бактериям (роды Pseudomonas, Azoto-bacter и Acidovorax), а нитрил- и амидконверти-рующие изоляты – к грамположительным (Nocardia, Rhodococcus). Грампринадлежность бактерий, утилизирующих эфиры, зависела от типа почвы: в каштановых почвах, иловых отложениях преобла- дали грамотрицательные представители, в засо- ленных – грамположительные.
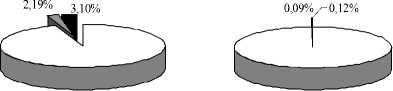
А В
Рис. 3 . Доля бактерий, утилизирующих этилацетат (■) и бутилацетат (■) в почвах С1 (А) и ПО (В) в общем количестве гетеротрофов (□)
Определены минимальные ингибирующие рост бактерий концентрации АцАд, АцН, АцА для некоторых штаммов, изолированных на ацетальдоксиме из разных почв (табл. 2).
Таблица 2
Минимальные ингибирующие концентрации нитрилов и амидов некоторых изолятов
|
Штамм |
МИК, М |
|||
|
АцАд |
АцН |
АцА |
||
|
С1-3 |
0,5 |
1,0 |
2,0 |
|
|
С1-5 |
0,5 |
0,5 |
2,0 |
|
|
С6-6 |
0,5 |
0,5 |
2,0 |
|
|
С6-10 |
0,5 |
0,5 |
2,0 |
|
|
С6-11 |
0,25 |
0,5 |
2,0 |
|
|
Р14 |
0,25 |
1,0 |
4,0 |
|
|
Р17 |
0,5 |
2,0 |
4,0 |
|
|
Р18 |
0,5 |
1,0 |
4,0 |
|
|
НС20 |
0,25 |
0,5 |
2,0 |
|
|
НС21 |
0,25 |
0,5 |
2,0 |
|
|
НО23 |
0,5 |
0,5 |
2,0 |
|
|
НО26 |
0,25 |
1,0 |
2,0 |
|
|
С1А |
ЭА |
БА |
||
|
1,27 |
0,95 |
|||
|
ПО ЭА 11 |
1,27 |
0,95 |
||
|
НС1 |
1,27 |
0,47 |
||
|
НО ЭА 6 |
2,55 |
1,89 |
||
|
НО БА 12 |
1,27 |
0,95 |
||
Все штаммы были устойчивы к высоким концентрациям исследованных субстратов. Токсичность нарастала в ряду АцА→АцН→АцАд. Клетки четырех штаммов были устойчивы к 0,25 М ацетальдоксиму. Наименьшее ингибирующее дей- ствие оказывал ацетамид: все культуры росли при концентрации амида 1 М (6% раствор). Устойчивость выделенных изолятов не зависела от степени солености почвы. Культуры, изолированные на ацетальдоксиме (10 мМ), были устойчивы к более высоким концентрациям как селективного субстрата (в 25 раз превышающим концентрации в среде выделения), так и соответствующего нитрила и/или амида. При определении МИК двух эфиров обнаружено, что все штаммы способны расти при более высоких концентрациях этилацетата, тогда как природный бутилацетат подавлял рост в концентрации более 1 М.
Заключение
Почвы, несмотря на различные, в том числе и техногенные, воздействия, способны поддерживать гомеостаз за счет регуляторных механизмов, основанных на микробном пуле и пуле ферментов, контролирующих синтетико-деструктивные биохимические процессы в почве (Звягинцев, 1978; 2003; Хазиев, 1982). Источником ферментов, участвующих в процессах «самоочищения» почв от экзогенных веществ, трансформирующих, нейтрализующих, разрушающих несвойственные почвам вещества, которые могут быть токсичными изначально или в результате их накопления выше определенных пределов, в большинстве случаев являются микроорганизмы (Исмаилов, 1988; Пиков-ский, 1988). Ферменты микроорганизмов играют важную роль в сохранении биохимического равновесия в почве при ее различных загрязнениях (Хазиев, 1982). Благодаря ферментному пулу метаболизм почвы может сохраняться стабильным, даже если условия окружающей среды неблагоприятны для жизнедеятельности микроорганизмов.
Результаты проведенных исследований свидетельствуют о том, что штаммы бактерий, трансформирующие нитрилы карбоновых кислот и эфиры, широко представлены в различных типах почв, включая почвы с повышенным засолением. Более того, именно из последних выделены культуры с высокой активностью ферментов (нитрилгидрата-зы, амидазы, эстеразы). Микроорганизмы, активно утилизирующие нитрилы и эфиры, являются важнейшим фактором детоксикации данных загрязнений и перспективным объектом для локальной очистки стоков.
Большое значение для биотехнологического применения выделенных бактерий – активных деструкторов нитрилов, амидов и эфиров имеет определение резистентности к высоким концентрациям этих соединений в среде. С учетом того, что минимальные ингибирующие концентрации этих соединений для большинства изолятов высоки, микробные сообщества данных культур могут быть использованы в биоремедиации загрязненных территорий (при разливах нитрильных соединений, вымывании акриламида из полиакрилатных цементирующих компонентов, утечке компонентов лакокрасочных производств и др.).
Таким образом, выделенные штаммы микроорганизмов могут служить базой для создания консорциумов биодеструкторов при разработке биотехнологий комплексной очистки почвы, воды, сточных вод.
Работа поддержана программой Президиума РАН «Биологическое разнообразие», АВЦП «Развитие научного потенциала высшей школы (2009– 2010 годы)», проект № 2.1.1.6252.
Список литературы Распространение бактерий, обладающих системами трансформации нитрилов и эфиров, в почвах умеренной и степной зоны
- Доронина Н.В. и др. Биодеградация метилацетата и этилацетата иммобилизованными клетками Pseudomonas esteropholus//Прикл. биохимия и микробиология. 2006. Т. 42, № 1. С. 52-54.
- Звягинцев Д.Г. Почва и микроорганизмы. М.: Изд-во МГУ, 1987. 256 с.
- Исмаилов Н.М. Микробиологическая и ферментативная активность нефтезагрязненных почв//Восстановление нефтезагрязненных почвенных экосистем. М.: Наука, 1988. С. 42-57.
- Исмаилов Н.М., Пиковский Ю.И. Современное состояние методов рекультивации нефтезагрязненных земель//Восстановление нефтезагрязненных почвенных экосистем. М.: Наука, 1988. С. 222-236.
- Кузнецова М.В. и др. Распространение нитрилконвертирующих бактерий в почвах Пермского края//Вестн. Перм. ун-та. 2007. Вып. 5(10). С. 96-99.
- Методы почвенной микробиологии и биохимии/под ред. Д.Г. Звягинцева. М.: Изд-во МГУ, 1991. 304 с.
- Теппер Е.З., Шильникова В.К., Переверзева Г.И. Практикум по микробиологии. М.: Дрофа, 2004. 256 с.
- Хазиев Ф.Х. Системно-экологический анализ ферментативной активности почв. М.: Наука, 1982. 204 с.
- Экология микроорганизмов/под ред. А.И. Нетрусова. М.: Академия, 2004. 272 с.
- Bornscheuer U.T. Microbial carboxyl esterases: classification. properties and application in biocatalysis//FEMS Microbiol. reviews. 2002. Vol. 26. P. 73-81.
- Brandao P.F.B., Clapp J.P., Bull A.T. Discrimination and taxonomy of geographically diverse strains of nitrile-metabolizing actinomycetes using chemometric and molecular sequencing techniques//Environ. Microbiol. 2002. Vol. 4, N 5. Р. 262-276.
- Kato Y., Ooi R., Asano Y. Distribution of aldoxime dehydratase in microorganisms//Appl. Environ. Microbiol. 2000. Vol. 66. P. 2290-2296.
- Kobayashi M., Nagasawa T., Yamada H. Enzymatic synthesis of acrylamide: a success story not yet over//Trends Biotechnol. 1992. Vol. 10. P. 402-408.
- Layh N. et al. Enrichment strategies for nitrilehydrolysing bacteria//Appl. Microbiol. Biotechnol. 1997. Vol. 47. P. 668-674.
- Watanabe I., Satoh Y., Enomoto K. Screening, isolation and taxonomical properties of microorganisms having acrylonitrile-hydrating activity//Agric. Biol. Chem. 1987. Vol. 51. P. 3193-3199.


