Распространение и потенциальная активность углеводородокисляющих бактерий в воде Среднего и Северного колен Кольского залива
Автор: Литвинова Марина Юрьевна, Ильинский Владимир Викторович, Семененко Михаил Николаевич, Перетрухина Инга Владимировна
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 3 т.15, 2012 года.
Бесплатный доступ
В статье представлены данные о численности и распределении микроорганизмов в поверхностном слое вод Кольского залива Баренцева моря. Работы проводились на трѐх станциях, расположенных в среднем и северном коленах залива. Исследованы общая численность микроорганизмов по прямому счету, количество углеводородокисляющих бактерий и их активность. Численность углеводородокисляющих бактерий в зависимости от сезона года колебалась от нескольких десятков до нескольких тысяч клеток в 1 мл морской воды. Показатель естественной минерализации (ПЕМокт) углеводородов, измеренных в пробах воды при температурах in situ c использованием 14С-октадекана в качестве субстрата, в водах Кольского залива варьировал от 0,069 до 0,134 мкг·л-1·ч-1. Согласно сделанным расчѐтам, за сутки микроорганизмами в воде среднего и северного колен окисляется в среднем не более 1/4 присутствующих в акватории Кольского залива углеводородов.
Общая численность бактерий, кольский залив, углеводородокисляющие микроорганизмы, активность бактерий
Короткий адрес: https://sciup.org/14294484
IDR: 14294484
Текст научной статьи Распространение и потенциальная активность углеводородокисляющих бактерий в воде Среднего и Северного колен Кольского залива
Настоящая статья посвящена оценке роли микроорганизмов в процессах естественного очищения Кольского залива от нефтяного загрязнения. Вклад микроорганизмов в процессы естественного очищения его акватории от нефтяных углеводородов практически не изучен, имеются отдельные данные только о литоральной зоне этого залива ( Перетрухина , 2006а). Полученные нами данные об углеводородокисляющей активности гетеротрофных бактерий в открытых водах Кольского залива могут быть использованы как для расчета максимально допустимых нагрузок на данную водную экосистему, так и для учета вклада микроорганизмов в процессы ее естественного очищения от нефтяного загрязнения.
Микробиологические наблюдения в водных массах Кольского залива проводили на трёх станциях, располагавшихся в среднем и северном коленах. Первая станция находилась на выходе из залива, на границе северного колена и Баренцева моря. Влияние городских и промышленных стоков по причине удаленности от городов и поселков здесь минимально. Вторая станция находилась в середине северного колена Кольского залива. На берегу, напротив этой станции, расположены ЗАТО Александровск и посёлок Тюва-Губа,
инфраструктура которых включает промышленные предприятия. Бытовые и промышленные стоки от населенных пунктов спускаются непосредственно в залив с минимальной степенью очистки. Третья станция находилась в центральной части залива, в среднем колене, возле города Североморска, где располагается база крупнейшего в стране атомного флота. Бытовые и промышленные стоки и города, и базы спускаются непосредственно в залив, не
Рис. 1. Схема отбора проб в Кольском заливе подвергаясь какой-либо значительной очистке.
Микробиологические наблюдения проводили в период с декабря 2009 г. по ноябрь 2010 г. Отбор проб воды осуществляли с борта судна "Клавдия Еланская" стерильным батометром-бутылкой. Пробы обрабатывали не позднее 3-4 ч после их отбора в лаборатории кафедры микробиологии МГТУ.
Окраску бактерий для прямого счёта проводили непосредственно в пробах воды водным раствором акридинового оранжевого (конечная концентрация – 1:10 000). Подсчёт клеток осуществляли с помощью люминесцентного микроскопа МИКМЕД-2 не менее чем в 20 полях зрения.
Для определения численности углеводородокисляющих бактерий (УОБ) использовали среду ММС с добавлением в качестве единственного источника углерода и энергии дизельного топлива марки "летнее" ( Практическая гидробиология , 2006). Численность УОБ определяли методом предельных разведений. Наиболее вероятное количество бактерий определяли по таблице Мак-Креди ( Руководство… , 1980). Все посевы делали в четырёх повторностях и инкубировали их при температуре 10 °С.
Для оценки потенциальной углеводородокисляющей (УВ-окисляющей) активности гетеротрофных бактерий использовали меченый углеводород – 14С-октадекан ( Ильинский, Семененко , 1994). Данный метод основан на пассивном поглощении раствором щелочи меченого 14СО 2 , образовавшегося в ходе минерализации бактериями 14С-углеводорода. Учитывали как количество меченого углекислого газа, образованного микроорганизмами, так и количество меченого углерода, включенного в состав их клеток. Определение содержания 14С-углерода проводили на жидкостном сцинтилляционном счетчике Mark-3 на кафедре радиохимии Химического факультета МГУ им. М.В. Ломоносова.
Химические анализы воды были выполнены в ГУ "Мурманское управление по гидрометеорологии и мониторингу окружающей среды". Для этого использовались методы, принятые и сертифицированные в области мониторинга загрязнения окружающей природной среды (РД 52.10.24392, РД 52.18.595-96).
Для статистической обработки полученных данных использовали пакет статистических программ Statistica 6.0.
-
3. Результаты и обсуждение
Поскольку основная часть нефти состоит из углеводородов (УВ), с нефтяным загрязнением в среду поступает главным образом углерод. Микроорганизмам же кроме углерода необходимы также азот и фосфор, входящие в состав их клеток. Содержание этих биогенных элементов в морской воде очень мало, поэтому минеральные соединения азота и фосфора наиболее часто в этом случае выступают факторами, лимитирующими активность гетеротрофных микроорганизмов ( Кураков и др ., 2006).
По данным ГУ "Мурманское УГМС" концентрации фосфатов на исследованных станциях в период с марта по август колебались от 2 до 32 мкг/л. Содержание в воде нитритов было весьма низким – их концентрации находились в пределах от 1 до 2,1 мкг/л. Содержание нитратов варьировало от 2 до 93 мкг/л.
Между тремя обследованными станциями в содержании в воде нитритов, нитратов и фосфатов обнаружены различия. Наибольшие концентрации этих ионов в воде всегда отмечались на ст. 3, а наименьшие – на ст. 1. Ст. 2 по содержанию биогенных элементов занимала промежуточное положение. Это, скорее всего, свидетельствует о наибольшем загрязнении ст. 3 бытовыми сточными водами. В целом уровень содержания биогенов на обследованных станциях в период с октября по август оставался достаточно высоким.
Увеличение солености, как и ее уменьшение, также способно оказывать влияние на скорость биодеградации нефтяных углеводородов морскими бактериями. Показатели солености на ст. 1 (34 ‰) значительно превышают значения ст. 2 и 3 (26 и 22 ‰ соответственно), что свидетельствует о большей степени опреснения водных масс на последних двух станциях за счет речных стоков. Расположенная мористее ст. 1 более подвержена влиянию вод из открытой части Баренцева моря.
Окисление углеводородов микроорганизмами наиболее активно проходит в аэробных условиях. Поэтому им необходимо наличие в воде достаточного количества свободного или растворенного кислорода. Его содержание в водах северного колена колеблется в пределах от 8,02 до 9,83 мг O 2 /л, для среднего колена этот показатель варьирует от 7,74 до 8,43 мг O 2 /л.
УВ присутствовали на всех трех исследованных станциях, за исключением одного срока наблюдений (в декабре) на ст. 1. Их содержание в период наших наблюдений варьировало от аналитического нуля до 51 мкг/л в зависимости от сезона и расположения станции, т.е. практически постоянно было ниже ПДК (50 мкг/л). При этом наибольшие концентрации УВ постоянно наблюдались на ст. 3, а наименьшие – на ст. 1. Ст. 2 по содержанию УВ занимала промежуточное положение.
Таким образом, все три обследованные станции заметно различались между собой по содержанию биогенов и УВ, причем наиболее высокие значения этих параметров практически всегда регистрировались на ст. 3, а наиболее низкие – на ст. 1. Эти различия, скорее всего, обусловлены разной степенью антропогенного влияния на эти станции. Оно было максимально на ст. 3 и минимально – на ст. 1. Различия по солености наиболее велики между ст. 1 с одной стороны и ст. 2 и 3 – с другой.
Температура воды на станциях в осенне-зимний период варьировали от 1 до 7 °С и от 7 до 10 °С – в весенне-летний сезон (табл.).
Общая численность бактерий (ОЧБ) на обследованных нами станциях колебалась в пределах одного порядка – от 3,1۰106 до 2,1۰107 кл/мл ( Литвинова и др. , 2011). Максимумы этого показателя обнаружены на всех трёх станциях летом, в августе месяце. Они составили: на ст. 1 – 1,2۰107 кл/мл, ст. 2 – 1,5۰107 кл/мл, ст. 3 – 2,1۰107 кл/мл. Минимальные значения ОЧБ наблюдались в январе месяце: на ст. 3 – 3,1۰106 кл/мл, ст. 2 они составили 3,9۰106 кл/мл, ст. 1 – 3,6۰106 кл/мл (табл., рис. 2).
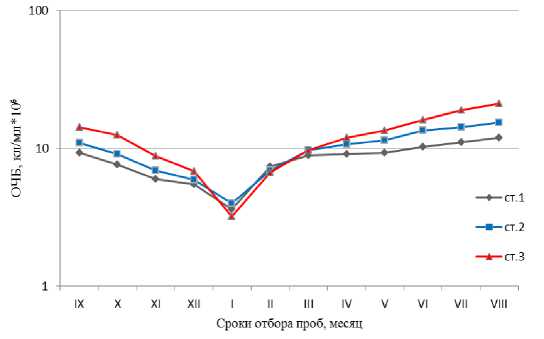
Рис. 2. Изменения общей численности бактериопланктона (ОЧБ) по прямому счету
Касаясь динамики временной изменчивости численности бактериопланктона, можно отметить, что с сентября по январь значения ОЧБ на всех трёх станциях медленно снижались, однако в последующие месяцы возрастали и к концу лета увеличивались в пять раз по сравнению с минимальными зимними значениями (табл., рис. 2). Таким образом, в развитии гетеротрофных бактерий в Кольском заливе нами обнаружено только два пиковых значения: максимальное – в августе и минимальное – в январе. В целом временная динамика изменений значений ОЧБ на всех трех обследованных станциях оказалась очень схожей. Между ними были обнаружены значимые корреляционные связи, при этом значения коэффициента корреляции (R) составили 0,95-0,99 (α < 0,001).
Обычно вспышки в развитии бактериопланктона с некоторым опозданием следуют за вспышками в развитии фитопланктона ( Кузнецов и др ., 1996). Однако в период полярной ночи, в феврале, трудно предположить, что численность фитопланктона может существенно возрасти по сравнению с январем месяцем. С большей вероятностью можно предположить, что рост значений ОЧБ на всех трех станциях в период с января по март связан с наблюдаемым в этот же период возрастанием содержания в воде нитратов.
Полученные нами данные по динамике развития планктонных бактерий согласуются с приводимыми в литературе результатами аналогичных исследований. К примеру, ранее также было отмечено увеличение ОЧБ в весенне-летний период в воде прибрежной зоны южного колена Кольского залива ( Перетрухина , 2006а).
Углеводородокисляющие бактерии (УОБ), способные к деструкции дизельного топлива, обнаружены нами во всех пробах воды, отобранных на исследованных станциях в разное время. Их количество варьировало от нескольких десятков до нескольких тысяч клеток в 1 мл ( Литвинова и др. , 2011). Максимальная численность УОБ (тысячи клеток в 1 мл) чаще всего наблюдалась на ст. 3, сходные или несколько меньшие количества УОБ были отмечены на ст. 2. На ст. 1 этот показатель не превышал нескольких сотен клеток в 1 мл воды (табл., рис. 3). Сезонные изменения численности УОБ на ст. 1, 2 и 3 оказались схожими. Между величинами численности УОБ на всех трех станциях обнаружены значимые корреляционные связи, значения коэффициента корреляции R составили от 0,92 до 0,97 (α<0,001). Значимых связей между численностью УОБ и концентрациями УВ в воде обнаружено не было. Отсюда следует, что численность УОБ напрямую не была связана с уровнем загрязнения акватории углеводородами. Тесная корреляционная связь обнаружена между значениями ОЧБ и количествами УОБ на всех трех исследованных станциях. Для ст. 1 значение коэффициента корреляции между этими показателями составило 0,95; для ст. 2 – 0,86; а для ст. 3 – 0,84 (при α < 0,001 во всех трех случаях).
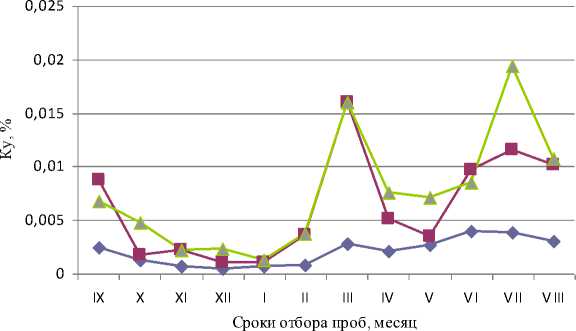
Для всех трех станций нами рассчитаны значения индекса Ку , показывающие, какую долю от общей численности гетеротрофной популяции составляют УОБ в разные сезоны года. Эти значения на всех трех станциях были низкими и в зимние месяцы (декабрь-март) составляли менее 0,001 % (табл., рис. 4). В остальное время величина индекса К у варьировала от 0,004 до 0,019 %. Величина индекса К у в большинстве случаев была выше на ст. 3 и ниже – на ст. 1, тогда как ст. 2 по величине этого показателя чаще всего занимала промежуточное положение. Корреляции значений К у с концентрациями углеводородов в воде не обнаружено.
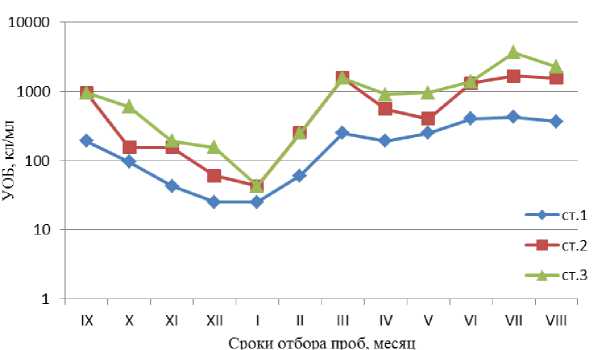
Рис. 3. Динамика численности планктонных углеводородокисляющих бактерий (УОБ) на станциях в северном и среднем коленах Кольского залива
— ♦ — с т.1
— ■ — с т.2
—*- с т.3
Рис. 4. Сезонная динамика коэффициента К у на станциях в северном и среднем коленах Кольского залива
Таблица. Общая численность бактерий и численность углеводородокисляющих микроорганизмов, их потенциальная углеводородокисляющая активность в воде северного и среднего колен Кольского залива
|
Месяц |
№ станции |
Температура воздуха °С |
Темпера-тура воды °С |
УОБ (кл/мл) Ν УОБ |
Общая численность бактерий (кл/мл) Ν ОЧБ |
Ν УОБ /Ν ОЧБ ( К у ), % |
ПЕМ окт , мкг∙л-1∙ч-1 |
ПНБ окт , мкг∙л-1∙ч-1 |
ПЕБ ОКТ , мкг∙л-1∙ч-1 |
ПЕБ ОКТ / ПЕМ ОКТ |
|
IX |
1 |
8 |
6 |
1,9۰102 |
(9,24±0,70)۰۱۰6 |
0,002 |
0,121±0,002 |
0,215±0,007 |
0,336 |
2,78 |
|
2 |
9 |
7 |
9,50۰102 |
(10,88±0,66)۰106 |
0,009 |
0,119±0,005 |
0,213±0,011 |
0,332 |
2,79 |
|
|
3 |
10 |
7 |
9,50۰102 |
(14,14±0,20)۰106 |
0,007 |
0,123±0,005 |
0,222±0,011 |
0,345 |
2,80 |
|
|
X |
1 |
6 |
4 |
0,95۰102 |
(7,59±0,35)۰106 |
0,001 |
0,103±0,003 |
0,188±0,003 |
0,290 |
2,81 |
|
2 |
7 |
5 |
1,55۰102 |
(9,04±0,40)۰106 |
0,002 |
0,103±0,002 |
0,190±0,001 |
0,293 |
2,84 |
|
|
3 |
8 |
6 |
6,00۰102 |
(12,39±0,22)۰106 |
0,005 |
0,106±0,006 |
0,190±0,008 |
0,296 |
2,79 |
|
|
XI |
1 |
0 |
3 |
0,42۰102 |
(5,97±0,54)۰106 |
0,0007 |
0,092±0,003 |
0,172±0,002 |
0,264 |
2,87 |
|
2 |
-2 |
4 |
1,55۰102 |
(6,87±0,22)۰106 |
0,002 |
0,098±0,002 |
0,178±0,006 |
0,276 |
2,82 |
|
|
3 |
-3 |
4 |
1,90۰102 |
(8,79±0,10)۰106 |
0,002 |
0,099±0,005 |
0,188±0,008 |
0,287 |
2,89 |
|
|
XII |
1 |
-5 |
3 |
0,25۰102 |
(5,44±0,68)۰106 |
0,0005 |
0,069±0,003 |
0,126±0,002 |
0,195 |
2,83 |
|
2 |
-6 |
2 |
0,60۰102 |
(5,92±0,53)۰106 |
0,001 |
0,075±0,004 |
0,137±0,009 |
0,212 |
2,83 |
|
|
3 |
-6 |
2 |
1,55۰102 |
(6,80±0,76)۰106 |
0,002 |
0,079±0,002 |
0,145±0,004 |
0,224 |
2,84 |
|
|
I |
1 |
-4 |
3 |
0,25۰102 |
(3,60±0,54)۰106 |
0,0007 |
0,073±0,002 |
0,135±0,006 |
0,208 |
2,85 |
|
2 |
-5 |
2 |
0,42۰102 |
(3,99±0,34)۰106 |
0,001 |
0,080±0,004 |
0,146±0,009 |
0,226 |
2,81 |
|
|
3 |
-6 |
2 |
0,42۰102 |
(3,18±0,61)۰106 |
0,001 |
0,079±0,003 |
0,147±0,004 |
0,222 |
2,81 |
|
|
II |
1 |
-6 |
2 |
0,60۰102 |
(7,31±0,81)۰106 |
0,0008 |
0,076±0,003 |
0,139±0,006 |
0,215 |
2,83 |
|
2 |
-8 |
1 |
2,50۰102 |
(6,86±0,14)۰106 |
0,004 |
0,079±0,004 |
0,141±0,007 |
0,216 |
2,73 |
|
|
3 |
-10 |
1 |
2,50۰102 |
(6,62±0,55)۰106 |
0,004 |
0,083±0,003 |
0,148±0,001 |
0,232 |
2,78 |
|
|
III |
1 |
-7 |
2 |
2,50۰102 |
(8,82±0,71)۰106 |
0,003 |
0,073±0,002 |
0,136±0,003 |
0,206 |
2,82 |
|
2 |
-8 |
1 |
1,55۰103 |
(9,69±0,58)۰106 |
0,016 |
0,073±0,003 |
0,140±0,003 |
0,216 |
2,96 |
|
3 |
-8 |
1 |
1,55۰103 |
(9,69 ±0,27)۰106 |
0,016 |
0,076±0,002 |
0,144±0,005 |
0,220 |
2,89 |
|
|
IV |
1 |
-4 |
3 |
1,90۰102 |
(9,02±0,87)۰106 |
0,002 |
0,096±0,004 |
0,177±0,01 |
0,273 |
2,84 |
|
2 |
-5 |
2 |
5,50۰102 |
(10,62±0,59)۰106 |
0,005 |
0,098±0,006 |
0,180±0,01 |
0,278 |
2,83 |
|
|
3 |
-6 |
2 |
9,00۰102 |
(11,9±0,19)۰106 |
0,008 |
0,102±0,006 |
0,186±0,008 |
0,287 |
2,81 |
|
|
V |
1 |
4 |
3 |
2,50۰102 |
(9,26±0,53)۰106 |
0,003 |
0,100±0,005 |
0,184±0,006 |
0,285 |
2,85 |
|
2 |
4 |
4 |
4,00۰102 |
(11,36±0,42)۰106 |
0,004 |
0,106±0,007 |
0,186±0,006 |
0,292 |
2,75 |
|
|
3 |
5 |
4 |
9,50۰102 |
(13,4±0,35)۰106 |
0,007 |
0,107±0,006 |
0,197±0,008 |
0,304 |
2,84 |
|
|
VI |
1 |
8 |
4 |
4,00۰102 |
(10,19±0,30)۰106 |
0,004 |
0,108±0,006 |
0,202±0,007 |
0,309 |
2,86 |
|
2 |
9 |
5 |
1,30۰103 |
(13,39±0,49)۰106 |
0,010 |
0,117±0,005 |
0,216±0,007 |
0,333 |
2,85 |
|
|
3 |
10 |
6 |
1,37۰103 |
(16,1±0,69)۰106 |
0,008 |
0,129±0,006 |
0,237±0,008 |
0,367 |
2,84 |
|
|
VII |
1 |
11 |
6 |
4,25۰102 |
(10,99±0,46)۰106 |
0,004 |
0,121±0,004 |
0,219±0,004 |
0,339 |
2,80 |
|
2 |
12 |
9 |
1,65۰103 |
(14,21±0,40)۰106 |
0,012 |
0,123±0,005 |
0,223±0,009 |
0,346 |
2,81 |
|
|
3 |
15 |
10 |
3,65۰103 |
(18,81±0,86)۰106 |
0,020 |
0,134±0,005 |
0,241±0,007 |
0,376 |
2,80 |
|
|
VIII |
1 |
7 |
6 |
3,65۰102 |
(11,85±0,29)۰106 |
0,003 |
0,125±0,006 |
0,234±0,016 |
0,359 |
2,87 |
|
2 |
8 |
7 |
1,55۰103 |
(15,3±0,75)۰106 |
0,010 |
0,129±0,008 |
0,234±0,010 |
0,363 |
2,81 |
|
|
3 |
9 |
7 |
2,25۰103 |
(21,01±0,87)۰106 |
0,010 |
0,133±0,008 |
0,236±0,013 |
0,369 |
2,77 |
Условные обозначения: Ν ОЧБ – общая численность бактерий; Ν УОБ – численность углеводородокисляющих микроорганизмов; ПЕМ ОКТ – показатель естественной минерализации 14С-октадекана; ПНБ ОКТ – показатель естественной биодеградации 14С-октадекана; ПЕБ ОКТ = ПЕМ ОКТ +ПНБ ОКТ – суммарное количество 14С-октадекана, окисленного микроорганизмами.
При определении скоростей биодеградации мы учитывали количество 14СО 2 , образованного микроорганизмами при минерализации меченого субстрата до углекислого газа и воды (показатель естественной минерализации, ПЕМокт) и количество 14С, включенного в клетки микроорганизмов (показатель неполной биодеградации, ПНБокт). При суммировании этих двух показателей получали величину показателя естественной биодеградации (ПЕБокт). Она отражала общее количество использованного микроорганизмами УB и позволяла судить о потенциальной способности водной экосистемы к восстановлению после загрязнения нефтепродуктами ( Практическая гидробиология , 2006).
Нами было установлено, что в одном литре воды из Кольского залива в течение часа при температурах in situ микроорганизмами полностью окисляется (минерализуется) до углекислого газа и воды от 0,069 до 0,134 микрограмм октадекана в час (табл., рис. 5). В среднем это составляет 0,1 мкг∙л-1∙ч-1. Значения показателя неполной биодеградации (ПНБ окт ), в свою очередь, составляли от 0,126 мкг∙л-1∙ч-1 до 0,241 мкг∙л-1∙ч-1 (или, в среднем, 0,183 мкг∙л-1∙ч-1). Таким образом, среднее значение ПЕБокт для среднего колена Кольского залива составляет 0,294 мкг∙л-1∙ч-1, а для северного колена – 0,278 мкг∙л-1∙ч-1. Величина ПЕБокт не коррелировала с концентрациями УВ в воде исследованных станций, это означало, что содержание УВ в воде не оказывало существенного влияния на активность УОБ. Значимая корреляционная связь была обнаружена между значениями ПЕБокт и численностью УОБ ( R = 0,59, α < 0,05).
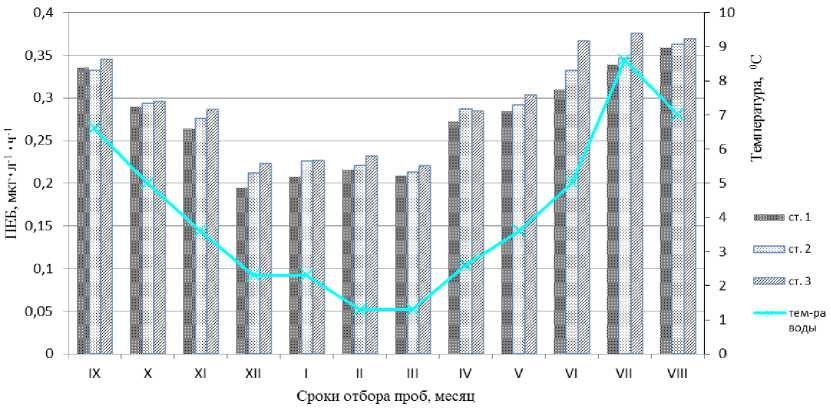
Рис. 5. Потенциальная углеводородокисляющая активность (ПЕБокт) бактериопланктона в воде Кольского залива
Анализ связей между колебаниями значений ПЕБокт и изменениями температуры воды на исследованных станциях показал наличие тесной корреляционной зависимости между этими двумя параметрами ( R = 0,91, а < 0,001). Отсюда следует, что изменения УВ-окисляющей активности бактериопланктона связаны с изменениями температуры воды и потому носят сезонный характер. Действительно, низкие значения ПЕБокт (0,195-0,232 мкг.Г^ч-1) наблюдаются на трёх станциях с декабря по март, когда температура воды близка к минимальной. Высокие же значения УВ-окисляющей активности бактериопланктона (ПЕБокт варьирует от 0,339-0,376 мкг.Г^ч-1) имеют место в летний период времени, в июле-августе, при температурах воды, близких к максимальным (рис. 5). Таким образом, УВ-окисляющая активность бактериопланктона открытых вод Кольского залива в зимний период снижается только на 1/3 по сравнению с летним. Подобное явление в целом характерно для северных морей. К примеру, ранее, на основании исследований углеводородокисляющей активности микроорганизмов в Карском и Белом морях был сделан вывод о высокой активности УОБ как в летний, так и в зимний сезоны ( Ильинский, Семененко , 2001).
Обнаруженные нами ранее значения ПЕБокт в воде литорали южного колена Кольского залива составляли от 0,219 до 0,301 мктл^-ч " 1 ( Перетрухина и др. , 2006б). По данным настоящего исследования, значения этого показателя в воде среднего и северного колен этого залива составляют от 0,195 до 0,369 мктл^-ч " 1, таким образом, величина этого показателя мало изменяется как по направлению с юга на север залива, так и с удалением от берегов залива в его открытые воды. Можно полагать, что это связано с практически постоянным и повсеместным присутствием нефтяных углеводородов в его акватории.
Сравнение полученных нами для Кольского залива данных относительно углеводородокисляющей активности бактериопланктона с ранее полученными данными для других морских акваторий ( Ильинский , 2000) показывает, что в Кандалакшском заливе Белого моря значения этого показателя в аналогичный период года были примерно в 2 раза ниже, а в прибрежных водах Карского моря - в пять раз ниже. Это позволяет считать углеводородокисляющую активность бактериопланктона Кольского залива сравнительно высокой.
Соотношение между величинами ПЕБокт и ПЕМокт в водах северного и среднего колен Кольского залива колеблется в узких пределах - от 2,73 до 2,89. Таким образом, микроорганизмами расходуется на процессы дыхания немногим менее 40 % углеводорода от всего использованного количества данного субстрата. Остальные 60 % включаются в состав микробной биомассы, этот углерод становится доступен организмам более высоких трофических уровней. Сходные величины соотношения ПЕБ окт и ПЕМ окт отмечались ранее для других пресноводных и морских акваторий ( Ильинский , 2000; Ильинский и др ., 2005; Перетрухина и др ., 2006б).
Из полученных нами данных следует, что, по данным за 2010 год, в течение суток в одном литре воды северного колена микроорганизмами полностью минерализуется в среднем 2,35 мкг н-алканов, а всего разрушается ими в среднем 6,67 мкг. Среднее содержание углеводородов в литре этой же воды составляет 20 мкг. Таким образом, согласно среднегодовому значению углеводородокисляющей активности, за сутки микроорганизмами может быть окислено не более 33 % присутствующих в данной акватории углеводородов, из них только третья часть полностью минерализуется до углекислого газа и воды, а остальное включается в состав микробной биомассы. Микроорганизмами, находящимися в воде среднего колена, за сутки окисляется около 18 % углеводородов от их общего количества, присутствующего в данной акватории. Это связано с более сильным загрязнением вод среднего колена углеводородами (37 мкг/л) по сравнению с северным коленом (20 мкг/л). В воде литорали южного колена Кольского залива, согласно среднегодовому значению ПЕБокт, за сутки микроорганизмами может быть окислено около 14 % присутствующих там углеводородов ( Перетрухина и др. , 2006б). Воды южного колена в большей степени подвергаются антропогенному воздействию, чем среднее и северное. Количество УВ в воде южной части залива на тот момент составляло 44 мкг/л.
Следует отметить, что полученные нами значения относительно углеводородокисляющей активности бактериопланктона Кольского залива являются, скорее всего, максимально возможными для данной экосистемы, что связано с использованием для определения этого показателя н-октадекана, углеводорода, который относится к н-алканам. Соединения данного класса, за исключением длинноцепочечных углеводородов, сравнительно легко используются микроорганизмами. Скорость микробного окисления входящих в состав нефти и нефтепродуктов, углеводородов других классов, в частности - разветвленных и ароматических углеводородов, смол и асфальтенов, будет намного ниже.
-
4. Заключение
Проведенные нами долгосрочные исследования позволили охарактеризовать пространственно -временную изменчивость численности и активности углеводородокисляющих микроорганизмов, важной части гетеротрофного бактериопланктонного сообщества открытых вод среднего и северного колен Кольского залива.
Полученные данные подтверждают ранее сделанный нами для литорали Кольского залива ( Перетрухина и др. , 2006б) вывод о том, что существенного снижения УВ-окисляющей активности микроорганизмов в зимний период по сравнению с летним периодом не наблюдается.
Скорость микробной деструкции нефтяных загрязнений в водах Кольского залива оказалась на уровне, превышающем таковой в других северных акваториях. Скорее всего, это связано с высокой степенью адаптированности бактериопланктона к нефтяным углеводородам по причине постоянного присутствия их небольших количеств в заливе, а также с хорошей обеспеченностью бактериопланктона Кольского залива биогенными элементами – нитратами и фосфатами. Вместе с тем, активность микроорганизмов не настолько высока, чтобы полностью разрушать поступающие нефтяные загрязнения, поэтому значительная их часть может накапливаться в осадках Кольского залива, а также выноситься из залива в Баренцево море.


