Распространение протеолитических бактерий в холодных источниках Буксыхен (Северное Прибайкалье)
Автор: Банзаракцаева Туяна Геннадьевна, Дамбинова Екатерина Цыдыпжаповна, Муруева Елена Леонидовна, Биджоян Арман Мурадович, Лаврентьева Елена Владимировна
Журнал: Природа Внутренней Азии @nature-inner-asia
Рубрика: Биология
Статья в выпуске: 2 (15), 2020 года.
Бесплатный доступ
В холодных источниках Буксыхен (Северное Прибайкалье) рассмотрено пространственно-временное распространение гетеротрофных бактерий, в частности протеолитической группы. Показано, что воды пяти выходов источников Буксыхен являются постоянно холодными, пресными и слабощелочными и относятся к гидрокарбонатному кальциевому типу. Сравнительный анализ не выявил сезонных изменений в распространении гетеротрофных бактерий. Численность аэробных и анаэробных протеолитических бактерий, независимо от типа пробы, была достаточно высокой и достигала 106 кл/мл. Впервые из источников Буксыхен-щитовидный и Буксыхен-желудочный выделены чистые культуры психротолерантных протеолитических факультативно-анаэробных бактерий родов Janthinobacterium и Yersinia, по предварительным данным, представляющие новые виды данных таксонов.
Холодные источники, микробное сообщество, гетеротрофные бактерии, протеолитические бактерии, психрофильные и психротолерантные бактерии
Короткий адрес: https://sciup.org/148318041
IDR: 148318041 | УДК: 579.26 | DOI: 10.18101/2542-0623-2020-2-24-36
Текст научной статьи Распространение протеолитических бактерий в холодных источниках Буксыхен (Северное Прибайкалье)
К настоящему времени исследования микробных сообществ наземных холодных источников были спорадическими [Rudolph et al., 2001, Camacho et al., 2005, Perreault et al., 2007; Perreault et al., 2008, Chaudhary et al., 2009, Zeng et al., 2010, Li, et al., 2012]. Эти исследования показали, что в холодных источниках присутствуют в основном психротолерантные или психрофильные микробные сообщества с представителями Proteobacteria, Acidobacteria, Deinococci, Sphingobacteria, Flavobacteria, Nitrospirae, Actinobacteria, Gemmatimonadetes , архейные клоны были классифицированы как Crenarchaeota и Thaumarchaeota . Также было установлено, что видовое разнообразие микробных сообществ исследуемых источников схоже с сообществами других холодных местообитаний, таких как снег, лед и почвы высокогорий. Распространение гетеротрофных психрофильных бактерий в холодных источниках практически не изучалось. Тем не менее данная группа бактерий является потенциальными носителями различных ферментов, в том числе протеаз, устойчивых и активных при низких температурах, и может представлять биотехнологический интерес.
Целью данной работы было изучение пространственно-временного распространения протеолитических бактерий в микробных сообществах холодных источников Буксыхен (Северное Прибайкалье).
Материалы и методы
Объектами исследования были холодные источники Буксыхен (Северное Прибайкалье, 53°59’41.2» с.ш., 110°02’00.9» в.д.). Источники Буксыхен расположены в 375 км от г. Улан-Удэ, недалеко от административной границы района (5 км от Баргузинского дацана) в 500 м от трассы у северо-западного борта Баргузинской впадины. Высота над уровнем моря 604 м. Источник представлен пятью выходами, которые берут начало из-под крутого скального выступа и сливаются в единый ручей. Каждый из пяти выходов имеет собственное название: глазной, щитовидный, сердечный, желудочный и печеночный. Четыре источника из пяти имеют активную разгрузку воды. Источник Буксыхен-глазной представляет собой небольшую воронку с водой, которая, вероятно, имеет низкий дебит и просачивается через грунты. Местные жители используют источники в бальнеологических целях.
Пробы воды и донных осадков для бактериологических исследований отбирали в стерильную посуду. До проведения анализов пробы хранили в темноте при температуре in situ или в холодильнике. В местах отбора проб температуру воды измеряли сенсорным электротермометром Prima (Португалия), кислотность среды (рН) — портативным рН-метром рНер2 (Португалия), значения общей минерализации — портативным тестер-кондуктометром TDS — 4 (Сингапур), Eh — измерителем редокс-потенциала ORP (Португалия).
Содержание карбонатов, гидрокарбонатов определяли титрованием [Резников и др., 1970]. Катионный и анионный состав воды определяли методом капиллярного электрофореза на системе «Капель-105М» (Россия) в ЦКП «Прогресс» ВСГУТУ (г. Улан-Удэ), сульфиды были определены колориметрическим методом на портативном фотоколориметре DR/890 (HACH, США). Микроэлементный состав донных осадков определен методом ИСП-МС на приборе высокого разрешения ELEMENT 2 фирмы Finnigan MAT в ЦКП ИГХ СО РАН (г. Иркутск).
Содержание органического углерода (Сорг) в пробах определяли по методу Тюрина в модификации Никитина (Аринушкина, 1970).
Учет численности психрофильных гетеротрофных жизнеспособных клеток микроорганизмов проводили методом 10-кратных разведений на среде Пфеннига с добавлением 1,5% пептона в качестве субстрата. Культивирование психро-фильных бактерий проводили в аэробных и анаэробных условиях при температуре 5–7 °С.
Для выделения чистых культур аэробных протеолитических бактерий на твердой среде использовали метод Коха с последующим применением метода истончающегося штриха. Для выделения чистых культур анаэробных протеолитиков проводили посев на агаризованную среду в чашках Петри и помещали их в анаэро-статы, предварительно откачав воздух, и закачивали в них азот. Культивирование проводили при температуре 5–7 °С в течение 7–14 дней, в промежутках повторно продували анаэростаты азотом.
В результате последовательных пересевов единичных колоний с твердой среды на жидкую среду были получены чистые культуры психроактивных протеолитических микроорганизмов.
Для определения оптимальных условий роста выделенных бактерий использовали основную среду для каждого штамма. Температурный диапазон роста определяли по удельной скорости роста при температурах от 5 до 42°С. Диапазон и оптимум солености — по скорости роста при различных концентрациях NaCl (0–20 г/л). Влияние pH среды на скорость роста определяли, культивируя клетки при оптимальной температуре и солености на основной среде для роста при различных значениях pH.
Результаты и обсуждение
Функционирование микробного сообщества зависит от множества факторов среды обитания. Основными физико-химическими показателями для деятельности микроорганизмов являются температура, рН, общая минерализация, доступность кислорода и т. д., которые были определены в местах проведения исследований и отбора проб в июле 2014 г. и декабре 2016 г. В зимний период в источнике Буксыхен-глазной отбор проб воды не производился в связи с отсутствием проточной воды.
Исследуемые источники характеризуются постоянно низкой температурой воды, слабощелочными значениями рН и низкой минерализацией независимо от сезона (табл. 1). Сезонные исследования гидрохимических показателей в других холодных источниках нашего региона также показывают стабильность данных параметров [Ульзетуева, Хахинов, 2011]. Все источники имели положительные значения редокс-потенциала. Вода источника Буксыхен-глазной в летнее время имела более высокую температуру (7,4 оC) и более окисленные условия относительно других выходов источника, что связано с низким дебитом воды и более застойными условиями в воронке с водой.
Таблица 1
Физико-химическая характеристика исследуемых источников
|
Источник |
Сезон |
T,°С |
pH |
Eh, мВ |
M, мг/дм3 |
|
Бук-глазной |
летний |
7,4 |
8,09 |
210 |
62 |
|
зимний |
- |
- |
- |
- |
|
|
Бук-щитовидный |
летний |
4,5 |
8,03 |
161 |
51 |
|
зимний |
3,9 |
8,6 |
142 |
55 |
|
|
Бук-сердечный |
летний |
4,5 |
8,16 |
151 |
51 |
|
зимний |
3,8 |
8,42 |
155 |
49 |
|
|
Бук-желудочный |
летний |
4,2 |
8,34 |
135 |
52 |
|
зимний |
3,5 |
8,28 |
145 |
68 |
|
|
Бук-печеночный |
летний |
4,2 |
8,29 |
134 |
55 |
|
зимний |
3,5 |
8,43 |
146 |
51 |
М — минерализация «-» — не определено
Макрокомпонентный и микрокомпонентный анализ проводили в пробах летнего периода. Анализ катионного состава воды выявил преобладание ионов кальция, их содержание варьировало от 460 до 548 мг/дм3 (табл. 2). Содержание ионов калия не превышало 5,36 мг/дм3, натрия — 2,98 мг/дм3. Преобладающим анионом в воде источников были гидрокарбонат-ионы, их концентрация достигала 548 мг/дм3. Карбонат-ионы не были зафиксированы, что характерно для вод с низкой щелочностью. Проведенный анализ содержания ионов сульфида в водах исследуемого источника показал их отсутствие. Определение органического углерода в осадках выявило их низкую концентрацию (0,23–0,54%), что, вероятно, связано со структурой осадков. Осадки в основном были представлены смесью камней и песка.
Таблица 2
Ионный состав воды (мг/дм3) и содержание органического углерода в осадках (%) источников Буксыхен
Таким образом, наши исследования физико-химических параметров показали, что воды источника Буксыхен являются холодными, пресными (до 0,1 г/л), слабощелочными. По анионному составу воды этих источников являются гидро-карбонатными, а по катионному — кальциевыми.
Также был изучен микроэлементный состав донных осадков, было определено более 50 элементов, в таблице представлены элементы с концентрацией выше 10 мг/кг (табл. 3). Полученные результаты показали, что в целом содержание всех элементов не превышало кларковые значения для поверхности земной коры.
В воде источников Буксыхен был проведен подсчет общего микробного числа. Наиболее высокая общая микробная численность (ОМЧ) была выявлена в пробе Бук-глазной (120 625 кл/мл), в остальных пробах ОМЧ было на порядок ниже, и минимальное значение было обнаружено в пробе Бук-печеночный (15 010 кл/мл). Максимальное число микробных клеток в воде пробы Бук-глазной, вероятно, связано опять же с низким дебитом источника, что обусловливает увеличение концентрации бактериальных клеток. Полученные результаты сопоставимы с данными других исследователей в холодных морских местообитаниях, так, численность микроорганизмов в арктических водах в среднем достигает 105–106 клеток/мл [Brinkmeyer et al., 2003; Gerdes et al., 2005; Harder, 2009].
Проведен первичный микробиологический анализ воды и осадков исследуемых источников с целью определения в этих образцах психрофильных бактерий различных физиологических групп. Полученные результаты показали, что в воде источников Буксыхен активно развиваются психрофильные аэробные и анаэробные гетеротрофы (до 107 кл/мл) и отсутствуют сульфатредукторы, метаногены, ацетогены и железоредукторы, культивирующиеся при 7 оС.
Таблица 3
|
Элемент |
Бук-гл. |
Бук-щит. |
Бук-серд. |
Бук-желуд. |
Бук-печ. |
|
Ti |
5623 |
7098 |
5095 |
5352 |
4256 |
|
V |
146 |
188 |
163 |
160 |
116 |
|
Mn |
859 |
961 |
846 |
854 |
631 |
|
Cu |
65 |
82 |
28 |
107 |
142 |
|
Zn |
317 |
228 |
140 |
458 |
205 |
|
Sr |
1232 |
1228 |
1568 |
1627 |
1242 |
|
Zr |
200 |
152 |
266 |
128 |
139 |
|
Ba |
844 |
723 |
569 |
703 |
930 |
|
Cr |
19 |
20 |
22 |
20 |
14.4 |
|
Ni |
67 |
39 |
15 |
63 |
31 |
|
Ga |
19 |
20 |
19 |
20 |
20 |
|
Rb |
46 |
41 |
31 |
30 |
55 |
|
La |
35 |
36 |
24 |
43 |
27 |
|
Ce |
66 |
72 |
46 |
81 |
50 |
|
Nd |
32 |
36 |
25 |
37 |
24 |
Микроэлементный состав донных осадков источников Буксыхен, >10 мг/кг
Учет численности аэробных и анаэробных гетеротрофов в пробах воды летнего и зимнего периодов не выявил сезонной динамики (рис. 1, 2). В зимний период в источнике Буксыхен-глазной разгрузка воды не происходила, в связи с чем количественный анализ распространения гетеротрофных бактерий не был осуществлен.
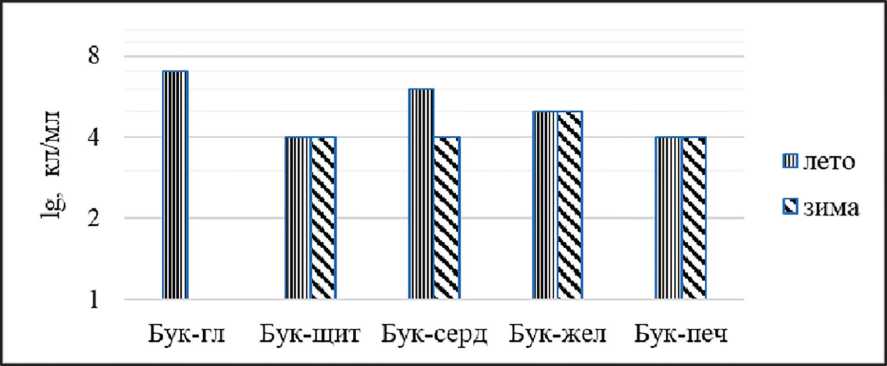
Рис. 1. Численность гетеротрофных аэробных бактерий в воде по сезонам
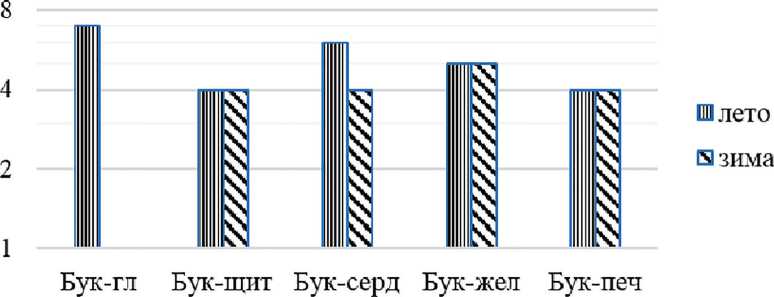
Рис. 2. Численность гетеротрофных анаэробных бактерий в воде по сезонам
Была определена численность аэробных и анаэробных протеолитических бактерий в пробах воды и осадков исследуемых выходов источника Буксыхен. Учет аэробных протеолитических бактерий в воде показал их распространение во всех выходах от 105 до 106 кл/мл. В осадках также максимальное число аэробных про-теолитиков достигало 106 кл/мл (выход Буксыхен «желудочный», «сердечный» и «глазной»). В пробах четырех источников из пяти численность анаэробных клеток в воде составила 105 кл/мл, исключением был источник Бук-глазной, здесь число анаэробных протеолитиков было на порядок ниже. Минимум протеолитических бактерий наблюдали в пробах осадка Бук-щитовидный — 104 кл/мл (табл. 4).
Таблица 4
Численность протеолитических бактерий в источниках Буксыхен, кл/мл
|
Источник |
Аэробы |
Анаэробы |
||
|
Вода |
Осадки |
Вода |
Осадки |
|
|
Бук-глазной |
106 |
106 |
104 |
105 |
|
Бук-щитовидный |
106 |
105 |
105 |
104 |
|
Бук-сердечный |
106 |
106 |
105 |
105 |
|
Бук-желудочный |
105 |
106 |
105 |
106 |
|
Бук-печеночный |
105 |
105 |
105 |
106 |
Были выделены и получены накопительные и чистые культуры анаэробных и факультативно-анаэробных психрофильных и психроактивных бактерий, и были изучены их некоторые физиолого-биохимические свойства. Для выделения чистых культур пептолитических микроорганизмов был использован метод анаэробного культивирования [Hungate, 1969] на твердых средах и отобраны 24 штамма. После пересева в жидкую среду штаммы были сгруппированы по родам с использованием метода MALDI масс-спектрометрии целых клеток. В результате проведенного анализа полученные штаммы протеолитических бактерий были разделены на 7 групп: штаммы 1–7 отнесены к виду Janthinobacterium lividum; штаммы 8, 10, 11, 15 и 16 — к виду Yersinia enterocolitica; штаммы 9, 12, 13 и 20 — к виду Y. bercovieri; штаммы 14, 17, 18 и 24 — к виду Y. aleksieciae; штамм 21 — к виду Lactobacillus saerimneri; штамм 22 — к виду Bacillus funiculus; штамм 23 — к виду Achromobacter insolitus.
Из каждой группы штаммов были отобраны по одному представителю и выполнены секвенсы генов 16S рРНК с универсальным бактериальным праймером 27F. Филогенетический анализ полученных последовательностей показал, что 2 штамма генетически отдалены от известных видов и, вероятно, представляют собой новые таксоны.
Нами получен полный сиквенс последовательности гена 16S рРНК штаммов Buс-1 и Buс-16. Филогенетический анализ полученных последовательностей показал, что оба штамма генетически отдалены от известных видов и, вероятно, представляют собой новые таксоны. Для штаммов 1 и 16 были получены почти полные последовательности длиной 1398 и 1411 п. н. соответственно (рис. 3). Филогенетический анализ c помощью базы данных GenBank и программы BLAST показал, что близкородственным видом для штамма Buс-1 являются J. livi-dum со сходством 99,4%, штамму Buс-16 родственен вид Y. аldovae и Y. рek-kanenii со сходством 99,7%. Филогенетическая дендрограмма была построена с использованием пакета программ MEGAX [Tamura et al., 2013, Kumar et al, 2018] с применением метода поиска ближайших соседей («neibour-joining») [Saitou and Nei., 1987].
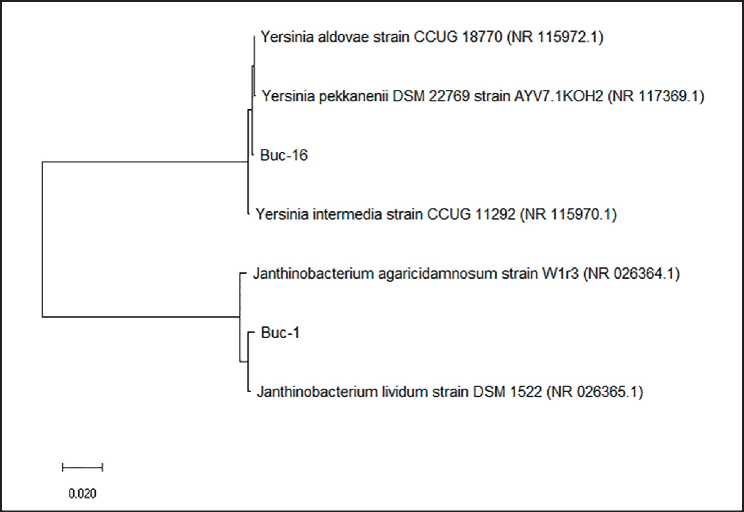
Рис. 3. Филогенетическая дендрограмма, построенная на основе анализа нуклеотидных последовательностей генов 16S рРНК. Длина масштабной линейки: 2 замены на 100 нуклеотидов. Учетный номер базы данных NCBI указан в скобках. Дендрограмма построена с использованием метода поиска ближайших соседей ( “neibour-joining” )
В результате работы также были получены чистые культуры психроактив-ных анаэробных гидролитических бактерий на казеине (18 штаммов), желатине (12 штаммов), сахарозе (10 штаммов) и Tween-80 (11 штаммов). Микроскопические исследования выявили в них палочки, отличающие размером, подвижностью и спорообразованием.
Характеристика штамма Buс-1
Получен из накопительной культуры на среде Пфеннига с донным осадком источника Буксыхен-желудочный. По данным анализа, 16S рРНК относится к роду Janthinobacterium , близок виду Janthinobacterium lividum . Эти микроорганизмы относятся к бета-протеобактериям порядка Bukholderiales и семейству Oxalobacte-riaceae . Являются грамотрицательными факультативно-анаэробными бактериями, обитающими в низкотемпературных экосистемах [Shivaji et al., 1991; Brambilla et al., 2001; Schloss et al. 2010]. Штамм Buс-1 на агаризованной среде образовывал круглые гладкие блестящие колонии размером до 4 мм. Его клетки представляли собой подвижные палочки длиной от 2 до 6 мкм. Культура выделена в анаэробных условиях, но может расти и аэробно.
Характеристика штамма Buс-16
Получен из накопительной культуры на среде Пфеннига с донным осадком источника Буксыхен-щитовидный. По данным MALDI масс-спектрометрии целых клеток и филогенетического анализа последовательностей генов, 16S рРНК относится к роду Yersinia, принадлежащему ветви Gammaproteobacteria, порядку Enterobacteriales и семейству Enterobacteriaceae и наиболее близок к видам Y. аldovae и Y. рekkanenii. Это грамотрицательные факультативно-анаэробные бактерии, часто обнаруживающиеся в желудочно-кишечном тракте животных. На агаризованной среде штамм Bush-16 образовывал круглые гладкие блестящие с ровным краем колонии диаметром 1–2 мм. Клетки новых бактерий представляли собой неподвижные палочки, напоминающие фитильки. Культура выделена при 7 оС в анаэробных условиях, но может расти и аэробно.
Исследование экофизиологии выделенных культур протеолитиков из холодных источников показало, что они способны развиваться в широком диапазоне температур (7–42 °С), солености и рН (4–10).
Штамм Buс-1 рос при температуре от 7 до 42 °С с оптимумом при 29 °С и, соответственно, является психротолерантным мезофиллом (рис. 4). Температурный диапазон роста для выделенного штамма Buс-16 составлял от 7 до 42 °С с оптимумом при 20 °С. Таким образом, выделенный штамм является факультативным психрофилом.
Изучение роста исследуемых культур в градиенте рН показал, что все культуры способны накапливать биомассу в диапазоне рН от 5 до 10 (рис. 5). Оптимальное значение для штамма Buс-1 является рН 7. Для штамма Buс-16 максимальный рост наблюдался при рН 7 и 8. Таким образом, исследуемые культуры относятся к нейтрофильным микроорганизмам по отношению к рН.
Изучение ростовых характеристик исследуемых штаммов при различных концентрациях NaCl показало, что штамм Buс-1 имел максимальный рост при концентрации хлорида натрия 2,5 г/л (рис. 6). Штамм Buс-16 демонстрировал наименьшие показатели роста во всем диапазоне, но при концентрации 10 г/л накопил достаточно высокую биомассу. Исследования показали, что, несмотря на пресноводное местообитание изучаемых культур — холодные источники Буксы-хен, эти бактерии имеют достаточно высокий потенциал и способны развиваться и при более высоких концентрациях хлорида натрия.
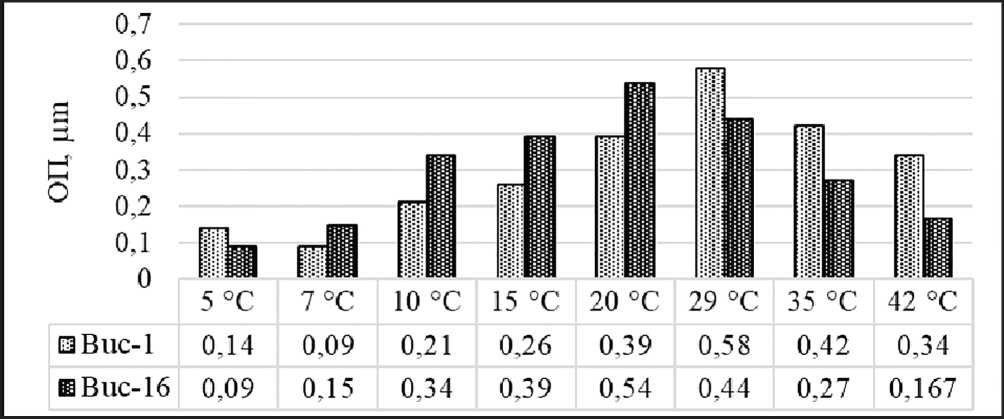
Рис. 4. Зависимость роста культур Buc-1 и Buс-16 от температуры
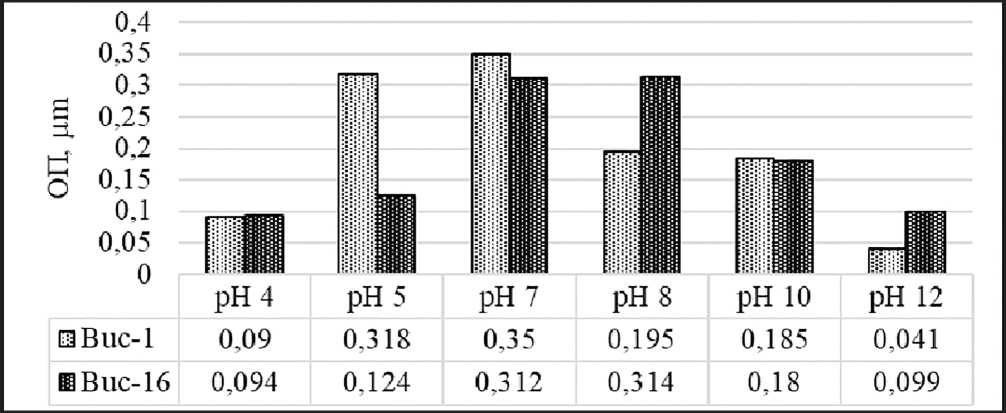
Рис. 5. Зависимость роста культур Buc-1 и Buс-16 от рН
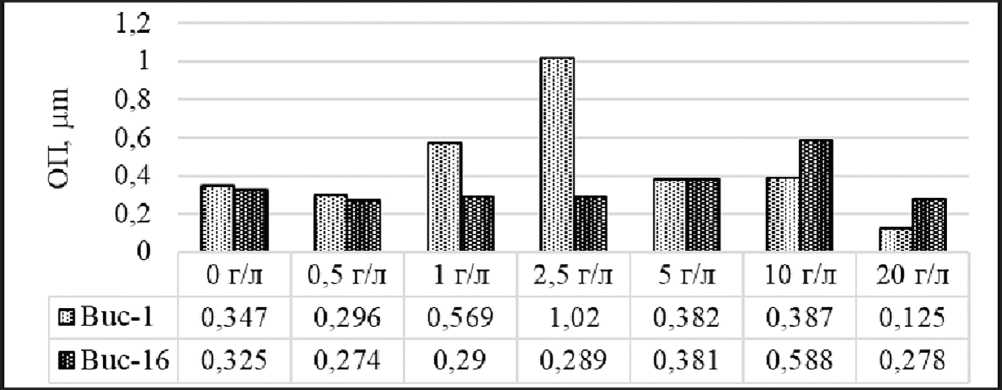
Рис. 6. Зависимость культур Buc-1 и Buс-16 от концентраций NaCl
Заключение
Исследуемые источники Буксыхен являются постоянно холодными пресными и слабощелочными. Температура воды не превышала 7,4 оС, минерализация воды в источниках была менее 1 г/л, рН воды был в пределах 8,03–8,6. По химическому составу воды исследуемых источников гидрокабонатные кальциевые. Эти воды представляют ценность как нативные пресные, которые могут употребляться для питья и приготовления пищи, для целей розлива без специальной реагентной водоподготовки. Изучение сравнительной характеристики сезонных изменений физико-химических параметров не выявило значительных различий, что свидетельствует о стабильности экосистемы источников Буксыхен.
Микробиологические исследования показали широкое пространственновременное распространение гетеротрофных психрофильных и психротолерант-ных бактерий в источниках Буксыхен. Общая микробная численность в воде была сопоставима с результатами исследований в холодных морских местообитаниях. Анализ численности аэробных и анаэробных протеолитических бактерий в воде и донных осадках исследуемых источников выявил их высокую численность при температуре культивирования 5–7 °С. Впервые из источников Буксыхен-щитовидный и Буксыхен-желудочный выделены чистые культуры психро-толерантных протеолитических факультативно-анаэробных бактерий родов Janthinobacterium и Yersinia, по предварительным данным, представляющие новые виды данных таксонов. Исследование экофизиологии выделенных культур протеолитиков из холодных источников показало, что они способны развиваться в широком диапазоне температур (7–42 °С) и рН (4–10). Также было установлено, что, несмотря на пресноводное местообитание изучаемых культур, эти бактерии имеют достаточно высокий потенциал и способны развиваться и при более высоких концентрациях хлорида натрия.
Таким образом, полученные нами результаты показали, что в холодных источниках Буксыхен развивается и функционирует микробное сообщество, представленное различными таксономическими группами бактерий. В исследуемых микробных сообществах широко распространенны гетеротрофные бактерии, представляющие деструкционное звено в экосистеме источников, и они метаболически активны при пониженной температуре.
Список литературы Распространение протеолитических бактерий в холодных источниках Буксыхен (Северное Прибайкалье)
- Аринушкина Е. В. Руководство по химическому анализу почв. М.: Изд-во Моск. ун-та, 197Ö. 488 с.
- Ульзетуева И. Д., Хахинов В. В. Гидрохимическая характеристика минеральных источников Юго-Западного Забайкалья // Водные ресурсы. 2Ö11. Т. 38, № 5. С. 585-592.
- Anesio A. M., Lutz S., Chrismas N. A. M., Benning L. G. The microbiome of glaciers and ice sheets // NPJ Biofilms Microbiomes. 2Ö17. V 3, № 1Ö. D0I:10.1038/s41522-017-0019-0
- Boetius A., Anesio A. M., Deming J. W., Mikucki J. A., Rapp J. Z. Microbial ecology of the cryosphere: sea ice and glacial habitats // Nat. Rev. Microbiol. 2Ö15. V. 13, № 11. Pp. 677-69ö. doi:10.1038/nrmicro3522
- Brambilla E. et al. 16S rDNA diversity of cultured and uncultured prokaryotes of a mat sample from Lake Fryxell, McMurdo Dry Valleys, Antarctica // Extremophiles. 2001. V 5, № 1. Pp. 23-33.
- Brinkmeyer R., Knittel K., Jürgens J., Weyland H., Amann R. Helmke E. Diversity and Structure of Bacterial Communities in Arctic versus Antarctic Pack Ice // Applied and environmental microbiology. 2003. V 69. Pp. 6610-6619. doi:10.1128/AEM.69.11.6610-6619.2003.
- Camacho A., Rochera C., Silvestre J. José, Vicente E., Hahn M. W. Spatial Dominance and Inorganic Carbon Assimilation by Conspicuous Autotrophic Biofilms in a Physical and Chemical Gradient of a Cold Sulfurous Spring: The Role of Differential Ecological Strategies // Microbial ecology. 2005. V. 50. Pp. 172-184. doi:10.1007/s00248-004-0156-x
- Chaudhary A., Haack Sh. K., Duris J. W., Marsh T.L. Bacterial and Archaeal Phylogenetic Diversity of a Cold Sulfur-Rich Spring on the Shoreline of Lake Erie, Michigan // Applied and Environmental Microbiology. 2009. V 75, № 15. Pp. 5025-5036. doi:10.1128/AEM.00112-09
- Gerdes B., Brinkmeyer R., Dieckmann G., Helmke E. Influence of crude oil on changes of bacterial communities in Arctic sea-ice // FEMS Microb. Ecol. 2005. V 53, № 1. Pp. 129-139.
- Hungate R. E. A roll tube method for cultivation of strict anaerobes // In: Methods in microbiology 13. Eds. Norris J. R., Ribbons D. W. New York: Acad. 1969. V. 1. P. 117.
- Harder T. Marine epibiosis: concepts, ecological consequences and host defence // Mar. Indust. Biofouling. 2009. V. 4. Pp. 219-231.
- Hotaling S., Finn D. S., Joseph Giersch J., Weisrock D. W., Jacobsen D. Climate change and alpine stream biology: progress, challenges, and opportunities for the future // Biol Rev Camb Philos Soc. 2017. V. 92. № 4. Pp. 2024-2045. doi:10.1111/brv.12319
- Kumar S., Stecher G., Li M., Knyaz C., and Tamura K. MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms // Molecular Biology and Evolution. 2018. V. 35. Pp. 1547-1549.
- Li G.H., Jiang W., Hou S. Wang L., Huang H., Ren S., Deng H., Dong. Microbial diversity in two cold springs on the Qinghai-Tibetan Plateau // Geosci. Front. 2012. V. 3. Pp. 317-325. doi:10.1016/j.gsf.2011.12.004.
- Margesin R., Miteva V Diversity and ecology of psychrophilic microorganisms // Res. Microbiol. 2011. V. 162, № 3. Pp. 346-361. doi:10.1016/j.resmic.2010.12.004
- Martin A., McMinn A. Sea ice, extremophiles and life on extra-terrestrial ocean worlds // Int. J. Astrobiol. 2018. V 17, № 1. Pp. 1-16.
- Perreault N. N., Andersen D. T., Pollard W. H., Greer C. W., Whyte L. G. Characterization of the prokaryotic diversity in cold saline perennial springs of the Canadian high Arctic // Applied and environmental microbiology. 2007. V. 73, № 5. Pp. 1532-1543. doi.org/10.1128/ AEM.01729-06
- Perreault N. N., Greer C. W., Andersen D. T., Tille S., Lacrampe-Couloume G., Lollar B. Sh., Whyte, L. G. Heterotrophic and Autotrophic Microbial Populations in Cold Perennial Springs of the High Arctic // Applied and Environmental Microbiology. 2008. V. 74. Pp. 68986907. doi:10.1128/AEM.00359-08
- Rudolph C, Wanner G, Huber R. Natural communities of novel archaea and bacteria growing in cold sulfurous springs with a string-of-pearls-like morphology // Applied and Environmental Microbiology. 2001 V. 67, №. 5. Pp. 2336-2344. doi:10.1128/aem.67.5.2336-2344.2001.
- Saitou N. and Nei M. The neighbor-joining method: A new method for reconstructing phylogenetic trees // Molecular Biology and Evolution. 1987. V. 4. Pp. 406-425.
- Shivaji S. Ray, M. K., Kumar, G. S., Reddy G. S. N., Saisree L., Wynn-Williams D. D. Identification of Janthinobacterium lividum from the soils of the islands of Scotia Ridge and from Antarctic peninsula // Polar biology. 1991. V. 11, № 4. Pp. 267-271.
- Schloss P. D., Allen H. K., Klimowicz A. K., Mlot C., Gross J.A., Savengsuksa S., McEllin J., Clardy J., Ruess R. W., Handelsman J. Psychrotrophic strain of Janthinobacterium lividum from a cold Alaskan soil produces prodigiosin // DNA and cell biology. 2010. V. 29. №. 9. Pp. 533-541.
- Tamura K., Nei M., and Kumar S. Prospects for inferring very large phylogenies by using the neighbor-joining method // Proceedings of the National Academy of Sciences (USA). 2004. V. 101. Pp. 11030-11035.


