Распространение «западной» и «восточной» форм озерной лягушки Pelophylax ridibundus s. l. на территории Самарской и Саратовской областей (по данным анализа митохондриальной и ядерной ДНК)
Автор: Ермаков Олег Александрович, Файзулин Александр Ильдусович, Закс Михаил Михаилович, Кайбелева Эльмира Исмаиловна, Зарипова Фалия Фуатовна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Наземные экосистемы
Статья в выпуске: 5-1 т.16, 2014 года.
Бесплатный доступ
Проведен молекулярно-генетический анализ 71 экз. озерной лягушки из 21 локалитета Самарской, Саратовской областей и прилежащих районов. Установлено, что в районе исследования обитают две генетически дифференцированные формы озерной лягушки - «восточная» и «западная». Выявлено несовпадение распределения частот аллелей митохондриальной и ядерной ДНК - большинство озерных лягушек имели яДНК «западной» формы, а мтДНК «восточной» формы. Изучены особенности географического распространения криптических форм и их биотопической приуроченности.
Озерная лягушка, молекулярно-генетические маркеры, распространение, самарская область, саратовская область
Короткий адрес: https://sciup.org/148203346
IDR: 148203346 | УДК: 597.851
Текст научной статьи Распространение «западной» и «восточной» форм озерной лягушки Pelophylax ridibundus s. l. на территории Самарской и Саратовской областей (по данным анализа митохондриальной и ядерной ДНК)
В настоящее время среди бесхвостых амфибий выявлен ряд криптических форм различного таксономического статуса [1]. На территории Русской равнины известны «западные» и «восточные» формы у чесночниц, «номинативная» и «переднеазитская» у зеленых жаб, которые рассматриваются в качестве подвидов или видов [4, 5, 8, 9, 12].
У озерной лягушки Pelophylax ridibundus также имеются формы с неясным таксономическом статусом и требующие дальнейшего исследования [1]. На территории Поволжья отмечены две генетически дифференцированные формы – «западная» P. ridibundus и «восточная» P. cf. bedriagae . По данным анализа митохондриальной ДНК крайними северными географическими пунктами распространения «восточной» формы ранее указывались Волгоград – Уральск – Орск [7]. Позднее нами было показано, что в Поволжье (Пензенская обл.) «восточная» форма распространена до 54 параллели, а в зоне симпатрии двух форм обитают лягушки с «западными», «восточными» гаплотипами, а также экземпляры гибридного происхождения [2, 3]. Отметим, что «западная» и «восточная» формы пространственно не изолированы, достоверных морфологическим отличий между ними нами не обнаружено [3], что позволяет их рассматривать как крипти-ческие.
Данное исследование посвящено изучению распространения двух криптических форм озер-
ной лягушки на территории Самарской и Саратовской областей с использованием молекулярногенетических маркеров митохондриальной и ядерной ДНК.
МАТЕРИАЛ И МЕТОДЫ
Всего проанализирован 71 экз. озерной лягушки: 65 экз. из 19 географических пунктов Самарской и Саратовской областей и 6 экз. из 2-х лока-литетов пограничных с Оренбургской и Волгоградскими областями (табл. 1).
Молекулярно-генетический анализ выполнен в лаборатории молекулярной экологии и систематики животных при кафедре зоологии и экологии Пензенского государственного университета. В качестве образцов тканей для выделения ДНК использовалась часть пальца передней конечности амфибий, взятая прижизненно. ДНК выделяли по стандартной методике [11].
Использовались 2 молекулярно-генетических маркера: для митохондриальной ДНК (мтДНК), наследуемой по материнской линии – фрагмент первой субъединицы гена цитохром оксидазы COI , для ядерной ДНК (яДНК), имеющей «менделеевский» тип наследования – интрон 1 гена сывороточного альбумина SA1 [10].
Генетическое типирование, позволяющее определять принадлежность гаплотипов мт- и яДНК к «восточной» или «западной» форме проводилось по методике опубликованной нами ранее [3]. При расчете частот встречаемости гаплотипов учитывалось, что мтДНК является гаплоидной и формально может рассматриваться как один аллель, поэтому процентное соотношение аллелей и исследованных экземпляров равно. яДНК диплоидна, содержит два аллеля одного гена, соответственно доли аллелей и экземпляров той или иной формы различны в зависимости от соотношения гомо- и гетерозиготных особей. Различия частот аллелей оценивались с помощью двустороннего Классификацию биотопов, где были отловле-критерия Фишера (F, two-tailed) в программе ны озерные лягушки, проводили по методике STATISTICA (. предложенной в работе [6].
Таблица 1. Характеристика исследованного материала. Номера, указанные перед адресом, соответствуют номерам точек на картах (рис.)
|
№ |
Локалитет |
Год |
n |
Координаты N 1 E |
|
|
Самарская область |
|||||
|
1 |
Елховский р-н, с. Красные дома |
2012 |
5 |
53,830 |
50,357 |
|
2 |
г. Самара, пруд на ул. Бронной |
2012 |
5 |
53,269 |
50,230 |
|
3 |
г. Самара, пруд на ул. 8 просека |
2013 |
5 |
53,261 |
50,195 |
|
4 |
г. Самара, пруд «Нижний», Ботанического сад |
2013 |
5 |
53,216 |
50,178 |
|
5 |
г. Самара, озера у платформы «Соцгород», ул. Заводская |
2012 |
5 |
53,124 |
50,072 |
|
6 |
Ставропольский р-н, пос. Мордово, протока «Кольцовская воложка» Саратовское вдхр. |
2011 |
5 |
53,172 |
49,440 |
|
7 |
Сызранский р-н, пруд у с. Смолькино, верховья р. Уса |
2011 |
5 |
53,453 |
48,126 |
|
8 |
Большечерниговский р-н, пруд у пос. Большая Черниговка |
2007 |
5 |
52,100 |
50,878 |
|
Оренбургская область |
|||||
|
9 |
Бузулукский р-н, с. Колтубан |
2012 |
5 |
52,917 |
51,932 |
|
Саратовская область |
|||||
|
10 |
Пугачевский р-н, окр. с. Каменка (пойма р. Бол. Иргиз) |
2006 |
2 |
51,937 |
48,692 |
|
11 |
Пугачевский р-н, окр. г. Пугачев (пойма р. Бол. Иргиз) |
2009 |
2 |
52,000 |
48,848 |
|
12 |
Ершовский р-н, окр. с. Чапаевка (р. Б. Кушум) |
2011 |
2 |
51,634 |
48,042 |
|
13 |
Хвалынский р-н, г. Хвалынск |
2013 |
5 |
52,493 |
48,075 |
|
14 |
Ртищевский р-н, с. Урусово, р. Песчанка (приток р. Хопер) |
2013 |
1 |
52,388 |
43,779 |
|
15 |
окр. г. Аткарск, (пойма р. Медведица) |
2012 |
5 |
51,831 |
45,994 |
|
16 |
Аткарский р-н, окр. с. Приречное (пойма р. Медведица) |
2006 |
1 |
51,745 |
44,929 |
|
17 |
Аткарский р-н, г. Аткарск (р. Аткара) |
2009 |
1 |
51,873 |
44,989 |
|
18 |
Воскресенский р-н, о-в Чардым, Волгоградское вдхр. |
2012 |
1 |
51,736 |
46,333 |
|
19 |
Лысогорский р-н, окр. с. Урицкое |
2011 |
2 |
51,428 |
44,935 |
|
20 |
Балашовский р-н, с. Алмазово, (р. Хопер) |
2013 |
3 |
51,552 |
42,917 |
|
Волгоградская область |
|||||
|
21 |
Камышинский р-н, окр. пос. Щербаковка |
2001 |
1 |
50,512 |
45,764 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Генетические характеристики исследованных экземпляров выборки представлены в таблице 2. В первую очередь отметим несоответствие частот распределения двух генетических маркеров. Если результаты анализа маркера мтДНК (COI) показали почти двукратное преобладание в общей вы- борке гаплотипов «восточной» формы: B – 63%, R – 37%, то исследования маркера яДНК (SA1) напротив – трехкратное преобладание аллелей «западной» формы: R – 89%, B – 11%. Различия частот встречаемости аллелей мт- и яДНК достоверны (р = 0,0001).
Таблица 2. Генетические характеристики озерных лягушек ( n =71) района исследований, R – аллели P. ridibundus , B – аллели P. cf. bedriagae, H – гетерозигота; экз. (%)
мтДНК – ген COI
|
R (RR) 56 (79) |
H (RB) 15 (21) |
B (BB) – |
|||
|
Правобережье |
Заволжье |
Правобережье |
Заволжье |
Правобережье |
Заволжье |
|
28 |
28 |
2 |
13 |
– |
– |
Комбинация маркеров – яДНК/мтДНК
|
R (RR)/ R 22 (31) |
R (RR)/ B 34 (48) |
H (RB)/ R 4 (6) |
H (RB)/ B 11 (15) |
|
Правобережье Заволжье 17 5 |
Правобережье Заволжье 11 23 |
Правобережье Заволжье 2 2 |
Правобережье Заволжье – 11 |
Кроме того, только треть исследованных озерных лягушек (31%) имеет видоспецифичную для P. ridibundus комбинацию маркеров мт- и яДНК (R/R), т.е. диагностируется как генетически «чистая» «западная» форма. Остальные две трети ля- гушек имеют гибридное происхождение. Меньшая часть из них представлена гетерозиготными по маркеру яДНК экземплярами с мтДНК «западной» (H/R – 6%) или «восточной» (H/B – 15%) форм. Такое сочетание маркеров не противоречит отнесению их к гибридам первого поколения (F1).
Однако генетически «чистые» особи «восточной» формы, имеющие специфичные для P. cf. bedria-gae маркеры мт- и яДНК ( B/B ), среди исследованных экземпляров не выявлены (табл. 1). При отсутствии одной из родительских форм более вероятно, что гетерозиготные особи являются не гибридами F 1 , а результатом выщепления при возвратных скрещиваниях и беккроссах. С этим согласуется и большая доля лягушек (48 %) совмещающих в генотипе маркеры двух форм – яДНК «западной» формы и мтДНК «восточной». Такая комбинация маркеров ( R/B ) может возник-
А
нуть лишь при возвратных скрещиваниях гибридных экземпляров.
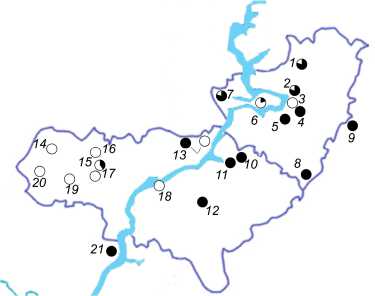
Географическое распределение гаплотипов мти яДНК показано на рисунке. Видно, что «восточная» форма полностью оправдывает свое на- звание, т.к. именно в заволжской части исследованного района преобладают специфичные для этой формы гаплотипы мтДНК (рис. А). Также в левобережной части располагается большая часть водоемов, в которых обитают особи несущие аллели яДНК «восточной» формы (рис. Б). Роль
Волги в закономерностях распределения аллелей разных форм озерной лягушки подтверждается статистически. По данным анализа мтДНК соотношение «западных» и «восточных» гаплотипов приблизительно составляет 2:1 на правом берегу Волги (n=30) и 1:7 в Заволжье (n=41). В том же направлении возрастает доля «восточных» аллелей яДНК – от 3% на Правобережье, до 16% в Заволжье. Различия соотношений «западных» и «восточных» аллелей на двух берегах Волги достоверны в большей степени для митохондриальной ( р = 0,0001) и в меньшей для ядерной ( р =
0.01) ДНК. Б
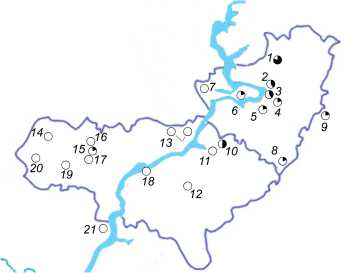
Рис. Распространение гаплотипов митохондриальной (А) и ядерной (Б) ДНК у озерных лягушек в районе исследования. «Западная» форма – прозрачный пунсон, «восточная» – залитый пунсон
Как указывалось выше, все исследованные экземпляры озерных лягушек делятся на две группы – «чистые» особи «западной» формы, с комбинацией маркеров мт- и яДНК ( R/R ) и «гибридные» экземпляры – гетерозиготные ( H/R , H/B ) или совмещающие маркеры двух форм ( R/B ). На правом берегу Волги доля озерных лягушек «западной» формы несколько выше, чем «гибридов» – 57% и 43%, соответственно. В Заволжье доля особей «западной» формы резко снижена (12%) и большинство экземпляров представлено «гибридами»
(88%). Различия между берегами достоверны ( р = 0,0001).
Мы также попытались оценить, существует ли зависимость биотопического распределения от генотипа исследованных озерных лягушек. Данные (табл. 3) показывают, что частота аллелей «восточной» формы возрастает в антропогенных водоемах по сравнению с естественными, а также в открытых водоемах по сравнению с полуоткрытыми и закрытыми. Однако эта зависимость выявлена пока лишь на уровне тенденции, так как не имеет значимой статистической поддержки.
Таблица 3. Биотопическое распределение генетически типированных озерных лягушек ( n =71)
|
Тип водоема |
Естественный |
Антропогенный |
ИТОГО абс. (%) |
||||||
|
R/R |
R/B |
H/R |
H/B |
R/R |
R/B |
H/R |
H/B |
||
|
Открытый |
1 |
4 |
– |
1 |
2 |
8 |
– |
6 |
22 (31) |
|
Полуоткрытый |
7 |
6 |
– |
1 |
8 |
7 |
3 |
2 |
34 (48) |
|
Закрытый |
2 |
3 |
1 |
– |
2 |
6 |
– |
1 |
15 (21) |
|
ИТОГО абс. (%) |
10 (14) |
13 (18) |
1 (1) |
2 (3) |
12 (17) |
21 (30) |
3 (4) |
9 (13) |
71 (100) |
Данные настоящего исследования, согласуются с данными полученными нами ранее для Пензенской области [2, 3], где также выявлено обитание двух криптических форм озерной лягушки, наличие гибридов между ними, а также асимметрия в распределении маркеров мт- и яДНК.
Таким образом, результаты молекулярногенетического анализа озерных лягушек обитающих на территории Самарской и Саратовской областей значительно расширяют «поволжскую» зону симпатрии и гибридизации «западной» и «восточной» форм, а также указывают на роль Волги как возможного пути расселения «восточной» формы.
Исследование выполнено при финансовой поддержке Министерства образования и науки РФ в рамках государственного задания ФГБОУ ВПО «Пензенский государственный университет» в сфере научной деятельности на 2014 – 2016 год ы.
Список литературы Распространение «западной» и «восточной» форм озерной лягушки Pelophylax ridibundus s. l. на территории Самарской и Саратовской областей (по данным анализа митохондриальной и ядерной ДНК)
- Боркин Л.Я., Литвинчук С.Н., Розанов Ю.М., Скоринов Д.В. // О криптических видах (на примере амфибий) // Зоологический журнал. 2004. Т. 83. Вып. 8. С. 936-960.
- Ермаков О.А., Закс М.М., Титов С.В. Диагностика и распространение «западной» и «восточной» форм озерной лягушки Pelophylax ridibundus s.l. в Пензенской области (по данным анализа гена COI мтДНК) Вестник ТГУ. 2013. T. 18, вып. 6. С. 2999-3002.
- Закс М.М., Быстракова Н.В., Ермаков О.А., Титов С.В. Молекулярно-генетическая и морфологическая характеристика озерных лягушек (Pelophylax ridibundus) из Пензенской области//Современная герпетология: проблемы и пути их решения. Статьи по материалам докладов Первой международной молодежной конференции герпетологов России и сопредельных стран. СПб., 2013. С. 86-89.
- Лада Г.А. Криптическое видообразование у бесхвостых амфибий русской равнины//Вестник Тамбовского университета. Серия: Естественные и технические науки. 2013. Т. 18. № 3. С. 790-794.
- Литвинчук С.Н., Розанов Ю.М., Боркин Л.Я., Скоринов Д.В. Молекулярно-биохимические и цитогенетические аспекты микроэволюции у бесхвостых амфибий фауны России и сопредельных стран//Вопросы герпетологии. Материалы Третьего съезда Герпетологического общества им. А.М. Никольского. СПб: 2008. С. 247-257.
- Ручин А.Б., Лада Г.А., Боркин Л.Я., Литвинчук С.Н., Розанов Ю.М., Рыжов М.К., Замалетдинов Р.И. О биотопическом распределении трех видов зеленых лягушек (Rana esculenta complex) в бассейне р. Волги//Поволжский экологич. журн. 2009. № 2. С. 137-147.
- Akın C., Bilgin C.C., Beerli P., Westaway R., Ohst T., Litvinchuk S.N., Uzzell T., Bilgin M., Hotz H., Guex G.-D., et al. Phylogeographic patterns of genetic diversity in eastern Mediterranean water frogs have been determined by geological processes and climate change in the Late Cenozoic//J Biogeogr. 2010. V. 37. P. 2111-2124.
- Borkin L.J., Litvinchuk S.N., Rosanov J.M., Khalturin M.D., Lada G.A., Barissovsky A.G., Faizulin A.I., Kotserzhinskaya I.M., Novitsky R.V., Ruchin A.B. New data on the distribution of the two cryptic forms of the common spadefoot toad (Pelobates fuscus) in Eastern Europe//Russ. J. Herpetol. 2003. 10. № 1. P. 115-122.
- Litvinchuk S.N., Crottini A., Federici S., De Pous Ph., Donaire D., Andreone F., Kalezić M.L., Džukić G., Lada G.A., Borkin L.J., Rosanov J.M. Phylogeographic patterns of genetic diversity in the common spadefoot toad, Pelobates fuscus (Anura: Pelobatidae), reveals evolutionary history, postglacial range expansion and secondary contact//Org Divers Evol. 2013. P. 433-451.
- Plötner J., Köhler F., Uzzell T., Beerli P., Schreiber R., Guex G.D., Hotz H. Evolution of serum albumin intron-1 is shaped by a 5’ truncated non-long terminal repeat retrotransposon in western Palearctic water frogs (Neobatrachia)//Molecular Phylogenetics and Evolution. 2009. V. 53. P. 784-791.
- Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory Manual, V. 3. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. 1989. 479 p.
- Stöck M., Moritz C., Hickerson M., Frynta D., Dujsebayeva T., Eremchenko V., Macey J.R., Papenfuss T.J., Wake D.B. Evolution of mitochondrial relationships and biogeography of Palearctic green toads (Bufo viridis subgroup) with insights in their genomic plasticity//Molecular Phylogenetics and Evolution. 2006. N 41. P. 663-689.


