Распространенность компонентов метаболического синдрома у больных ишемической болезнью сердца в популяции г. Еревана (Армения)
Автор: Могадам Эзат Фазели, Тадевосян Арташес Эдуардович, Подосян Геворг Аршалуйсович, Зелвеян Парунак Арутюнович
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2013 года.
Бесплатный доступ
Целью данного исследования явилось изучение взаимосвязи метаболического синдрома (МС) и его составляющих с ишемической болезнью сердца (ИБС) среди взрослого населения г. Еревана (Армения). Методы. За период 2010-2011 гг. в клиниках Ереванского государственного медицинского университета и в Центре превентивной кардиологии были рандомизированы 320 больных со стабильными формами ИБС (средний возраст 57,2±10,9 лет) и 320 - без ИБС (средний возраст 55,5±11,7 лет). Все больные обследовались согласно современным рекомендациям клиникоинструментальных и лабораторных исследований. Диагноз МС определялся по критериям AHA/NHLBI, 2005. Результаты исследования статистически обработаны методами параметрической и непараметрической статистики, достоверной считалась вероятность ошибки p
Метаболический синдром, ишемическая болезнь сердца, распространенность, ереван, армения
Короткий адрес: https://sciup.org/14342725
IDR: 14342725
Текст научной статьи Распространенность компонентов метаболического синдрома у больных ишемической болезнью сердца в популяции г. Еревана (Армения)
Распространенность метаболического синдрома (МС) проявляет тенденцию роста в развитых и развивающихся странах и ныне рассматривается как одна из основных проблем здравоохранения. Актуальность проблемы МС, в первую очередь, обусловлена его негативным влиянием на сердечно-сосудистый риск [1]. В течение последних десятилетий появилось много убедительных данных по этому вопросу, но, тем не менее, проблема влияния МС на риск развития ишемической болезни сердца (ИБС) остается объектом исследований многих авторов.
Рядом медицинских сообществ и организаций были предложены различные критерии определения МС. Согласно третьему докладу Национального комитета США по холестерину (NCEPATPIII, 2001), факторами, характеризующими МС, являются абдоминальное ожирение (АО), повышение триглицеридов (ТГ ≥ 1,7 ммоль/л), снижение липопротеидов высокой плотности (ЛПВП < 1,0/1,3 ммоль/л, м/ж), высокое артериальное давление (АД ≥ 130/85 мм рт. ст.), инсулинорезистентность (гликемия натощак ≥ 6,1 ммоль/л) [2]. Сочетание трех и более вышеперечисленных компонентов считалось критерием диагноза МС.
Согласно обновленной классификации, границами снижения ЛПВП принимаются < 0,9 и < 1,1 ммоль/л соответственно для мужчин и женщин, а для гликемии натощак ≥5,6 ммоль/л. Немаловажным можно считать также тот факт, что стали учитывать наличие антигипертензивного, гиполипи-демического или гипогликемического лечения. По обновленной классификации МС диагностируется при сочетании от трех до пяти вышеуказанных компонентов [3].
Критерии определения МС по Международной федерации диабета (МФД, IDF 2005) несколько отличаются от вышеуказанных: для диагностики МС абдоминальное ожирение рассматривается как главный компонент. МС считается сочетанием центрального ожирения с не менее чем двумя нижеперечисленными факторами: высокий уровень триглицеридов (≥1,7 ммоль/л) или соответствующее лечение, снижение ЛПВП (<1,03/1,29 ммоль/л, м/ж) или соответствующее лечение, повышение АД (≥130/85 мм рт. ст.) или соответствующее антигипертензивное лечение, повышение глюкозы в плазме крови натощак (≥ 5,6 ммоль/л) или ранее диагностированный сахарный диабет II типа[4].
В патогенезе атеротромбоза и развития ИБС связующим звеном патофизиологических нарушений при МС является нарушенная толерантность к глюкозе (НТГ) или инсулинорезистент-ность. В этом процессе существенную роль играет ассоциация инсулинорезистентности с другими метаболическими компонентами общего кластера МС, каждый из которых обладает собственным атерогенным потенциалом.
Сравнительный анализ распространенности в разных странах и в отдельных этнических группах затруднен из-за применения различных критериев определения МС. С другой стороны, есть исследования, в которых не выявлена связь меж-дуИБС и МС при рассмотрении отдельных компонентов МС [5].
По данным крупного проспективного исследования ARIC (Atherosclerosis Risk in Communities Study), распространенность МС достигает 24 % у женщин и 23 % у мужчин, что в значительной степени повышает риск сердечно-сосудистых осложнений [6].
Результаты исследования EUROPA (European Trialon Reduction of Cardiac Events with Perindopril in Stable CAD), охватившего 12218 человек, показали, что наличие МС усугубляет прогноз у паци- ентов с уже диагностированной ИБС [7].
Iribarren C. и коллеги установили, что при наличии МС и сахарного диабета (СД) риск раннего развития ИБС увеличился в 8 раз, по сравнению с группой контроля, а при наличии только МС – в 5 раз. Тем не менее, исследователи показали, что МС не дает дополнительной прогностической информации, по сравнению с его отдельно взятыми компонентами [8].
Эпидемиологических исследований по определению распространенности МС в странах СНГ немного. В 2007-2009 гг. впервые на пространстве Восточной Европы и СНГ было проведено популяционное исследование по выявлению МС в случайной выборке взрослого населения. Во взрослой (30 – 69 лет) популяции отдельно взятого города Чебоксары по критериям ATPIII МС выявлен у 20,6% населения. Артериальная гиперто-нияи АО являлись наиболее распространенными компонентами МС [9].
Проведенное в 2004 г. эпидемиологическое исследование среди взрослого населения города Еревана показало высокую распространенность как АГ (27,4%) [10], так и абдоминального ожирения у мужчин (22,3%) и женщин (40,0%) [11], однако, данные взаимосвязи ИБС и МС среди населения Армении отсутствуют. Представленная работа – первое региональное исследование по типу «случай-контроль», относящееся к вопросу взаимосвязи между МС и ИБС.
Целью настоящего исследования явилось изучение взаимосвязи между общим кластером МС и его составляющих и ИБС среди взрослого населения города Еревана.
МАТЕРИАЛ И МЕТОДЫ
Представленное исследование проведено в период с марта 2010 г. по февраль 2011 г. в двух клиниках Ереванского медицинского университета и в Центре превентивной кардиологии. Из числа всех посетителей были отобраны 320 больных с ИБС (группа «случай») согласно критериям включения-исключения исследования и 320 больных без ИБС («контрольная» группа). Критериями исключения были: беременность на момент исследования, системные заболевания в анамнезе, недавно (менее 6 месяцев) перенесенный инфаркт миокарда согласно медицинской документации, операции на сердце или ангиопластика по поводу сердечно-сосудистых заболеваний в анамнезе. Всеми участниками исследования предварительно дано письменное согласие на участие в исследовании. Таким образом, всего в исследовании приняли участие 640 больных (303 мужчин и 337
женщин в возрасте 56,4±11,4 года). Диагноз МС определялся на основании критериев, разработанных экспертами AHA/NIHLBATPIII 2005.
Протокол исследования был одобрен Комитетом этики Ереванского государственного медицинского университета им. М. Гераци. Все участники были ознакомлены с целями исследования и дали устное согласие на участие.
КЛИНИКО-ИНСТРУМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ
Антропометрическое обследование: масса тела фиксировалась с точностью до 0,1 кг; рост оценивался с помощью ростомера, без обуви и верхней одежды, с точностью до одного см. Индекс массы тела (ИМТ) рассчитывали как отношение массы тела (кг) к квадрату роста (м2). Согласно рекомендациям ВОЗ, окружность талии (ОТ) измеряли между краем нижнего ребра и крестцовым отделом подвздошной кости с точностью до 0,1 см; в норме ОТ у мужчин < 102 см, у женщин < 88 см, согласно критериям AHA/NIHLB АТР III 2005 [4].
АД измерялось методом Короткова, согласно рекомендациям Европейского общества гипертензии и Европейского общества кардиологов. ИБС диагностировали исходя из данных анамнеза, физикального и инструментального обследования, включая стандартный опросник на выявление болей в грудной клетке при физическом напряжении.
ЛАБОРАТОРНЫЕ ДАННЫЕ
Пробы крови для определения уровня глюкозы и концентрации липидов забирали утром натощак, после 12 часов голодания. Уровень ЛПВП, липопротеидов низкой плотности (ЛПНП), общего холестерина, триглицеридов и гликемии натощак (ГН) определяли на анализаторе CobasC 111 (Roche Diagnostics) и измеряли в единицах ммоль/л.
СТАТИСТИЧЕСКИЙ АНАЛИЗ
Все данные, полученные путем интервьюирования, клинического обследования и лабораторных исследований, введены в специально разработанную базу данных. Объем выборки вычислялся общепринятыми методами с учетом вероятности ошибки первого рода, равной 0,05, и мощности теста 0,1. Основные демографические и лабораторные данные представлены в виде средних значений и стандартных отклонений (СО). Для анализа количественных показателей использованы методы параметрической статистики, для качественных и градированных показателей – методы непараметрической статистики (χ2 тест Пирсона). При сравнении средних значений независимых выборок применялся t-тест Стьюдента. Статистическая обработка проводилась с использованием пакета программ SPSS (версия 15), достоверной считалась вероятность ошибки первого рода p< 0,05.
РЕЗУЛЬТАТЫ
Клинико-демографические и антропометрические характеристики пациентов со стабильной ИБС и без ИБС представлены в табл. 1. Из представленных данных следует, что обе группы сопоставимы по возрасту. Пациенты с ИБС были немного старше, с более высокими показателями ИМТ, но без статистически достоверных различий. Исследуемые группы имели одинаковый состав по полу. Однако, несмотря на отсутствие достоверных отличий между показателями ИМТ, ОТ у мужчин с ИБС была достоверно больше, чем у лиц контрольной группы (p<0,05). Аналогичная закономерность наблюдалась и у женщин. Окружность талии у больных с ИБС была достоверно больше, чем в контрольной группе (p<0,05).
Среди обследованных обеих групп у 123 пациентов (21,3%) выявлен СД. Из общего числа больных СД 45 были больные ИБС и 78 – без ИБС (p<0,005). В липидном спектре больных ИБС отмечались повышенные уровни как общего холесте- рина (ОХ), так инаиболее атерогенных фракций – ЛПНП и триглицеридов (ТГ). У больных ИБС достоверно чаще встречалась АГ (p<0,001). Кроме того, в исследуемой группе больных наблюдалось достоверно высокое (p<0,05) систолическое АД (САД) и количество больных, получающих антигипертензивное лечение (p<0,005), тогда как не было отмечено статистически значимой разницы диастолического АД (ДАД). АГ была наиболее частым хроническим заболеванием как в исследуемой, так и в контрольной группе. Сахарный диабет чаще наблюдался в контрольной группе. У 14% больных ИБС и 3% лиц без ИБС отмечалось наличие ИБС в семейном анамнезе (p<0,0001).
У больных ИБС значения ЛПНП, ОХ и ТГ плазмы были значительно выше, чем в контрольной группе. Между обследуемой и контрольной группами не выявлено статистически значимой разницы концентраций ГН и ЛПВП у мужчин. Следует отметить, что хотя межгрупповая разница концентраций ЛПВП у женщин была статистически недостоверной, однако, в контрольной группе отмечалась тенденция повышения данного показателя (p=0,055). В табл. 2 показана сравнительная распространенность МС и его составляющих в исследуемой и контрольной группах. Выявлена высокая частота МС как у больных ИБС, так и у пациентов без ИБС в анамнезе (p< 0,005).
Высокие значения ОТ, ТГ, а также САД и ДАД чаще наблюдались у больных, страдающих ИБС, чем у обследованных без ИБС: p<0,05; p<0,001 и p<0,005 соответственно. Тем не менее, не выявле-
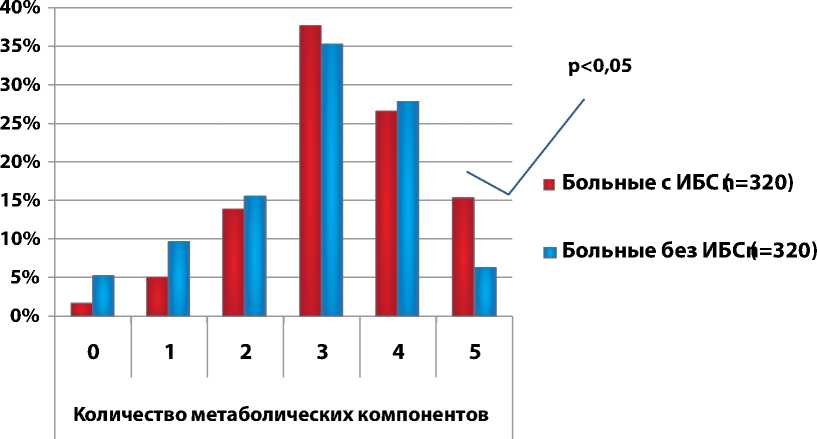
Рисунок 1. Процентное распределение метаболических компонентов в исследуемой и контрольной группах, согласно критериям AHA/NIHLB ATP III, 2005. (n=640)
ИБС – ишемическая болезнь сердца
Рисунок 1. Процентное распределение метаболических компонентов в исследуемой и контрольной группах, согласно критериям AHA/NIHLB ATP III, 2005. (n=640)
МС – метаболический синдром, ИБС – ишемическая болезнь сердца
на разница между распространенностью низких уровней ЛПВП в обеих группах. В исследуемой группе наиболее часто встречаемыми компонентами МС были высокое содержание ТГ и показатели САД/ДАД ≥ 130/85 мм рт. ст., а также низкий уровень ЛПВП, в то время как высокое САД и ДАД были наиболее частыми компонентами МС у лиц контрольной группы.
Для исследования распределения метаболических компонентов по количеству их комбинаций и связи этих комбинаций с фактом наличия ИБС мы провели анализ данных 640 обследованных (рис. 1). Отсутствие или комбинация одного или двух компонентов МС, как и предполагалось, чаще наблюдались в контрольной группе, хотя и без статистически достоверной разницы. При комбинации трех и более компонентов наблюдалось резкое увеличение числа больных ИБС. Разница становилась достоверной при полном кластере компонентов МС.
В рамках представленного исследования мы изучали вопрос сопоставимости критериев AHA/ NIHLB и МФД в процессе диагностики МС и особенности взаимосвязей компонентов МС с ИБС при разных принципах детерминации МС.
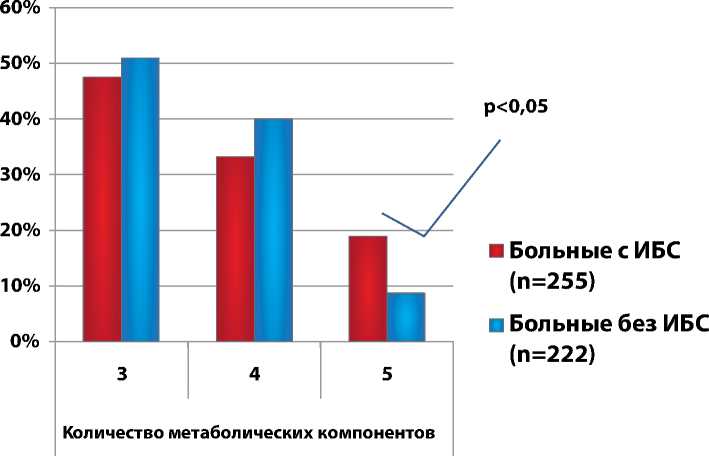
На рис. 2 показано распределение МС по количеству метаболических компонентов в исследуемой и контрольной группах согласно критериям AHA/NIHLB. Как видно из графического изображения, сочетание трех и четырех компонентов чаще
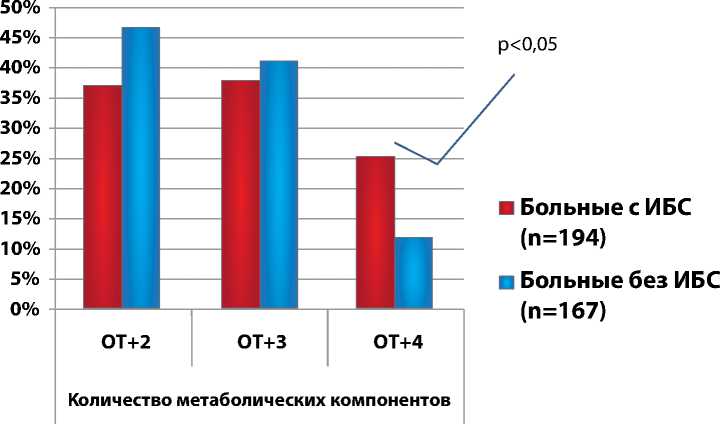
Рисунок 3. Процентное распределение МС по количеству метаболических компонентов в исследуемой и контрольной группах, согласно критериям IDF 2005. (n=361)
МС – метаболический синдром, ИБС – ишемическая болезнь сердца, ОТ – окружность талии
Таблица 1. Клинико-демографические и антропометрические характеристики пациентов, рандомизированных по наличию или отсутствию ИБС Больные ИБС Больные без
(n=320) ИБС (n=320)
|
Средний (СО) возраст (годы) |
57,2 (10,9) |
55,5 (11,7) |
NS |
|
Мужчины, % |
50,6 |
44,1 |
NS |
|
Средние (СО) антропометрические данные |
|||
|
ИМТ (кг/м2) |
29,5 (5,5) |
30,2 (16,9) |
NS |
|
ОТм (см) |
103,9 (12,3) |
100,4 (14,2) |
< 0,05 |
|
ОТж (см) |
100,5 (13,9) |
97,1 (12,9) |
< 0,05 |
|
Средние показатели (СО) липидемического профиля |
|||
|
ОХ (ммоль/л) |
5,45 (1,35) |
5,23 (1,30) |
< 0,05 |
|
ЛПВП м (ммоль/л) |
1,08 (0,25) |
1,06 (0,30) |
NS |
|
ЛПВП ж (ммоль/л) |
1,18 (0,28) |
1,25 (0,33) |
NS |
|
ЛПНП (ммоль/л) |
3,63 (1,17) |
3,06 (1,02) |
< 0,001 |
|
ТГ (ммоль/л) |
2,27 (1,04) |
2,06 (0,99) |
< 0,05 |
|
Средние показатели (СО) гликемического профиля |
|||
|
ГН (ммоль/л) |
6,0 (1,8) |
6,2 (2,3) |
NS |
|
АД (ммрт.ст.) |
|||
|
Систолическое АД |
140,2 (23,0) |
136,1 (20,5) |
< 0,05 |
|
Диастолическое АД |
86,5 (14,2) |
84,8 (12,0) |
NS |
|
Другие медицинские критерии, % |
|||
|
Сахарный диабет |
15,5 |
27,1 |
< 0,005 |
|
Антидиабетическое лечение |
6,6 |
8,8 |
NS |
|
Артериальная гипертензия |
78,1 |
64,4 |
< 0,001 |
|
Гипотензивное лечение |
44,1 |
31,9 |
< 0,005 |
|
ИБС в семейном анамнезе |
14,1 |
3,1 |
< 0,0001 |
|
Терапия статинами |
13,4 |
6,3 |
< 0,005 |
ИБС – ишемическая болезнь сердца, СО – стандартное отклонение, ИМТ – индекс массы тела, ОТм – окружность талии у мужчин, ОТж – окружность талии у женщин, ОХ – общий холестерин, ЛПВПм – липопротеиды высокой плотности у мужчин, ЛПВПж – липопротеиды высокой плотности у женщин, ЛПНП – липопротеиды низкой плотности, ТГ – триглицериды, ГН – гликемия натощак, АД – артериальное давление наблюдается в контрольной группе, а при полном кластере компонентов МС – достоверное превосходство числа больных ИБС.
Аналогичные закономерности обнаружены при изучении распределения МС по количеству метаболических компонентов в исследуемой и контрольной группах согласно критериям МФД (рис. 3).
ОБСУЖДЕНИЕ
У обследованного нами контингента выявлена высокая распространенность МС: 79,7% в группе
ИБС и 69,4% в контрольной группе. Полученные данные частоты АГ у обследованных больных идентичны данным с МС: 79,7 и 69,4% соответственно для групп ИБС и без ИБС (табл. 2). В некоторых исследованиях также показана высокая распространенность МС (70% согласно критериям ATPIII и 74% согласно критериям МФД) [12]. В других выявлена относительно низкая распространенность: у больных ИБС и без ИБС распространенность МС среди жителей Тегерана составила 56,7% против 46,9%, соответственно (ATPIII), и 45,9% против 39,3 %, соответственно (МФД) [5].
В представленной работе распространен
Таблица 2. Процентная распространенность МС и его компонентов в исследуемой и контрольной группах
|
Показатели, % |
Группы |
p |
|
|
ИБС (n=320) |
без ИБС (n=320) |
||
|
ОТ ≥ 102/88 см (м/ж) |
68,8 |
60,6 |
<0,05 |
|
ТГ ≥ 1,7 ммоль/л |
73,3 |
58,9 |
<0,001 |
|
ЛПВП < 1,03/ 1,29 ммоль/л (м/ж) |
62,0 |
62,8 |
NS |
|
САД/ДАД ≥ 130/85 мм рт.ст. |
79,7 |
69,4 |
<0,005 |
|
ГН ≥ 5,6 ммоль/л |
59,2 |
49,8 |
<0,05 |
|
МС |
79,7 |
69,4 |
<0,005 |
ИБС – ишемическая болезнь сердца, ОТ – окружность талии, ТГ – триглицериды, ЛПВП – липопротеиды высокой плотности, САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление, ГН – гликемия натощак, МС – метаболический синдром
ность МС и АГ значительно высока, что, по нашему мнению, обусловлено характером исследуемой выборки: исходно в исследование включены лица, обратившиеся в медучреждения по поводу сердечно-сосудистых заболеваний, среди которых значительную долю составила АГ. Так как исследование по методологическому характеру не скрининговое, среди обследуемого контингента также выявлена большая распространенность МС и составляющих компонентов. Особого внимания заслуживает тот факт, что при высокой распространенности АГ в обеих группах остается низким число больных, получавших антигипертензивное лечение (44,1% и 31,9%, соответственно). Аналогична картина антидиабетической и гиполипиде-мической терапии. Вышеуказанные данные могут свидетельствовать о низкой приверженности больных (или низком уровне контроля со стороны врачей) к лекарственной коррекции отдельных компонентов МС в контрольной группе и, что особенно важно, – в группе ИБС.
Хотя статистически значимой разницы показателей ЛПВП между групп не наблюдалось, установлено, что абсолютная разница имеет обратно пропорциональную тенденцию у мужчин по сравнению с женщинами. Так, у мужчин средний уровень ЛПВП был ниже в контрольной группе (NS), тогда как у женщин – наоборот: средний показатель ЛПВП ниже в группе больных ИБС (p=0,05).
Учитывая высокую распространенность и существенное увеличение сердечно-сосудистого риска, мы уделили особое внимание распределению отдельных компонентов в общей структуре МС. Считается доказанным, что для каждого пациента совокупный МС содержит больше риска, чем сумма отдельных факторов риска [13]. Поскольку в разных популяциях сопоставимые распространенности МС могут отличаться по структуре соот- ношения компонентов, это может стать причиной некоторых дебатов при сравнительном анализе популяционных исследований.
В группе больных с МС 83,2% имели АД ≥ 130/85 мм рт. ст., гипертриглицеридемию – 79,2%, большую ОТ – 75,7%, низкий уровень ЛПВП – 72,1%, высокие показатели ГН – 64,7%. По данным Simons L. и соавт.: АГ выявлена у 99% пациентов, гипертриглицеридемия – у 83 %, низкий уровень ЛПВП – у 75 %, и только 43% имели критерии ожирения, и 48% – гипергликемию [14]. В другом исследовании получены иные данные профиля факторов риска: 91% имели АГ, 85% – низкий уровень ЛПВП, 56% – критерии ожирения и только 48% – гипертриглицеридемию [15].
Полученные нами данные показывают: в процентном соотношении чаще наблюдается сочетание трех компонентов (больше 35%), а частота полного кластера компонентов МС больше 10%. Расхождение результатов объясняется, в первую очередь, различными критериями детерминации МС.
Как и в предыдущей детерминации МС, достоверная разница между исследуемой и контрольной группами выявляется при полном кластере факторов риска. Отметим, что при детерминации МС, согласно МФД, число больных с МС значительно меньше: 56,4% (МФД) против 74,5% (AHA/ NIHLB) (p<0,005).
Несмотря на статистически достоверную разницу между числом больных МС, согласно рассмотренным критериям определения МС, при данном анализе нами не выявлены существенные разногласия.
ЗАКЛЮЧЕНИЕ
-
• Частота встречаемости метаболического син-
- дрома достоверно выше в группе больных с ИБС, что относится ко всем компонентам кластера метаболического синдрома, за исключением липопротеидов высокой плотности.
-
• Достоверная статистическая взаимосвязь между распространенностью метаболического синдрома и ИБС отчетливо проявляется при полном кластере МС.
-
• Критерии детерминации метаболического синдрома Национального комитета США по холестерину и МФД являются эквивалентными в аспекте клинического и практического применения.
Авторы выражают свою благодарность участникам исследования А. Киракосян и Н. Степанян, которые приняли участие в сборе данных, и к.б.н. Г. М. Аветисян за редактирование статьи.
Список литературы Распространенность компонентов метаболического синдрома у больных ишемической болезнью сердца в популяции г. Еревана (Армения)
- Hoang K.C., Ghandehari H., Lopez V.A., et al. Global Coronary Heart disease risk assessment of individuals with the metabolic syndrome in the U.S. Diabetes Care 2008; 31(7): 1405-9.
- ExecutiveSummary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285(19): 2486-97.
- Grundy S.M., Cleeman J.I., Daniels S.R., et al. Diagnosis an Management of the Metabolic Syndrome: An American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement: Executive Summary. Circulation 2005; 112: e285-e290.
- Zimmet P., Alberti K.G., Rlosc M.S. A New International Diabetes Federation Worldwide Definition of the Metabolic Syndrome: the Rationale and the Results. Rev EspCardiol 2005; 58(12): 1371-6.
- Hadaegh F., Zabetian A., Tohidi M., et al. Prevalence of Metabolic Syndrome by the Adult Treatment Panel III, International Diabetes Federation, and World Health Organization Definitions and their Association with Coronary Heart Disease in an Elderly Iranian Population. Ann Acad Med (Singapore) 2009; 38: 142.
- McNeill A.M., Rosamond W.D., Girman C.J., et al. The metabolic syndrome and 11-year risk of incident cardiovascular disease in the atherosclerosis risk in communities study. Diabetes Care 2005; 28: 385-90.
- Daly C.A., Hildebrandt P., Bertrand M., et al. Adverse prognosis associated with the metabolic syndrome in established coronary artery disease: data from the EUROPA trial. Heart 2007; 93: 1406-11.
- Iribarren C., Go A.S., Husson G., et al. Metabolic Syndrome and Early-Onset Coronary Artery Disease: is the Whole Greater Than It's Parts? J Am CollCardiol 2006; 48: 1800-7.
- Mamedov M.N., Poddubskaya E.A., Didigov R.T. Possibility of self-control the metabolic syndrome in the home. Kardiologia 2011; 19(5): 329-32. Russian (Мамедов М.Н., Поддубская Е.А., Дидигов Р.Т. Возможности самоконтроля проявлений метаболического синдрома в домашных условиях. Кардиология 2011,19(5): 329-32.).
- Zelveian P.A., Podosyan G.A., Barsamyan S.G., et al. Distribution, awareness and control of blood pressure in Yerevan, Armenia. Journal of Hypertension 2008; 26: Suppl.1: S.100.
- Podosyan G.A. Prevalence of abdominal obesity among adult population of Yerevan City and its relationship with arterial hypertension. Scientific papers of VII Congress of Armenian Cardiologists. 2009: 65.[Armenian]
- Brown T.M., Vaidya D., Rogers W.J., et al. Prevalence of the Metabolic Syndrome in Women with Coronary Artery Disease Differ by the ATP III and IDF Criteria? Journal of Women's Health 2008; 17(5): 841-7.
- Jeremy R.W. Metabolic syndrome -is the whole really greater than the sum of the parts? Heart Lung and Circulation 2011; 20: 211-3.
- Simons L.A., Simons J., Friedlander Y., et al. Is prediction of cardiovascular disease and all-cause mortality genuinely driven by the Metabolic Syndrome, and independently from its component variables? The Dubbo Study. Heart Lung and Circulation 2011; 20: 214-9.
- Malik S., Wong N.D., Franklin S.S., et al. Impact of the Metabolic Syndrome on mortality from coronary heart disease, cardiovascular disease, and all causes in United States adults. Circulation 2004; 110: 1245-50.


