Рассмотрение на примере линкера ASIC каналов способ создания химерного вектора на основе вектора PVAX1
Автор: Храмов А.П., Уграицкая В.М.
Журнал: Форум молодых ученых @forum-nauka
Статья в выпуске: 11 (63), 2021 года.
Бесплатный доступ
В этой статье приведены характеристики и общие сведения о структуре вектора pVAX1 и линкере ASIC каналов. Также здесь рассматривается способ его модификации для дальнейших исследований в лабораторных условиях.
Вектор, pvax1, линкер, asic-каналы, праймеры, плазмида, клонирование
Короткий адрес: https://sciup.org/140289975
IDR: 140289975 | УДК: 577.2
Текст научной статьи Рассмотрение на примере линкера ASIC каналов способ создания химерного вектора на основе вектора PVAX1
Линкеры ASIC каналов и подбор сайтов рестрикции для клонирования
Последовательность аминокислотных линкеров, связывающих субъединицы, была выбрана, исходя из литературных данных, структуры генов каналов и возможности клонирования в вектор pVАХ.
Ранее для контатамерных каналов ASIC1a/ ASIC2a [13] было показано, что использование линкера Asn-Asn-Asn-Asp-Ile-Asn-Asn (NNNDINN) для сшивки субъединиц позволило получить функциональные контатамерные каналы.
Подобная структура линкера была выбрана за основу.
Дополнительно линкер должен быть содержать сайты рестрикции, отсутствующие в целевых генах rASIC3 и hASIC3. Также подходящие сайты рестрикции должны содержаться в векторе для клонирования.
Анализ структуры генов позволил подобрать следующие линкеры (табл.1).
Таблица 1. Состав линкеров
|
Кодируемая аминокислотная последовательность |
Нуклеотидная последовательность |
|
|
Линкер 1 |
NNVDINN |
Aataatgtcgacatc aataat SalI |
|
Линкер 2 |
NNQALNN |
Aataa tcaagctttaaataat HindIII |
Дополнительно для создания химерных конструкций были выбраны рестриктазы BglII и ЕcoR1 , также отсутствующие в целевых генах.
Подготовка вектора для клонирования
Вектор pVAX1
pVAX1 ™ представляет собой плазмидный вектор размером 3,0 т.п.н., который часто используется для клонирования генов, предназначенных для экспрессии в клетках млекопитающих.
Особенности вектора позволяют реплицировать большое количество копий в E.coli и быстро экспрессировать интересующий белок в большинстве клеток млекопитающих. Вектор содержит следующие элементы (рис.1):
-
- Промотор раннего цитомегаловируса человека для высокого уровня экспрессии в широком спектре клеток млекопитающих.
-
- Сигнал полиаденилирования бычьего гормона роста (BGH) для эффективного завершения транскрипции и полиаденилирования мРНК.
-
- Ген устойчивости к канамицину для селекции в кишечной палочке.
3.0 kb
Comments for pVAX1 ™: 2999 bp
CMV promoter: bases 33-620
T7 promoter/priming site: bases 664-683
Multiple cloning site: bases 696-811
BGH reverse priming site: bases 823-840
BGH polyadenylation signal: bases 829-1053
Kanamycin resistance gene: bases 1226-2020 pUC origin: bases 2320-2993
Рисунок 1. Схема строения pVAX1 вектора.
Пример изменения его для работы.
В pVAX1 векторе имеются участки лишь для некоторых выбранных рестриктаз. Методом направленного мутагенеза полилинкер вектора был изменен и добавлены сайты рестрикции для рестриктаз BglII и SalI, что обеспечивало последовательное клонирование отдельных субъединиц (табл. 2).
Таблица 2. Сравнение изначальной структуры pVAX1 вектора и изменённого для дальнейших работ вектора pVAX1-new
|
Вектор |
pVax1 |
pVax1-new |
|
Последовательность cайтов рестрикции в полилинкере |
Nhe1-Hind3- ЕcoR1 |
Nhe1- BglII-SalI-Hind3-ЕcoR1 |
|
Нуклеотидная последовательность полилинкера |
GACCCAAGCTGGCTAGCGTTT AAACTTAAGCTTGGTACCGAG CTCGGATCCACTAGTCCAG…… ….GAATTC |
GACCCAAGCTGGCTAGCGTTAGATCT CGAGGTCGACACTTAAGCTTGGTACC GAGCTCGGATCCACTAGTCCAG…… ….GAATTC |
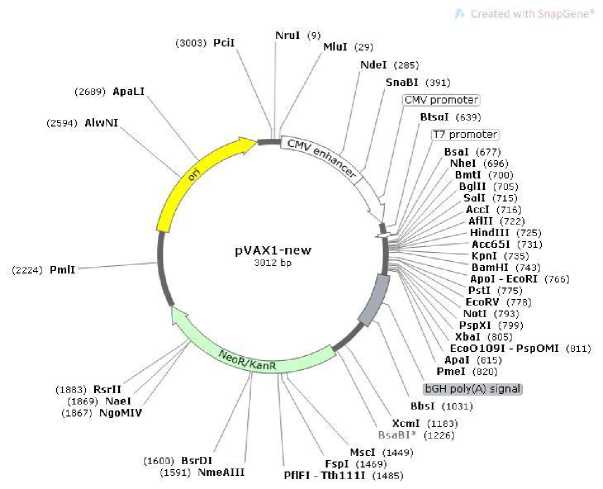
Рисунок 2. Модифицированный для работы pVAX1 вектор после вставки в него двух сайтов рестрикции BglII Sall
Для решения поставленной задачи нужно было получить фрагменты ДНК, содержащие соответствующие фланкирующие 5’ и 3’ нуклеотидные последовательности с сайтами рестрикции. Все фрагменты, предназначенные для последующего клонирования в вектор pVAX, не должны были иметь ошибок в последовательности, кодирующей белки канала, т.к. секвенирование целевых конструкций было невозможно из-за повторяющихся ДНК фрагментов.
Фрагменты ДНК были амплифицированы методом ПЦР с исходной матрицы (соответственно, плазмиды pcDNA3.1(rASIC3) и pcDNA3.1(hASIC3) с использованием специфичных праймеров (структура праймеров в таблицах 3 и 4). Праймеры использовались попарно для получения соответствующего фрагмента - см. Таблица 4. Все амплифицированные фрагменты были заклонированы в рAL-TA вектор (Евроген), предназначенный для быстрого клонирования продуктов ПЦР, и отсеквернированы в обоих направлениях. Далее использовались только клоны, содержащие верифицированные фрагменты, при трансляции которых в аминокислотной последовательности белков rASIC3 и hASIC3 не содержалось ошибок.
Таблица 3. Структура праймеров, использованных для амплификации
ДНК фрагментов hASIC3
|
Название праймера |
Структура праймера |
|
hA3-Bgl2-HA |
5’ctccttagatctatgaagcccacctcaggcc 3’ 31 bp |
|
hA3-Sal1-HArev |
5’ gatgtcgacattattgagctgtgtgacaaggtagcag 3’ 37 bp |
|
hA3-Sal1-HB |
5’ aatgtcgacatcaataatatgaagcccacctcaggcc 3’ 37 bp |
|
hA3-Hind3-HBrev |
5’ttaaagcttgattattgagctgtgtgacaaggtagcag 3’ 38 bp |
|
hA3-Hind3-HC |
5’atcaagctttaaataatatgaagcccacctcaggcc 3’ 36 bp |
|
hA3-EcoR1-HCrev |
5’attggattcctagagctgtgtgacaaggtagcag 3’ 34 bp |
Таблица 4. Структура праймеров, использованных для амплификации
ДНК фрагментов rASIC3
|
Название праймера |
Структура праймера |
|
rA3-Bgl2-RA |
5’ctccttagatctatgaaacctcgctccggactg 3’ 33 bp |
|
rA3-Sal1-RArev |
5’gatgtcgacattattgagccttgtgacgaggtaacag 3’ 37 bp |
|
rA3-Sal1-RB |
5’ aatgtcgacatcaataatatgaaacctcgctccggactg 3’ 39 bp |
|
rA3-Hind3-RBrev |
5’ttaaagcttgattattgagccttgtgacgaggtaacag 3’ 38 bp |
|
rA3-Hind3-RC |
5’atcaagctttaaataatAtgaaacctcgctccggactg 3’ 38 bp |
Таблица 5. Попарное использование праймеров для амплификации.
|
Фрагмент ДНК |
Прямой праймер |
Обратный праймер |
|
H1 |
hA3-Bgl2-HA |
hA3-Sal1-HArev |
|
H2 |
hA3-Sal1-HB |
hA3-Hind3-HBrev |
|
H3 |
hA3-Hind3-HC |
hA3-EcoR1-HCrev |
|
R1 |
rA3-Bgl2-RA |
rA3-Sal1-RArev |
|
R2 |
rA3-Sal1-RB |
rA3-Hind3-RBrev |
|
R3 |
rA3-Hind3-RC |
rA3-EcoR1-RCrev |
Таким образом, в распоряжении были клоны, содержащие в составе вектора рAL-TA последовательности:
R1 BglII – rASIC3 — linker1- SalI (клон рAL-TA (R1))
R2 SalI - rASIC3 - linker2 -Hind3 (клон рAL-TA (R2))
R3 Hind3- rASIC3-stop-ЕcoR1(клон рAL-TA (R3))
H1 BglII – hASIC3—linker1- SalI (клон рAL-TA (H1))
H2 SalI - hASIC3- linker2- Hind3(клон рAL-TA (H2))
H3 Hind3- hASIC3-stop- ЕcoR1 (клон рAL-TA (H3))
Дальнейшая стратегия заключается в последовательном клонировании фрагментов в вектор pVAX1-new.
Список литературы Рассмотрение на примере линкера ASIC каналов способ создания химерного вектора на основе вектора PVAX1
- Adelman, J.P., McCleskey, E.W. (2007) A conformation change in the extracellular domain that accomp anies desensitization of acidsensing ion channel (ASIC) 3, J. Gen. Physiol., 129, 345–350.
- Allen, N.J., Attwell, D. (2002) Mo du lation of ASIC channels in rat cere bellar Purkinje neurons by ischaemiarelated signals, J. Physiol., 543, 521–529.
- Alvarez de la Rosa D., Krueger S.R., Kolar A., Shao D., Fitzsimonds R.M., Canessa C.M. Distribution, subcellular localization and ontogeny of ASIC1 in the mammalian central nervous system / J. Physiol. 2003. V. 546. № 1. P. 77 – 87
- Baconguis I., Bohlen C.J., Goehring A., Julius D., Gouaux E. X-ray structure of acidsensing ion channel 1-snake toxin complex reveals open state of a Na(+)-selective channel / Cell. 2014. V. 156. № 4. P. 717 – 729
- Baconguis I., Gouaux E. Structural plasticity and dynamic selectivity of acid-sensing ion channel-spider toxin complexes / Nature. 2012. V. 489. № 7416. P. 400 – 405
- Bargeton, B., Kellenberger, S. (2010) The contact region between three domains of the extracellular loop of ASIC1a is critical for channel function, J. Biol. Chem., 285, 13816– 13826.
- Baron, A., Voilley, N., Lazdunski, M., Lingueglia, E. (2008) Acid sensing ion channels in dorsal spinal cord neurons, J. Neurosci., 28, 1498–1508.
- Bartoi T., Augustinowski K., Polleichtner G., Gründer S., Ulbrich M.H. Acid-sensing ion channel (ASIC) 1a/2a heteromers have a flexible 2:1/1:2 stoichiometry / Proc. Natl. Acad. Sci. U. S. A. 2014. V. 111. № 22. P. 8281 – 8286
- Benos, D.J., Stanton, B.A. (1999) Func tional domains within the degene rin/epithelial sodium channel (Deg/ ENaC) superfamily of ion channels, J. Physiol., 520, 631–644.
- Benson, C.J., Xie, J., Wemmie, J.A., Price, M.P., Henss, J.M., Welsh, M.J., Snyder, P.M. (2002) Heteromultimers of DEG/ENaC subunits form H+gated channels in mouse sensory neurons, Proc Natl Acad Sci U S A, 99, 2338–2343.
- Coric, T., Zhang, P., Todorovic, N., Canessa, C.M. (2003) The extracellu lar domain determines the kinetics of desensitization in acidsensitive ion channel 1, J. Biol. Chem., 278, 45240–45247.
- Coric, T., Zheng, D., Gerstein, M., Canessa, C.M. (2005) Proton sensitivity of ASIC1 appeared with the rise of fishes by changes of residues in the region that follows TM1 in the ectodomain of the channel, J. Physiol., 568, 725–735.
- Coryell M.W., Ziemann A.E., Westmoreland P.J., Haenfler J.M., Kurjakovic Z., Zha X. ming, Price M., Schnizler M.K., Wemmie J.A. Targeting ASIC1a Reduces Innate Fear and Alters Neuronal Activity in the Fear Circuit / Biol. Psychiatry. 2007. V. 62. № 10. P. 1140 – 1148
- Coryell, M.W., Wunsch, A.M., Haenfler, J.M., Allen, J.E., McBride, J.L., Davidson, B.L., Wemmie, J.A. (2008) Restoring Acidsensing ion channel1a in the amygdala of knockout mice rescues fear memory but not unconditioned fear responses, J. Neuro sci., 28, 13738–13741.
- Coscoy, S., de Weille, J.R., Lingueglia, E., Lazdunski, M. (1999) The pretransmembrane 1 domain of acidsensing ion channels participates in the ion pore, J. Biol. Chem., 274, 10129–10132.
- Cushman, K.A., MarshHaffner, J., Adelman, J.P., McCleskey, E.W. (2007) A conformation change in the extracellular domain that accomp anies desensitization of acidsensing ion channel (ASIC) 3, J. Gen. Physiol., 129, 345–350.


