Расстройства функционального состояния печени в раннем послеоперационном периоде после холецистэктомии
Автор: Власов А.П., Рубцов О.Ю., Шейранов Н.С., Власов П.А., Болотских В.А., Власова Т.И., Малахова О.С., Чигакова И.А.
Журнал: Хирургическая практика @spractice
Статья в выпуске: 1, 2018 года.
Бесплатный доступ
Целью работы стало изучение функционального состояния печени до операции и в раннем послеоперационном периоде после холецистэкто- мии у больных острым холециститом, осложненным обструкцией пузырного протока с эмпиемой или пропотным перитонитом. Проанализировано 94 клинических случая больных острым калькулезным холециститом, перенесших лапароскопическую холецистэктомию. Всем больным проводилась оценка общих и биохимических показателей крови и мочи, определение уровня токсических ве-ществ в плазме крови, маркеров оксидативного стресса и антиоксидантной системы.Результаты: в группах больных с осложненным воспалительным процессом в желчном пузыре (эмпиема, пропотной перитонит) маркеры функцио- нальной активности печени по сравнению с таковыми при не окклюзионном холецистите были измененными в большей степени на всем протяжении раннего послеоперационного периода.Аналогичная картина выявлялась при изучении эндотоксикоза у больных острым деструктивным калькулезным холециститом...
Холецистит, эндотоксикоз, оксидативный стресс, лапароскопическая холецистэктомия
Короткий адрес: https://sciup.org/142221833
IDR: 142221833 | УДК: 616.366-089.85 | DOI: 10.17238/issn2223-2427.2018.1.5-11
Текст научной статьи Расстройства функционального состояния печени в раннем послеоперационном периоде после холецистэктомии
Лапароскопическая холецистэктомия в настоящее время стала обычным оперативным пособием в лечении острого холецистита. Круг противопоказаний к малотравматичным вмешательствам с каждым годом уменьшается. Безусловно, для проведения такого рода операций требуется высокий уровень опыта в лапароскопической и неотложной хирургии [1,2,3]. Однако имеются все основания признать, что совершенствование оперативных навыков хирурга, разработка и внедрение нового оборудования и инструментария позволяют значительно уменьшить количество интраоперационных осложнений[4,5,6]. Таким образом техническая сторона самого оперативного пособия фактически решена. Тем не менее, следует помнить, что даже миниинвазивное вмешательство несет в себе элементы хирургической агрессии, что не может не отразиться на «функциональных» результатах операций, которые во многом определяют не только течение раннего, но и отдаленного послеоперационного периода[7]. Безусловно, в этой связи в первую очередь речь идет об органах топографоанатомически и функционально объединенныхрамками этой области (печень, поджелудочная железа, двенадцатиперстная кишка, желудок и др.). Отметим, что изменения их функционального статуса возможно и до операции, и сопряжено не только с продолжительностьюхолецистита, но и его выраженностью в манифестной фазе заболевания[8].
Цель работы
Изучениефункционального состояния печени до операции и в раннем послеоперационном периоде после холецистэктомии у больных острым холециститом, осложненным обструкцией пузырного протока с эмпиемой или пропотным перитонитом.
Материал и методы.Проанализировано 94 клинических случая больных острым калькулезным холециститом, перенесших лапароскопическую холецистэктомию. В зависимости от операционных находок, пациенты были разделены на три группы. Первая группа (n=55) (группа сравнения) – больные острым (неокклюзионным) деструктивным каль-кулезным холециститом. Вторая группа (n=21) – пациенты острым (окклюзионным) деструктивным калькулезным холециститом, осложнившемся эмпиемой желчного пузыря. В третьей группу (n=18) у больных обнаруживался пропот-ной перитонит вследствие острого (окклюзионного)деструк-тивного калькулезного холецистита. В послеоперационном периоде пациентам осуществлялось стандартизированно-елечение, состоящееиз инфузионного, детоксикационного, антибактериального и обезболивающего компонентов.
Помимо клинико-инструментальныхисследований, всем больным изучались общие и биохимические показатели крови и мочи, позволяющие оценитьне только функциональное состояние печени, но и детоксикационную, альбуминсинте-зирующую и альбумин- и липид-метаболизирующую функ- цию органа. Так, в плазме крови определяли количество токсических продуктов гидрофильной природы (по содержанию молекул средней массы) спектрофотометрическим методом при длинах волн 254 и 280 нм и гидрофобной природы (по общей (ОКА) и эффективной (ЭКА) концентрации альбумина) флюоресцентным методом на специализированном анализаторе АКЛ-01 «Зонд». Резерв связывания альбумина (РСА) рассчитывали по формуле РСА=ЭКА/ОКА, а индекс токсичности плазмы (ИТ) – по формуле ИТ=ОКА/ЭКА-1. Об интенсивности процессов перекисного окисления липидов судили по уровню диеновых и триеновых конъюгатов, которые определяли спектрофотометрическим методом на спектрофотометре СФ-46 и по уровню малонового диальдегида в реакции с тиобарбитуровой кислотой.Об актив-ностисупероксиддисмутазы (СОД) судили по реакции с нитросиним тетразолем, аактивностифосфолипазы А2 – по каталитической деятельности фермента потенциометрическим методом.
Результаты и обсуждение
Сопоставление больных острым деструктивным холециститом в группах по возрасту, полу не выявило существенных отличий, что позволило провести сравнение результатов лечения.
Клиническими исследования установлено, что послеоперационный период у больных острым (неокклюзионным) калькулезным холециститом протекал более гладко по сравнению с таковым в группах пациентов острым (окклюзионным) осложненным калькулезным холециститом. Так, выпот из брюшной полости в I-ой группе больных наблюдался только первые двое суток после операции (при этом на 2-е сутки послеоперационного периода только у 24 пациентов – 43,64 %), что было достоверно меньше относительно II-ой и III-ей групп пациентов в 2,44-5,68 раза (p<0,05). Восстановление функции кишечника у больных первой группы достоверно происходило в ранние сроки послеоперационного периода – первые сутки (15,3±2,7 ч), тогда как во второй и третьей – в основном (более 85 %) на вторыесутки (26,5±4,3 ч) после операции. Именно на этих этапах послеоперационного наблюдения у пациентов регистрировались при аускультации кишечные шумы, отмечено отхождение газов, были соответствующие УЗИ-признаки. Температурная реакция у больных острым (неоклюзионным) калькулезным холециститом составила 1,69±0,27 день, тогда как у пациентов острым (окклюзионным) осложненным калькулезным холециститомо-на была продолжительной и составила2,95±0,30 и 3,39±0,43 дней (p<0,05)соответственно.В I-ой группе больных острым калькулезным холециститом пребывание больных в стационаре составило 6,29±0,26 койко-дней, во II-ой и III-ей группе пациентов соответственно – 7,71±0,23 и 8,44±0,50 койко-дня, что относительно первой группой пациентов был достоверно продолжительнее соответственно на 22,73 и 34,34 %.
Клинико-лабораторные обследования показали, что при госпитализации в хирургическую клинику у всех больных выявлялись нарушения функциональной активности печени. При этом в группах больных с осложненным воспалительным процессом в желчном пузыре (эмпиема, либо про- потной перитонит) изучаемые маркеры функциональной активности печени по сравнению с таковыми первой группы были измененными в большей степени(на 12,55-47,68 %, p<0,05)(табл. 1).
Таблица 1
Некоторые маркеры функционального состояния печени у больных острым деструктивным калькулезным холециститом (M±m, n1=55, n2=21, n3=18)
|
Показатель |
Группа |
Норма |
До операции |
Сроки послеоперационного наблюдения |
||||
|
1-е сутки |
2-е сутки |
3-е сутки |
4-е сутки |
5-е сутки |
||||
|
Общий билирубин, мкмоль/л |
I |
16,07±0,27 |
19,08±0,60* |
20,18±0,55* |
21,68±0,51* |
20,55±0,51* |
19,08±0,60* |
17,56±0,37* |
|
II |
23,86±0,34* |
26,14±0,27* |
27,27±0,32* |
26,08±0,41* |
23,86±0,39* |
20,42±0,42* |
||
|
III |
28,27±0,24* |
30,42±0,38* |
34,18±0,34* |
32,45±0,25* |
31,34±0,29* |
30,45±0,33* |
||
|
Аспарагиновая аминотрансфераза, ммоль/ л•ч |
I |
22,24± 0,30 |
25,67±0,54* |
26,32±0,45* |
26,08±0,40* |
25,26±0,49* |
23,48±0,41* |
23,09±0,37* |
|
II |
28,95±0,42* |
30,08±0,33* |
29,84±0,36* |
28,73±0,34* |
27,01±0,39* |
25,79±0,31* |
||
|
III |
30,44±0,39* |
31,87±0,54* |
31,72±0,46* |
30,38±0,40* |
28,84±0,33* |
27,18±0,31* |
||
|
Аланиновая аминотрансфераза, ммоль/л•ч |
I |
16,88± 0,23 |
25,40±0,63* |
25,56±0,37* |
24,89±0,37* |
22,72±0,46* |
20,48±0,45* |
18,76±0,30* |
|
II |
34,53±0,29* |
36,28±0,45* |
35,19±0,31* |
33,20±0,46* |
29,42±0,42* |
26,34±0,50* |
||
|
III |
39,65±0,35* |
42,37±0,43* |
41,41±0,38* |
38,72±0,42* |
34,12±0,48* |
29,78±0,25* |
||
|
Коэффициент де Ритиса |
I |
1,318±0,040 |
1,011±0,030* |
1,030±0,034* |
1,048±0,055* |
1,112±0,051* |
1,146±0,032* |
1,231±0,044* |
|
II |
0,838±0,020* |
0,829±0,024* |
0,848±0,027* |
0,866±0,025* |
0,918±0,019* |
0,979±0,017* |
||
|
III |
0,768±0,021* |
0,752±0,022* |
0,766±0,018* |
0,788±0,023* |
0,845±0,017* |
0,913±0,020* |
||
Примечание: Здесь и далее: I – группа больных острым (неокклюзионным) деструктивным калькулезным холециститом; II – группа больных острым (окклюзионным) деструктивным калькулезным холециститом, осложнившемся эмпиемой желчного пузыря;III – группа больных острым (окклюзионным) деструктивным калькулезным холециститом, осложнившемся пропотным перитонитом; * – достоверность изменений по отношению к норме при p<0,05; жирный шрифт – достоверность разницы между данными I-ой группы и данными II-ой, III-ейгруппы при p<0,05; курсив – достоверность разницы между данными II-ой и данными III-е йгруппы при p<0,05
На всем протяжении раннего (до 5 суток) послеоперационного периода функциональные изменения печени сохранялись. При осложненной форме патологии они были более значимы. Так, у больных острым (окклюзионным) деструктивным калькулезным холециститом, осложненным эмпиемой желчного пузыря,изменения печеночных показателей, по сравнению с первой группой, были большими на 11,42-46,00 % (p<0,05),у пациентов с такого рода патологией, осложненной пропотным перитонитом, – на 17,31-70,29 % (p<0,05) (рис. 1).
Аналогичная картина выявлялась при изучении эндотоксикоза у больных острым деструктивным калькулезным холециститом. При поступлении у пациентов диагностирован синдром эндогенной интоксикации.Количество гидрофильных продуктов эндотоксикоза относительно нормы повышалось на 35,26-99,32 % (p<0,05), гидрофильных – на 10,70-43,39 % (p<0,05). Индекс токсичности плазмы увеличивался в 1,714,57 раза (p<0,05) (табл. 2).
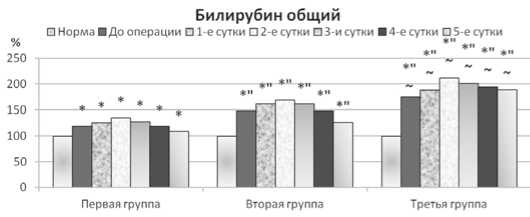
Рис. 1. Содержание общего билирубина у больных острым деструктивным калькулезным холециститом в раннем послеоперационном периоде. Здесь и далее: норма взята за 100 %; * – достоверность изменений по отношению к норме при p<0,05; ″ – достоверность разницы между данными I-ой группы и данными II-ой,III-ейгруппы при p<0,05; ~ – достоверность разницы между данными II-ой и данными III-ейгруппы при p<0,05
Таблица 2
Некоторые показатели эндогенной интоксикации у больных острым деструктивным калькулезным холециститом (M±m, n1=55, n2=21, n3=18)
|
Показатель |
Группа |
Норма |
До операции |
Сроки послеоперационного наблюдения |
||||
|
1-е сутки |
2-е сутки |
3-е сутки |
4-е сутки |
5-е сутки |
||||
|
Молекулы средней массы (λ=280 нм) усл. ед. |
I |
0,3478±0,0132 |
0,4695±0,0187* |
0,4721±0,0202* |
0,4508±0,0202* |
0,4208±0,0167* |
0,3803± 0,0161 |
0,3508± 0,0187 |
|
II |
0,6348±0,0194* |
0,6435±0,0218* |
0,6273±0,0234* |
0,5690±0,0148* |
0,5035±0,0218* |
0,4371±0,0138* |
||
|
III |
0,7112±0,0184* |
0,7257±0,0200* |
0,7168±0,0211* |
0,6749±0,0210* |
0,5956±0,0204* |
0,4921±0,0122* |
||
|
Молекулы средней массы (λ=254 нм) усл. ед. |
I |
0,2508±0,0124 |
0,3592±0,0165* |
0,3658±0,0120* |
0,3240±0,0142* |
0,2988±0,0117* |
0,2610± 0,0125 |
0,2522± 0,0139 |
|
II |
0,4985±0,0182* |
0,5006±0,0198* |
0,5082±0,0215* |
0,4631±0,0215* |
0,3970±0,0201* |
0,3467±0,0192* |
||
|
III |
0,5883±0,0235* |
0,5969±0,0192* |
0,5982±0,0191* |
0,5553±0,0145* |
0,4703±0,0225* |
0,4159±0,0200* |
||
|
Общая концентрация альбумина, г/л |
I |
54,04± 0,88 |
48,23±1,22* |
47,26±1,03* |
50,80±1,10 |
51,57±1,11 |
52,49±1,22 |
53,60±1,00 |
|
II |
45,76±1,02* |
48,05±0,95* |
50,52±1,10* |
52,19±1,14 |
51,86±1,13 |
52,67±1,07 |
||
|
III |
46,00±1,01* |
46,50±0,95* |
50,06±1,13* |
51,17±0,87* |
52,67±1,28 |
53,83±1,18 |
||
|
Эффективная концентрация альбумина, г/л |
I |
46,48± 0,51 |
37,74±0,65* |
36,83±0,54* |
40,09±0,59* |
42,57±0,51* |
44,40±0,60* |
46,37± 0,51 |
|
II |
29,81±0,74* |
28,86±0,67* |
32,29±0,77* |
34,71±0,62* |
35,71±0,62* |
38,86±0,77* |
||
|
III |
26,44±0,70* |
25,78±0,73* |
26,83±0,56* |
29,06±0,79* |
31,61±0,65* |
36,22±0,81* |
||
|
Резерв связывания альбумина, усл. ед. |
I |
0,8601±0,0175 |
0,7826±0,0179* |
0,7793±0,0210* |
0,7891±0,0108* |
0,8255±0,0135 |
0,8459±0,0109 |
0,8651±0,0196 |
|
II |
0,6514±0,0198* |
0,6006±0,0173* |
0,6390±0,0162* |
0,6651±0,0184* |
0,6887±0,0175* |
0,7378±0,0140* |
||
|
III |
0,5749±0,0179* |
0,5544±0,0093* |
0,5361±0,0191* |
0,5679±0,0204* |
0,6002±0,0152* |
0,6729±0,0129* |
||
|
Индекс токсичности, усл. ед. |
I |
0,1627±0,0058 |
0,2778±0,0144* |
0,2832±0,0157* |
0,2673±0,0139* |
0,2114±0,0149* |
0,1821±0,0053* |
0,1559± 0,0148 |
|
II |
0,5351±0,0147* |
0,6650±0,0185* |
0,5649±0,0140* |
0,5034±0,0158* |
0,4520±0,0148* |
0,3554±0,0152* |
||
|
III |
0,7395±0,0159* |
0,8039±0,0160* |
0,8654±0,0172* |
0,7610±0,0216* |
0,6661±0,0163* |
0,4862±0,0094* |
||
В группе больных острым (неокклюзионным) деструктивным калькулезным холециститом явления эндотоксикоза купировались на 3-5-е сутки после операции, что подтверждалось отсутствием существенного различия изучаемых значений с нормой (рис. 2).
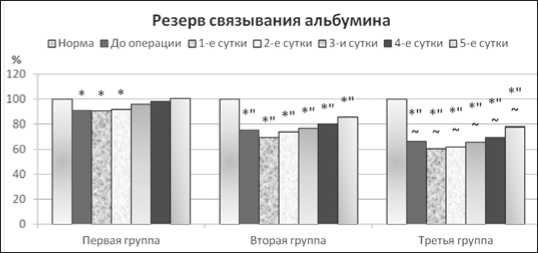
Рис. 2. Уровень резерва связывания альбумина в раннем послеоперационном периоде у больных острым деструктивным калькулезным холециститом
При возникновении осложнений острого (окклюзионного) деструктивного калькулезного холецистита на всех этапах послеоперационного наблюдения содержание молекул средней массы было повышено относительно нормы на 25,70-139,18 % (p<0,05), а по сравнению с первой группой – на 24,47-85,79 % (p<0,05). Одновременно эффективная кон- центрация альбумина была снижена по сравнению с нормой соответственно на 16,52-44,83 и 16,41-33,42 %. Отметим, что нормализации изучаемых показателей на пятые сутки после операции не наблюдалось.
При развитии у больных острого деструктивного кальку-лезного холецистита отмечалось нарастание интенсивности свободно-радикальных процессов перекисного окисления липидов. Количество молекулярных продуктов липоперео-кисления у больных в разных группах при поступлении повышалось на 32,39-151,27 % (p<0,05). Активность фосфоли- пазы А2 увеличивалась соответственно группам в 3,48, 4,51 и 2,51 раза (p<0,05), а активность супероксиддисмутазы достоверно снижалась – на 11,02, 21,60, и 28,04 %(табл. 3).
Таблица 3
Некоторые показатели перекисного окислениялипидов у больных острым деструктивным калькулезным холециститом (M±m, n1=55, n2=21, n3=18)
|
Показатель |
Группа |
Норма |
До операции |
Сроки послеоперационного наблюдения |
||||
|
1-е сутки |
2-е сутки |
3-е сутки |
4-е сутки |
5-е сутки |
||||
|
Коньюгаты, усл. ед./мг липидов |
I |
0,2520±0,0077 |
0,3336±0,0112* |
0,3721±0,0118* |
0,3276±0,0106* |
0,2949±0,0099* |
0,2556±0,0096 |
0,2545±0,0091 |
|
II |
0,4184±0,0126* |
0,4842±0,0102* |
0,4278±0,0107* |
0,3735±0,0095* |
0,3231±0,0113* |
0,2928±0,0101* |
||
|
III |
0,4926±0,0160* |
0,5710±0,0130* |
0,5022±0,0159* |
0,4384±0,0098* |
0,3730±0,0154* |
0,3367±0,0140* |
||
|
ТБК-активные продукты, нмоль/г белка |
I |
2,23± 0,15 |
4,12±0,11* |
4,08±0,12* |
3,77±0,14* |
3,28±0,12* |
2,77±0,11* |
2,25± 0,17 |
|
II |
5,06±0,11* |
5,17± 0,12* |
4,81±0,19* |
4,30±0,15* |
3,81±0,19* |
3,29±0,15* |
||
|
III |
5,59±0,15* |
5,91±0,20* |
5,72±0.15* |
5,12±0,20* |
4,55±0,16* |
4,04±0,13* |
||
|
Фосфолипаза А2, мкМоль/с/г белка |
I |
0,0813±0,0044 |
0,2829±0,0127* |
0,2873±0,0147* |
0,2322±0,0108* |
0,1911±0,0108* |
0,1407±0,0109* |
0,1082±0,0085* |
|
II |
0,3671±0,0127* |
0,4023±0,0157* |
0,3251±0,0152* |
0,2774±0,0210* |
0,2136±0,0148* |
0,1589±0,0071* |
||
|
III |
0,4207±0,0150* |
0,4528±0,0127* |
0,4120±0,0134* |
0,3426±0,0165* |
0,2627±0,0130* |
0,1906±0,0115* |
||
|
Супероксид-дис-мутаза (усл. ед / мг белка) |
I |
4,99± 0,082 |
4,44±0,084* |
4,35±0,104* |
4,46±0,099* |
4,57±0,094* |
4,78± 0,107 |
4,97± 0,073 |
|
II |
3,91±0,081* |
3,62±0,077* |
3,74±0,097* |
3,87±0,107* |
4,19± 0,106 |
4,53±0,086* |
||
|
III |
3,59±0,105* |
3,26±0,107* |
3,39±0,105* |
3,54±0,094* |
3,79±0,108* |
4,20±0,112* |
||
В первой группе больных количество коньюгат и активность супероксиддисмутазы достигало нормального значения на 4-е сутки после операции, а ТБК-реагирующих продуктов – на 5-е сутки, и свидетельствовало о восстановлении нормального течения процессов перекисного окисления липидов (рис. 3).
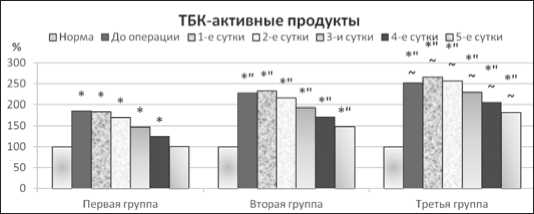
Рис. 3. Содержание ТБК-активных продуктов у больных острым деструктивным калькулезным холециститом после операции
В то же время при осложненном течении заболевания интенсивность свободно-радикальных процессов липопере-окисления сохранялась повышенной в течение всех пяти суток послеоперационного наблюдения.Содержание коньюгат и ТБК-активных продуктов было увеличено по сравнению с нормой на 16,18-166,62 % (p<0,05), а относительно первой группы пациентов – на 14,78-70,29 %(p<0,05). Активность фосфолипазы А2 была увеличена соответственно в 1,40-1,86 раза (p<0,05). Одновременно активность супероксиддисму-тазы была снижена по сравнению с нормой на 8,49-33,93 % (p<0,05), а по сопоставлениюс первой группой больных – на 8,75-24,71 % (p<0,05).
Выводы
У больных острым деструктивным холециститом, перенесших лапароскопическую холецистэктомию, до операции и в раннем послеоперационном периоде (особенно в первые двое суток) возникает нарушениедетоксикационной, альбу-минметаболизирующей, липидрегулирующей, в меньшей степени пигментрегулирующей функции печени.
Более выраженныефункциональные расстройства печени возникают при окклюзионном деструктивном холецистите, осложненным острой эмпиемой, а также деструктивном холецистите, осложненным пропотным перитонитом.
У больных острым деструктивным холециститом с клинико-лабораторными признаками острого поражения печени-ранний послеоперационный период протекает более тяжело, что обусловлено в первую очередь синдромом эндотоксемии и оксидативным стрессом.
Полученные данные имеют не только академическое, но и прикладное значение, поскольку могут явиться основой для проведения больным острым холециститом в раннем послеоперационном периоде персонифицированной терапии, которой в современной хирургими уделяется большое внимание.
Список литературы Расстройства функционального состояния печени в раннем послеоперационном периоде после холецистэктомии
- Курбанов Д.М., Расулов Н.И., Ашуров А.С. Осложнения лапароскопической холецистэктомии// Новости хирургии. 2014. Т. 22
- Goh JC, Tan JK, Lim JW, Shridhar IG, Madhavan K, Kow AW. Laparoscopic cholecys-tectomy for acute cholecystitis: an analysis of early versus delayed cholecystectomy and predictive factors for conversion. Minerva Chir. 2017 Jun 16. DOI: 10.23736/S0026-4733
- Bharathy K.G.S., Borle D., Kumar N. Acute Calculous Cholecystitis With Intrahepatic Gallbladder Perforation.JAMA Surg. 2017 Apr 1;152(4):403-404. DOI: 10.1001/jamasurg.2016.5544
- МахмадовФ.И., КурбоновК.М., КузратовФ.Х., Рафиков С.Р. Возможности неотложных лапароскопических холецистэктомий у лиц старших возрастных групп// Вестник Педагогического университета. 2014. № 5 (60). С. 152-156
- Acar T., Kamer E., Acar N., Atahan K., Bağ H., Hacıyanlı M., Ak- gül Ö. Laparoscopic cholecystectomy in the treatment of acute cholecystitis: comparison of results between early and late cholecystectomy// Pan Afr Med J. 2017 Jan 31;26:49. DOI: 10.11604/pamj.2017.26.49.8359
- Scott J, Singh A, Mayhew PD, Brad Case J, Runge JJ, Gatineau M, Kilkenny J. Periop-erative Complications and Outcome of Laparoscopic Cholecystectomy in 20 Dogs//Vet Surg. 2016 Nov;45(S1):O49-O59. DOI: 10.1111/vsu.12534
- Ackerman J., Abegglen R., Scaife M., Peitzman A., Rosengart M., Marsh J.W., Stahlfeld K.R. Beware of the interval cholecystectomy // J Trauma Acute Care Surg. 2017 Jul;83(1):55-60. 10.1097/ TA.0000000000001515 DOI: 10.1097/TA.0000000000001515
- Кукош М.В., Власов А.П. Острый холецистит. М.: Наука, 2009. 308 с


