Равновесие водяного газа с углеродом
Автор: Кузнецов Юрий Серафимович, Качурина Ольга Ивановна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.15, 2015 года.
Бесплатный доступ
Рассчитанные возможные параметры равновесия водяного газа с углеродом представлены поверхностью пространственной диаграммы в координатах x CO- x H2 - T, которую можно дополнить графиком проекций изотермических сечений поверхности на плоскость составов x CO- x H2. Рассмотрены различные способы получения газовой атмосферы, кислородный потенциал которой позволяет восстанавливать оксиды металлов. Наиболее технологически простым способом получения восстановительной по отношению к оксиду металла газовой смеси является нагревание водяного пара в контакте с углеродом. В этом случае состав получающегося водяного газа определяется только температурой нагрева. Максимальная концентрация водорода достигает x H2 ≈ 0,5 при нагревании H 2O - C до ~ 900 К, а при нагревании до температур выше 1100 К получается смесь газов-восстановителей с равными концентрациями x CO = x H2 = 0,5. При нагревании в контакте с углеродом смесей H 2O - CO 2 получается водяной газ, в котором уменьшается концентрация H 2 и увеличивается концентрация CO. Газовую атмосферу (Н 2 - Н 2О - СО - СО 2) любого состава можно получить нагреванием в контакте с углеродом смесей (Н 2 - СО). Образование CO 2 происходит в результате реакции диссоциации CO, а паров воды - в результате реакции Н 2 + СО 2 = Н 2О + СО. Предложена методика количественной оценки газификации углерода парами воды Н 2О и диоксидом СО2. Расчетами показано, что в зависимости от состава исходной газовой смеси и температуры реакции газификации C + CO 2 = 2CO и C + H 2O = CO + H 2 могут протекать в прямом и обратном направлениях.
Водяной газ, углерод, параметры равновесия, условия получения, кислородный потенциал
Короткий адрес: https://sciup.org/147156974
IDR: 147156974 | УДК: 546.26 | DOI: 10.14529/met150404
Текст научной статьи Равновесие водяного газа с углеродом
Водяной газ (Н 2 – Н 2 О–СО–СО 2 ) является основой газовых атмосфер в металлургических технологиях. Особенности равновесия реакции водяного газа в приближении линейной зависимости стандартного изменения энергии Гиббса реакции от температуры обсуждались в работе [1]. Параметры водяного газа изменяются, если он находится в равновесии с углеродом. В этом случае задача по оценке параметров равновесного состояния решается расчетом равновесий любых двух независимых реакций из трех возможных в системе ( A r G T , Дж):
H2 +CO2 =H2O+CO,
ArGT (1) = 36 580 - 33,465 T;(1)
C+CO2 = 2CO,
ArGT (2) = 172140 -177,7 T;(2)
C+H2O=CО+H2,
ArGT (3) = 135 560 -144,235 T.(3)
Появление второй фазы при неизменном числе компонентов приводит к изменению вариантности системы:
с = к + 2 – ф = 3 + 2 – 2 = 3.
Если заданы и не изменяются давление и температура, число степеней свободы с = к – ф = 3 – 2 = 1.
Следовательно, равновесные характеристики сис- темы Н2–Н2О –СО–СО2–С можно определить, лишь задав какой-либо один равновесный параметр. Возможны несколько вариантов решения задачи.
Рассмотрим для примера вариант расчета совместных равновесий реакций (1) и (2). Здесь следует отметить следующее обстоятельство. В «простой» двухкомпонентной двухфазной системе C–CO2–CO при постоянной температуре и заданном давлении 1 атм строго фиксируется не только соотношение x CO / x C O2 = K 2, но и концентрации и отношение концентраций x CO x CO (табл. 1).
Приведенная в последней строке табл. 1 информация позволяет определить температуру восстановления оксидов металлов в системе СО–СО2–С. Условие восстановления оксида определяется неравенством ( lg p о ) < ( lg p о ) На—
-
2 СО – СО2– С 2 MeО
пример, для оксида Fe3O4 это неравенство выполняется при температуре выше 917 К, а для оксида FeO – выше 955 К [2].
В системе Н2–Н2О–СО–СО2 –С фиксируют-xCO xH O ся соотношения K 1 =-----—, K2 = xCO2 xH2
xCO xH также соотношение K3 =------ = —2. Однако xH2O
Таблица 1
Концентрации компонентов и окислительный потенциал равновесной с углеродом газовой смеси (СО 2 – СО) при 1 атм
|
Т , К |
700 |
800 |
900 |
1000 |
1100 |
1200 |
1300 |
1400 |
1500 |
|
K 2 , атм |
2,73-Ю-4 |
0,0110 |
0,1956 |
1,952 |
12,82 |
61,53 |
232 |
724 |
1940 |
|
x CO |
0,0164 |
0,0995 |
0,3552 |
0,7283 |
0,9322 |
0,9843 |
0,9957 |
0,9986 |
0,9995 |
|
x CO 2 |
0,9836 |
0,9005 |
0,6448 |
0,2717 |
0,0678 |
0,0157 |
0,0043 |
0,0014 |
0,0005 |
|
–lg p O 2 |
29,48 |
25,85 |
23,14 |
21,24 |
19,97 |
19,05 |
18,30 |
17,65 |
17,14 |
отношение концентраций x CO x CO , как это следует из правила фаз, изменяется. Следовательно, изменяется и отношение x H x H O – в соответствии с равновесием реакции водяного газа (1). С одной стороны, это означает, что для расчета параметров равновесной системы необходимо кроме температуры и давления задавать еще какой-либо параметр, например, концентрацию любого компонента равновесного водяного газа. С другой стороны, это означает, что состав водяного газа может быть любым, но в некотором зависящем от температуры интервале. Покажем это конкретными расчетами.
При заданных температуре Т и давлении P решаем систему трех уравнений с четырьмя неизвестными:
СО 2 монотонно увеличиваются, а концентрации Н 2 с ростом x CO уменьшаются, тогда как изменение x H O характеризуются максимумом. Во-вторых,
x CO x H2O
K1 - xCO2 xH2
A G (1)
e RT
2 A G (2)
K 2 - xCOP - e RT x CO2
I
x i - x CO
+ x H2O + x CO2
+ x H2 - 1.
Если задавать концентрацию, например, x CO рав-
новесной газовой смеси, то решение уравнений (4) будет таким:
xC2O xCO2 - K2 ;
системы
x H 2 O
1 - x CO - x CO2 ,
1 x CO + 1 K 1 x CO2
задаваемая молярная доля x CO не может быть больше некоторого значения, определяемого равновесием реакции газификации углерода (см. табл. 1). Расчеты при задаваемых x CO , превышающих приведенные в табл. 1 величины, дают не имеющие физического смысла (отрицательные) концентрации Н2О и Н2.
Возможные параметры равновесия систем Н2–Н2О–СО–СО2–С можно представить пространственной диаграммой в координатах x CO – x H – T (рис. 1). На рис. 1 показаны возможные концентрации Н2 и СО в равновесной системе Н 2 –Н 2 О–СО–СО 2 –С при температурах в интервале 800…1000 К, причем точки, характеризующие возможные сочетания x CO , x H при разных температурах, располагаются на криволинейной поверхности MLFE . Линия FE на плоскости x CO – T определяет максимальные концентрации СО в равновесном водяном газе (см. табл. 1). На изотерме LF точками показаны некоторые результаты расчетов, которые в табл. 2 выделены жирным курсивом. Пространственную диаграмму можно дополнить графиком, показывающим проекции изотермических сечений поверхности MLFE на плоскость составов x CO – x H (рис. 2). Изотермы соединяют точку с координатами x CO = 0, x H = 1
x H2
1 - xCO -
x C 2 O
K
1 +
K 1 x CO
K
Замечание. Такие же расчетные уравнения получаются, если оценивать совместные равновесия других двух независимых реакций (1) и (3).
Для примера в табл. 2 для трех температур и давления 1 атм представлены результаты расчетов по соотношениям (5) возможных концентраций компонентов водяного газа, равновесного с углеродом. Следует отметить два обстоятельства. Во-первых, возможные равновесные концентрации
с точками, координаты которых определяют состав равновесного газа в двухкомпонентной двухфазной системе СО–СО 2 –С, линия EF на рис. 1. Изотермические линии являются образующими криволинейной поверхности MLFE , любая точка которой определяет возможные концентрации Н2 и СО в равновесном с углеродом водяном газе.
Внешне проекции изотерм на рис. 2 похожи на прямые линии. Однако эти линии, строго говоря, нельзя считать прямыми. Действительно, уравнение
1 - x CO -
2 x CO
x H 2
K 2
1 + K 1 x CO
K 2
(5*)
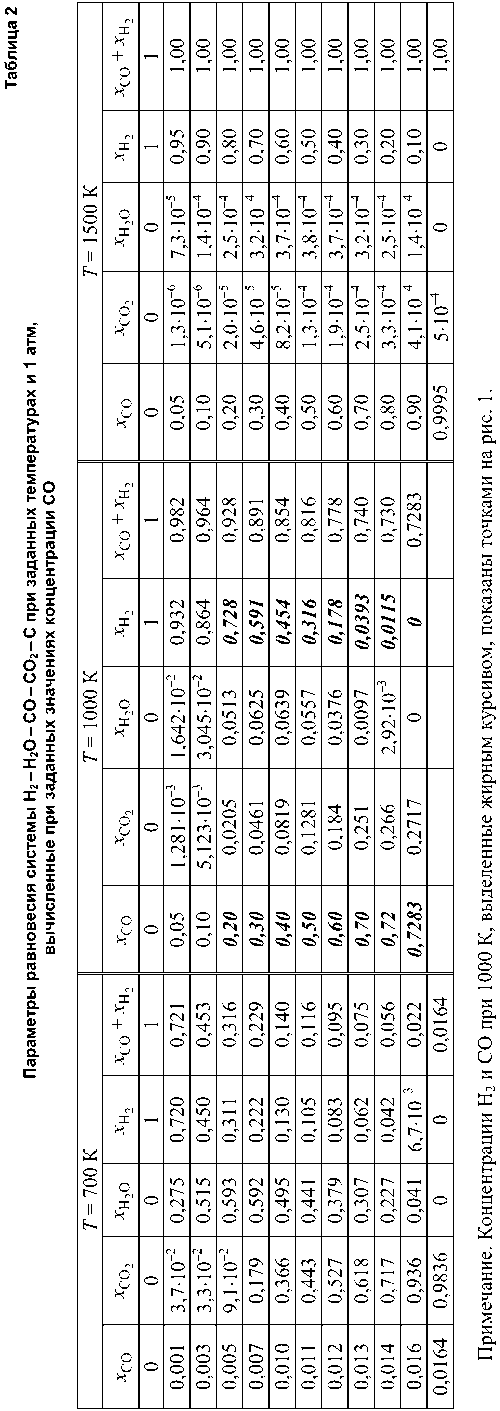
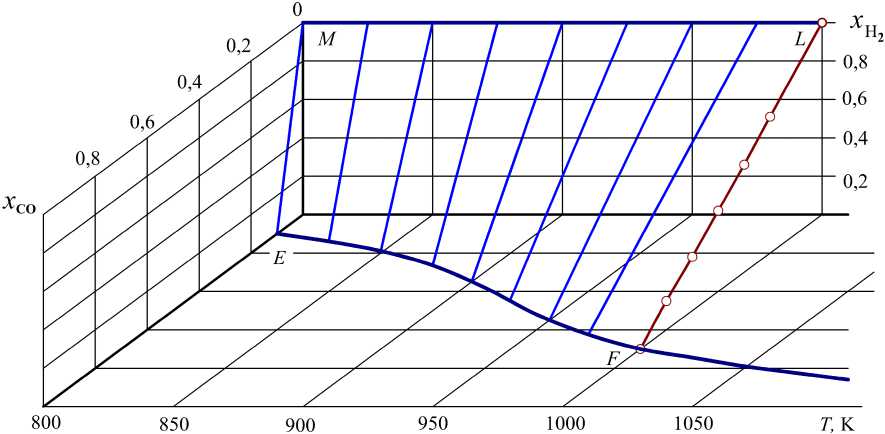
Рис. 1. Параметры равновесия водяного газа с углеродом: точки на изотерме 1000 К – вычисленные концентрации Н 2 и СО (табл. 2)
Рис. 2. Концентрации газов Н 2 и СО в системах Н 2 –Н 2 О–СО–СО 2 –С: линия 1 – 800; 2 – 850; 3 – 900; 6 – 1000; 7 – 1100; 8 – выше 1300 К; 4 – 917;
5 – 955 К. Точки – концентрации x CO и x H для 1000 К приведены в табл. 2
определяет нелинейные соотношения между x CO и x H . Аппроксимация этих зависимостей линейными функциями характеризуются такими коэффициентами корреляции при разных температурах:
1500 К – R 2 = 1; 1100 К – R 2 = 1;
1000 К – R 2 = 1, 950 К – R 2 = 1;
923 К – R 2 = 0,999; 900 К – R 2 = 0,997;
850 К – R 2 = 0,977; 800 К – R 2 = 0,902;
700 К – R 2 = 0,304.
Можно с достаточной достоверностью соотношения между x H и x CO при температурах выше 850 К считать линейными и определять такими уравнениями:
Представленными расчетами показано, что равновесие водяного газа с углеродом может реализоваться при бесконечном множестве сочетаний концентраций его компонентов. В практических технологиях процессы восстановления оксидов металлов чаще всего осуществляются в многокомпонентных газовых смесях в присутствии углерода. В зависимости от исходных параметров реальной технологии можно получать газовые атмосферы строго контролируемого состава. Приведем здесь расчеты составов водяного газа в равновесных состояниях «H 2 ( a моль) – H 2 O ( b моль) – CO ( c моль) – CO 2 ( d моль) – C», получающихся такими различными способами:
-
1) при нагревании до заданной температуры паров воды в контакте с углеродом – нагревание исходной системы
«H2O ( b 0 моль) – C»;
-
2) при нагревании исходной системы
«H 2 O ( b 0 моль) – CO 2 ( d 0 моль) – C»;
-
3) при нагревании исходной системы
«H 2 ( a 0 моль) – CO ( c 0 моль) – C».
Способ 1. Нагревание исходной системы
«H2O ( b 0 моль) – C»
Этот способ представляет, по нашему мнению, наибольший практический интерес, так как в промышленных технологиях создать атмосферу водяного газа технически проще и с наименьшими затратами можно в результате нагревания паров воды в контакте с углеродом. Рассчитаем параметры перехода исходной системы «Н 2 О ( b 0 моль) – С» в равновесие «Н 2 ( a ) – Н 2 О ( b ) – СО ( c ) – СО 2 ( d моль) – С», используя термодинамические характеристики двух независимых реакций газификации углерода (2) и (3). При изотермической выдержке исходной системы «Н2О ( b 0 моль) – C» образуются в результате протекания реакции (3) газы H2 и CO, газ CO2 образуется по реакции водяного газа (1), что провоцирует реакцию (2). Представим исходное и равновесное состояния системы:
C + CO 2 = 2CO C + H 2 O = CO + H 2
Исходное – – b – – состояние 0
Равновесное d c b c a состояние
Равновесные количества газов определяем решением системы уравнений с учетом баланса по во дороду b0 = b + a и кислороду b0= b + 2d + c:
(асЛ ( с2 ^
K = ac ; K = c- ; 2 = a + b + c + d . (7)
3 I b 2 I 2 I d 2 I
Так как уравнений три, а неизвестных четыре, то возможно, например, такое решение, когда величины c, b и d выражаются через a:
c =---- aJC 1 -----; ь = - a ; d = a— c . (8)
2(b0 - a) + aK 1 0
Тогда, варьируя задаваемую величину a, опреде- ляем такое её значение, при котором вычисленные величины c, b и d и концентрации:
a bcd xh2 =2; xh2o =2; xco = 2; xco2 = 2
удовлетворяют трем константам равновесия K 1, K 2 и K 3. Результаты расчетов представлены в табл. 3. Например, из приведенных в табл. 3 результатов расчетов для 1000 К получаем для изменений энергии Гиббса реакций:
2 x CO
—
x((,
I CO 2 J
A r G T (2) = A rG T (2) + RT In
= 172 140 - 177,7 - 1000 + 8314 - ln0------ = 0;
0,0683
[ x x H ]
I x H 2 O J
A rGT (3) = A r G T (3) + RT ln
= 135 560-144235 + 8314 - In
0,3652 ■ 0,5019
0,0646
≈0;
[ x H ^ O x CO ]
I x H2 x CO 2 J
A rGT (1) = A r G T (1) + RT ln
= 36 580 - 33 465+ 8314 - In
0,0646 ■ 0,3652
0,5019 ■ 0,0683
≈ 0.
Равенство нулю изменений энергии Гиббса реакций свидетельствует о равновесии всех трех возможных в системе реакций.
Из результатов термодинамических расчетов следует, что составы газовой смеси, получающейся при любой изотермической выдержке разных количеств паров воды (b0) в контакте с углеродом, представляется одной политермической линией, соединяющей точку N с координатами xНзо = 1 и точку М с координатами xH2 = xCO = 0,5 (рис. 3). Для каждой температуры получается одно единственное равновесное состояние, не зависящее от количества воды. Протекание реакций газификации приводит к заметному увеличению количества газов в системе. Из сравнения величин lgpO для получающейся газовой фазы и, например, для оксида железа FeO следует, что восстановление FeO до Fe в газовой смеси, полученной нагреванием Н2О–С, возможно при температурах выше ~ 900 К.
Образование водяного газа при нагревании паров воды в контакте с углеродом является следствием протекания двух реакций газификации. При изотермической выдержке исходной системы образуются в результате протекания реакции (3) газы H2 и CO, диоксид углерода CO2 может образоваться по двум реакциям:
CO + H 2 O = CO 2 + H 2 и 2CO = CO 2 + C.
Apriori следует ожидать, что углерод расходуется по реакции (3) и образуется сажистый углерод в результате диссоциации CO. Можно определить вклад
Таблица 3
Параметры равновесной системы «Н 2 ( a ) –Н 2 О ( b ) – СО( c ) –СО 2 ( d моль) – С», получающейся при нагревании исходной системы «Н 2 О (1 моль) – С», 1 атм
|
T , К |
700 |
850 |
900 (0,5) |
900 (1) |
900 (2) |
1000 |
1100 |
1300 |
1500 |
|
a |
0,3059 |
0,6265 |
0,36325 |
0,7265 |
1,4530 |
0,8860 |
0,9641 |
0,9959 |
0,9992 |
|
b |
0,6941 |
0,3735 |
0,1368 |
0,2735 |
0,5470 |
0,1140 |
0,0359 |
0,0041 |
0,0008 |
|
c |
0,0069 |
0,1313 |
0,1304 |
0,2608 |
0,5216 |
0,6447 |
0,8988 |
0,9916 |
0,9987 |
|
d |
0,1495 |
0,2476 |
0,1164 |
0,2328 |
0,4657 |
0,1207 |
0,0326 |
0,0022 |
0,0003 |
|
∑ |
1,1564 |
1,3789 |
0,7468 |
1,4937 |
2,9873 |
1,7653 |
1,9315 |
1,9937 |
1,9989 |
|
x H 2 |
0,2645 |
0,4543 |
0,4864 |
0,4864 |
0,4864 |
0,5019 |
0,4991 |
0,4994 |
0,4999 |
|
x H 2 O |
0,6003 |
0,2709 |
0,1831 |
0,1831 |
0,1831 |
0,0646 |
0,0186 |
0,0021 |
0,0004 |
|
x CO |
0,0059 |
0,0953 |
0,1746 |
0,1746 |
0,1746 |
0,3652 |
0,4653 |
0,4974 |
0,4996 |
|
x CO 2 |
0,1293 |
0,1795 |
0,1559 |
0,1559 |
0,1559 |
0,0683 |
0,0170 |
0,0011 |
0,0001 |
|
x H 2 + x CO |
0,2705 |
0,5496 |
0,6610 |
0,6610 |
0,6610 |
0,8671 |
0,9645 |
0,9969 |
0,9995 |
|
x H2 / x CO |
44,50 |
4,7698 |
2,7856 |
2,7856 |
2,7856 |
1,3743 |
1,0726 |
1,0043 |
1,0005 |
|
lg p O 2 |
–30,36 |
–25,04 |
–23,76 |
–23,76 |
–23,76 |
–21,84 |
–20,57 |
–18,89 |
–17,68 |
|
(lg p O 2 ) FeO |
— |
–25,52 |
–23,74 |
–20,72 |
–18,24 |
–14,42 |
–11,63 |
Примечания: Для 900 К расчет выполнен при заданных величинах b 0 = 2; 1 и 0,5 моль.
Кислородные потенциалы для системы FeO–Fe–O2 определены по данным, приведенным в работе [2].
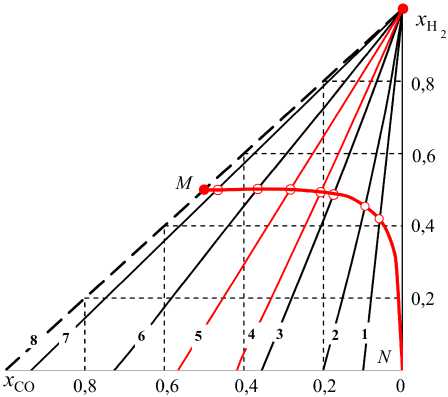
Рис. 3. Параметры равновесия (линия NM ) систем H 2 –H 2 O–CO–CO 2 –C, получающихся после нагревания смеси H 2 O–C: T = 800 (1), 850 (2), 900 (3), 917 (4), 955 (5), 1000 (6), 1100 (7), 1700 К (8)
каждой из реакций (2) и (3) в общий расход углерода при нагревании исходной системы Н2О–С:
C + CO 2 = 2CO C + H 2 O = CO + H 2
Исходное – состояние
Равновесное d состояние
Равновесное s состояние
– b0 – – c b c a y –2s b0– y y –2s y
Здесь в первой строке после уравнений реакций показано количество паров воды в исходном состоя- нии. Во второй строке – количества газов в системе после нагревания паров воды в контакте с углеродом до какой-либо температуры. В третьей строке – то же самое с учетом вклада каждой из реакций газификации в образовании равновесной газовой фазы:
y – количество углерода, вступившего в реакцию (3);
s – количество углерода, образовавшегося по реакции
2CO = CO 2 + C. (2*) Тогда константы равновесия реакций при P = 1 атм и условие нормировки:
У ( У - 2 5 )
3"(b0 - У )2 ;
К _ ( У - 2 5 )2.
K 2 = v ;
5 2
-
2 = a + b + c + d = b0 + y - 5.
Решение этой системы уравнений приводит к таким расчетным формулам:
t У ( b o - У ) .
-
5 K
Л y + 2 (bo - y) (10)
K 3
-
a = y ; b = b o - y ; d = 5 ; c = y - 2 5 .
Результаты расчетов приведены в табл. 4. Равновесные параметры газовой фазы, приведенные в этой таблице, абсолютно совпадают с параметрами, полученными расчетами по уравнениям без детализации расхода углерода. Кроме того, из результатов расчетов следует, что с повышением температуры увеличивается до единицы ( b 0 = 1 моль) количество углерода, вступившего в реакцию газификации (3). Получающийся по этой реакции оксид CO разлагается с образованием CO2 и сажистого углерода и это снижает общий расход углерода на газификацию. С повышением температуры уменьшается до нуля количество получающегося сажистого углерода, по реакции разложения монооксида CO:
при T ^ ~ 1700 К, y = n C (3) ^ 1, 5 = n C (2 * ) ^ 0, У n C = y - 5 ^ 1, У ^ 2 моль.
Для любого другого исходного количества паров воды b 0 моль:
при T ^ ~ 1700 К, y = n C (3) ^ b 0, 5 = n C (2 * ) ^ 0, У n C = y - 5 ^ b 0 , У ^ 2 b 0 .
Таким образом, с повышением температуры все возрастающую роль в газификации углерода играют пары воды и при температурах выше ~ 1100 К получается практически бинарная газовая смесь (CO–H2) с равными концентрациями компонентов.
-
Способ 2. Нагревание исходной системы
«H2O ( b 0 моль) – CO2 ( d 0 моль) – C»
В исходной системе соотношения количеств Н2O и СО2 могут быть любыми. Возможен расчет равновесия при 1 атм с детализацией расхода углерода по реакциям (2) и (3):
|
C + CO 2 = 2CO |
C + H 2 O = CO + H 2 |
||
|
Исходное |
– |
||
|
состояние |
0 |
0 |
|
|
Равновесное |
d 0 + s |
b 0 – y y –2 s y |
|
|
состояние |
y –2 s |
||
Решение системы трех уравнений с четырьмя неизвестными:
-
_ y ( y - 2 5 )
-
3 = ( b 0 - У ) 2 ;
K = (y - 25 )2
-
2 ( d 0 + 5 ) 2 ;
Ss = b0 + d 0 + y - 5
дает следующие соотношения для расчетов:
(a
-
У| b0 - У -
- V
-
5 = "K
-
-2 y + 2 ( b 0 - y )
K 3
a = y ; b = b 0 - y ; d = d 0 + 5 ; c = y - 2 5 ,
Таблица 4
Параметры равновесия систем Н 2 –Н 2 О–СО–СО 2 –С, получающихся при нагревании исходной системы «Н 2 О (1 моль) – С», давление 1 атм
Для примера результаты расчетов по уравнениям (11) для одной температуры 900 К приведены в табл. 5 и на рис. 4. Как и прежде параметры равновесного состояния определяются точками пересечения правых фрагментов полученных кривых N1, N2, N3 и др. с изотермой 6, определяющей возможные концентрации СО и Н2 в равновесной системе «водяной газ – углерод». Левые фрагменты 1M1, 2M2, 3M3 и др. реализуются при нагрева- ниях «Н2O (b0) – СО2 (d0) – С» до температур выше 900 К. При некотором увеличении общего количества газа соотношение xC2O xCO фиксировано, а отношение концентраций xCO ! xCO изменяется. С увеличением отношения d0 / b0 точка пересечения перемещается по изотерме 6 вниз, то есть в равновесной газовой смеси молярная доля водорода xH снижается от 0,4864 при d0 = 0 (отсутствие в исходной смеси СО2) до нуля в отсутствии в исходной смеси паров воды, b0 = 0.
Таблица 5
Параметры равновесия систем Н 2 –Н 2 О–СО–СО 2 –С, получающихся при нагревании до 900 К исходной системы «Н 2 О (1 моль) – СО 2 ( d 0 ) – С», 1 атм
|
b 0 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
|
d 0 |
0 |
0,5 |
0,845 |
1 |
2 |
3 |
9 |
9 |
|
y = n C (3) |
0,7265 |
0,6635 |
0,6427 |
0,6360 |
0,6108 |
0,5990 |
0,5789 |
0 |
|
s = n C (2) |
0,2328 |
0,0875 |
0 |
–0,0368 |
–0,2678 |
–0,4907 |
–1,7982 |
–1,9432 |
|
∑ n C = y – s |
0,4937 |
0,5760 |
0,6427 |
0,6728 |
0,8786 |
1,0897 |
2,3771 |
1,9432 |
|
a , моль |
0,7265 |
0,6635 |
0,6427 |
0,6360 |
0,6108 |
0,5990 |
0,5789 |
0 |
|
b , моль |
0,2735 |
0,3365 |
0,3573 |
0,3640 |
0,3892 |
0,4010 |
0,4211 |
0 |
|
c , моль |
0,2608 |
0,4884 |
0,6414 |
0,7096 |
1,1463 |
1,5804 |
4,1754 |
3,8865 |
|
d , моль |
0,2328 |
0,5875 |
0,8456 |
0,9632 |
1,7322 |
2,5093 |
7,2018 |
7,0668 |
|
∑, моль |
1,4937 |
2,0759 |
2,4870 |
2,6728 |
3,8786 |
5,0897 |
12,3772 |
10,9533 |
|
V , л |
110,23 |
153,2 |
183,54 |
197,3 |
286.2 |
375,6 |
913,4 |
808,4 |
|
x H 2 |
0,4864 |
0,3196 |
0,2584 |
0,2379 |
0,1575 |
0,1177 |
0,0468 |
0 |
|
x H 2 O |
0,1831 |
0,1621 |
0,1437 |
0,1362 |
0,1003 |
0,0788 |
0,0340 |
0 |
|
x CO |
0,1746 |
0,2352 |
0,2579 |
0,2655 |
0,2956 |
0,3105 |
0,3373 |
0,3551 |
|
x CO 2 |
0,1559 |
0,2830 |
0,3400 |
0,3604 |
0,4466 |
0,4930 |
0,5819 |
0,6449 |
|
lg p O 2 |
–23,76 |
–23,50 |
–23,42 |
–23,40 |
–23,30 |
–23,32 |
–23,19 |
–23,14 |
|
Для определения параметров состояния, по- СО могут быть любыми, а состав исходной смеси лучающегося при нагревании исходной системы (Н2 –СО) представляется точками на диагонали «СО 2 ( d 0 ) –С», рассчитывается равновесие реак- «( x CO = 1) – ( x H = 1)». Образование диоксида уг- ции (2): лерода CO2 при изотермической выдержке смеси C + CO 2 = 2CO (Н 2 –СО) происходит в результате реакции диссо- Исходное состояние d 0 – циации 2CO = C + CO 2 , а паров воды – в результа- Равновесное состояние d* = d. _ c c* те Реакции водяного газа Н + СО 2 = Н 2 О + СО. По - 0 2 этому рассчитываем равновесия тех же реакций: c * C + CO 2 = 2CO C + H 2 O = CO + H 2 S, = d * + c * = d n + —; Исходное
2 состояние 0 0 0
Ki = ----------; (12) s c 0-2 s - y y c 0-2 s - y a 0- y
д 2 ( c ) d о 4 Решение системы трех уравнений с четырьмя не известными: c * = 2 d 0J— K— . _ ( а 0 _ y )( c 0 _ 2 s _ y ) 04 4 + K2 K 3 = v ; 2 y S Для примера в последнем столбце табл. 5 приве- 2 дены результаты расчета для 900 К и d 0 = 9 моль. ( c 0 _ 2 s _ y ) Таким образом, нагреванием смеси (Н 2 О-СО 2 ) 2 = s s ; разного состава в контакте с углеродом можно получит водяной газ, концентрация водорода в ко- S * = a 0 + c 0 - s - y тором меньше величин, определяемых линией NM . дает такие расчетные уравнения: Например, нагреванием до 900 К можно получить y ( c 0 - y ) водяной газ, в котором концентрации компонен- s = к а Г к ) ’ тов изменяются в пределах: x H - от 0,4864 до 0; „ + y 1 2 „ 1 2 K 3 1 к 3 ) x H 2 O - от 0,1831 до 0; x CO-от 0,1746 до 0,3551; ( a^ _ y ) y x CO - от 0,1831 до 0,6449. x H2 = S ; x H2O =S ; Способ 3. Нагревание исходной системы x = ( c 0 _ 2 s _ y ) . x = s «H2 ( а 0 моль) - CO ( c 0 моль) - C» CO S ’CO ^ Этим способом можно получить атмосферу Результаты расчетов по этим уравнениям приведе- водяного газа любого состава. Количества Н2 и ны в табл. 6 и на рис. 5. Таблица 6 Параметры перехода исходной системы «H 2 ( a 0 моль) – CO ( c 0 моль) – C» в равновесия при изотермической выдержке 900 К ( K 2 = 0,1956; K 3 = 0,4638), 1 атм |
|||||||||
|
a 0 |
3 |
1,8571 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
|
c 0 |
1 |
1 |
1 |
1,1665 |
2 |
3 |
7 |
19 |
19 |
|
( x H 2 ) исх |
0,75 |
0,65 |
0,50 |
0,4616 |
0,333 |
0,25 |
0,125 |
0,05 |
0 |
|
y = n C (3) |
0,4624 |
0,3823 |
0,2735 |
0,2890 |
0,3366 |
0,3640 |
0,4010 |
0,4210 |
0 |
|
s = n C (2) |
0,1246 |
0,1703 |
0,2328 |
0,2889 |
0,5876 |
0,9632 |
2,5094 |
7,2014 |
7,4488 |
|
∑ n C = y – s |
0,3378 |
0,2120 |
0,0407 |
0 |
–0,2510 |
–0,5992 |
–2,1084 |
–6,7804 |
–7,4488 |
|
a |
2,5376 |
1,4748 |
0,7265 |
0,7110 |
0,6634 |
0,6360 |
0,5989 |
0,5790 |
0 |
|
b |
0,4624 |
0,3823 |
0,2735 |
0,2890 |
0,3366 |
0,3640 |
0,4010 |
0,4210 |
0 |
|
c |
0,2884 |
0,2772 |
0,2608 |
0,2997 |
0,4883 |
0,7096 |
1,5802 |
4,1762 |
4,1024 |
|
d |
0,1246 |
0,1703 |
0,2328 |
0,2889 |
0,5876 |
0,9632 |
2,5094 |
7,2014 |
7,4488 |
|
∑ |
3,4129 |
2,3046 |
1,4936 |
1,5886 |
2,0759 |
2,6728 |
5,0895 |
12,3776 |
11,5512 |
|
V |
251,88 |
170,07 |
110,23 |
117,24 |
153,20 |
197,25 |
375,61 |
913,41 |
852,5 |
|
x H 2 |
0,7435 |
0,6400 |
0,4864 |
0,4475 |
0,3196 |
0,2380 |
0,1177 |
0,0468 |
0 |
|
x H 2 O |
0,1355 |
0,1659 |
0,1831 |
0,1819 |
0,1621 |
0,1362 |
0,0788 |
0,0340 |
0 |
|
x CO |
0,0845 |
0,1202 |
0,1746 |
0,1887 |
0,2352 |
0,2655 |
0,3105 |
0,3373 |
0,3551 |
|
x CO 2 |
0,0365 |
0,0739 |
0,1559 |
0,1819 |
0,2830 |
0,3603 |
0,4930 |
0,5819 |
0,6449 |
|
lg p O 2 |
–24,39 |
–24,08 |
–23,76 |
–23,69 |
–23,50 |
–23,40 |
–23,26 |
–23,19 |
–23,14 |
Таблица 7
Параметры перехода исходной системы «H 2 ( a 0 моль) – CO ( c 0 моль) – C» в равновесия при изотермических выдержках, 1 атм
|
a 0 |
a 0 = 1, c 0 = 1, ( x H 2 ) исх = 0,5 |
a 0 = 1, c 0 = 3, ( x H 2 ) исх = 0,25 |
||||||
|
T , К |
850 |
900 |
950 |
1000 |
850 |
900 |
950 |
1000 |
|
y = n C (3) |
0,3735 |
0,2735 |
0,1849 |
0,1140 |
0,4830 |
0,3640 |
0,2539 |
0,1614 |
|
s = n C (2) |
0,2476 |
0,2328 |
0,1851 |
0,1207 |
1,0763 |
0,9632 |
0,7622 |
0,5094 |
|
∑ n C = y – s |
0,1259 |
0,0407 |
–0,0002 |
–0,0067 |
–0,5933 |
–0,5992 |
–0,5083 |
–0,3480 |
|
a |
0,6265 |
0,7265 |
0,8151 |
0,8860 |
0,5170 |
0,6360 |
0,7461 |
0,8386 |
|
b |
0,3735 |
0,2735 |
0,1849 |
0,1140 |
0,4830 |
0,3640 |
0,2539 |
0,1614 |
|
c |
0,1313 |
0,2608 |
0,4449 |
0,6447 |
0,3644 |
0,7096 |
1,2216 |
1,8198 |
|
d |
0,2476 |
0,2328 |
0,1851 |
0,1207 |
1,0763 |
0,9632 |
0,7622 |
0,5094 |
|
∑ |
1,3789 |
1,4936 |
1,6300 |
1,7654 |
2,4407 |
2,6728 |
2,9838 |
3,3292 |
|
V |
96,11 |
110,23 |
126,98 |
144,76 |
170,12 |
197,25 |
232,44 |
272,99 |
|
x H 2 |
0,4543 |
0,4864 |
0,5001 |
0,5019 |
0,2118 |
0,2380 |
0,2500 |
0,2519 |
|
x H 2 O |
0,2709 |
0,1831 |
0,1134 |
0,0646 |
0,1979 |
0,1362 |
0,0851 |
0,0485 |
|
x CO |
0,0953 |
0,1746 |
0,2730 |
0,3651 |
0,1493 |
0,2655 |
0,4094 |
0,5465 |
|
x CO 2 |
0,1795 |
0,1559 |
0,1135 |
0,0684 |
0,4410 |
0,3603 |
0,2555 |
0,1531 |
|
lg p O 2 |
–25,04 |
–23,76 |
–22,70 |
–21,84 |
–24,65 |
–23,40 |
–22,34 |
–21,49 |
|
(lg p O 2 ) Fe 3 O 4 |
–25,52 |
–23,43 |
— |
–19,84 |
–25,52 |
–23,43 |
— |
–19,84 |
|
(lg p O 2 ) FeO |
–25,52 |
–23,74 |
–22,15 |
–20,72 |
–25,52 |
–23,74 |
–22,15 |
–20,72 |
«H 2 (1 моль) – CO (1 моль) – C» и «H 2 (1 моль) – CO (3 моль) – C» до разных температур. С повышением температуры мало изменяется концентрация водорода и заметно повышается концентрация CO. При этом примерно на три порядка увеличивается равновесное давление кислорода, однако восстановительные способности получающейся газовой фазы по отношению к монооксиду железа при ~ 900 и ~ 920 К, соответственно, сохраняются.
Выводы
-
1. Нагреванием паров воды Н 2 О, смесей (Н2О–СО2) и (Н2–СО) в контакте с углеродом можно получить газовую смесь (Н 2 –Н 2 О–СО–СО 2 ), в которой возможно восстановление оксидов металлов. Самым эффективным, технологически простым и дешевым способом получения нужной газовой смеси является нагревание паров воды в контакте с углеродом, (Н2О – С).
-
2. Предложена методика термодинамических расчетов составов газовой смеси и расхода углерода на процессы газификации. Эта методика может быть полезной для термодинамических расчетов процессов восстановления оксидов металлов, введенных в рассмотренные системы.
-
3. Полученные данные позволяют обоснованно оценить роли окислительной газификации углерода диоксидом СО2 и парами Н2О. Авторы работы [3], по нашему мнению, некорректно судят о несоответствии кинетических особенностей газификации углерода термодинамическим предпосылкам. Причина этого состоит в том, что авторы определяют термодинамическую возможность газификации величинами стандартных изменений энергии Гиббса реакций (2) и (3), то есть по суще-
ству константами равновесия, и не учитывают исходные состояния. Результаты термодинамических расчетов для 900 К (см. табл. 5) показывают, что расход углерода по двум реакциям газификации существенно зависит от соотношения исходных количеств Н2О и СО2. Например, при молярном соотношении Н 2 О и СО 2 1 : 0,845 = ~ 1,183 углерод газифицируется только парами воды:
y = n C (3) = 0,6427; s = n C (2) = 0 моль.
Если молярное соотношение Н2О и СО2 в исходной смеси больше 1,183, расход углерода по реакции (3) y = n C(3) незначительно увеличивается до 0,7265 моль в отсутствии СО 2 . При этом увеличивается выделение сажистого углерода по реакции 2CO = C + CO 2 . Если же молярное соотношение Н2О и СО2 меньше 1,183, y = n C(3) незначительно уменьшается, тогда как существенно увеличивается количество углерода, вступившего в реакцию газификации (2).
Список литературы Равновесие водяного газа с углеродом
- Кузнецов, Ю.С. Термодинамический анализ реакции водяного газа/Ю.С. Кузнецов, Г.Г. Михайлов, О.И. Качурина. -Вестник ЮУрГУ. Серия «Металлургия». -2014. -Т. 14, № 1. -С. 5-11.
- Михайлов, Г.Г. Анализ фазовых равновесий в системе «оксиды железа -углерод -СО -СО2»/Г.Г. Михайлов, Ю.С. Кузнецов, О.И. Качурина, А.С. Чернуха. -Вестник ЮУрГУ. Серия «Металлургия». -2013. -Т. 13, № 1. -С. 6-13.
- Гришин, А.М. О несоответствии кинетических закономерностей термодинамическим предпосылкам реакций газификации углерода Н2О и СО2/А.М. Гришин, В.К. Симонов, И.С. Щеглова. -Изв. вузов. Черная металлургия. -2013. -№ 7. -С. 64-67.


