Равновесие жидкофазной структурной и позиционной изомеризации разветвленных пентилфенолов
Автор: Воронин И.О., Наумкин П.В., Нестерова Т.Н.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Технологии добычи и переработки нефти и газа
Статья в выпуске: 4-4 т.13, 2011 года.
Бесплатный доступ
На основе собственного эксперимента и литературных данных установлено, что «орто-пара» изомеризация третичных пентилфенолов может быть выделена из общей системы превращений, что позволяет осуществить в промышленности селективное получение пара-третичного пентилфенола в условиях достижения равновесия.
Алкилирование, жидкофазная изомеризация, пара-третичный пентилфенол
Короткий адрес: https://sciup.org/148200268
IDR: 148200268 | УДК: 661.715.4/.7
Текст научной статьи Равновесие жидкофазной структурной и позиционной изомеризации разветвленных пентилфенолов
Цель работы: изучение равновесия изомеризации разветвленных ПФ и выявлении на основе результатов изомеризации возможности получения пара -третичного пентилфенола (ПТПФ).
Для достижения цели решались следующие задачи.
-
1. Выполнение синтеза и выделения необходимых препаратов. Идентификация компонентов реакционных смесей. Анализ составов равновесных смесей.
-
2. Изучение равновесия жидкофазной структурной и позиционной изомеризации разветвленных ПФ.
-
3. Обоснование возможности создания альтернативной технологии получения ПТПФ.
При изучении структурной изомеризации нам было важно установление самого факта преобладания одной из структур (третичной или вторичной) в условиях достижения равновесия изомеризацией разветвленных ПФ. В большинстве жидкофазных процессов получения низших алкилароматических соединений именно равновесие позиционной изомеризации и переалкилирования играют главную роль в формировании состава реакционных масс. Для ПФ литературные сведения единичны [1, 3].
Экспериментальная часть. Для синтеза ПФ алкилировали фенол (квалификации «чда»): а) третичным пентиловым или изопентиловым спиртом при азеотропной отгонке образующейся воды с бензолом. Синтез проводили в трехгорлой колбе, снабженной ловушкой Дина-Старка, термометром и делительной воронкой для введения алкилирующего агента; б) смесью изоамиленов, полученной дегидратацией изоамилового спирта на активной окиси алюминия при 583 – 613 К. Реактор – трехгорлая колба с мешалкой и рубашкой для обеспечения изотермического режима в реакторе. В обоих случаях катализатором являлся активный сульфокатионит КУ-23 в Н-форме, высушенный до постоянного веса при 105-110°С. Процедура нейтрализации реакционной массы не проводилась. Пробы разбавлялись бензолом (до 50% по объему) во избежание перегрузки хроматографических пиков во время ГЖХ анализа.
Химическое равновесие разветвленных ПФ исследовано в присутствии концентрированной серной кислоты (92% масс.), либо сульфокатионита КУ-23. Загрузка катализатора варьировалась от 1,5 до 4% масс. для серной кислоты, для сульфокатионита – до 10% масс. Соотношение реагентов, направляемых на изомеризацию, варьировались в диапазоне 0,20,8 моль/моль (разветвленный пентил-/арил-). Полученный алкилат известного состава (табл. 1) загружали в реактор, снабженный рубашкой и мешалкой. Смесь доводили до температуры исследования и при постоянном перемешивании вносили необходимое количество катализатора. С этого момента начинался отсчет времени реакции. Поддержание необходимой температуры исследования осуществлялось за счет различных теплоносителей, кипящих в рубашке реактора: толуол – 383,8 К [4], этилбензол – 409,3 К [4], орто-ксилол– 417,6 К [4], нонан – 423,8, декан – 447,2 К [4]. Колебания атмосферного давления не вызывали изменения температуры кипения теплоносителя более чем на 1 К.
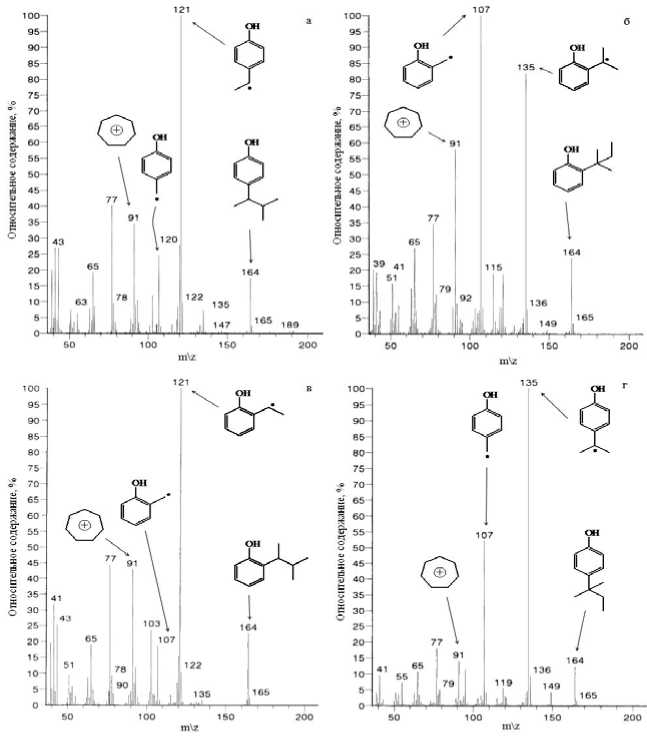
Рис. 1. Масс-спектры пентилфенолов:
а – 4-(1,2-диметилпропил)фенол; б – 2-(1,1-диметилпропил)фенол; в – 2-(1,2-диметилпропил)фенол; г – 4-(1,1-диметилпропил)фенол
В данной работе основным методом анализа реакционных смесей являлась газожидкостная хроматография. Хроматографический анализ проводился на приборе «Кристалл 2000 М» со следующими параметрами: пламенноионизационный детектор; кварцевая капиллярная колонка 50 м × 0,25 мм с привитой неподвижной фазой SE-30; температура испарителя 543 К, детектора – 473 К; газ-носитель – гелий, давление на входе 3 атм; делитель потока 1: 15. Идентификация всех компонентов сложных смесей включала в себя как хромато-масс- спектрометрический анализ, выполненный на кафедре «Органической химии» СамГТУ на приборе Finnigan Trace DSQ с базой NIST, так и постановку специального химического эксперимента. Информация в масс-спектрометрических базах данных NIST [4] была неполной и по совпадению полученных масс-спектров со сведениями баз данных однозначно идентифицирован только 4-(1,1-диметилпропил)фенол. Поэтому применительно к масс-спектрам прочих изомеров, рассматриваемых в работе, использованы следующие правила и направления фрагментации ионов, рекомендованные в [5]: а) все масс-спектры алкилароматических соединений характеризуются пиками молекулярного иона и тропилий-катиона (m/z 91), интенсивность которого невелика в случае, если алкильный заместитель имеет разветвление; б) высокоинтенсивные пики, образованные за счет разрыва β-связи алкильного заместителя, будут характеризовать строение алкильного заместителя. То есть, таким пикам будут соответствовать ионы, образованные согласно правилу выброса максимального алкильного радикала.
В соответствии с этими правилами были интерпретированы полученные масс-спектры (рис. 1) изомеров ПФ. Идентификация в группе орто-пара изомеров подробно описана в диссертационной работе Веревкина С.П. [1], откуда следует, что при алкилировании преимущественно образуются, орто - и пара трет - ПФ (пики 4 и 6 на рис. 2а), при смещении условий в сторону равновесных на протонных кислотах, пара - изомеры значительно преобладают над орто -изомерами (рис. 2б). Установлено, что при увеличении жесткости условий образуются орто - и пара -(1,2-диметилпропил)фенолы (пики 3 и 5 на рис. 2б). Мета -изомеров обнаружено не было.
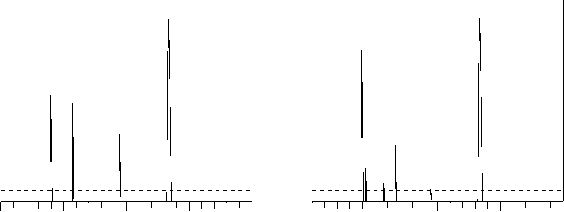
Рис. 2. Хроматограмма реакционных масс:
а – алкилирование фенола третичным пентиловым спиртом, T=353 К, 15 мин от начала синтеза; б – изомеризация продуктов алкилирования, T=383 К, 180 мин от начала синтеза. 1. Фенол. 2. трет -Пентилфениловый эфир.
3. орто -(1,2-Диметилпропил) фенол. 4. орто -(1,1-Диметилпропил) фенол. 5. пара -(1,2-Диметилпропил) фенол.
6. пара -(1,1-Диметилпропил)фенол
Обсуждение результатов. Структурная изомеризация. Результаты исследований, выполненных Веревкиным [1], свидетельствуют о том, что структурная изомеризация с образованием разветвленных вторичных пентилфенолов не протекает даже при достижении равновесия реакциями позиционной изомеризации трет -ПФ в ароматическом ядре. Это более чем устраивает потенциальных производителей пара- трет -пентилфенола. Однако нами установлено, что даже на протонных катализаторах, таких как серная кислота или активные сульфокатиониты, может быть достигнуто преобладание (1,2-диМП)фенолов над (1,1-диМП)фенолами вплоть до трех-четырех-кратного. Равновесие между структурными изомерами не достигалось, однако проблема для селективного получения пара- трет пентилфенола была обозначена.
Позиционная изомеризация в ароматическом ядре. Для этого типа превращений важно располагать надежными равновесными данными. Учитывая то, что фенольные системы неидеальны, это тем более важно. Собственные результаты исследования зафиксировали факт изменения отношения равновесных концентраций
4- трет -пентил- и 2- трет -пентил-фенолов от соотношения алкил/арил при 409 К (рис. 3а). В тоже время при 523 К это отношение практически постоянно [1] (рис. 3б).
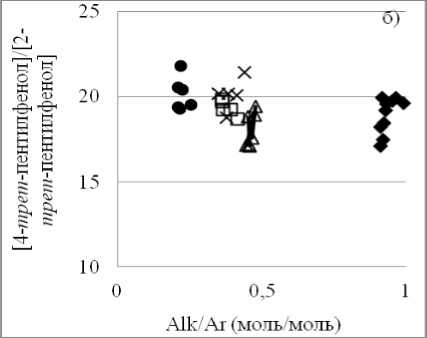
Рис. 3. Результаты исследования равновесия реакции 2- трет -пентилфенол ^^ 4- трет -пентилфенол (1): а) при 409 К (наши данные); б) при 523 К [1]
Обращает на себя внимание тот факт, что равновесие реакции (1)
2- трет -пентил фенол =^ 4- трет -пентилфенол (1)
изучено Веревкиным [1] при широком варьировании составов исходных смесей (табл. 3.1). Обработка экспериментальной информации [1] в том виде, в каком она была проведена для собственных данных, показала, что изменения отношений концентраций от соотношения ал-кил/арил при температурах 453-523 К практически не наблюдается. При низкой температуре (383-403 К) тенденция более заметна. Из таблицы 2 видно, что в условиях достижения равновесия система «фенол - разветвленные ПФ» представлена исключительно пара -ПФ. Однако для низких температур, которые предпочтительны для синтеза пара- трет -пентилфенола, строгое использование равновесных данных должно основываться на термодинамических константах равновесия, а не концентрационных.
Таблица 1. Состав исходных смесей для исследования равновесия в жидкой фазе
|
Исходная смесь, % мол. |
Маркировка в табл. 2 |
|
71,6[Ф]+0,2[п-ТБФ]+0,4[о-1,2-диМПФ]+1,7[о-1,1-диМПФ]+ 0,2[п-1,2-диМПФ]+25,6[п-1,1-диМПФ]+0,2[дипентилФ] |
O |
|
86,5[Ф]+0,1[п-ТБФ]+0,1[о-1,2-диМПФ]+3,3[о-1,1-диМПФ]+ 9,6[п-1,1-диМПФ]+0,2[дипентилФ] |
P |
|
64,2[Ф]+0,3[п-ТБФ]+0,9[о-1,2-диМПФ]+3,2[о-1,1-диМПФ]+ 30,9[п-1,1-диМПФ]+0,5[дипентилФ] |
Q |
|
71,1[Ф]+0,2[п-ТБФ]+0,4[о-1,2-диМПФ]+1,9[о-1,1-диМПФ]+ 0,2[п-1,2-диМПФ]+25,8[п-1,1-диМПФ]+0,3[дипентилФ] |
R |
|
84,7[Ф]+0,1[п-ТБФ]+0,1[о-1,2-диМПФ]+3,0[о-1,1-диМПФ]+ 8,2[п-1,1-диМПФ]+3,8[дипентилФ] |
S |
|
25,6[Ф]+2,8[п-ТБФ]+4,4[о-1,2-диМПФ]+2,2[о-1,1-диМПФ]+ 1,1[п-1,2-диМПФ]+62,2[п-1,1-диМПФ]+1,7[дипентилФ] |
T |
|
85,3[Ф]+0,1[п-ТБФ]+0,2[о-1,2-диМПФ]+3,6[о-1,1-диМПФ]+ 10,6[п-1,1-диМПФ]+0,3[дипентилФ] |
U |
|
66,9[Ф]+0,4[п-ТБФ]+0,7[о-1,2-диМПФ]+4,1[о-1,1-диМПФ]+ 0,1[п-1,2-диМПФ]+25,8[п-1,1-диМПФ]+2,1[дипентилФ] |
V |
Сведения по структурной и позиционной изомеризациям обладают ценностью непосредственно в практическом отношении - производстве индивидуальных АФ. В свое время совместными усилиями сотрудников кафедры «ТО-иНХС», исследователей и инженеров Новокуйбышевского нефтехимкомбината была решена задача селективного получения (ПТБФ) алкилированием фенола изобутиленом в условиях практического достижения равновесия системой превращений «фенол-трет-бутилфенолы» [6, 7]. Промышленный процесс был реализован, технология не претерпела изменений до сих пор. Однако в настоящее время изменилась конъюнктура на сырьевом рынке. Рост цены на изобутилен создал проблемы для сбыта ПТБФ. Актуальной стала замена изобутилена на другой алкилирующий агент с получением товарного продукта близкого по свойствам к ПТБФ. В табл. 3 приведены наши обобщенные экспериментальные данные по алкилированию фенола различными реагентами при катализе H2SO4 и AlCl3. Они показывают, что при низких температурах (323-353 К) и малых временах контакта реакционные массы действительно представлены исключительно третичными структурами, а соотношение концентраций третичных изомеров (92.2/7.8) только в присутствии катализаторного комплекса на основе AlCl3 начинает приближаться к равновесному значению (100/1) [1]. Повышение температуры процесса и/или увеличение времени контакта способствует структурной изомеризации
(табл. 3, рис. 4б). Итак, цена вопроса – высокая селективность процесса. То, что задача имеет положительное решение, следует из информации, приведенной на рис. 4а.
Таблица 2. Результаты исследования химического равновесия позиционной изомеризации трет -пентилфенолов
|
T, K |
τ, час |
Катализатор, % масс |
Исходная смесь из табл. 1 |
n |
fix |
t 0.05 S |
A Y |
t 0.05 s |
|
2- трет -пентилфенол 4- трет -пентилфенол (X) |
||||||||
|
383 |
8-16 |
1,5 [H 2 SO 4 ] |
O |
7 |
39,9 |
0,9 |
35,7 |
3,4 |
|
7-14 |
2,4 [H 2 SO 4 ] |
P |
16 |
46,0 |
0,8 |
|||
|
7-14 |
2,3 [H 2 SO 4 ] |
Q |
14 |
24,4 |
0,3 |
|||
|
409 |
3-7 |
1,8 [H 2 SO 4 ] |
R |
9 |
26,1 |
1,1 |
25,3 |
1,9 |
|
3-12 |
3,0 [H 2 SO 4 ] |
Q |
13 |
20,5 |
0,3 |
|||
|
3-8 |
2,4 [H 2 SO 4 ] |
S |
11 |
35,7 |
1,1 |
|||
|
3-9 |
7,9 [КУ-23] |
T |
12 |
19,9 |
0,3 |
|||
|
447 |
1-9 |
2,0 [H 2 SO 4 ] |
U |
19 |
24,6 |
0,7 |
21,0 |
2,5 |
|
3-8 |
2,7 [H 2 SO 4 ] |
V |
9 |
14,8 |
0,6 |
|||
Таблица 3. Условия и характеристики алкилирования фенола
|
Алкилирующий агент* |
Катализа-тор |
T , K |
Время, мин |
Состав разветвленных пентилфенолов, % |
|||
|
2-(1,2-диМПФ) |
2-(1,1-диМПФ) |
4-(1,2-диМПФ) |
4-(1,1-диМПФ) |
||||
|
ИАС |
H 2 SO 4 |
353 |
5 |
0,0 |
49,7 |
0,0 |
50,3 |
|
ТАС |
H 2 SO 4 |
353 |
5 |
0,0 |
73,6 |
0,0 |
26,4 |
|
ИАБ |
AlCl 3 |
323 |
5 |
0,0 |
7,8 |
0,0 |
92,2 |
|
ТАХ |
AlCl 3 |
323 |
5 |
0,0 |
22,8 |
0,0 |
77,2 |
|
ТАС |
H 2 SO 4 |
353 |
30 |
0,0 |
68,5 |
0,0 |
31,5 |
|
ИАБ |
AlCl 3 |
323 |
30 |
0,0 |
28,9 |
0,0 |
71,1 |
|
ИАС |
H 2 SO 4 |
353 |
60 |
1,0 |
51,2 |
0,0 |
47,7 |
|
ИА |
AlCl 3 |
453 |
5 |
3,3 |
31,6 |
0,6 |
59,4 |
|
ТАС |
AlCl 3 |
453 |
5 |
0,0 |
19,8 |
0,0 |
66,8 |
|
ИАС |
H 2 SO 4 |
453 |
15 |
12,6 |
15,5 |
4,9 |
67,0 |
|
ТАС |
AlCl 3 |
453 |
20 |
6,3 |
2,7 |
0,0 |
90,0 |
|
ИА |
AlCl 3 |
453 |
25 |
2,8 |
1,5 |
0,8 |
93,7 |
Примечание: * ТАХ - третичный амил хлористый; ИАБ - изоамил бромистый; ТАС - третичный амиловый спирт; ИАС – изоамиловый спирт; ИА – изоамилены
Итак, для фенолов реакции позиционной изомеризации алкильных заместителей в ароматическом ядре и структурной изомеризации указанного типа настолько энергетически различны. Кроме того, применительно к рассмотренным структурам алкилирование фенола протекает с образованием третичных соединений вне зависимости от природы реагентов и от типа катализатора, что указывает на реализацию механизма процесса с участием карбокатионов. Сочетание этих двух факторов позволяет выделить «ортопара» изомеризацию трет-АФ из совокупности всего комплекса превращений. Причем в данном случае речь идет о возможности селективного осуществления «орто-пара» изомеризации трет-АФ не только в специально подобранных условиях, когда избирательность процесса кинетически обеспечена, но когда практически важный процесс может селективно осуществляться в условиях достижения им химического равновесия. Это служит основой для создания альтернативной технологии получения ПТПФ, являющегося структурным аналогом технически важного пара-третичного бутилфенола, и расширения, таким образом, номенклатуры фенольных антиоксидантов.
Выводы: экспериментально установлено, что равновесное преобладание разветвленных вторичных структур над третичными изомерами является характерным для ПФ; установлен факт возможности селективного выделения «орто-пара» изомеризации третичных
ПФ из общей системы превращений ПФ, что служит основой для создания альтернативной технологии получения пара- трет -пентилфенола, являющегося структурным аналогом технически важного пара- трет -бутилфенола.
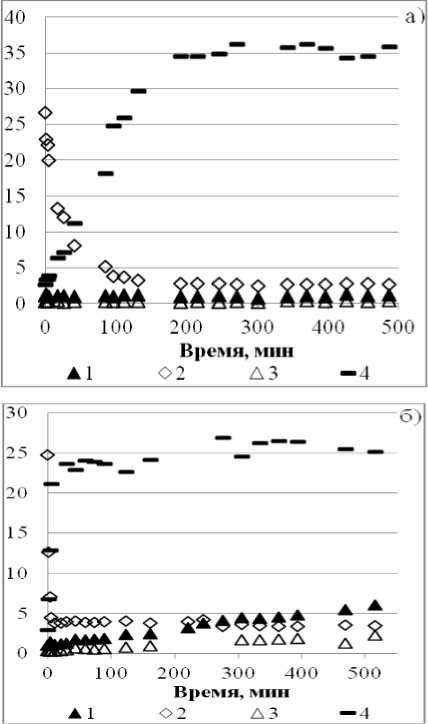
Рис. 4. Разветвленные пентилфенолы:
а) при кипении этилбензола: 1 – о -(1,2-диметил пропил) фенол (% масс.); 2 – о -(1,1-диметилпропилфенол (% масс.); 3 – п -(1,2-диметилпропил)фенол (% масс.); 4 – [ п -(1,1-диметилпропил)фенол] / [ о -(1,1-диметилпропил) фенол] (% масс./% масс.); б) при кипении на декана: 1 – о -(1,2-диметилпропил)фенол (% масс.); 2 – о -(1,1-диметил пропил)фенол (% масс.); 3 – п -(1,2-диметилпро-пил)фенол (% масс.); 4 – [ п -(1,1-диметилпропил) фе-нол] / [ о -(1,1-диметилпропил)фенол] (% масс./% масс.).
Список литературы Равновесие жидкофазной структурной и позиционной изомеризации разветвленных пентилфенолов
- Веревкин, С.П. Исследование зависимости термодинамических свойств третичных алкилфенолов от их строения: дисс. канд. хим. наук: 02.00.04. -Куйбышев, 1984. 316 с.
- Campbell, C.B. Cation-Exchange Resin (Amberlyst-15) Catalyzed Alkylation of Phenol with Unhydrogenated PA0 Decene Trimer. Rearrangement of tert-Alkylphenols to sec-Alkylphenols/Curt B. Campbell, Anatoli Onopchenko//Ind. Eng. Chem. Res. 1992. Vol. 31. P. 2278-2281.
- Пимерзин, А.А. Зависимость термодинамических свойств вторичных алкилбензолов и алкилфенолов от их строения: Дисс. канд. хим. наук. -Куйбышев, 1986. 217 с.
- NIST Chemistry WebBook [электронный ресурс]. http://webbook.nist.gov.
- Лебедев, А.Т. Масс-спектрометрия в органической химии. -М.: Бином, Лаборатория знаний, 2003. 493 с.
- Ремпель, Р.Д. Разработка научных основ интенсификации производства пара-трет-бутилфенола: Дисс. канд. хим. наук. -Новокуйбышевск, 1986. 250 с.
- Пильщиков, В.А. Исследование равновесных превращений в системе фенол-алкилфенолы: дис. канд. хим. наук. -Куйбышев, 1981. 171 с.


