Равновесные параметры газовых смесей H2-H2O-CO-CO2-CH4 в отсутствии и присутствии углерода
Автор: Чернуха Александр Сергеевич, Кузнецов Юрий Серафимович, Качурина Ольга Ивановна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.16, 2016 года.
Бесплатный доступ
Внедоменное бескоксовое прямое получения железа (процесс «Мидрекс») осуществляется при 1000…1100 °C с использованием природного газа. Процессы конверсии основного компонента природного газа - метана: CH4 = C + 2H2, CH4 + CO2 = 2H2 + 2CO, CH4 + H2O = CO + 3H2 приводят к получению восстановительного газа и сажистого углерода при определенном соотношении молярных долей CO и CO2. Термодинамическая возможность протекания процессов восстановления оксида металла в сложной газовой смеси определяется соотношением кислородных потенциалов оксида и газовой атмосферы: (πo = RT ln pO2)оксид > (πo = RT ln pO2)газ. смесь. Кислородный потенциал газовой смеси количественно оценивается величиной равновесного давления кислорода, а кислородный потенциал оксида упругостью его диссоциации. Присутствие в рассматриваемой газовой фазе очень малого количества кислорода определяется реакциями диссоциации CO2 и H2O: lg[pO2, атм] = 2 lg(xH2O / xH2) - 25708 / T + 5,653; lg[pO2, атм] = 2 lg(xCO2 / xCO) - 29529 / T + 9,149. В работе определен кислородный потенциал газовых смесей H2-H2O-CO-CO2-CH4 в зависимости от их состава в интервале температур 800…1500 К. Полученные результаты позволяют оценить влияние присутствия метана на восстановительные свойства газовых смесей по отношению не только к оксидам железа.
Водяной газ, кислородный потенциал, метан, восстановление оксидов
Короткий адрес: https://sciup.org/147157062
IDR: 147157062 | УДК: 544.342-13 | DOI: 10.14529/met160401
Текст научной статьи Равновесные параметры газовых смесей H2-H2O-CO-CO2-CH4 в отсутствии и присутствии углерода
В науке и технике важную роль играют различные диаграммы, позволяющие наглядно и компактно представить информацию по параметрам состояния различных систем и понять смысл и тенденции возможных процессов. Особое место диаграммам фазовых равновесий отводится при анализе металлургических процессов, а в ряде случаев они являются базой теоретических, лабораторных и промышленных исследований. Возможные параметры равновесного водяного газа H2–H2O–CO–CO2 давно и достаточно точно определены. Некоторые особенности в графической интерпретации параметров равновесного водяного газа и характеристик взаимодействия его с углеродом опубликованы в работах [1–4]. Однако в этих работах авторы придерживались общепринятого пред- положения – не учитывали возможность образования метана по реакциям:
2H 2 + 2CO = CH 4 + CO 2 ,
C + 2H 2 = CH 4 .
В силу повышенного интереса к твёрдофазному восстановлению металлов следует определить целесообразность учёта присутствия в газовой фазе метана.
Гомогенное равновесие
«водяной газ – метан»
Такая однофазная трехкомпонентная система (пять веществ минус две независимые реакции) при заданной температуре и постоянном давлении имеет по правилу фаз Гиббса две степени свободы. Для определения параметров газовой смеси H2–H2O–CO–CO2–CH4 необходимо рассчитать совместное равнове- сие двух независимых реакций (здесь и да- лее справочные величины ArGТ определяются в Дж):
H 2 + CO 2 = H 2 O + CO,
A rG°T (I) = 36 580 - 33,465 Т ; (I)
2H 2 + 2CO = CH 4 + CO 2 ,
A rG°T (II) = - 262 365 + 287,23 Т . (II)
Для этого решается система трех уравнений с четырьмя неизвестными:
x H 2 O x CO
KI = xH2 xCO2
K
II =
x CH 4 x CO 2
222 x H 2 x CO P
xh2 + x h2o + xco + xco2 + xch4 = 1 . (3) Важная особенность равновесной газовой смеси – при любой температуре возможно множество концентраций компонентов смеси, удовлетворяющих константам равновесия KI и KII [2–4]. По этой причине невозможно представлять графически составы равновесного водяного газа. Однако можно получить газо- вую смесь нужного состава, если задать ка- кой-либо исходный технологический пара- метр. Например, нагреванием смеси H2 и CO2
исходного состава
x H 2
I x CO 2 Асх
a 0 при кон- d 0
центрациях x CO = x Н2О = 0 [3] (или нагреванием смеси H 2 O и CO известного состава при исходных концентрациях x Н2 = x co2 = 0).
Рассмотрим решение системы уравнений (1)–(3) для случая нагревания смеси ( a 0 моль H 2 + d 0 моль CO 2 ) при P = 1 атм. При этом целесообразно оценить количества всех компонентов получающейся смеси:
|
H 2 |
+ CO 2 = |
H 2 O |
+ |
CO |
|
a 0 |
d 0 |
– |
– |
|
|
( a 0 – x – y ) |
( d 0 – x + y/ 2) |
x |
( x – y ) |
|
|
2H 2 |
+ 2CO = |
CH 4 |
+ |
CO 2 |
|
a 0 |
– |
– |
d 0 |
|
|
( a 0 – x – y ) |
( x – y ) |
y/ 2 |
( d 0 |
– x + y/ 2) |
Здесь в первой строке после уравнений реакций показаны количества веществ в начальном состоянии, во второй строке – в равновесном состоянии: x и y – расходы H2 и CO2 по реакциям (I) и (II), x – получено H2O и CO, y – расход CO, y/2 – получено CH4 и CO2. При нагревании исходной смеси (H2 + CO2) общее количество газов изменяется и в состоянии равновесия оно составляет
∑ = a 0 + d 0 – y . (4)
Вместо весьма сложного решения в общем виде системы уравнений (1)–(3) возможно такое численное решение. Из константы равновесия реакции (I) и условия нормировки с учетом принятых обозначений:
A = y, B = a0 -1, C = d0 -1, xxx
D = B - C + — , E = 2 BC - —
2 KI получаем уравнение для соотношения между величинами A = y/x и x
A = D ± VD2 + E .(5)
Из множества возможных сочетаний вычисленных величин y и заданных x следует найти такое, которое удовлетворяет константе равновесия реакции (II). Равновесные концентрации компонентов газовой смеси определяются соотношениями:
a x h2 = —
—
- x - y _ x _ x - y
2 , x h2o = ^ , x CO = ^ ,
_ d0 -x -0,5y _ 0,5y xCO2 = у , x CH4 = у
На рис. 1–3 показаны результаты вычисления концентраций H2 и CO в равновесных смесях H2–H2O–CO–CO2–CH4 в сравнении с равновесными параметрами водяного газа H2–H2O–CO–CO2, получающегося при нагревании тех же исходных смесей (H2 + CO2) без учета реакции образования метана (II). На рис. 4 показано влияние состава исходной смеси на суммарные концентрации газов-восстановителей и газов-окислителей.
Обнаруживается ожидаемый эффект – в интервале температур 1000…1500 К молярная доля метана не превышает ~ 10–3…10–7, лишь при температурах ниже ~ 950 К имеет смысл учитывать образование метана. Например, при нагревании исходной смеси (H2, a 0 моль – CO 2 , b 0 моль) до 800 К молярная доля метана при изменении соотношения a 0 / b 0 от 0 до 9 определяется кривой с максимумом 0,1669 при a 0 / b 0 = ~ 4, рис. 4). Это объясняется малой величиной константы равновесия реакции (II) при высоких температурах: 5,03·10–2 при 1000 К и 1,36·10–6 при 1500 К, тогда как при 800 К она равна 134,1 атм–2. Этим же объясняется практически незначимое при температурах выше ~ 950 К влияние метана
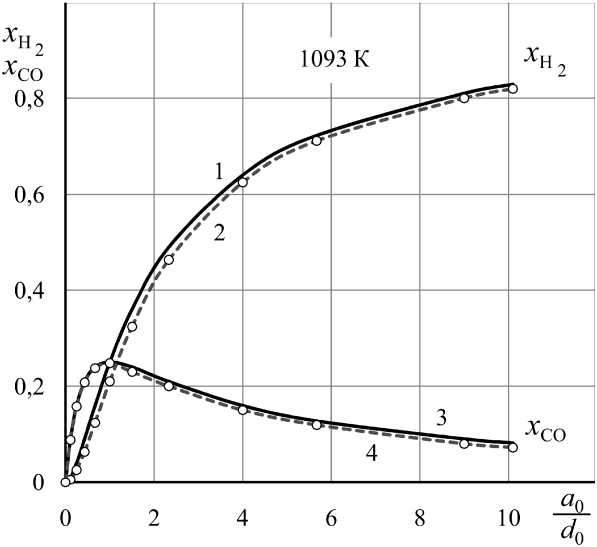
Рис. 1. Концентрации газов-восстановителей в газовых смесях, получающихся при нагревании (H 2 , a 0 – CO 2 , b 0 моль) до 1093 К: 1, 3 – водяной газ H 2 –H 2 O–CO–CO 2 [3]; 2, 4 – смесь H 2 –H 2 O–CO–CO 2 –CH 4
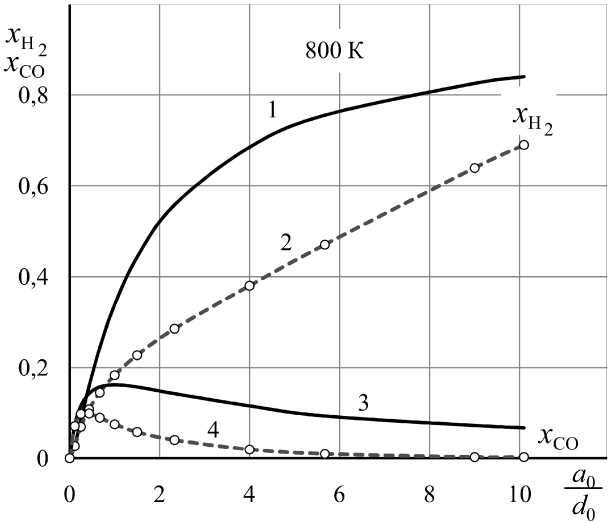
Рис. 2. Концентрации газов-восстановителей в газовых смесях, получающихся при нагревании (H 2 , a 0 – CO 2 , b 0 моль) до 800 К: 1, 3 – водяной газ H 2 –H 2 O–CO–CO 2 [3]; 2, 4 – смесь H 2 –H 2 O–CO–CO 2 –CH 4
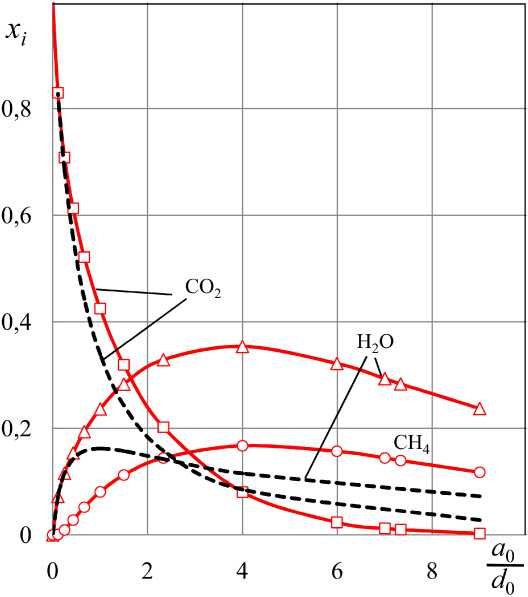
Рис. 3. Концентрации H 2 O, CO 2 и CH 4 в газовых смесях, получающихся при нагревании (H 2 , a 0 – CO 2 , b 0 моль) до 800 К: штриховые линии – водяной газ H 2 –H 2 O–CO–CO 2 [3]; сплошные – смесь
H 2 –H 2 O–CO–CO 2 –CH 4
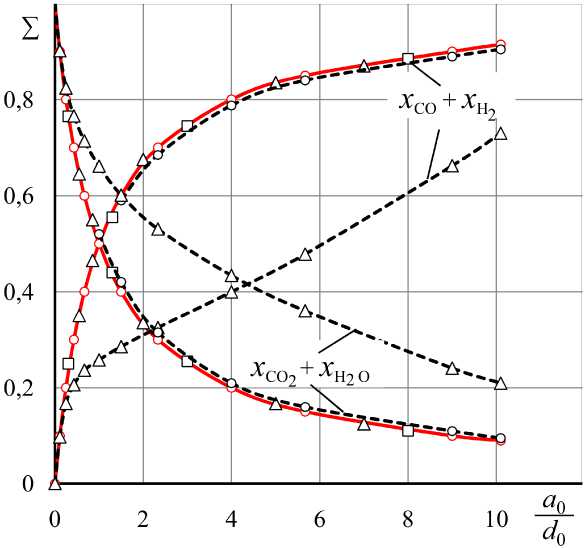
Рис. 4. Суммы концентраций восстановителей и окислителей: сплошные линии – водяной газ при любых температурах; штриховые – H 2 –H 2 O–CO–CO 2 –CH 4 при Т > 950 К; штриховые линии с точками (∆) при Т = 800 К
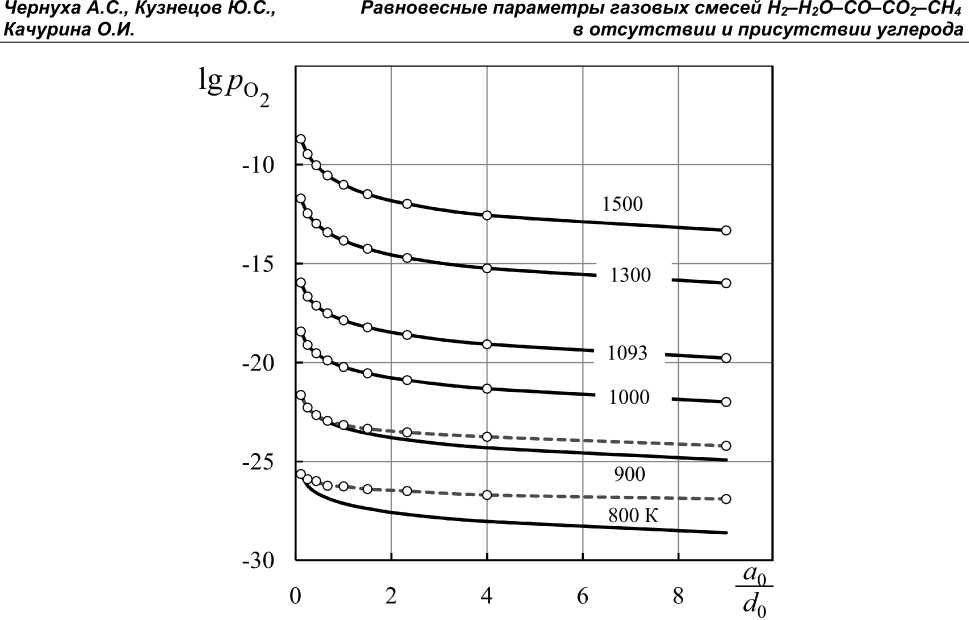
Рис. 5. Кислородный потенциал газовых смесей, получающихся при нагревании исходной смеси (H 2 , a 0 – CO 2 , b 0 моль): сплошные линии – водяной газ H 2 –H 2 O–CO–CO 2 [3]; точки и штриховые линии – смесь H 2 –H 2 O–CO–CO 2 –CH 4
на восстановительные свойства газовой смеси H 2 –H 2 O–CO–CO 2 –CH 4 , которые количественно оцениваются кислородным потенциалом n o = RT In p O2, или величиной 1g( p O2, атм).
Расчетные формулы для логарифма равновесного давления кислорода [3, 4]:
2H 2 O = 2H 2 + O2, A rG°T = 492 230 - 108,24 T ;
2CO 2 = 2CO + O2, A r G T = 565 390 - 175,17 T .
На рис. 5 результаты вычислений lg( pO , атм) показаны в сравнении с равно- весными параметрами водяного газа H2–H2O– CO–CO2, получающегося при нагревании тех же исходных смесей (H2 + CO2) без учета реакции образования метана [3]. Лишь при температурах ниже ~ 950 К равновесное давле- ние кислорода смесей H2–H2O–CO–CO2–CH4 отличается от равновесного давления кислорода водяного газа, вычисленного без учета образования метана. Восстановление Fe3O4 до FeO, например, при 1000 К начинается, если lg( pO , атм) ≤ –19,84, при 1500 К, если lg( pO , атм) ≤ –8,72. Восстановление FeO до Fe при 1000 К начинается, если lg( pO , атм) ≤ ≤ –20,72, при 1500 К, если lg( pO , атм) ≤ ≤ –11,63. В существующих технологиях восстановление железа из железорудной составляющей шихты осуществляется при температурах выше 1000 К, поэтому для упрощения расчетов параметров таких процессов можно не учитывать образование метана.
Гетерогенное равновесие
«водяной газ – метан – углерод»
В присутствии углерода в качестве самостоятельной фазы метан получается не только по реакции (II), но и в результате взаимодействия водорода с углеродом. Определение параметров равновесия смеси (H 2 –H 2 O–CO– CO 2 –CH 4 –C) связано c учетом совместного равновесия пяти реакций:
H 2 + CO 2 = H 2 O + CO,
Д rGT (I) = 36 580 - 33,465 T;(I)
2H 2 + 2CO = CH 4 + CO 2 ,
Д rGT (II) = -262 365 + 287,23 T;(II)
C + CO 2 = 2CO,
Д rGT (III) = 172140 - 177,7T;(III)
C + H 2 O = CO + H 2 ,
Д rGT (IV) = 135 560 -144,235 T;(IV)
C + 2H 2 = CH 4 ,
Д rGT (V) = -90 225 +109,53 T.(V)
Для расчетов следует взять три независимые реакции, например (I), (IV) и (V). Рассматриваемая двухфазная трехкомпонентная (шесть веществ минус три независимые реакции) система при заданной температуре и давлении 1 атм имеет по правилу фаз Гиббса одну сте- пень свободы. Поэтому из системы четырех уравнений:
x H 2 O x CO x H 2 x CO
KI = , KIV = xH2 xCO2
Kv = ^CIH^, ZXi = 1(6)
x H2
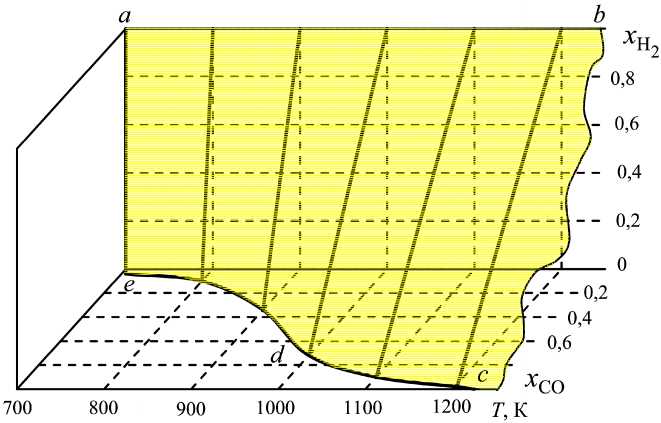
концентрации всех компонентов газовой смеси можно определить, задавая концентрацию одного из пяти компонентов. В работе [2] не учитывалась возможность образования метана, а результаты расчетов иллюстрировались трехмерной диаграммой и изотермическими сечениями этой диаграммы, показывающими соотношения концентраций H 2 и CO, рис. 6, a и 7. В этом случае соотношения между x H от x СО можно аппроксимировать прямыми линиями,
а)
700 800 900 1000 1100 1200 ^ к
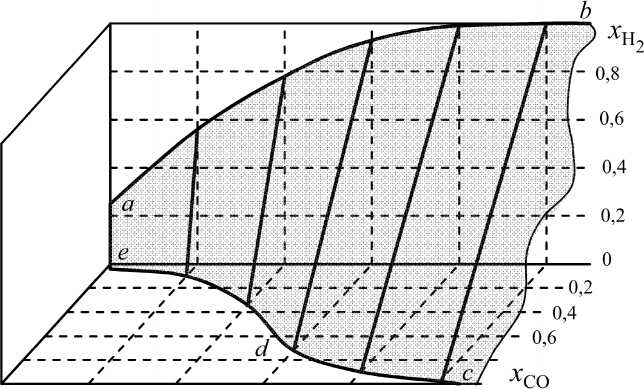
Рис. 6. Влияние учета реакций образования метана на соотношение между концентрациями H 2 и CO: a – системы H 2 –H 2 O–CO–CO 2 –C [2]; б – системы H 2 –H 2 O–CO–CO 2 –CH 4 –C
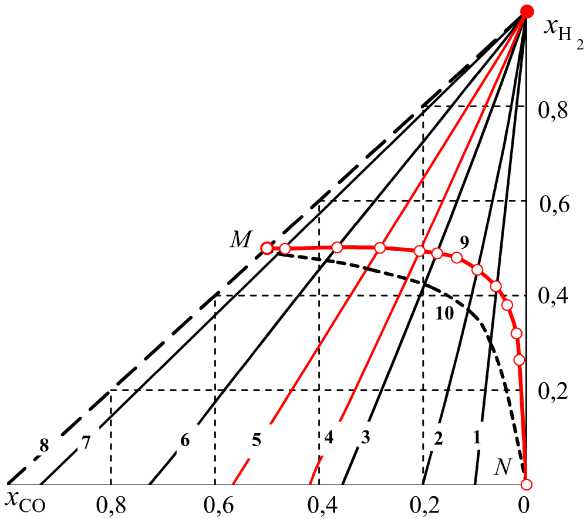
Рис. 7. Концентрации Н 2 и СО в системах Н 2 –Н 2 О–СО–СО 2 –С [2]: линия 1 – определяет все возможные состояния при 800, 2 – 850, 3 – 900, 4 – 917, 5 – 955, 6 – 1000, 7 – 1100, 8 – выше 1300 К; линия 9 – определяет состояния систем при нагревании (Н 2 О–С) [2], линия 10 – определяет состояния систем при нагревании (Н 2 О–С) с учетом образования метана
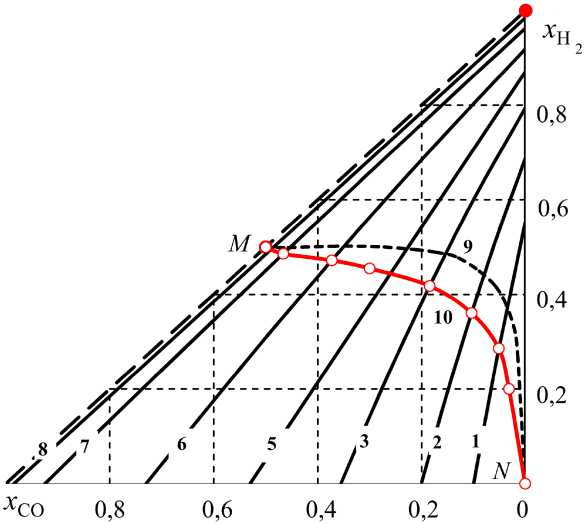
Рис. 8. Концентрации Н2 и СО в системах Н2–Н2О–СО–СО2–СН4–С: линия 1 определяет все возможные состояния при 800, 2 – 850, 3 – 900, 5 – 950, 6 – 1000, 7 – 1100, 8 –1200 К и выше; линия 9 – состояния систем без метана при нагревании (Н2О–С) [2], линия 10 – состояния систем при нагревании (Н2О–С) с учетом метана соединяющими точку с координатами xH = 1 и xСО = 0 с точками, координаты которых оп-
ределяются параметрами равновесия системы CO–CO 2 –C. При решении системы уравнений (6) для сравнения с результатами работы [2]
выведено уравнение для соотношения между
x H и x СО при заданной температуре с учетом
образования метана:
x H 2
- 0,5
' K IV + X CO "
V K IV K V 7
+
+. 0,25
K IV + X CO ^ + 1 X CO v K iv K v 7
—
( x C 2 O K III )
K V
. (7)
Результаты расчетов показаны криволинейной поверхностью abcde на рис. 6, б и прямыми линиями 1–8 изотермических сечений этой поверхности на рис. 8. Координаты точек пересечения изотерм с осью x H ( x CO = 0) определяют концентрацию водорода в системе H 2 –CH 4 –C. При температурах T ≥ 1000 К поверхности abcde и изотермические линии на рис. 6–8 не отличаются. Однако при температурах ниже 1000 К положения изотерм различаются и становятся существенными различия при температурах ниже ~ 950 К. Это обстоя-
тельство еще раз подтверждает допустимость не учитывать образование метана при температурах выше ~ 950 К.
В практических технологиях процессы восстановления оксидов металлов чаще всего осуществляются в многокомпонентных газовых смесях нужного состава в присутствии углерода. Получать газовые атмосферы строго контролируемого состава в присутствии углерода можно различными способами. Наибольший интерес представляет возможность создания атмосферы водяного газа нагреванием паров воды в контакте с углеродом. В частности, в работах [5, 6] анализируются особенности восстановления оксидов с использованием углерода и паров воды. В предлагаемых «колпаковых» устройствах [7, 8] организуется постоянная подпитка системы парами воды. В таких открытых системах имеет место обмен с окружающей средой газом, и это исключает возможность установления равновесия. Однако информация о предельно возможных (равновесных) параметрах закрытых систем позволяет судить о влиянии различных факторов на протекание и неравновесных процессов. В работе [2] приведены результаты термодинамического расчета параметров водяного газа, получающегося при нагрева-
Параметры газовой фазы, получающейся при нагревании 1 моля паров воды в контакте с избытком углерода, P = 1 атм
|
T , К |
800 |
850 |
900 |
1000 |
1093 |
1200 |
|
x H 2 |
0,2858 |
0,3603 |
0,4179 |
0,4719 |
0,4859 |
0,4933 |
|
x H 2 О |
0,3040 |
0,2347 |
0,1662 |
0,0620 |
0,0199 |
0,0057 |
|
x СО |
0,0512 |
0,1041 |
0,1845 |
0,3730 |
0,4660 |
0,4932 |
|
x СО 2 |
0,2381 |
0,2144 |
0,1740 |
0,0713 |
0,0191 |
0,0040 |
|
x СH 4 |
0,1208 |
0,0864 |
0,0572 |
0,0218 |
0,0092 |
0,0040 |
|
E n |
1,203 |
1,3025 |
1,4314 |
1,7314 |
1,9078 |
1,9733 |
|
A n h2o |
0,6343 |
0,6943 |
0,7621 |
0,8927 |
0,9620 |
0,9888 |
|
A n C(CH 4 ) |
0,1453 |
0,1126 |
0,0819 |
0,0378 |
0,0175 |
0,0077 |
|
A n C(CO) |
0,0616 |
0,1356 |
0,2641 |
0,6458 |
0,8890 |
0,9732 |
|
A n C(CO 2 ) |
0,2864 |
0,2793 |
0,2491 |
0,1234 |
0,0364 |
0,0078 |
|
EA n C |
0,4933 |
0,5275 |
0,5951 |
0,8070 |
0,9429 |
0,9877 |
|
lg( p O 2 , атм) |
–26,42 |
–25,45 |
–23,71 |
–21,82 |
–20,64 |
–19,65 |
|
lg( p O 2 , атм) без метана* |
– |
–25,04 |
–23,76 |
–21,84 |
–20,64 |
–19,65 |
Примечание. * Вычислено без учета реакций образования метана [2].
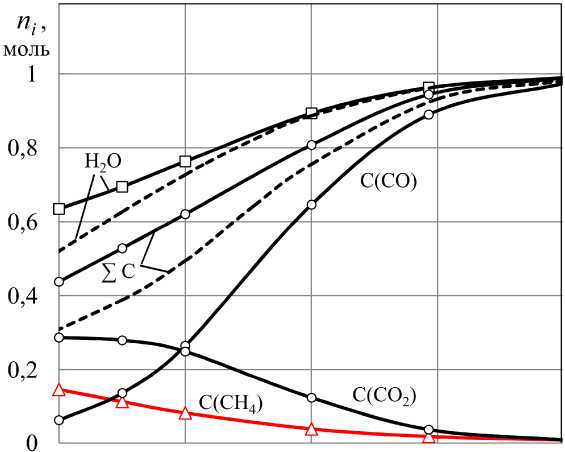
Рис. 9. Расход паров воды и углерода при нагревании смеси (Н 2 О, 1 смоль – С): сплошные линии – с учетом образования метана, штриховые – без метана; C(CH 4 ), C(CO 2 ), C(CO) – расход углерода на образование CH 4 , CO 2 и CO; ∑C – суммарный расход углерода;
Н 2 О – расход воды
нии до разных температур исходной системы C–H 2 O без учета образования метана. Эти параметры представлены политермической линией 9 на рис. 7 и 8. Результаты аналогичных расчетов с учетом двух реакций образования метана приведены в таблице и показаны на рис. 7 и 8 политермической линией 10. Из сравнения положений линий 9 и 10 следует, что образование метана незначительно снижает концентрацию водорода и приводит к увеличению концентрации монооксида СО. Однако, важнейшая технологическая характеристика lg( p O , атм) газовой смеси, получающейся при нагревании паров воды в контакте с углеродом, существенно не изменяется с учетом реакций образования метана, рис. 5.
На рис. 9 представлены результаты расчетов расхода паров воды и углерода при нагревании исходной системы (Н2О, 1 смоль – С). При нагревании до 800 К в равновесной газовой смеси Н2–Н2О–СО–СО2–СН4 xH = 0,2858, xCO = 0,0512 (см. рис. 7), lg( pO , атм) = –26,42. Расход паров воды составляет около 63 %, а углерода – лишь 42 % от максимально возможного расхода. При этом около трети общего количества израсходованного углерода переходит в газовую фазу с образованием метана, около двух третей – с образованием СО. При нагревании до 1200 К расходы паров воды и углерода достигают максимально возможных величин – по 1 молю. При этом весь углерод переходит в газовую фазу только с образованием СО, все пары воды восстанавливаются до водорода. Получающаяся газовая фаза представляет собой эквимолярную смесь Н2–СО со следами Н2О, СО2 и СН4 с высоким восстановительным потенциалом lg( pO , атм) = –19,65.
Выводы
При температурах ниже ~ 950 К в водяном газе в отсутствии углерода в качестве самостоятельной фазы возможно образование метана, что незначительно снижает восстановительную способность газовой фазы. При температурах выше 950 К при количественной оценке параметров водяного газа можно не учитывать возможность образования метана. При нагревании до температур выше ~ 1200 К паров воды в контакте с избытком углерода получается смесь только Н 2 и СО с равными концентрациями компонентов.
Список литературы Равновесные параметры газовых смесей H2-H2O-CO-CO2-CH4 в отсутствии и присутствии углерода
- Строкина, И.В. Изменения окислительно-восстановительных свойств газовой фазы системы C-O2-H2/И.В. Строкина, Н.Ф. Якушевич//Изв. вузов. Черная металлургия. -2011. -№ 6. -С. 3-5.
- Кузнецов, Ю.С. Системный анализ процессов восстановления оксидов железа в атмосфере водяного газа в присутствии углерода // Ю.С. Кузнецов, Г.Г. Михайлов, О.И. Качурина // Металлы. ИМЕТ РАН. - 2014. - № 2. - С. 10-15.
- Reduction of Iron Oxides in a Humid Atmosphere/G.P. Vyatkin, G.G. Mikhailov, Yu.S. Kuznetsov et al.//Steel in Translation. -2012. -Vol. 42, no. 2. -P. 103-106 DOI: 10.3103/S0967091212020301
- Кузнецов, Ю.С. Окислительно-восстановительный потенциал газовых фаз // Ю.С. Кузнецов, О.И. Качурина // Современные проблемы электрометаллургии стали: материалы XVI Междунар. науч. конф. / под ред. В.Е. Рощина. - Челябинск: Издат. центр ЮУрГУ, 2015. - Ч. 1. - С. 75-82.
- Дигонский, С.В. Роль водорода в восстановлении оксидов металлов твердым углеродом/С.В. Дигонский, В.В. Тен//Альтернативная энергетика и экология. -2009. -№ 11 (79). -С. 45-55.
- Дигонский, С.В. Карботермическое восстановление оксидного сырья в неравновесных химических системах/С.В. Дигонский//Технология металлов. -2008. -№ 8. -С. 3-7.
- Пат. 2111271 С1 Российская Федерация. Способ получения металлов из их сульфидов/С.В. Дигонский, Н.А. Дубинин, Е.Д. Кравцов. -Заявл. 22.10.96, опубл. 20.05.98.
- Пат. 2033431 С1 Российская Федерация. Способ получения металлов/В.В. Дигонский, С.В. Дигонский, В.Е. Горбовский. -Заявл. 02.04.91, опубл. 20.04.95.


