Разделение хлоридов алюминия и железа методом высаливания
Автор: Валеев Дмитрий Вадимович, Лайнер Юрий Абрамович, Вомпе Татьяна Сергеевна, Пак Вячеслав Игоревич
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Современные наукоемкие инновационные технологии
Статья в выпуске: 4-3 т.16, 2014 года.
Бесплатный доступ
Представлены результаты исследования по разделению хлоридов алюминия и железа после растворения бемит-каолинитовых бокситов в соляной кислоте. Изучены условия, влияющие на содержание основных примесей в гексагидрате хлорида алюминия. Исследованы различные подходы по отмывке полученных кристаллов от маточного раствора. Полученные результаты позволяют получить гексагидрат хлорида алюминия, необходимый для дальнейшего термогидролиза в рамках солянокислотной технологии получения металлургического глинозема.
Хлорид алюминия, хлорид железа, соляная кислота, высаливание
Короткий адрес: https://sciup.org/148203238
IDR: 148203238 | УДК: 66.065.31
Текст научной статьи Разделение хлоридов алюминия и железа методом высаливания
В Российской Федерации практически отсутствуют высококачественные бокситы – основное сырьё для производства глинозема, однако в значительном количестве представлены другие виды сырья: низкосортные бокситы, нефелины, каолиновые глины, золы от сжигания углей [1]. Эти месторождения, находящиеся в основном в районах Сибири и Северо-Западных регионах РФ, не используются из-за отсутствия комплексной рациональной технологии их переработки. Для таких видов сырья перспективными становятся кислотные способы, которые позволяют уже в начале технологического процесса (передел выщелачивания руды) отделить оксид кремния от раствора и, таким образом, существенно облегчить процесс дальнейшего получение металлургического глинозема [2]. Использование соляной кислоты имеет ряд преимуществ по сравнению с другими минеральными кислотами [3]:
-
• относительная простота разложения руды с переводом оксида алюминия в раствор;
-
• низкая растворимость кремнезема в HCl и возможность полного отделения твердого остатка (сиштофа) без существенных потерь кислоты;
-
• возможность селективной кристаллизации AlCl 3 ·6H 2 O;
-
• промышленно освоенная технология улавливания HCl с получением соляной кислоты для повторного использования в процессе растворения сырья.
Одним из важных переделов солянокислотной технологии является процесс высаливания гексагидрата хлорида алюминия.
Цель работы: выделение AlCl 3 ^6H 2 O из солянокислых растворов с минимальным количеством примесей.
Методика эксперимента. Для исследования использовали растворы объёмом 100 мл, полученные после растворения бемит- каолинитовых бокситов Североонежского месторождения (Архангельская область) раствором 20% HCl. Растворение при непрерывном перемешивании в круглодонной колбе при Т=1100C проходило в течение 3 часов. Были получены растворы следующего состава, г/л: Al – 11,5; Fe – 5,5; Cr – 0,55. Высаливание проводили газообразным хлороводородом (HCl), полученным путём реакции NaCl с серной кислотой концентрацией 94% по реакции:
т
H 2 SO 4 + 2NaCl = 2HCl + Na 2 SO 4 (1)
Полученные пары HCl направлялись в дрексель с солянокислым раствором после выщелачивания, где происходил барботаж хлороводорода во всем объёме раствора. В качестве носителя был использован нейтральный газ аргон. Также был установлен ещё один дрексель с раствором NaOH для нейтрализации паров HCl. Схема лабораторной установки показана на рис. 1. Выделенные из солянокислого раствора кристаллы отделяли от раствора на воронке Шотта, в качестве фильтровальной ткани использовали стойкий в соляной кислоте – полипропилен. В качестве промывной жидкости использовали соляную кислоту концентрацией 20-35% и ацетон. После промывки полученные кристаллы анализировали на содержание примесей: Fe, Cr на фотометре КФК-3 и атомно-эмиссионном спектрометре с индуктивно-связанной плазмой Optima-4300 DV.
Изучение формы и размеров кристаллов гексагидрата хлорида алюминия проводили с помощью оптического металлографического микроскопа ММР-1 (БИОМЕД, Россия), оснащенного цифровой камерой-окуляром Levenchuk C510NG. Обработку полученных изображений, а также измерение фракционного состава проводили в программе ToupView.
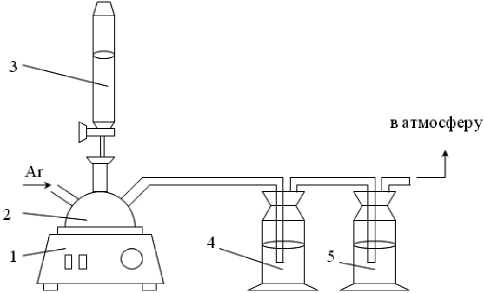
Рис. 1. Схема лабораторной установки по высаливанию хлорида алюминия:
-
1 – колбонагреватель; 2 – круглодонная колба с NaCl; 3 – сосуд с H2SO4; 4 – дрексель с солянокислым раствором;
-
5 – дрексель с NaOH
Результаты и их обсуждение. Процесс селективного осаждения (высаливания) гексагидрата хлорида алюминия основан на разной степени растворимости соединений в соляной кислоте. С повышением концентрации HCl растворимость хлоридов алюминия и хрома понижается, а растворимость хлорида железа повышается (рис. 2-4) [4-5].
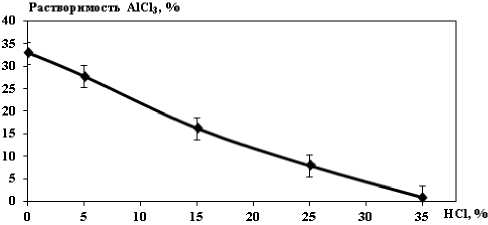
Рис. 2. Растворимость хлорида алюминия в HCl при 250C
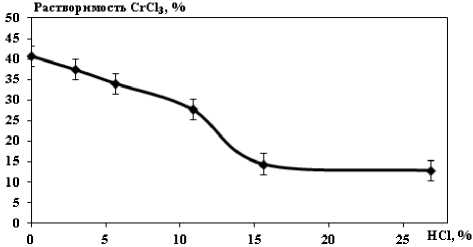
Рис. 3. Растворимость хлорида хрома в HCl при 250C
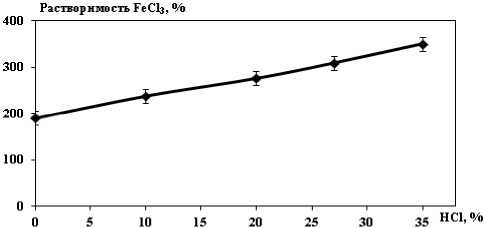
Рис. 4. Растворимость хлорида железа в HCl при 250C
В связи с тем, что растворимость AlCl 3 минимальна при 00C (табл. 1), исследования по высаливанию проводили при охлаждении солянокислого раствора до этой температуры. Охлаждение осуществлялось за счет нахождения дрекселя в кристаллизаторе с охлаждающей смесью (лед и хлорид натрия в соотношении 1:1 по объёму).
Таблица 1. Зависимость растворимости AlCl 3 от температуры
|
Температура, 0C |
0 |
20 |
40 |
60 |
80 |
100 |
|
растворимость AlCl 3 , г/100 мл H 2 O |
43,9 |
45,8 |
47,3 |
48,1 |
48,6 |
49,0 |
В первые 15 минут процесса высаливания происходило насыщение раствора парами HCl, далее появлялись первые кристаллы и через 30 минут после начала эксперимента наблюдался лавинообразный рост образования кристаллов во всем объёме раствора. По прошествии часа образование кристаллов замедлялось и практически останавливалось. Полученные кристаллы имели следующий химический состав, %: AlCl3·6H2O – 99,8; Cr – 0,095; Fe – 0,025. Примесь Cr окрашивал AlCl3·6H2O в зеленый цвет. Для снижения содержания примесей были проведены дополнительные исследования по выбору температурного режима, который оказывает существенное влияние на повышение растворимости хлоридов хрома и железа (табл. 2) [4]. Эксперименты проводили при температурах 40 и 800C. Нагрев происходил путём помещения дрекселя в водяную баню с заданной температурой. Химический состав полученных кристаллов представлен в табл. 3. При нагреве раствора до 400C цвет полученных кристаллов бледно-зеленый, при 800C остаточное содержание примесей не окрашивает AlCl3·6H2O, соответственно, цвет кристаллов – белый. Таким образом, нагрев рабочего раствора до 800C позволяет снизить содержание хрома в 3,5, железа в 1,9 раза.
Таблица 2. Зависимость растворимости FeCl 3 и CrCl 3 от температуры
|
Температура, 0C |
0 |
20 |
35 |
60 |
80 |
100 |
|
растворимость FeCl 3 , г/100 мл H 2 O % |
74,4 |
96,9 |
282 |
373 |
526 |
536 |
|
растворимость CrCl 3 , г/100 мл H 2 O % |
- |
40,7 |
- |
- |
54,26 |
- |
Таблица 3 Химический состав кристаллов, полученных в процессе высаливания с подогревом солянокислого раствора
|
Температура, ˚C |
Компонент, % |
||
|
AlCl 3 · 6H 2 O |
Fe |
Cr |
|
|
40 |
99,81 |
0,018 |
0,056 |
|
80 |
99,83 |
0,013 |
0,027 |
Важным моментом наших исследований процесса высаливания является промывка полученных кристаллов от остатков солянокислого раствора. Показана [6] возможность промывки кристаллов соляной кислотой различной концентрации (20-35%). Были проведены аналогичные исследования при промывке гексагидрата хлорида алюминия 20%, 25%, 30%, 35,5% HCl. Во всех опытах мы наблюдали частичное растворение полученных кристаллов. Потери влаги после просушки при 1100C составили 25%. Для уменьшения влажности и предотвращения обратного растворения кристаллов были проведены испытания с применением органического реагента – ацетона. Обратное растворение хлорида алюминия при промывке не наблюдалось. Потери после просушки при 1100C были в пределах 3,5-4,5%.
В работе были проведены исследования формы и размеров кристаллов гексагидрата хлорида алюминия. Полученные данные (рис. 5) свидетельствуют, что кристаллы имеют ярко выраженную гексагональную форму. Размеры кристаллов находятся в интервале 100-200 мкм, однако, присутствуют кристаллы размером до 700 мкм (рис. 5 (а)).

Рис. 5. Микрофотографии гексагидрата хлорида алюминия. х100)
Выводы: исследован процесс высаливания гексагидрата хлорида алюминия из растворов после выщелачивания бемит-каолинитовых бокситов соляной кислотой. Показано, что повышение температуры процесса до 800C понижает количество основных примесей (Fe, Cr) в гексагидрате хлорида алюминия. Предложена промывка получившихся кристаллов ацетоном для предотвращения обратного растворения хлорида алюминия и уменьшения влажности кристаллогидрата.
Список литературы Разделение хлоридов алюминия и железа методом высаливания
- Лайнер, Ю.А. Производство глинозема. «Металлургия цветных металлов»//Итоги науки и техники ВИНИТИ АН СССР. 1986. Т. 16. С. 3-63.
- Панов, А.В. Состояние и перспективы развития кислотных способов получения глинозема/А.В. Панов, А.С. Сенюта, А.Г. Сусс, Ю.А. Лайнер//Сб. научн. статей «Цветные металлы-2012». -Красноярск: Версо, 2012. С. 272-277.
- Сусс, А.Г. Особенности поведения различных Al-Si минералов при соляно-кислотном вскрытии небокситового сырья Сибири/А.Г. Сусс, А.А. Дамаскин, А.С. Сенюта и др.//Сб. научн. статей. 31-я Межд. конф. ICSOBA. -Красноярск: Версо, 2013. С. 433-438.
- Запольский, А.К. Коагулянты и флокулянты в процессе очистки воды: Свойства. Получение. Применение//А.К. Запольский, А.А. Баран. -Л.: Химия. 1987. 208 с.
- Фурман, А.А. Неорганические хлориды (химия и технология). -М.: Химия. 1980. 416 с.
- Maysilles, J.H.//BuMines RI 8590, 1982, 38 p.


