Разделения катионов тяжелых металлов из концентрированных гальванических стоков
Автор: Бондарева Л.П., Чесноков А.И., Загорулько Е.А.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 1 (75), 2018 года.
Бесплатный доступ
При нанесении гальванических покрытий применяются растворимые в воде соли тяжелых металлов: железа, меди, никеля, цинка, кадмия, хрома и других металлов. Токсичные катионы попадают в сточную воду с возможностью последующей миграции их в биосферу. К настоящему времени разработаны многочисленные способы очистки гальванических стоков, которые нельзя считать достаточно эффективными. В работе исследована совместная сорбция двухвалентных катионов меди, никеля и кадмия из концентрированных водных растворов. Расчетным и экспериментальным методами подобраны условия разделения различающихся и близких по сорбционным свойствам бинарных ионных систем на аминофосфоновом полиамфолите Purolite S950 в натриевой форме. Показано, что выделение катионов кадмия (II) из растворов, содержащих катионы меди (II) или никеля (II) можно провести уже при высоте сорбирующего слоя 0,13 м благодаря различию определяющих характеристик катионов. Такая высота слоя может быть использована не только в хроматографической колонке, но и в концентрирующем патроне. Разделение близких по сорбционным свойствам меди (II) и никеля (II) требует высоты поглощающего слоя 0,76 м, что может быть использовано только в хроматографической колонке, но не применимо для концентрирующего патрона. В работе рассчитаны степени разделения ионов в различных сорбционных условиях. Показана применимость кондуктометрического метода для контроля ионообменного процесса не только при выделении свободных катионов из водных растворов, но и связанных в комплексы.
Катионы меди, никеля, кадмия, ионный обмен, комплексные соединения, разделение
Короткий адрес: https://sciup.org/140229963
IDR: 140229963 | DOI: 10.20914/2310-1202-2018-1-223-227
Текст научной статьи Разделения катионов тяжелых металлов из концентрированных гальванических стоков
Технологический процесс на предприятиях цветной металлургии требует большого водо-потребления. Качественная очистка сточных вод решает несколько задач, во-первых, защищает окружающую среду, во-вторых, снижает расход воды за счет ее повторного использования в системах оборотного водоснабжения. Кроме того, в результате выделения из сточных вод
в производство могут быть возвращены целевые компоненты, теряемые со сточными водами, что повышает рентабельность технологического цикла [1].
В ходе нанесения гальванических покрытий применяются хорошо растворимые в воде соли тяжелых металлов: железа, меди, никеля, цинка, кадмия, хрома и других металлов. При промывке готовых изделий токсичные катионы попадают в воду, а затем могут попасть For citation
в канализационные стоки, с последующей миграцией их в биосферу. К настоящему времени разработаны многочисленные способы очистки гальванических стоков от ионов металлов [2-6].
Большую часть примесей удается удалить методами реагентной очистки восстановителями, известью или электрокоагуляцией. Данные методы получили широкое распространение несмотря на два существенных недостатка. Во-первых, применяемые для восстановления сульфиты обладают не только восстанавливающими, но и комплексообразующими свойствами. Взаимодействуя с катионами металлов, они образуют комплексы, не способные выпадать в осадок с осадителем (известью). Металлы, «замаскированные» в комплексы, проходят все системы очистки, поступают в окружающую среду и легко проникают в клетки растений, начиная свою разрушительную для биосферы работу. Во-вторых, для создания соответствующего окислительно-восстановительного потенциала необходимо вводить в реакцию восстановитель в большом избытке, и чем ниже концентрация гальваностока, тем больше избыток. Кроме того, в присутствие осадителя – гидроксида кальция вода становится жесткой и не может применяться в водообороте. После осаждения получаются большие объемы токсичного и экономически не интересного гальванического шлама.
Несмотря на то, что на отраслевом рынке имеется большое количество технологий, не требующих использования комплексообра-зователя (в качестве комплексообразователей выступают сульфиты, бисульфиты, тиосульфаты, соединения аммония), они не нашли широкого применения на промышленных предприятиях из-за необходимости контролировать состав раствора на участках минимальной плотности тока, а также поддерживать строго определенную температуру. Процент потерь металлов при этом составляет 10–15%.
Целью настоящей работы стало исследование совместной сорбции двухвалентных катионов меди, никеля и кадмия из концентрированных водных растворов и определение эффективных условий их разделения на аминофосфоновом полиамфолите.
Материалы и методы
Изучение условий очистки сложных растворов проводили на макропористом аминофосфоновом полиамфолите Purolite S950, предназначенном для удаления катионов токсичных металлов, таких как свинец, медь и цинк из промышленных стоков при низких температурах. При правильно подобранных условиях возможно разделение катионов меди, кальция и магния, а также токсичных кадмия и никеля.
Аминофосфоновый полиамфолит Purolite S950 более селективен (в соответствующих условиях) как к ионам тяжелых металлов, так и обычным двухвалентным ионам по сравнению с иминодиуксусным ионообменником Purolite S930, который поглощает катионы тяжелых металлов, но не селективен к двухвалентным ионам кальция и магния.
Для перевода смолы в рабочую Na+- форму осуществляли ее специальную подготовку, для этого пропускали через слой ионообменника последовательно раствор NаОН с концентрацией 0,5 моль/дм3 и дистиллированную воду до полного удаления гидроксида натрия из межгранульного пространства.
Определение возможности разделения катионов металлов проводили на колонке, заполненной полиамфолитом Purolite S950 в натриевой форме. С различной скоростью пропускали водные растворы бинарных смесей катионов (Сu2+– Ni2+, Сu2+– Сd2+, Ni2+– Сd2+) с различным соотношением концентраций в интервале от 10-2 до 10-4 моль/дм3.
Проведение ионного обмена контролировали потенциометрическим и кондуктометрическим методами.
Концентрацию ионов меди (II) в растворе определяли потенциометрическим методом, с помощью медь-селективного электрода «Элит 227». Измерение разности потенциалов производили на рН-метре 150-М. Концентрацию никеля и кадмия в смеси с медью определяли методом комплексонометрического титрования.
Для определения возможности выделения катионов металлов (Сu2+, Ni2+, Сd2+), связанных с ионами аммония, и контроля полноты извлечения катионов использовали кондуктометрический метод с применением универсального кондуктометра III 8733(N).
Обсуждение результатов
Разделение катионов металлов происходит вследствие различия термодинамических и кинетических характеристик ионного обмена. Константы устойчивости ионитных комплексов аминфосфонового полиамфолита с медью(II) составляет рKу ~ 9,6, никелем (II) – рKу ~ 8,9 и кадмием(II) – рKу ~ 5,2; коэффициенты диффузии в фазе ионообменника катионов меди (II) равны 2,3×10-13 м2/с, никеля (II) – 2,5×10-13 м2/с и кадмия(II) – 4,7×10-13 м2/с [7]. Сравнение характеристик показывает, что катионы Cu (II) и Ni (II) имеют достаточно близкие сорбционные свойства, в то время как свойства Cd (II) сильно отличаются. Следует ожидать, что отделение катионов кадмия (II) от катионов меди (II) и никеля (II) должно происходить достаточно легко.
В работе получены выходные кривые сорбции катионов на полиамфолите Purolite S950 в натриевой форме (рисунок 1) . Установлено, что при высоте ионообменного слоя 0,13 м наблюдается практически полное разделение хроматографических пиков. Благодаря различию сорбционных свойств разделение Cu (II) и Cd (II), Ni (II) и Cd (II) происходит и при уменьшении высоты ионообменного слоя до 0,03 м. Такая высота слоя может быть использована в сорбционном патроне не только для количественного определения, но и для идентификации данных ионов при их совместном присутствии.
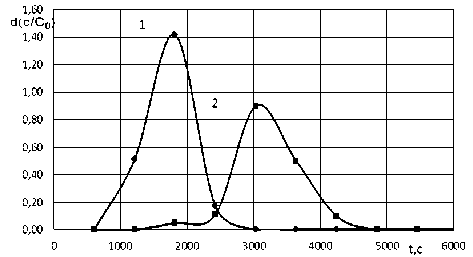
Рисунок 1. Дифференциальные выходные кривые сорбции ионов Сd2+ (1) и Сu2+ (2) на Purolite S950 (Na+) при с 0 = 0,1 моль/дм3, L = 1,25×10-7 м3/с и z = 0,13 м
Figure1. Differential output curves for the sorption of Сd2+ (1) and Сu2+ (2) ions on Purolite S950 (Na+) at с 0 = 0,1 mol/dm3, L = 1,25×10-7 m3/s and z = 0,13 m.
Более сложная задача состоит в установлении условий разделений близких по свойствам ионов меди (II) и никеля (II). Разделение осуществляли путем подбора оптимальных условий сорбции, в частности, высоты слоя сорбента, массы загрузки, скорости пропускания раствора через колонну.
Для этого использовали, описанную и примененную в работе [8] математическую модель расчета выходных кривых ионного обмена. Расчет основан на использование асимптотического уравнения динамики сорбции, предложенного Томасом [9], и дополнительно моделью капиллярного течения для расчета переноса ионов в фазе водного раствора к поверхности ионообменника [10]. При расчете выходных кривых сделано допущение об аддитивности ионного обмена катионов меди (II) и никеля (II) на полиамфолите Purolite S950 (Na+).
Выходные кривые рассчитанные при массе загрузки 41 г., высоте сорбционного слоя 0,56 м, концентрации катионов в растворе по 0,1 моль/дм3 и скорости подачи очищаемого раствора 1,25×10-7 м3/с приведены на рисунке 2. Установлено, что степень разделения катионов в данных условиях не превышает 0,2, что соответствует значительному перекрыванию хроматографических пиков.
Рисунок 2. Расчетные выходные кривые сорбции ионов Ni2+ (1) и Сu2+ (2) на Purolite S950 (Na+) при с 0 = 0,1 моль/дм3, L = 1,25×10-7 м3/с и z = 0,56 м
-
Figure 2. Calculated output curves for the sorption of Ni2+ ions (1) and Сu2+ (2) on Purolite S950 (Na+) at с 0 = 0,1 mol/dm3, L = 1,25×10-7 m3/s and z = 0,56 m.
Полученные экспериментально выходные кривые ионного обмена меди и никеля на полиамфолите Purolite S950 (Na+) в условиях, соответствующих рассчитанным, приведены на рисунке 3.
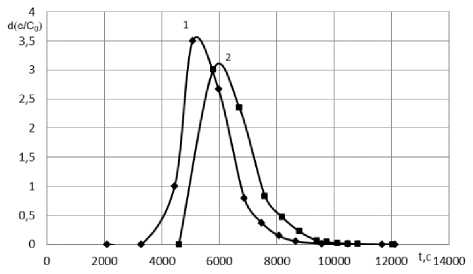
Рисунок 3. Экспериментальные дифференциальные выходные кривые сорбции ионов Ni2+ (1) и Сu2+ (2) на Purolite S950 (Na+) при с 0 =0,1 моль/дм3, L =1,25×10-7 м3/с и z =0,56 м
-
Figure 3. Experimental differential output curves for the sorption of Ni2+(1) and Сu2+(2) ions on Purolite S950 (Na+) at с 0 =0,1 mol/dm3, L =1,25×10-7 m3/s and z =0,56 m
Критерием оценки разделения выходных высоту сорбционного слоя ионита в колонке, кривых является степень разделения (Rs), можно добиться разделения, поскольку возрастает рассчитываемая по уравнению: время контакта раствора с ионообменником
Rs = 2(t R2 – t R1 ) / (ω 1 + ω 2 ), (1)
и влияние различия коэффициентов диффузии на степень разделения.
где tR1, tR2 – время удержания катионов,ω1, ω2 – Экспериментально получены выходные ширина хроматографических пиков. кривые ионного обмена меди (II) и никеля (II)
Предельное значение Rs, которое позволяет при их совместном присутствии в водном получить на хроматограмме два раздельных растворе на сорбционном слое различной максимума, составляет 0,42. высоты (рисунок 4). Предварительно установ-
Степень разделения меди (II) и никеля (II) лено, что уменьшение скорости пропускания на полиамфолите Purolite S950 (Na+), опреде- очищаемого раствора не приводит к увеличению ленная экспериментально при z = 0,56 м, степени разделения, а лишь увеличивает ширину составляет Rs 0,056 = 0,17. Однако, увеличивая хроматографических пиков.
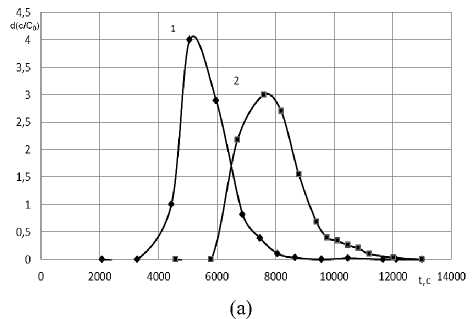
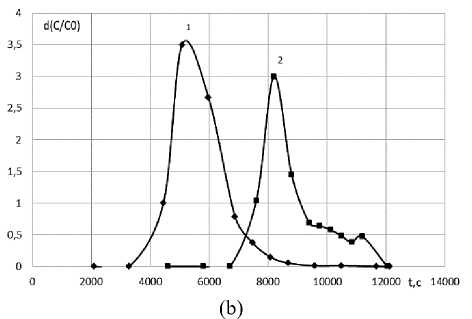
Рисунок 4. Дифференциальные выходные кривые сорбции ионов Ni2+ (1) и Сu2+ (2) на Purolite S950 (Na+) при с 0 = 0,1 моль/дм3, L = 1,25 ×10-7 м3/с z = 0,66 м (a) и z = 0,76 м (b)
Figure 4. Differential output curves for the sorption of Ni2+ ions (1) and Сu2+ (2) on Purolite S950 (Na+) at с0 = 0,1 mol/dm3, L = 1,25 ×10-7 m3/s, z = 0,66 m (a) and z = 0,76 m (b)
Технохимический контроль ионообменной сорбции в динамических условиях осуществлялся одновременно несколькими методами: количественным определением концентрации целевого компонента, электрической проводимости и рН внешнего раствора. Зависимость рН = f(с) характеризуется изменением идентичным скачку титрования, но при этом нельзя однозначно судить об окончании сорбции. О завершении процесса выделения целевого компонента можно судить по изменению электрической проводимости внешнего раствора. Зависимость æ = f(с) имеет вид параболы с минимумом в точке соответствующей полному извлечению целевого компонента.
При увеличении высоты колонки на 0,1 м степень разделения ( Rs ) возрастает в 2 раза и становится равной Rs 0,66 =0,35, при увеличении высоты сорбционного слоя на 0,2 м – Rs 0,76 =0,43. Данная степень разделения позволяет считать, что разделение меди (II) и никеля (II) на полиамфолите Purolite S950 (Na+) проведено полностью. Однако, высота сорбирующего слоя большая, что не позволяет проводить идентификацию ионов в концентрирующем патроне.
Заключение
В работе расчетным и экспериментальным методами подобраны условия разделения различающихся и близких по сорбционным свойствам бинарных ионных систем на аминофосфоновом полиамфолите Purolite S950 в натриевой форме. Показано, что выделение катионов кадмия (II) из растворов, содержащих катионы меди (II) или никеля (II) можно провести уже при высоте сорбирующего слоя 0,13 м благодаря различию определяющих характеристик катионов. Такая высота слоя может быть использована не только в хроматографической колонке, но и в концентрирующем патроне. Разделение близких по сорбционным свойствам меди (II) и никеля (II) требует высоты поглощающего слоя 0,76 м, что может быть использовано только в хроматографической колонке, но не применимо для концентрирующего патрона. В работе рассчитаны степени разделения ионов в различных сорбционных условиях. Показана применимость кондуктометрического метода для контроля ионообменного процесса не только при выделении свободных катионов из водных растворов, но и связанных в комплексы.
Список литературы Разделения катионов тяжелых металлов из концентрированных гальванических стоков
- Виноградов С.С. Экологически безопасное гальваническое производство. М.: Глобус., 2002. С. 135 -148.
- Вансовская К.М. Гальванические покрытия. Л.: Машиностроение, 1984. 148 с.
- Fu F., Wang Q. Removal of heavy metal ions from wastewaters: a review//Journal of environmental management. 2011. V. 92. №. 3. С. 407-418.
- Gunatilake S. K. Methods of removing heavy metals from industrial wastewater//Methods. 2015. V. 1. №. 1.
- Fu, F., Wang, Q. Removal of heavy metal ions from wastewaters: a review//Journal of environmental management. 2011. № 92(3). Р. 407-418.
- Li C. et al. A novel conversion process for waste residue: Synthesis of zeolite from electrolytic manganese residue and its application to the removal of heavy metals//Colloids and Surfaces A: Physicochemical and Engineering Aspects. 2015. V. 470. P. 258-267.
- Салдадзе К.М., Копылова-Валова В.Д. Комплексообразующие иониты (комплекситы). М. Химия, 1980. 336 с.
- Корниенко Т.С., Загорулько Е.А., Бондарева Л.П., и др. Математическая модель динамики сорбции в слое ионообменника//Сорбционные и хроматографические процессы. 2011. Т. 11. № 6. С. 895-899
- Thomas H. Heterogeneous ion exchange in a flowing system.//J. Am. Chem. Soc. 1964. V. 66. № 10. P. 1664-1666.
- Кишиневский М.Х., Корниенко Т.С., Лейкин М.А. Массообмен в неподвижном зернистом слое при малых числах Рейнольдса.//Жур. прикл. химии. -1986. Т. LIX. № 10. С. 2167-2169.


