Различия эффектов импульсно-периодического рентгеновского излучения в опухолевых клетках линии MOLT-4 и лимфоцитах периферической крови человека
Автор: Васильев С.А., Беленко А.А., Кутенков О.П., Большаков М.А., Лебедев И.Н., Ростов В.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (56), 2013 года.
Бесплатный доступ
Разработаны источники, способные генерировать импульсно-периодическое рентгеновское излучение (ИПРИ) в наносекундном диапазоне с возможностью изменения частоты повторения импульсов и дозы за импульс. Целью настоящего исследования стал анализ воздействия ИПРИ на уровень двунитевых разрывов ДНК в опухолевых и нормальных клетках человека в условиях in vitro. Для оценки уровня двунитевых разрывов ДНК и эффективности их репарации использовался метод анализа флуоресцентных фокусов белков репарации ДНК γH2AX и 53BP1 в клетках опухолевой линии MOLT-4, имеющей лимфобластное происхождение, после воздействия ИПРИ в условиях in vitro. Наибольший уровень фокусов γH2AX и 53BP1 через 18 ч после воздействия, являющийся маркером эффективности репарации ДНК, в клетках линии MOLT-4 отмечался при воздействии ИПРИ с частотой повторения импульсов 8 имп./с, при которой ранее в лимфоцитах наблюдалось наименьшее количество двунитевых разрывов ДНК. Полученные результаты указывают, что использование ИПРИ с различными частотами повторения импульсов может позволить дифференцированно воздействовать на опухолевые клетки, незначительно повреждая при этом нормальные клетки человека.
Импульсно-периодическое рентгеновское излучение, малые дозы, гиперрадиочувствительность, фокусы γh2ax и 53bp1, двунитевые разрывы днк
Короткий адрес: https://sciup.org/14056317
IDR: 14056317 | УДК: 577.2.043:539.1
Текст научной статьи Различия эффектов импульсно-периодического рентгеновского излучения в опухолевых клетках линии MOLT-4 и лимфоцитах периферической крови человека
Эффекты малых доз и малых мощностей доз ственных и искусственных источников радиации, ионизирующего излучения представляют интерес так и благодаря потенциальной возможности их как с точки зрения потенциальной опасности есте- использования в клинике [2, 8]. В мировой лите- ратуре во многих случаях, вследствие недостатка данных, касающихся повреждающего влияния собственно малых доз ионизирующего излучения, предполагаемые эффекты малых доз получаются путем экстраполяции результатов, установленных в экспериментах с воздействием больших доз радиации [6]. Однако результаты многочисленных исследований указывают на существенные различия эффектов, наблюдаемых при воздействии малых и высоких доз радиации на биологические объекты. В частности, имеются данные об изменении профилей экспрессии генов и белков [7], а также посттрансляционной модификации белков [12, 13]. Таким образом, выявление механизмов возникновения повреждений ДНК в клетках при воздействии радиации в малых дозах даст возможность модулировать радиочувствительность клеток в этом диапазоне доз, открывая широкий простор для создания новых методов низкодозовой противоопухолевой лучевой терапии.
Дополнительные потенциальные возможности открываются при использовании импульсного характера подведения дозы ионизирующего излучения. Так, применительно к воздействию импульсно-периодического рентгеновского излучения (ИПРИ) в малых дозах с частотами повторения импульсов в диапазоне 8–22 имп./с показано эффективное ингибирование пролиферативной активности клеток и изменение уровня синтеза ДНК и РНК в опухолевых клетках мастоцитомы Р-815 и карциномы Эрлиха [4]. Кроме того, интересным аспектом является генотоксическое воздействие ИПРИ на клетки человека. Наиболее чувствительной методикой, позволяющей оценить уровень генотоксических эффектов в клетках на основе анализа уровня двунитевых разрывов ДНК, является иммунофлуоресцентная детекция фокусов белков γH2AX и 53BP1 [5]. Они представляют собой комплексы из сотен молекул белков, образующиеся в клетке вокруг двунитевых разрывов ДНК и участвующие в репарации ДНК и активации контрольных точек клеточного цикла. Ранее при проведении анализа уровня фокусов белков γH2AX и 53BP1 отмечалась гиперрадиочувствительность лимфоцитов периферической крови человека при воздействии ИПРИ в суммарных дозах от 12 до 32 мГр и так называемая индуцированная радиорезистентность при воздействии ИПРИ в дозе 72 мГр [3]. Учитывая значительные отличия эффектов ра- диации в нормальных и опухолевых клетках человека и потенциальную возможность использования источников ИПРИ в низкодозовой лучевой терапии опухолей, было изучено влияние ИПРИ в диапазоне малых доз на уровень двунитевых разрывов ДНК в опухолевых клетках линии MOLT-4. В качестве сравнения использовались данные из проведенного ранее исследования влияния ИПРИ на лимфоциты периферической крови [3].
Материал и методы
Для характеристики влияния ИПРИ на опухолевые клетки были использованы клетки линии MOLT-4 [9]. Будучи полученными из Т-клеточной опухоли, клетки линии MOLT-4 обладают многими характеристиками, сходными с лимфоцитами периферической крови, что облегчает сравнение результатов.
Клетки выращивались в суспензионной культуре в среде RPMI 1640 с добавлением 10 % эмбриональной бычьей сыворотки (FBS, Sigma) до концентрации 2×106 клеток/мл, после чего производился пересев клеток в свежую среду. Таким образом, клетки постоянно поддерживались в экспоненциальной фазе роста. Для проведения эксперимента клетки концентрировались до 3×106 кле-ток/мл в среде RPMI 1640 с добавлением 10% FBS, разделялись по 3 мл в пластиковые центрифужные пробирки (Greiner) и транспортировались во льду для облучения.
В качестве источника ИПРИ использовалось тормозное излучение электронов сильноточного электронного пучка на аноде ускорителя Sinus 150 (ускоряющее напряжение 260 кВ, сила тока 4 кА, длительность импульса 4 нс). Во время облучения пробирки с культурой клеток размещались на определённом расстоянии от анода ускорителя, что обеспечивало требуемую дозу. Измерения доз производились на различных расстояниях от коллектора (3–70 см) вдоль оси системы с использованием термолюминесцентного дозиметра КДТ-02М (Россия) и электростатического дозиметра с кварцевым волокном серии «Arrow-Tech» модель 138-S (США) [1]. Клетки подвергались воздействию 4000 импульсов ИПРИ с частотами повторения импульсов 8, 13 и 25 имп./с с дозами 0,003; 0,008; 0,018; 0,04 и 0,08 мГр/имп.
После облучения клетки транспортировали во льду и инкубировали в термостате при 37°С для оценки динамики фокусов через 30 мин, 2 ч и 18 ч
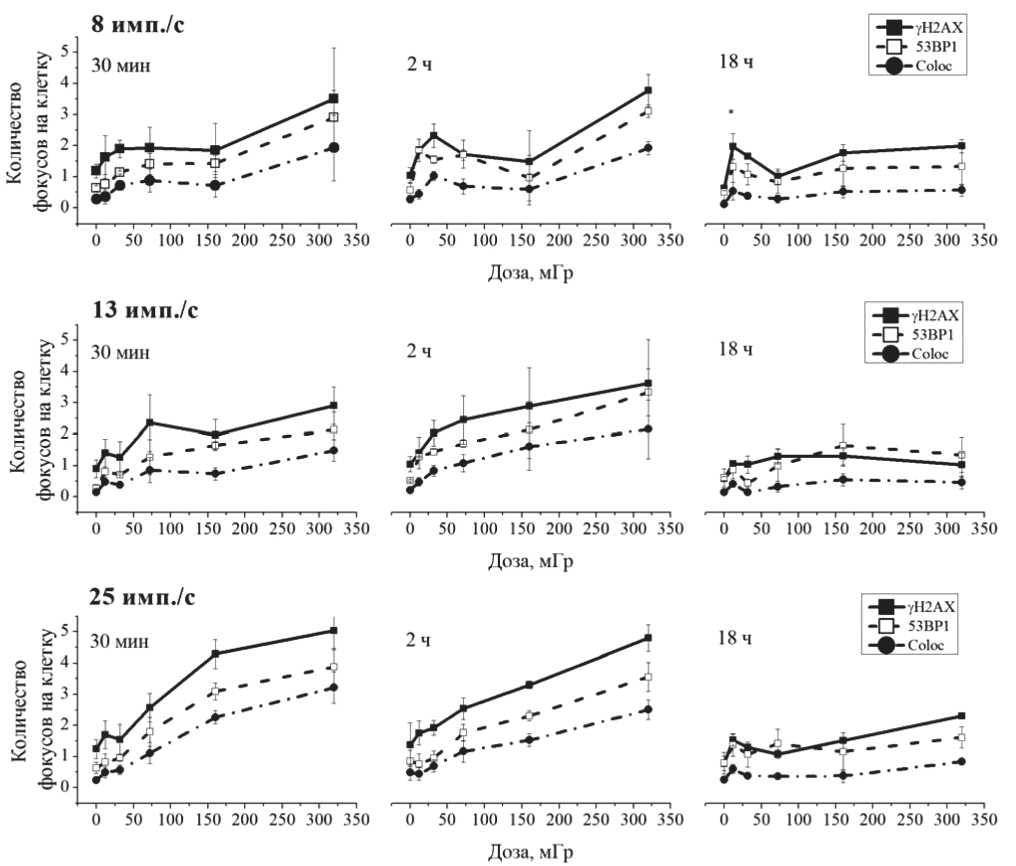
Рис. 1. Дозовая зависимость уровня фокусов γH2AX, 53BP1 и колокализованных фокусов обоих белков через 30 мин, 2 ч и 18 ч в клетках опухолевой линии MOLT-4 после воздействия ИПРИ в условиях in vitro. Данные представлены в виде средних арифметических значений со стандартным отклонением
репарации ДНК с помощью иммунофлуоресценции. Протокол фиксации клеток, приготовления препаратов и иммунофлуоресцентной оценки аналогичен использованному ранее на лимфоцитах периферической крови человека [3]. Были использованы следующие первичные антитела: моноклональные мышиные антитела к белку γH2AX (Novus) и поликлональные антитела кролика к белку 53BP1 (Novus). Вторичными антителами, несущими флуорохромы, были мышиные антитела к иммуноглобулинам кролика (Novus), конъюгированные с флуоресцеин изотиоционатом (FITC), и кроличьи антитела к иммуноглобулинам мыши (Novus), конъюгированные с родамином.
Статистический анализ дозовой и временной зависимостей количества фокусов проводился с использованием дисперсионного анализа. В дальнейшем для множественных сравнений количества фокусов использовался критерий Шеффе. Для проведения анализа изменений количества фокусов во времени использовался парный критерий Стьюдента. Все статистические процедуры были проведены с помощью программного обеспечения Statistica 8.0 (Statsoft). Эксперимент был проведен в 3 повторах.
Результаты и обсуждение
В отсутствие воздействия ИПРИ фоновый уровень фокусов белков γH2AX и 53BP1 в опухолевых клетках MOLT-4 был сравним на всех временных точках и составлял от 0,9 до 1,2 и от 0,3 до 0,6 фокусов на клетку, соответственно. Таким образом, количество спонтанных двунитевых разрывов ДНК в опухолевых клетках линии MOLT-4 значимо не превышало соответствующий уровень в лимфоцитах периферической крови человека [3]. Кроме того, обнаруженный уровень двунитевых разрывов ДНК был сравним с полученным в другом исследовании с использованием клеток линии MOLT-4 [10].
Через 30 мин после воздействия ИПРИ отмечалось возрастание количества фокусов γH2AX и 53BP1 в зависимости от дозы (рис. 1). При этом наблюдались статистически значимые различия между количеством радиационно-индуцированных СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 2 (56)
фокусов через 30 мин после воздействия ИПРИ с различными частотами повторения импульсов в дозах 32 мГр (фокусы 53BP1, ANOVA, p<0,01) и 160 мГр (фокусы 53BP1 и колокализованные фокусы γH2AX и 53BP1 ANOVA, p<0,01) (рис. 1). В первом случае наибольшее количество фокусов 53BP1 было обнаружено в клетках после воздействия ИПРИ с частотой повторения импульсов 8 имп./с. Наоборот, при воздействии ИПРИ в дозе 160 мГр больше всего фокусов 53BP1 и колокали-зованных фокусов γH2AX и 53BP1 отмечалось для частоты повторения импульсов 25 имп./с.
Динамика фокусов γH2AX и 53BP1 в опухолевых клетках линии MOLT-4 была сходной с отмечавшейся динамикой в лимфоцитах периферической крови [3]. Уровень фокусов при воздействии большинства комбинаций частот повторения импульсов и доз за импульс ИПРИ значимо не изменялся между 30 мин и 2 ч после облучения (рис. 1). Хотя в некоторых случаях наблюдалось статистически значимое повышение количества фокусов при увеличении времени после воздействия с 30 мин до 2 ч: фокусы 53BP1 при воздействии в дозе 32 мГр при 13 имп./с (парный критерий Стьюдента, p=0,016) и колокализованные фокусы γH2AX и 53BP1 при воздействии в дозе 32 мГр при 8 имп./с (парный критерий Стьюдента, p=0,011). Данный результат подтверждает более высокую биологическую эффективность воздействия ИПРИ в дозе 32 мГр, обнаруженную ранее на лимфоцитах периферической крови [3]. Следует отметить, что в клетках линии MOLT-4 сравнительное возрастание уровня двунитевых разрывов ДНК при воздействии ИПРИ в дозе 32 мГр по сравнению с другими дозами ИПРИ отмечалось к 2 ч после облучения, что указывает на более медленную динамику формирования фокусов вокруг двунитевых разрывов ДНК в клетках MOLT-4, в отличие от лимфоцитов периферической крови, в которых отклонения от линейной дозовой зависимости при ИПРИ в дозе 32 мГр отмечались через 30 мин после облучения [3]. В то же время для обоих типов клеток отмечалось статистически значимое генотоксическое действие ИПРИ при суммарной дозе 12 мГр (p<0,05). При этом в обоих типах клеток фиксировалось наличие бимодальной дозовой зависимости уровня фокусов белков γH2AX и 53BP1, отклоняющейся от линейной.
При проведении анализа динамики фокусов во времени от 30 мин до 18 ч после облучения с помощью парного критерия Стьюдента было обнаружено, что статистически значимое уменьшение уровня фокусов отмечается лишь для ряда комбинаций частот повторения импульсов и доз ИПРИ: колокализованные фокусы при 160 мГр, 13 имп./с (p=0,00007); фокусы γH2AX, 53BP1 и колокализованные фокусы при 320 мГр, 13 имп./с (p=0,012, p=0,0002 и p=0,021, соответственно); фокусы γH2AX и колокализованные фокусы при 160 мГр, 25 имп./с (p=0,046 и p=0,043, соответственно); колокализованные фокусы при 320 мГр, 25 имп./с (p=0,039).
Таким образом, к 18 ч после облучения статистически значимо уменьшается лишь уровень дву-нитевых разрывов ДНК, вызванных воздействием ИПРИ в дозах более 160 мГр. При этом остаточный уровень фокусов после воздействия ИПРИ со всеми использованными параметрами был значимо выше соответствующего контрольного уровня через 18 ч после облучения (p<0,05). Таким образом, учитывая повышенный уровень двунитевых разрывов ДНК при воздействии ИПРИ в дозе менее 160 мГр на фоне отсутствия статистически значимого снижения количества радиационно-индуцированных фокусов γH2AX и 53BP1 к 18 ч, можно констатировать более низкую активность репарации дву-нитевых разрывов ДНК, индуцированных ИПРИ в дозе меньше 160 мГр, по сравнению с эффектами более высоких доз.
Важным показателем является остаточный уровень двунитевых разрывов ДНК через 18 ч после воздействия, являющийся маркером эффективности репарации ДНК. Ранее наибольший уровень фокусов γH2AX и 53BP1 в лимфоцитах периферической крови человека через 18 ч после облучения отмечался при воздействии ИПРИ с частотой повторения импульсов 13 имп./с за счет выраженной гиперчувствительности в диапазоне доз 12–32 мГр [3]. Клетки линии MOLT-4, напротив, оказались более чувствительны к воздействию ИПРИ с частотой повторения импульсов 8 имп./с, при которой в лимфоцитах наблюдалось наименьшее количество двунитевых разрывов ДНК. Обнаруженные различия в чувствительности опухолевых и нормальных клеток, вероятно, обусловлены нарушениями окислительного метаболизма в опухолевых клетках линии MOLT-4, изменяющими параметры гиперчувствительности этих клеток к воздействию радиации в малых дозах относительно нормальных лимфоцитов периферической крови человека. Наличие значимого уровня остаточных нерепарированных двунитевых разрывов ДНК в клетках через 18 ч после воздействия ИПРИ подтверждается литературными данными о повышенной чувствительности клеток линии MOLT-4 к воздействию ионизирующего излучения с низкой мощностью дозы (3,9 мГр/мин) [10, 11].
Полученные результаты о различном характере ответа клеток линии MOLT-4 и лимфоцитов периферической крови человека на воздействие ИПРИ с различными частотами повторения импульсов указывают на то, что возможно подобрать режимы ИПРИ, повреждающие в первую очередь опухолевые клетки и незначительно влияющие на нормальные клетки.
Работа выполнена при поддержке грантов РФФИ 12-04-00893_a, 12–04–32046_мол_а и ФЦП «Научные и научно-педагогические кадры инновационной России на 2009–2013 гг.» № 8596, АВЦП № 22.1/13778.


