Разработка биодатчика мочевины с применением полимерных технологий для анализов крови и мочи
Автор: Фомкина Мария Григорьевна, Ибадуллаева С.Ж.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Работы с конференции
Статья в выпуске: 3 т.28, 2018 года.
Бесплатный доступ
На основе полимерных нанотехнологий созданы ферментные датчики и микрореакторы, способные определять мочевину в жидкостях. Показано, что биосенсор мочевины способен работать в течение длительного времени (до 2 мес.) без значительной потери активности фермента. Полимерная технология изготовления датчиков менее трудоемкая и дорогостоящая по сравнению с другими аналогичными технологиями. Предлагаются к разработке биосенсорные приборы - анализаторы мочевины с полимерными ферментными чипами для экспресс-диагностики биологических жидкостей (кровь, моча).
Ферментные биосенсоры, полимерный наноматериал, портативный анализатор, микрореактор, микрокапсулы, мочевина
Короткий адрес: https://sciup.org/142214869
IDR: 142214869 | УДК: 577.3, | DOI: 10.18358/np-28-3-i3643
Текст научной статьи Разработка биодатчика мочевины с применением полимерных технологий для анализов крови и мочи
Объем проводимых лабораторных исследований во всем мире неуклонно растет и достигает 45 млрд. анализов в год, причем в промышленно развитых странах количество анализов на 1 жителя достигает 40–60 ежегодно. Универсальные биохимические анализаторы производят анализ любых биологических жидкостей (субстраты, ферменты, липиды, лекарственные препараты, гормоны, белки, электролиты, наркотики). Их выпускают около 60 фирм, основными производителями являются фирмы "Эббот" (США), ЭйБиДжей1 (Австрия), "Коне" (Финляндия), "Нова" (США), "Корнинг" (Англия), "Бекман" (США), "Радиометр" (Дания). Большим спросом пользуются готовые наборы реактивов. Рынок их составляет примерно 27 млрд. долларов при мировом рынке лабораторных приборов в 6 млрд. долл.
Для биохимических исследований (определение органических и неорганических химических веществ, таких как ионы калия, натрия, кальция, магния, лития, хлора, субстраты, метаболиты, ферменты биохимических процессов в крови и других биологических жидкостях человека) применяются спектроскопические анализаторы. Перспективными признаны универсальные биохимические анализаторы, с помощью которых производится анализ любых биологических жидкостей на содержание различных компонентов. Однако в настоящее время отсутствуют портативные приборы данного класса.
Разработка портативных приборов для проведения анализов биологических жидкостей является актуальной задачей современной медицинской диагностики. Особый интерес среди портативных анализаторов различных веществ несомненно представляют анализаторы на основе биосенсоров. Любой биосенсор состоит из двух функциональных элементов: биодатчика, содержащего биоселектирующий материал, и физического преобразователя, трансформирующего любой генерируемый сигнал (концентрация ионов, масса, цвет и т. д.) в электрический. В роли биоселектирующего материала выступают все типы биологических структур — ферменты, антитела, рецепторы, нуклеиновые кислоты и даже живые клетки. В биосенсорах применяются самые разные физические преобразователи: амперометрические, кондуктометрические, оптические, люминесцентные, флуоресцентные, акустические, гравитационные и т. д.
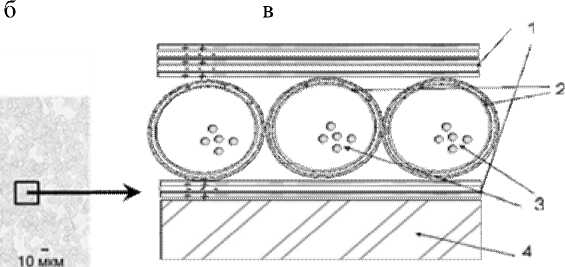
Разработка биосенсоров — крайне трудоемкий процесс. Наиболее важный этап разработки ферментных сенсоров — надлежащая иммобилизация ферментов на твердых носителях (подложках). Нами разработан способ иммобилизации ферментов с применением полимерных технологий, при котором иммобилизованный фермент находится в функционально-активном состоянии [1–3]. Иммобилизация ферментов проводилась в биосенсорном чувствительном покрытии, представляющем собой комбинацию нанометровых полиэлек-тролитных слоев и микрокапсул с ферментом, помещенных между этими слоями (рис. 1).
Как было показано в этих работах, ферменты в микроячейках полимерного материала надежно защищены от агрессивных воздействий среды (микробов, протеаз и т. п.); способны детектировать субстраты длительное время (до 3 недель
а

-
1 - полиэлектролитные слои
-
2 - полиэлектролитные
капсулы
-
3 - молекулы фермента
-
4 - подложка
Рис. 1. Ферментный электрод с чувствительным биосенсорным покрытием.
а — стеклянный рН-электрод с нанесенным чувствительным покрытием, содержащим фермент уреазу; б — изображение полиэлектролитного покрытия с микроячейками в световом микроскопе; в — схематическое изображение чувствительного покрытия с ферментом в условиях хранения при комнатной температуре). В настоящем исследовании продолжены работы по улучшению характеристик разработанного биосенсора мочевины.
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы и оборудование
Для получения ферментных биодатчиков и ферментных микрореакторов использовали лиофилизованную уреазу (EC 3.5.1.5) из бобов кана-валии мечевидной (Canavalia ensiformis) фирм "Sigma" и "Fluka", раствор уреазы из набора "Мочевина КТ(200)" (ЗАО "Диакон-ДС") с активностью 253000 ед./л, мочевину о.с.ч. (Реахим), буферы MES ("Sigma"), Трис-НСl ("Sigma"). Соли CaCl 2 , Na 2 CO 3 , NaCl и KCl имели градацию х.ч или ч.д.а. А также: этиленгликольтетрауксусная (ЭГТА) и этилендиаминтетрауксусная (ЭДТА) кислоты (обе "Sigma-Aldrich", США). Для формирования пленок и оболочек микрокапсул, содержащих ферменты использовали полиэлектролиты: полиэтиленимин (ПЭИ) с мол. массой 600000– 1 000 000, полистиролсульфонат (ПСС), полиалли-ламин гидрохлорид (ПААГ), (все от "Aldrich") с мол. массой 60000–70000. Исследуемые вещества использовали в виде растворов в 0.33 М NaCl. Все растворы солей готовили на деионизованной воде, полученной путем очистки дистиллированной воды с помощью Arium 611-UF ("Sartorius"). Проводимость воды составляла 1 мкСм/см.
В работе были задействованы следующие приборы: спектрофотометр Beсkman UV/Vis DU 520 (США), микроскоп Nikon eclipse E200, 4-канальный потенцио-микроамперометрический аналогоцифровой усилитель "Record-4usb" с подключением к компьютеру (разработка ИБК РАН), pH-метр Beсkman Ф 690 рН/Temp/mV/ISE Meter (CША), микроскоп Axiovert 200, фотометр (модель 680 BIO-RAD, США), Vortex (прибор для встряхивания и перемешивания), ультразвуковая ванна, магнитная мешалка, центрифуга настольная, полуавтоматические микропипетки на 2–20 мкл, 20– 200 мкл, 200–1000 мкл, 5000 мкл, камера Горяева.
Методы исследований
Получение ферментсодержащих кальций карбонатных кόровых частиц
В качестве кόровых микрочастиц для получения полиэлектролитных капсул использовали составные микросферолиты СаСО 3 —белок.
СаСО 3 -микросферолиты получали по реакции ионного обмена при смешивании растворов хлористого кальция и карбоната в присутствии белка (фермента) методом биоминерализации [4–6].
Получение ферментсодержащих полиэлектролитных микрокапсул
Полиэлектролитные микрокапсулы с уреазой получали методом поочередной адсорбции (layer-by-layer) c нанесением молекул полистиролсуль-фоната (ПСС) и полиаллиламин гидрохлорида (ПААГ) на составные кальций-карбонатные сфе- ролиты, содержащие уреазу, как описано в работах [4–6].
Поочередное наслаивание противоположно заряженных макромолекул полиэлектролитов на коллоидные частицы проводили 3–5 раз, получая 3- / 5-слойную оболочку с архитектурой ПА-АГ/(ПСС/ПААГ) n и ПСС/(ПААГ/ПСС) n где n = = 1, 2. Процедура формирования микрокапсул проводилась при комнатной температуре (15– 25°С). Контроль размеров микрокапсул и сферичность кальций-карбонатных частиц осуществляли с помощью светового микроскопа Nikon eclipse E200. Удаление кальций-карбонатных частиц из микрокапсул осуществляли при выдерживании раствора с микрокапсулами в диализных мешках в течение от 3 до 12–15 ч в 25 мМ ЭГТА или ЭД-ТА при температуре 4 оС или 20 оС при подщелачивании среды (рН 7.2–7.5). Количество капсул в растворе подсчитывали с помощью камеры Горяева.
Потенциометрический способ определения концентрации мочевины с помощью стандартного рН-электрода
По методике, описанной в работах [1, 2], получали потенциометрический полимерный биодатчик мочевины на основе модифицированного стеклянного рН-электрода (рис. 1, а). Измерения концентрации ионов водорода в исследуемом растворе проводили с помощью четырехканального АЦП "Рекорд 4usb". Раствор перемешивали магнитной мешалкой и поддерживали температуру 25 ± 1оС с помощью термостата U-1 (Германия). Затем в нее добавляли препарат фермента в необходимых количествах или вводили модифицированный рН-электрод. Регистрируемый (в мВ) щелочной сдвиг рН выходил на насыщение в течение 20–30 с.
Статистическая обработка результатов
Каждая экспериментальная точка получена 3–7 повторами. Pезультаты пpедcтавлены на pиcункаx в виде cpедниx значений ± cтандаpтное отклонение. Статистическая обработка результатов проводилась с помощью программы OriginPro 8.6. Для оценки статистической достоверности использовали метод ANOVA с вероятностью P > > 0.95.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Впервые возможность измерения концентрации мочевины модифицированным стеклянным рН-электродом, на который наносилось ультратонкое чувствительное полимерное покрытие с уреазой, была показана нами в работах [1, 2]. Следующие свойства полимерного покрытия обеспечили эту возможность: хорошая проницаемость полиэлек-тролитных мультислоев для субстрата (мочевины) и продуктов его разложения уреазой; непроницаемость этих слоев для фермента; сохранение ферментом, находящимся в ячейках покрытия, высокой активности достаточно длительное время; а также существенным защелачиванием среды при разложении мочевины на углекислый газ и аммиак. Улучшение характеристик и свойств полимерного чувствительного покрытия датчика мочевины связано с повышением начальной активности иммобилизованного фермента, увеличением длительности работы сенсора и возможностью измерения мочевины в биологических жидкостях. Как было показано в работе [7], нам удалось добиться достаточно высокой активности иммобилизованного фермента, которая составила 40–50 % активности свободного свежеприготовленного фермента.
В настоящей работе представлены данные по продолжению исследований, связанных с повышением начальной активности уреазного сенсора. На рис. 2 представлены данные исследований зависимости отклика стеклянного рН-электрода от концентрации мочевины в измерительной ячейке для свободного (линия 1) и инкапсулированного (линия 2) фермента.
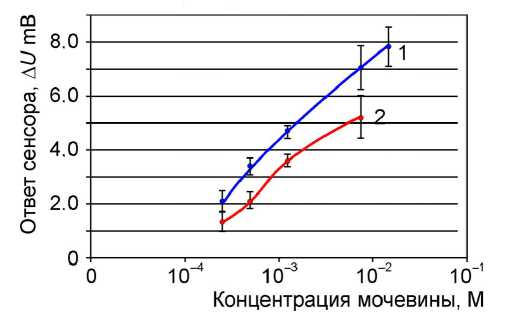
Рис. 2. Зависимость ответа стеклянного рН-элек-трода от концентрации мочевины (концентрацию фермента 0.5 мкг определяли методом Брэдфорда).
1 — свободный фермент (уреаза); 2 — инкапсулированный фермент, содержащийся в микрокапсулах с архитектурой оболочки ПСС-ПААГ-ПСС.
Среда исследования: 1 мМ Трис-HCl, 1 мМ MES, 100 мМ NаСl, начальная рН 5.3
Из рисунка видно, что активность инкапсулированного фермента сравнима с активностью свободного свежеприготовленного фермента и составляла 71 + 1.5 % от его активности. В процессе инкапсуляции ферменты частично повреждаются, и в первых исследованиях на капсулах с ферментом достичь высокой начальной активности инкапсулированного фермента не удавалось. Обычно наблюдалось снижение активности инкапсулированных ферментов в 6–7 раз [1, 6, 8]. Близкие результаты к нашим экспериментальным данным, представленными в данном исследовании по инкапсулированной уреазе, были получены в работе [9]. Авторам на примере фермента декстраназы удалось получить инкапсулированные ферменты с каталитической активностью, составляющей 80 % от активности свободного фермента (капсулы формировались из альгината кальция со включением кремнезема).
Поскольку при измерениях, проводимых в ячейках со свободным и капсулированным ферментом, использовались немодифицированные стеклянные рН-электроды, мы попробовали сравнить измерения рН при прохождении каталитической реакции уреаза—мочевина с помощью модифицированного нашим способом электрода и не-модифицированного электрода, которые одновре- менно были помещены в измерительную ячейку. При этом реакция разложения мочевины проходила в биочувствительном слое модифицированного электрода (рис. 3).
Показано, что потенциометрическим методом с помощью нового типа полимерного уреазного сенсора на стеклянном рН-электроде возможно проводить измерения концентрации мочевины, начиная от 10–20 мкМ. Верхний предел измерений зависит от концентрации уреазы, помещенной в полиэлектролитное покрытие, и от свойств электрода. Нам удавалось измерять более 100 мМ мочевины. Из диаграммы опыта видно, что время получения ответа после каталитической реакции фермент—субстрат с помощью модифицированного и немодифицированного электродов практически не отличаются друг от друга. Это связано с тем, что субстрат (мочевина) и продукты распада каталитической реакции уреаза—мочевина (углекислый газ и аммиак) легко проникают через нанометровую полиэлектролитную оболочку, отделяющую уреазу от внешнего раствора. Такие результаты экспериментов позволили нам создавать не только ферментные электроды, но и ферментные микрореакторы (когда регистрирующий электрод отделен от чувствительного слоя).
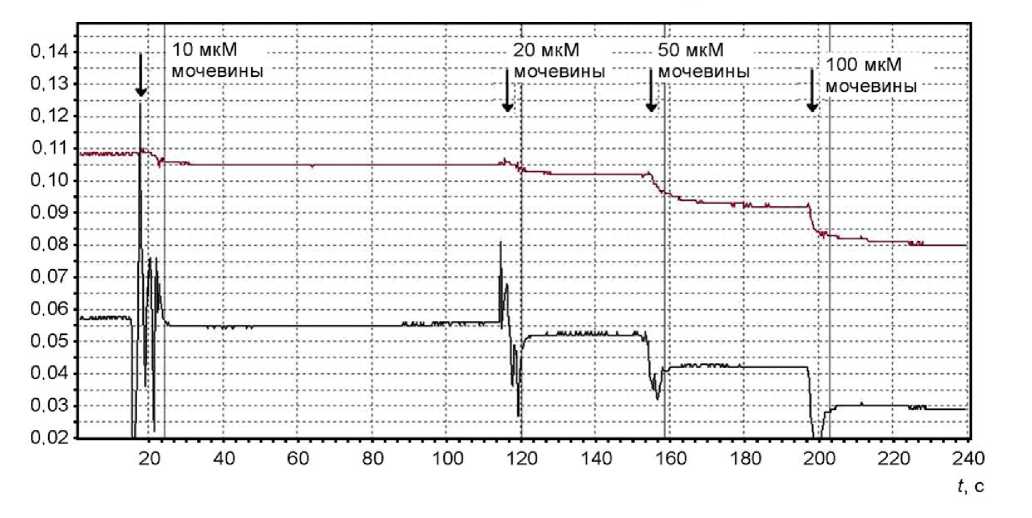
Рис. 3. Диаграмма опыта по измерению концентрации мочевины с помощью немодифицированного (верхняя кривая) и модифицированного рН-электродов.
Чувствительное покрытие с уреазой нанесено на шарик нижнего электрода.
Среда исследования: 1 мМ MES, 100 мМ NaCl, начальная рН 6.0
В качестве микрореактора использовали пластиковую и стеклянную кюветы с нанесенным по-лиэлектролитным покрытием, таким же, как на шарике модифицированного рН-электрода. Это покрытие, представляющее собой многослойную пленку, между слоями которой был расположен слой полиэлектролитных капсул диаметром около 2–5 мкм, заполненных молекулами уреазы, наносилось на одну из стенок кюветы. Наличие нескольких, не менее пяти, полиэлектролитных слоев, отделявших ферменты от внешней среды, предохраняло последние от инактивации, например, посторонними ферментами или микробами. Одной из особенностей покрытия было то, что суммарная толщина полимерных слоев составляла в нем менее 2 % от диаметра внутренних ячеек.
На рис. 4 представлены данные по изучению каталитической активности уреазного микрореактора спустя пять дней после его формирования.
Исследования стабильности нового типа сенсора мочевины показали, что при хранении его в дистиллированной воде при температуре 4оС сенсор способен работать до 2 месяцев. При этом снижение активности иммобилизованной уреазы по сравнению с первоначальной составляет 40– 50 %. Стабильность сенсора во времени может в том числе обуславливаться стабильностью поли-электролитных оболочек, защищающих ферменты от внешней среды в микроячейках покрытия. Возможно, в этом случае, размеры микрокапсул, а также число полиэлектролитных слоев, образующих оболочку микрокапсул, будут иметь зна- чение для увеличения стабильности полиэлектро-литного покрытия. Нами были проведены первичные исследования прочности микрокапсул размером 10 мкм, содержащих кальций-карбонатное ядро, с помощью нанотвердомера "НаноСкан-4D" [10]. Было показано, что разрушение единичной микрокапсулы происходило при ее сжатии на 1.1 мкм и величиной нагрузки 25 мН. Исследование прочности микрокапсул с удаленным кальцийкарбонатным ядром в зависимости от размеров микрокапсул и числа слоев полиэлектролитов оболочки капсул представляет интерес для повышения стабильности микрокапсул и нового поли-электролитного покрытия.
Необходимой составляющей исследований при разработке биодатчиков — это испытания на биологических жидкостях. Исследования уреазного полимерного сенсора для определения мочевины в биологических жидкостях были проведены на примере мочи и крови. Эти эксперименты представлены в работе [7], из которой следует, что если точность измерения нашим способом концентрации мочевины в суточной моче, разведенной в 100 раз, приближается к ошибке, получаемой при разведении мочи, то иная картина наблюдается при измерениях мочевины в сыворотке крови. Кровь у разных людей имеет собственную рН и буферную емкость, поэтому при измерениях мочевины в сыворотке крови нами был опробован метод "двойных добавок", который повысил точность измерений до 5 %.
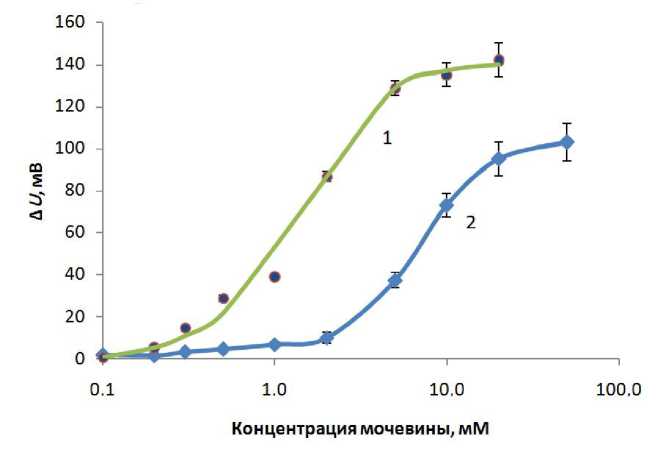
Рис. 4. Зависимость ответа стеклянного рН-электрода от концентрации мочевины (концентрацию фермента 3 мкг определяли методом Брэдфорда).
1 — свободный фермент (уреаза); 2 — фермент, иммобилизованный на боковой поверхности спектрофотометрической ячейки и содержащийся в микроячейках чувствительного покрытия с архитектурой оболочки ПААГ-(ПСС-ПААГ) 2 .
Среда исследования: 1 мМ MES, 100 мМ NаСl, начальная рН 6.0
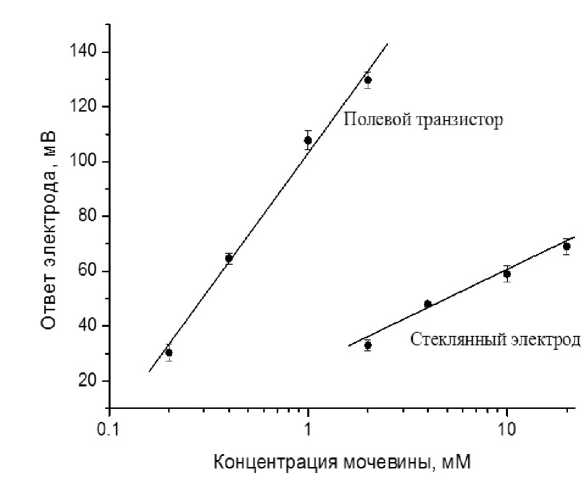
Рис. 5. Сравнение зависимостей ответа рН-чувствительного полевого транзистора и стеклянного рН-электрода от концентрации мочевины.
Чувствительное покрытие нанесено на шарик стеклянного электрода и на поверхность регистрирующего элемента транзистора.
Среда исследования: 2 мМ Трис-НСl, 200 мМ NaCl, начальная рН 7.8
Чувствительность уреазного датчика можно существенно повысить при использовании рН-чувствительных полевых транзисторов (рис. 5).
Как видно из рисунка, полевой транзистор увеличил чувствительность сенсора, больше чем на порядок. Расход фермента при создании чувствительного покрытия на полевом транзисторе составил 20 мкл из набора на 3 мл (см. "Материалы и методы"). Это количество фермента используется для одного-двух измерений в ферментном анализе обычным спектральным способом в поликлиниках.
ЗАКЛЮЧЕНИЕ
Биодатчик мочевины, изготовленный с помощью полимерных технологий и представляющий собой комбинацию полиэлектролитных слоев и микрокапсул с ферментом внутри и оболочкой из этих же полиэлектролитов, как показали экспериментальные данные, вполне пригоден для определения концентрации мочевины в крови и моче. Технология изготовления ферментного биодатчика существенно не отличается от известной технологии изготовления микрокапсул с ферментом методом laer-by-laer [4–6]. Это позволяет нам при конструировании биодатчика пользоваться информацией, полученной на инкапсулированных ферментах другими авторами. При этом биосенсор мочевины способен работать в течение длительного времени (до 2 мес.) без значительной потери активности фермента. Одним из существенных результатов настоящей работы с нашей точки зре- ния являются два фактора. Первый фактор — это оптимизация условий получения функциональноактивного фермента, иммобилизованного в поли-электролитное покрытие, когда фермент после процедуры иммобилизации показывает активность, сравнимую с активностью свежеприготовленного свободного фермента. Такой результат позволит удешевить расходы на ферменты при создании чувствительного слоя разрабатываемого прибора-анализатора мочевины. И второй фактор, это — то что полимерное покрытие с ферментом способно работать не только как ферментный электрод, но и как ферментный микрореактор, при этом не уменьшая скорость регистрации сигнала после прохождения каталитической реакции уреа-за—мочевина. Это обусловлено тем, что слои полиэлектролитов, отделяющие фермент от внешнего анализируемого раствора, обладают нанометровой толщиной и легко проницаемы для мочевины и продуктов распада каталитической реакции уреаза—мочевина. Отделение чувствительного датчика от регистрирующего электрода дает много возможностей для конструкторов приборов-анализаторов мочевины на основе полимерного ультратонкого покрытия.
Работа выполнена при финансовой поддержки Комитета науки МОН РК по проекту AP05134201
Список литературы Разработка биодатчика мочевины с применением полимерных технологий для анализов крови и мочи
- Монтрель М.М., Терновский В.И., Фомкина М.Г., Петров А.И. Ультратонкое полимерное покрытие, способ его изготовления и ферментативный биосенсор на его основе. Патент № 2333231 от 10.09. 2008. Бюл. № 25. Заявка 2006136254/04 от 16.10.2006.
- Терновский В.И., Чернохвостов Ю.В., Фомкина М.Г., Монтрель М.М. Потенциометрический сенсор на основе уреазы, иммобилизованной в полиэлектролитных микрокапсулах//Биофизика. 2007. Т. 52, № 5. С. 825-829.
- Фомкина М.Г., Минкабирова Г.М., Монтрель А.М. Способ получения подложек с многослойным покрытием на основе полиэлектролитных микрокапсул, содержащих биологически активные материалы. Патент № 2567320. Бюл. № 31 от 10.11.2015. Заявка 2011103074/05 от 28.01.2011. http://www1.fips.ru/fips_servl/fips_servlet.
- Sukhorukov G.B., Volodkin D.V., Günther A.M., Shenoy D.B., Möhwald H., Petrov A.I. Porous calcium carbonate microparticles as templates for encapsulation of bioactive compounds//Journal of Materials Chemistry. 2004. Vol. 14, no. 14. P. 2073-2081.
- Volodkin D.V., Prevot M., Sukhorukov G.B., Petrov A.I. Matrix polyelectrolyte microcapsules: new system for macromolecule encapsulation//Langmuir. 2004. Vol. 20, no. 8. P. 3398-3406.
- Petrov A.I., Volodkin D.V., Sukhorukov G.B. Protein-calcium carbonate coprecipitation: a tool for protein encapsulation//Biotechnology Progress. 2005. Vol. 21, no. 3. P. 918-925.
- Фомкина М.Г., Грохлина Т.И., Минкабирова Г.М., Монтрель А.М., Маевский Е.И. Экспресс-диагностика мочевины в биологических жидкостях на основе нового полимерного датчика//Medline.ru: Российский биомедицинский журнал. 2011. Т. 12, № 3. С. 701-710.
- Сухоруков Б.И., Тихоненко С.А., Сабурова Е.А., Дубровский А.В., Дыбовская Ю.Н., Шабарчина Л.И. Инкапсулирование белков в полиэлектролитные нано-и микрокапсулы и проблемы разработки ферментного микродиагностикума//Биофизика. 2007. Т. 52, № 6. С. 1041-1048.
- Pachariyanon P., Barth E., Agar D.W. Enzyme immobilisation in permselective microcapsules//Micro and Nano Carriers Journal of Microencapsulation. 2011. Vol. 28, no. 5. P. 370-383.
- Усеинов А., Кравчук К., Маслеников И., Решетов В., Фомкина М. Исследование прочности микрообъектов с помощью сканирующего нанотвердомера "НАНОСКАН"//Наноиндустрия. 2015. Т. 58, № 4. С. 54-61.


