Разработка физико-химических и технологических основ рационального использования ванадий-никель-железо-кальцийсодержащих отходов теплоэлектростанций
Автор: Сирина Татьяна Петровна, Красненко Татьяна Илларионовна, Соловьв Георгий Владимирович, Викторов Валерий Викторович, Ленв Дмитрий Сергеевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 1 т.5, 2013 года.
Бесплатный доступ
Комплексом исследований физико-химических свойств отходов теплоэлектростанций, сжигающих мазут, фазовых соотношений в модельных системах V 2O 5-NiO(MgO)-CaO-Na 2O и растворимостей основных фаз, образующихся при термообработке, показана возможность их переработки по единой технологической схеме с получением товарных ванадий-, никель- и кальцийсодержащих продуктов.
Тэс, шлам химической водоочистки, ванадий-никель-железо-кальцийсодержащие отходы теплоэлектростанций, аттестация шламов, десульфурация отходов тэс
Короткий адрес: https://sciup.org/147160258
IDR: 147160258 | УДК: 546.881
Текст научной статьи Разработка физико-химических и технологических основ рационального использования ванадий-никель-железо-кальцийсодержащих отходов теплоэлектростанций
Во многих регионах мира на сегодняшний день значительную роль в производстве электроэнергии играют тепловые электростанции (ТЭС), сжигающие мазут. Техногенные отходы ТЭС являются концентрированными продуктами сгорания мазута, они содержат золу, отложения, формирующиеся на поверхностях котлоагрегатов и шламы – осадки, выделяемые при нейтрализации промывочных вод. Энергетические отходы ТЭС, сжигающих мазут нефтяных месторождений Поволжья, Урала, Сибири в пересчете на оксиды содержат: V 2 O 5 – до 50 %; до 10 % каждого из оксидов натрия, магния, кальция, никеля, алюминия, значительные количества оксидов железа и кремния. Вовлечение в переработку этого вторичного сырья актуально, поскольку, прежде всего ванадий и никель являются ценными стратегически важными металлами, а их количество в ежегодно сжигаемых мазутах только Тюменского и Волжско-Уральского региона превышает 10 000 и 2000 т соответственно [1].
На любой ТЭС имеются шламонакопители, в которых складируются отходы, образующиеся при подготовке питательной воды котлоагрегатов за счет обработки «сырой» воды гидроксидом кальция и сульфатом двухвалентного железа с целью снижения ее жесткости. Исследование фазового состава сухих шламов химической водоочистки (ХВО) показали, что основу этих материалов составляет оксид кальция и/или карбонат кальция.
В некоторых странах отходы ТЭС активно вовлекаются в производственную сферу. В Японии к концу 80-х годов около 20 % потребности ванадия покрывалось за счет переработки отходов ТЭС, в Канаде, США и Венесуэле ванадий, а также никель получают не только из зольных остатков ТЭС, но и из нефти и битума. В России переработка ванадий-никель-железо-кальцийсо-держащих отходов электростанций до сих пор не освоена.
Цель настоящей работы – комплексная переработка двух отходов ТЭС, ванадий- и никельсодержащих отложений (зол и шламов) и кальцийсодержащих шламов ХВО с получением технической пятиокиси ванадия для выплавки феррованадия, композита, содержащего ванадий, никель, железо и гипс, являющегося комплексной шихтой для выплавки ферроникеля и обожженной извести, широко используемой в металлургии.
Кроме того, существует и экологический аспект необходимости переработки отходов тепло-станций. Для хранения отходов в каждой крупной ТЭС оказываются занятыми картами шламо-накопителей от 1000 до 3000 га земли. Отходы ТЭС содержат вещества различной степени токсичности.
Наиболее токсичными являются соединения ванадия, никеля, серы и бенз(а)пирен. На основании токсикологической оценки отходов, проведенной ВНИИ техники безопасности, приведенных в [1], все виды отходов ТЭС характеризуются как «вещества умеренно опасные» (III класс опасности). Повышение качества окружающей среды в промышленной зоне ТЭС предполагает изъятие канцерогенных соединений как из накопленных, так и из текущих поступлений, нахождение путей их детоксикации и/или их извлечение для прагматических целей. Поскольку все соединения ванадия, никеля и серы токсичны, детоксикация их невозможна, следовательно, необходим поиск путей извлечения этих соединений для последующего использования.
Элементный и фазовый состав ванадий-никель-железо-кальцийсодержащих отходов теплоэлектростанций
Усредненный химический состав энергетических отложений в пересчете на оксиды характеризуется наличием V 2 O 5 – 1,5–50 %; Na 2 O – 1–9 %; CaO – 0,8–30 %, MgO – 2,5–10 %; NiO – 1–10,2 %; Fe 2 O 3 – 4,0–48 %; SiO 2 – 10–20 %. В шламах ХВО содержится до 52 % CaO, 4,5 % MgO, 4 % SiO 2 , 13,8 % углерода, 0,02–0,06 % P, 1,4–11,7 % Fe 2 O 3, потери при прокаливании при 400–600 °C составляют ≈ 40 %. Ванадий в отложениях входит в состав ванадатов натрия, магния, кальция и никеля, оксидных натрий-ванадиевых бронз, шпинелей, силикатных фаз, пятиокиси ванадия. Никель находится в составе шпинели, образует ванадаты и ферриты. Основными соединениями, входящими в состав шлама ХВО после прокаливания при 1000 °C в течение одного часа, являются СaO (95–97 %) и феррит кальция Ca 2 Fe 2 O 5 (5–3 %) [2]. Сера присутствует в водорастворимых кристаллогидратах сульфатов никеля, железа, натрия, магния, сульфата ванадила и малорастворимого в воде кристаллогидрата сульфата кальция. Поскольку часть соединений серы, входящих в состав золы, образующейся на стенках воздухоподогревателя, водорастворима, частичная десульфурация отходов ТЭС может быть проведена предварительной обработкой раствором карбоната натрия. За счет обменных реакций карбоната натрия с растворимыми сульфатами железа, никеля, магния и гипса образуются осаждающиеся карбонаты:
Fe(Ni, Mg, Ca)SO 4 + NaCO 3 = Fe(Ni, Mg, Ca)CO 3 ↓ + Na 2 SO 4
Утилизация углерода из отходов ТЭС может быть осуществлена его выжиганием. Эксперименты, проведенные в лабораторных условиях, показали, что этот процесс необходимо проводить в интервале температур 600–850 °C [2]. Наряду с выжиганием углерода при обжиге отходов ТЭС, согласно [1], полностью уничтожается бенз(а)пирен.
Исходя из реального фазового состава, непосредственная обработка ванадийсодержащих отходов в воде и кислых растворах может привести лишь к частичному извлечению ванадия в раствор. Цель различных технологических приемов переработки сырья состоит в формировании ванадиевых соединений, пригодных для такого гидрометаллургического воздействия, в результате которого возможно более полное селективное извлечение в раствор ванадия и последующее его осаждение. Требованиям селективности удовлетворяют оксидные соединения ванадия, в которых ванадий-кислородный анион, наименее прочно связан с катионной подсистемой. Целевые соединения в данном случае должны обладать гетеродесмическими структурами с доминирующими ковалентной ванадий-кислородной и ионной металл-кислородной связями. К таким соединениям принадлежат, в первую очередь, сложные соединения пятивалентного ванадия – ванадаты натрия и двухвалентных металлов – никеля, магния, кальция. Образование таких соединений ванадия осуществляется в ходе обжига ванадийсодержащего сырья с добавками соединений натрия или кальция путем формирования соответственно водорастворимых ванадатов натрия или ванадатов кальция, легко растворяющихся в растворах серной кислоты. При разработке оптимальных параметров технологических режимов извлечения ванадия необходимо опираться на знание диаграмм фазовых равновесий, моделирующих ванадийсодержащее сырье и композиции, являющиеся итогом его пирометаллургического передела. Такими системами являются V 2 O 5 –Na 2 O–CaO–MO (М = Mg, Ni). Для построения фазовых диаграмм многокомпонентных систем использованы данные о трехкомпонентных системах, опубликованные в литературе [4, 5], а также полученные в настоящей работе. Наряду с этим учтены возможности двойного катионного замещения кальция не только на ионы двухвалентных металлов, но и на ионы натрия.
Неорганическая химия
Диаграммы фазовых равновесий, моделирующих ванадийсодержащее сырье и композиции, являющиеся итогом его пирометаллургического передела.
Система V 2 O 5 –NaVO 3 –Ca(VO 3 ) 2 –Ni 3 (VO 4 ) 2
Построенная нами диаграмма фазовых равновесий четырехкомпонентной системы приведена на рис. 1. Анализ фазового состава исследованных образцов свидетельствует об отсутствии в рассматриваемой системе как тройных ванадатов, так и одновременного замещения кальция в Ca(VO 3 ) 2 на натрий и никель, несмотря на существование на основе метаванадата кальция твердых растворов как с NaVO3, так и с Ni(VO3)2. Важно отметить, что все ванадаты никеля в состоянии равновесия сосуществуют с оксидными ванадиевыми бронзами [1]. Информация о фазовом составе многокомпонентных систем, включающих сложные оксиды ванадия, позволяет определить количество и вид добавок для получения композиций, растворение которых ведет к максимальному выщелачиванию ванадия. Образующиеся оксидные ванадиевые бронзы натрия в системе V 2 O 5 –Na 2 O–CaO–NiO находятся в термодинамическом равновесии со всеми ванадатами никеля (мета-, пиро- и орто-) и не сосуществуют с Ca 2 V 2 O 7 и Ca 3 (VO 4 ) 2 . Из этого следует, что водо-и кислотонерастворимые ванадиевые бронзы всегда сопровождают ванадаты никеля. Их наличие в термообработанном материале требует концентрированных сернокислотных растворов, которые «добирают» ванадий из образовавшихся ванадиевых бронз натрия. Низкая степень извлечения ванадия из никельсодержащих отходов ТЭС обуславливает поиск возможности их использования в металлургии, минуя стадию извлечения ванадия.
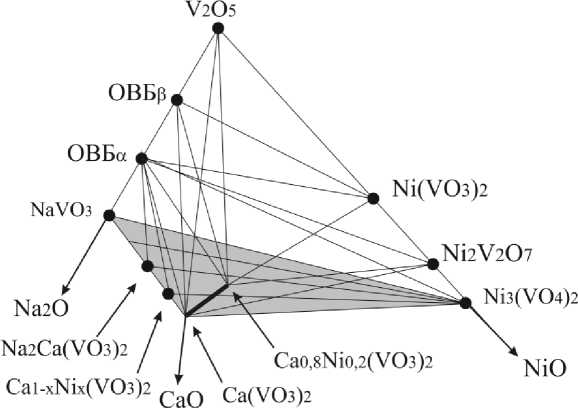
Рис. 1. Фазовые равновесия в системе V 2 O 5 –NaVO 3 –Ca(VO 3 ) 2 –Ni 3 (VO 4 ) 2
Система V2O5–NaVO3–Mg2V2O7–Ca2V2O7
Для получения информации, необходимой для тетраэдрации четверной диаграммы системы V 2 O 5 –NaVO 3 –Mg 2 V 2 O 7 –Ca 2 V 2 O 7 исследован фазовый состав ряда образцов тройной метаванадат-ной системе NaVO 3 –Ca(VO 3 ) 2 –Mg(VO 3 ) 2 . Обнаружено образование твердого раствора на основе метаванадата кальция с замещением катионной подрешетки на магний и натрий, однако и в этом случае результирующая изоморфная емкость метаванадата кальция не является суперпозицией емкости Ca(VO3)2 при замещении ионов кальция на ионы натрия и магния. Результатом этого является нелинейная форма конноды, соединяющей крайние составы твердых растворов на основе метаванадата кальция. Последние вместе с данными о фазовых равновесиях в плоскостях огране-ния четверной диаграммы дали возможность провести полную тетраэдрацию диаграммы фазовых равновесий системы V 2 O 5 –NaVO 3 –Ca 2 V 2 O 7 –Mg 2 V 2 O 7 [5].
Изучение растворимостей соединений, входящих в композициитехногенных отходов ТЭС
В составе термообработанных композиций в зависимости от количества вводимых реагентов могут присутствовать как хорошо, так и труднорастворимые в технологически приемлемых условиях соединения ванадия [7]. Информативными для технологов являются исследования, про- веденные в замкнутой системе с измельченным материалом (–0,16 мм) при перемешивании со скоростью 1000 об/мин в изотермическом режиме и заданном показателе рН среды. Особенностью фазового состава в далеких от равновесия системах с участием оксидов ванадия, натрия, кальция, магния, никеля и марганца совместное присутствие ОВБ и всех образующихся ванадатов возможно при любых соотношениях Na/V.
Система V2O5–Na2O–CaO–MgO
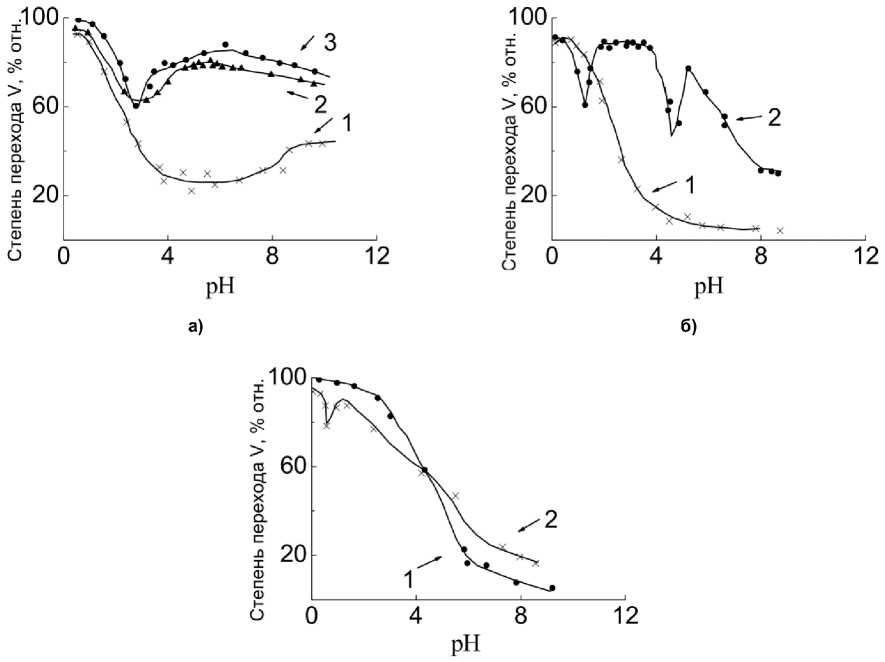
Ванадаты магния наиболее полно реагируют с серной кислотой при рН < 1 (рис. 2). При обработке метаванадата магния при различных температурах наибольшее количество ванадия в растворе достигается при рН = 0,5–1,0. Снижение температуры от 80–60 °C до комнатной приводит при рН = 5 к падению степени перехода ванадия в раствор до 10 %. Дальнейшее повышение рН до 10 позволяет увеличить степень перехода ванадия в раствор до 50 %. При 60 °C минимальная степень перехода ванадия в раствор находится на уровне 72–67,5 % в пределах рН = 2,0–4,2. В области рН = 5–6 отмечается повышение извлечения ванадия в раствор до 72 %. При 80 °C в области рН = 2,4–2,6 степень перехода ванадия в раствор достигает максимума при рН = 7 (87,8 %). Переход в щелочную область отмечен плавным снижением перехода ванадия в раствор при рН = 11 до 72 %. Пированадат магния в области рН = 0,5–1,2 растворяется практически полностью, но с повышением рН до 6,0 (20 °C) его растворимость резко падает до 4 % и остается неизменной при переходе в щелочную область. С ростом температуры до 60 °С характер взаимодействия изменяется: наблюдается резкое падение степени перехода ванадия в раствор до 56 % при рН = 2, а затем при переходе в область рН = 2,1–4,4 – повышение до 83–97,8 %. В области рН = 4,1–5,2 наблюдается второй минимум с переходом в раствор 46,5 % ванадия. Затем происходит повышение степени извлечения ванадия в раствор до 82 % и последующее плавное снижение при переходе в щелочную область до 23,5 %.
в)
Рис. 2. Зависимость степени перехода ванадия в растворы NaOH и H 2 SO 4 от величины pH: а – Mg(VO 3 ) 2 ; б – Mg 2 V 2 O 7 ; в – CaMgV 2 O 7 ; t , °С: 1 – 20 °С; 2 – 60 °С; 3 – 80 °С
Неорганическая химия
Особенностью четырехкомпонентной диаграммы V2O5–Na2O–CaO–MgO является возможность сосуществования ОВБ натрия с Mg(VO 3 ) 2 , Mg 2 V 2 O 7 и Ca(VO 3 ) 2 . Это означает, что даже при значительном содержании ионов натрия, соответствующего образованию водорастворимого NaVO 3 , присутствие магния ведет к образованию труднорастворимых ОВБ натрия, которые ни при каких условиях (при сохранении заданного соотношения Na/V) не трансформируются в ванадаты натрия. В частности, в рассмотренной области равновесной системы Na 2 O–CaO–MgO–V 2 O 5 ОВБ натрия присутствуют в восьми из тринадцати элементарных систем.
Система V2O5–Na2O–CaO–NiO
Образующиеся в системе V 2 O 5 –Na 2 O–CaO–NiO оксидные ванадиевые бронзы натрия находятся в термодинамическом равновесии со всеми ванадатами никеля (мета-, пиро- и орто-) и не сосуществуют с Ca 2 V 2 O 7 и Ca 3 (VO 4 ) 2 . Из этого следует, что водо- и кислотонерастворимые ванадиевые бронзы всегда сопровождают ванадаты никеля. Их наличие в термообработанном материале требует концентрированных сернокислотных растворов, которые «добирают» ванадий из образовавшихся ванадиевых бронз натрия.
Зависимость взаимодействия ванадатов никеля с растворами серной кислоты и едкого натра от рН также свидетельствует о низкой до 10 % степени, перехода ванадия в раствор. Увеличение растворимости ванадатов никеля от 10 до 20 % можно достичь только при существенном, до 4 часов, увеличении продолжительности обработки растворами 7 % H 2 SO 4 (рис. 3).
Ni 3 (VO 4 ) 2
H 2 O
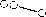
2 3 4 5 6 7 8 9 10 11
Ni2V 2 O 7
12 pH

H 2 O
—ОО о о
8 9 10 11
Ni(VO 3 ) 2
12 pH

H 2 O
1 2 3 4 5 6 7 8 9 10 11
12 pH
Рис. 3. Зависимость степени перехода ванадия в растворы H 2 SO 4 и NaOH от величины pH ( τ = 0,5 ч, t = 60 °C). Т : Ж = 1 : 8
Низкая степень извлечения ванадия из никельсодержащих отходов ТЭС обусловила поиск возможности их использования в металлургии, минуя стадию извлечения ванадия с последующим получением V2O5 и феррованадия. Одним из направлений использования шлама явилось получение на его основе оксидного ванадиевого сплава. Исследования и практическое использование оксидного сплава показали, что при легировании стали он может быть с успехом применен вместо феррованадия [3] .
Десульфурация отходов ТЭС
Известно, что при отсутствии соединений никеля практически полное осаждение ванадия происходит при соотношении Fe/V = 1,5–2 [7, 8]. Осаждение ванадия при совместном присутствии железа и никеля в литературе не описано. С целью определения оптимальных условий получения комплексного низкосернистого ванадий-никель-железо-углеродсодержащего концентрата из зольных отходов ТЭС проведены эксперименты на модельной системе, содержащей NaVO3, NiSO 4 , FeSO 4 и Н 2 О с корректировкой показателя рН раствором Na 2 СO 3 .
При получении твёрдой фазы осаждение проводили при Fe/V = 0,50–0,75 и Ni/V = 0,15–1,0 (массовые отношения). Изменение температуры раствора для одного из составов от 20 до 90 °С показало, что железо и никель практически полностью остаются в осадках, а ванадий осаждается на 99,8 % только при 20 °С. С повышением температуры до 90 °С степень его осаждения снижается до 58–60 %. Изменение времени перемешивания раствора, проводимого при 20 °С, выявило, что полнота осаждения ванадия максимальна при времени перемешивания до 1 часа, увеличение экспозиции до 4 часов приводит к снижению степени осаждения до 75 % . Степень осаждения никеля и железа на уровне 98–100 % получена независимо от продолжительности перемешивания, при этом содержание серы в осадке изменяется от 0,08 до 0,14 мас. %. Дальнейшие исследования проводили при 20 °С и продолжительности перемешивания 1 час. Изменение отношений Fe/V и V/Ni в системе (табл. 1) позволило выявить их оптимальные пределы, составляющие 0,5–0,75 и 0,33–0,15 соответственно.
Таблица 1 Зависимость степени осаждения и состава осадков от отношений V / Ni и Fe / V в исходных растворах.
Условия опытов: t = 20 °С , τ = 1 ч; рН конечное = 8,5
|
Отношение |
Степень осаждения. % отн. |
Состав осадка, мас. % |
|||||
|
V/Ni |
Fe/V |
V |
Ni |
Fe |
V |
Ni |
Fe |
|
1,0 |
0,50 |
98,0 |
99,9 |
99,8 |
18,9 |
19,2 |
9,6 |
|
1,5 |
0,50 |
95,3 |
99,7 |
99,8 |
21,4 |
15,0 |
11,2 |
|
3,0 |
0,15 |
31,1 |
96,0 |
92,2 |
18,8 |
19,3 |
8,4 |
|
0,25 |
41,6 |
97,4 |
96,2 |
21,2 |
16,5 |
12,2 |
|
|
0,50 |
88,8 |
99,7 |
99,7 |
24,7 |
9,2 |
13,8 |
|
|
0,75 |
94,2 |
95,0 |
99,4 |
21,9 |
7,4 |
17,3 |
|
|
4,5 |
0,25 |
39,1 |
83,7 |
93,4 |
17,7 |
12,2 |
15,3 |
|
0,50 |
85,4 |
98,8 |
98,4 |
25,6 |
6,6 |
14,8 |
|
|
0,70 |
97,7 |
99,8 |
99,8 |
24,0 |
5,4 |
17,2 |
|
|
0,75 |
98,0 |
99,7 |
99,8 |
24,1 |
5,4 |
18,4 |
|
|
6,5 |
0,25 |
37,3 |
75,6 |
80,8 |
26,4 |
8,2 |
14,3 |
|
0,50 |
76,2 |
96,7 |
99,0 |
26,2 |
5,1 |
17,0 |
|
|
0,75 |
91,9 |
99,3 |
99,1 |
24,1 |
4,0 |
19,5 |
|
Следует отметить, что щелочные растворы, полученные после фильтрации при оптимальных условия осаждения, содержат незначительные количества ванадия, никеля и железа (до 0,2 г/л V 2 О 5 ; 0,002 г/л Ni; 0,03 г/л Fe) и при переработке зол ТЭС могли бы быть использованы повторно в качестве оборотных растворов. Однако из-за перехода сульфат-ионов в раствор возрастает концентрация сульфата натрия в оборотном растворе. Для выявления влияния концентрации Na2SO4 на состав твёрдой фазы проведена серия опытов с добавкой его в исходный раствор от 10 до 250 г/л. Опыты показали, что при изменении отношении V/Ni от 0,5 до 6,5 увеличение концентрации сернокислого натрия в исходном растворе до 250 г/л не влияет на степень осаждения ванадия, никеля и железа – она находится на уровне 99,3–99,7 %. Однако при достижении максимальной концентрации сернокислого натрия в исходном растворе содержание серы в осадке возрастает до 3,89 мас. %, что указывает на невозможность дальнейшего использования оборотного раствора без выведения сульфата натрия.
При степени десульфурации исходного сырья на 82–98,4 % выход ванадия, никеля и железа с твёрдой фазой составил 95–99; 98–99,5; 98,3–99,7 отн. % соответственно. Остаток от золы после её водной обработки помимо ванадия, никеля и железа содержал значительное количество углерода. Полученные комплексные ванадий-никель-железо-углеродные концентраты могут быть использованы для выплавки ванадий-никелевой лигатуры, а содержащийся в них углерод служит восстановителем [8].
Одним из вариантов переработки сырья, содержащего СаSO 4 ·2Н 2 О, для последующего использования в производстве легированных сталей является проведение десульфурации – обработки раствором карбоната натрия. При этом гипс – фаза, в которую входит сера, взаимодействует с карбонатом натрия по реакции обмена (2), а сера переходит в раствор:
Неорганическая химия
СаSO 4 (т) + Na 2 СО 3 (р) = СаСО 3 (т) + Nа 2 SO 4 (р). (2)
Исследование последовательности фазообразования и характера взаимодействия сульфата кальция с растворами карбоната натрия проводили на модельной системе СаSO 4 ∙2H 2 О–Na 2 СO 3 –H 2 О. При изучении фазового анализа осадков, полученных при различном соотношении исходных компонентов ( m ) выявлено, что процесс десульфурации при перемешивании в течение 30–360 минут при рН = 7,5–7,8 и температуре 40 °С протекает ступенчато с образованием промежуточных фаз – глауберита СаNa 2 (SO 4 ) 2 и кальций-натриевого карбоната СаNa 2 (СO 3 ) 2 :
2СаSO4 + Nа2СO3 = СаNа2(SO4)2 + СаСO3;(3)
СаSO4 + 4Nа2СO3 + СаNа2(SO4)2 = 2СаNа2(СO3)2 + 3Nа2SO4;(4)
СаSO4 + СаNа2(CO3)2 = 2СаСO3 + Nа2SO4.(5)
Реакция (2) протекает полностью с образованием одной твёрдой фазы – карбоната кальция при m = 1,0–1,25 уже через 30 минут перемешивания.
Соединения ванадия хорошо растворимы в растворах карбоната натрия. С целью изучения влияния содержания гипса на концентрацию ванадия в растворах проведена серия опытов с добавлением различного количества метаванадата натрия к раствору карбоната натрия в оптимальных для десульфурации гипса условиях. С увеличением концентрации сульфата натрия с 40,4 до 202,3 г/л в растворе остается до 97,0 % ванадия, так как происходит уменьшение относительной массы ванадатов кальция за счет повышения солевого фона в системе и создаются лучшие условия для процесса десульфурации гипса. Степень десульфурации при этом достигает 93,7–99,9 %. Таким образом, на модельных системах показана высокая скорость и полнота растворения гипса при его взаимодействии с растворами карбоната натрия, возможность многократного использования растворов при малой степени потерь ванадия из раствора.
Аттестация шламов ХВО
Химический анализ твердой фазы ХВО Ново-Стерлитамакской ТЭС (базового материала), а также шламов ряда других ТЭС России (табл. 2) показывает, что состав шламов ХВО всех предприятий идентичен. Некоторое варьирование содержания оксидов кальция, кремния и магния объясняется различным составом исходной воды, а также технологическими режимами отчистки воды, выдерживаемыми на каждой ТЭС. Просушенный при 25 °С шлам ХВО представлен СаСО 3 , после обжига при 1000 °С, 1 ч – СаО и Ca 2 Fe 2 O 5 (5 мол. %).
Таблица 2 Характеристика шламов ХВО различных ТЭС
|
№ п/п |
Характеристика шлама ХВО |
Суспензия шлама ХВО |
|||||||||
|
Содержание твердого, г/л |
рН |
СаО |
С общ |
Fe e общ |
MgO |
SiO 2 |
S общ |
Р |
ППП* |
||
|
1 |
Ново-Стерлитамакская ТЭЦ (из шламона копителя) |
17,8 |
11,6 |
50,6 |
11,0 |
1,03 |
4,57 |
2,45 |
0,05 |
0,044 |
42,2 |
|
2 |
Ново-Стерлитамакская ТЭЦ (текущая выработка) |
16,7 |
11,8 |
51,8 |
11,4 |
0,95 |
3,38 |
2,56 |
0,07 |
0,038 |
41,5 |
|
3 |
Кармановская ГРЭС (из шламо-накопителя) |
– |
– |
45,7 |
13,8 |
8,20 |
2,00 |
3,92 |
0,74 |
0,063 |
39,9 |
|
4 |
ТЭЦ-26, г. Москва (текущая выработка) |
– |
– |
47,7 |
11,7 |
0,60 |
3,38 |
2,66 |
0,08 |
0,050 |
35,8 |
* ППП – потери при прокаливании образцов при t = 850 °С в течение 1 часа.
Возможные пути использования шламов ХВО
-
1. Нейтрали за ц ия к ислы х с точных вод и отходов (металлургических, хим и че с к и х, бытов ых и т. д. ) с пос лед у ю щ и м и зв л е че н и е м и з н и х ц е н н ых к омп он е н тов .
-
2. Испол ьзован ие в к а че ств е н а п олн и те ля ш и хты п ри п рои зв од с тв е стройматериалов (стено в ы х к а мн е й ) в с оче т а н и и с п е с ча н о-гравийной смесью. Обожженные шламы ХВО, согласно про в ед е н н ым и сс ле дов а н и ям, п ри годны как высокоэффективные пластифициру ю щ и е д оба в к и дл я строи т ельных и ш ту к а ту рн ых ра с тв ор ов
-
3. В се л ьс к ом хозяй с тве ш л ам ХВО в гранулированном виде, возможно использовать как н ейтрали зующ и й м ате риал д ля обработки кислых почв взамен доломитовой му к и
-
4. Испол ьзован ие ш ла м ов Х ВО (вместо применяемого в настоящее врем я карб он а та к а л ьц и я CaCO 3 ) в к а че с тв е к альци й с од е р жащ е й добавки при пирометаллургическом извлечении ванадия и з другого отход а э лек тр ос та н ц и й – пылей, шлаков и шламов, образующихся при сжигании ва н ад и й с оде рж а щ и х не фтеп род у к тов .
В целях и с с ле д ов а н и я к о мплексного использования двух видов отходот Т Э С п ос та в лен модельный эксперимент [9– 12] п о извлечению ванадия ванадия из термообработа н н ой с мес и «с ред н ес та ти с ти че ск а я зола ТЭ С + ш ла м Х В О» ( об жи г п ри 850 °С в течение 1 ч) в сернокислый раствор (рН = 2,6–4, 2, тем п ера ту ра 20 °С, продолжительность выщелачивания 30 мин). Используе мая з ол а с од ерж а ла ( в п ере с че те н а о к с и ды), % мас.: V 2 O 5 – 6,5; CaO – 2,5; Na 2 O – 1; состав шла ма Х В О п рив е де н в ыш е . В у к а занном режиме степень извлечения ванадия п ри молярн ом соотношении CaO / V 2 O 5 = 2 , 5 со с т авила 82 % (рис. 4, кривая 1). Повторная обработка обожженного образ ца бо лее ко н ц ент р и р о ванн ой кислотой (рН = 0,5) позволила повысить о б ще е из вл ечени е до 93 % (рис. 4, т о чка 2). Дл я с равне ния на эт о м ж е р исунк е (рис. 4, кривая 3) приведена кривая п ер е х ода ва на дия в р а ст во р с ерной кислоты из модельной обожженной см е си (0 ,9 CaCO 3 + 0,1 MgO / V2O5) в тех ж е ме тод и ческих условиях (степень извлечения ванади я в ра с тв ор с ерн ой кислоты составила 98 %). Так им о б раз ом, подтверждена принципиальная возможность использования отходов ТЭС – в анад и й содержащих продуктов сгорания мазута и к а льц и й сод е р жащ их шламов водоочистки – дл я п ромышленн ого и зв ле ч е н и я в а н а д и я.
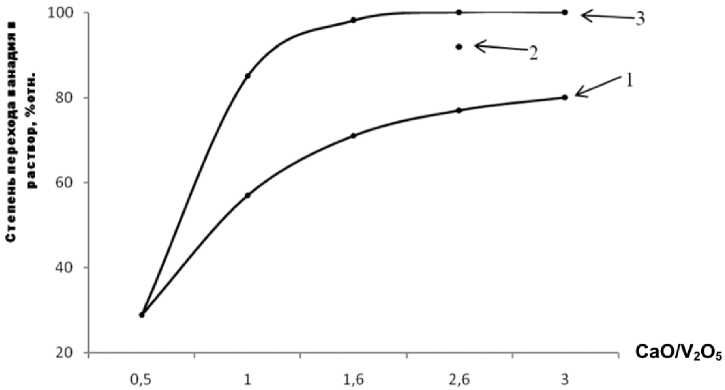
Рис. 4. Зависимость степени извлечения ванадия из смеси «ванадийсодержащие отходы + шлам ХВО» (кривая 1,точка 2) и из модельной смеси (0,9 CaCO 3 + + 0,1 MgO) / V 2 O 5 (кривая 3) от соотношения CaO / V 2 O 5
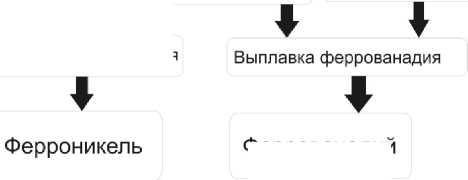
С ов ме с тн ое испо л ьз ов ан и е д вух отходов ТЭС, ванадийсодержащих зол, шла мов и ка льц ийсодержащих шламов ХВО, п озволяет получить товарную ванадиевую продук ц и ю : т е хн и че ск у ю п яти ок и с ь в а н ад и я для в ып ла в к и феррованадия, твердую фазу после извлече н и я в а н а д и я, с од ер ж а щ у ю н ик е ль, желе зо и ги п с , я вляющуюся комплексной шихтой для выпла в к и ф е ррон ик е ля, а при отдельной прокал к е ш ла ма ХВО и обожженную известь, широко использу е му ю в ме та ллу р г ии . Пров е де н н ые и с следовани я по разработке физико-химических и технологических основ ра ц и он а л ьн ого исп ользов а н и я в а н а д и й -никель-железо-кальцийсодержащих отходов теплоэлектростанций позволи л и п редложи ть принципиальную технологическую схему компл ек с н ой перера-
Неорганическая химия ботки зол и шламов тепловых электростанций [13–15] для получения товарных продуктов, используемых в металлургии (рис. 5). Единая технологическая схема предполагает создание научно обоснованной технологии, позволяющей максимально эффективно и экологически безопасно получить забалансовый источник ценных металлов, ванадия и никеля, и оптимизировать качество окружающей среды в промзонах ТЭС с возможностью ликвидации зольных отвалов и шламонакопителей.
Ванадийсодержащие Шпамы ^
шламы и золы
Смешивание, помол
H2SO4 *
Обжиг
Обжиг
Твёрдая фаза
Выщелачивание ванадия в раствор
Гидролитическое осаждение V2O5
Выплавка ферроникеля
Техническая пятиокись
Железоникелевый
Обожженная известь
Феррованадии
Рис. 5. Принципиальная технологическая схема комплексной переработки зол и шламов тепловых электростанций
Выводы
Установлен элементный и фазовый состав двух видов отходов теплоэлектростанций, сжигающих мазут: ванадий- и никельсодержащих зол и шламов и кальцийсодержащих шламов химической водоочистки. Построены многокомпонентные диаграммы фазовых соотношений в системах V 2 O 5 –NiO(MgO)–CaO–Na 2 O, моделирующих состав энергетических отходов. Определена растворимость в кислых и щелочных растворах фаз, образующихся при окислительном обжиге. На модельных системах определены области с максимальным выходом ванадия в раствор. Разработана принципиальная технологическая схема комплексной переработки всех видов отходов с получением товарной ванадий- и никельсодержащей продукции (FeV, FeNi) и извести.
Работа выполнена в рамках проектов: № 12-П-3-1016 Программа фундаментальных исследований Президиума РАН (№ 27); Министерства образования и науки № 6.37.81. 2011.
Список литературы Разработка физико-химических и технологических основ рационального использования ванадий-никель-железо-кальцийсодержащих отходов теплоэлектростанций
- Извлечение ванадия и никеля из отходов теплоэлектростанций/Т.П. Сирина, В.Г. Мизин, Е.М. Рабинович и др.//Екатеринбург: УрО РАН, 2001. -338 с.
- Отходы теплоэлектростанций -промышленное сырье для извлечения ванадия/Б.В. Слободин, Т.И. Красненко, Б.Е. Добрынин и др.//Металлург. -2001. -№ 8. -С. 32-35.
- Комплексная переработка ванадиевого сырья: химия и технология/В.Г. Мизин, Е.М. Рабинович, Т.П. Сирина и др.//Екатеринбург: УрО РАН, 2005. -415 с.
- Регулирование пирометаллургических процессов при извлечении ванадия из промышленного сырья на основе химического моделирования оксидных ванадийсодержащих систем/Б.В. Слободин, Т.И. Красненко, Е.М. Горбунова и др.//Металлург. -2004.-№ 2.-С. 44-48.
- Оксидные ванадиевые бронзы в системах Na2O-CaO-MO-V2O5 (M = Mg, Ni)/Б.В. Слободин, Т.И. Красненко, Б.Е. Добрынин и др.//Журн. неорган. химии. -2001. -Т. 46, № 11. -С. 1922-1926.
- Слободин Б.В. Химическое моделирование образования ОВБ натрия и ванадатов при извлечении ванадия из многокомпонентного сырья/Б.В. Слободин, Т.И Красненко//XIII Всероссийское совещание по высокотемпературной химии силикатов и оксидов (Санкт-Петербург, 19-21 ноября 2002 г.): тез. докл. -СПб.: Институт химии силикатов им. И.В. Гребенщикова РАН, 2002. -С. 62.
- Сирина Т.П. Изучение взаимодействия Mg(VO3)2, Mg2V2O7, CaMgV2O7 с растворами серной кислоты и гидроксида натрия/Т.П. Сирина, А.А. Фотиев, Т.И. Красненко//VI Всесоюзное совещание по химии, технологии и применению ванадиевых соединений (Нижний Тагил, 16-18 мая 1990 г.): тез. докл. -Нижний Тагил, 1990. -С. 150-153.
- Десульфурация зол мазутных тепловых электростанций с получением комплексных ванадий-никелевых концентратов/А.В. Сирин, Т.И. Красненко, Т.П. Сирина и др.//Международный симпозиум «Порядок, беспорядок и свойства оксидов 0DP0-2006» (Сочи, 19-23 сентября 2006 г.): сб. тр. -Ростов на/Д: Изд-во Ростов. гос. ун-та, 2006. -С. 119-121.
- Десульфурация вторичного ванадиевого сырья/А.В. Сирин, Т.И. Красненко, В.Г. Мизин и др.//Металлург. -2006. -№ 11. -С. 43-46.
- Красненко Т.И. Диаграммы фазовых равновесий -основа реализации технологий переработки техногенных отходов/Т.И. Красненко//Известия Российской Академии Наук. Серия физическая. -2010. -Т. 74, № 8. -С. 1217-1220.
- Красненко Т.И. Ресурсоэкологический подход к проблеме переработки техногенных отходов мазутных теплоэлектростанций России/Т.И. Красненко//Всероссийская конференция «Исследования в области переработки и утилизации техногенных образований и отходов» (Екатеринбург, 24-27 ноября 2009): тр. Всерос. конф. с элементами школы для молодых ученых. -Екатеринбург, 2009. -С. 94-96.
- Красненко Т.И. Физико-химическая модель оптимизации качества окружающей среды в промышленной зоне теплоэлектростанций/Т.И. Красненко, В.Г. Бамбуров//Журнал «Химическая технология». -2010. -Т. 11, № 6. -С. 380-383.
- Красненко Т.И. Физико-химические основы комплексной переработки ванадийсодержащих отходов/Т.И. Красненко, В.Г. Бамбуров//IX Международное Курнаковское совещание по физико-химическому анализу: тез. докл. -Пермь, 2010. -С. 281.
- Красненко Т.И. Комплексная переработка ванадийсодержащих отходов ТЭС Урала и Сибири/Т.И. Красненко, А.Н. Чванова//Симпозиум «Уральская горная школа -регионам» (Екатеринбург, 11-12 апреля 2011 г.): сб. докл. -Екатеринбург, 2011. -С. 159-160.
- Извлечение ванадия и молибдена из концентратов и техногенных отходов/В.Г. Бамбуров, Д.С. Ленёв, Т.П. Сирина и др.//14-й Международный симпозиум «Порядок, беспорядок и свойства оксидов ОДРО-14» (п. Лоо, 14-19 сентября 2011 г.): сб. тр. -Ростов на/Д: Изд-во СКНЦ ВШ ЮФУ АПСН, 2011. -Т. 1. -С. 192-194.


