Разработка функциональной модели, описывающей влияние сигнальных белков на процесс остеоинтеграции
Автор: Баранов Сергей Романович, Лызо Татьяна Сергеевна, Корчагина Анастасия Александровна, Крылова Анна Сергеевна
Журнал: Природные системы и ресурсы @ns-jvolsu
Рубрика: Экология и биология
Статья в выпуске: 3 т.10, 2020 года.
Бесплатный доступ
Дентальная имплантация - довольно популярный метод восстановления утраченного зуба, имеющий явные преимущества, такие как долговечность, прочность, отсутствие дополнительной нагрузки на соседние зубы, а также внешняя натуральность и эстетичность имплантата. Однако, несмотря на новейшие разработки в этой сфере, проблема успешности остеоинтеграции все еще остается, а факторы ее нарушения все еще не ограничиваются только лишь ошибкой стоматолога. В этой связи следует детально изучить действия сигнальных молекул системы «имплантат - кость», чтобы иметь возможность отслеживать правильность протекания всех этапов остеоинтеграции, а возможно и контролировать их. В данной статье представлена функциональная модель с информацией о воздействии сигнальных белковых молекул на остеогенные клетки с подробным описанием действия каждой сигнальной молекулы в каждом подпроцессе остеоинтеграции. На основе собранных здесь данных, при последующих исследованиях можно будет прогнозировать успешность, качество и интенсивность остеоинтеграции. Подробный анализ приведенных здесь данных может помочь свести к минимуму неудачи в сфере дентальной имплантации. В перспективе, следует изучить возможность воздействия на процесс остеоинтеграции путем изменения экспрессии или супрессии отдельных сигнальных молекул. Немаловажно, что при такой терапии можно свести к минимуму влияние несоблюдение рекомендаций врача пациентом на процесс остеоинтеграции. Таким образом исчезнет еще один огромный пласт причин возможного отторжения имплантата.
Дентальная имплантация, дентальный имплантат, остеоинтеграция, сигнальные молекулы, остеогенные клетки
Короткий адрес: https://sciup.org/149131479
IDR: 149131479 | УДК: 576 | DOI: 10.15688/nsr.jvolsu.2020.3.1
Текст научной статьи Разработка функциональной модели, описывающей влияние сигнальных белков на процесс остеоинтеграции
DOI:
Цитирование. Баранов С. Р., Лызо Т. С., Корчагина А. А., Крылова А. С. Разработка функциональной модели, описывающей влияние сигнальных белков на процесс остеоинтеграции // Природные системы и ресурсы. – 2020. – Т. 10, № 3. – С. 5–13. – DOI:
Введение. Дентальные имплантаты имеют большое количество преимуществ перед другими вариантами замены зубов: они прочны и долговечны, не оказывают давления на соседние зубы и даже наоборот, мешают корням соседних зубов двигаться, имплантаты, как и окружающая десна, после заживления выглядят натурально, не вызывают ощущения инородного тела и не мешают речи.
История дентальной имплантации насчитывает уже не одну сотню лет, перед специалистами до сих пор остро стоит вопрос успешности этой процедуры. При всей высоко-технологичности современных имплантатов отсутствие отторжения достигается не в 100 % случаев [3]. Одним из важнейших компонентов удачной установки имплантата является полная остеоинтеграция и возникновение полноценной системы «имплантат-костная ткань». Важно знать и понимать процессы, происходящие в этой системе на молекулярном и клеточном уровнях. Многие из них уже исследованы, но источник обобщенных знаний на эту тему отсутствует.
В перспективе, следует изучить возможность воздействия на процесс остеоинтеграции путем изменения экспрессии или супрессии отдельных сигнальных молекул, подробное описание действия на остеогенные клетки которых изложен ниже.
Целью работы стоит представление относительно полной структурированной информации о воздействии сигнальных белковых молекул на остеогенные клетки в виде функциональной модели.
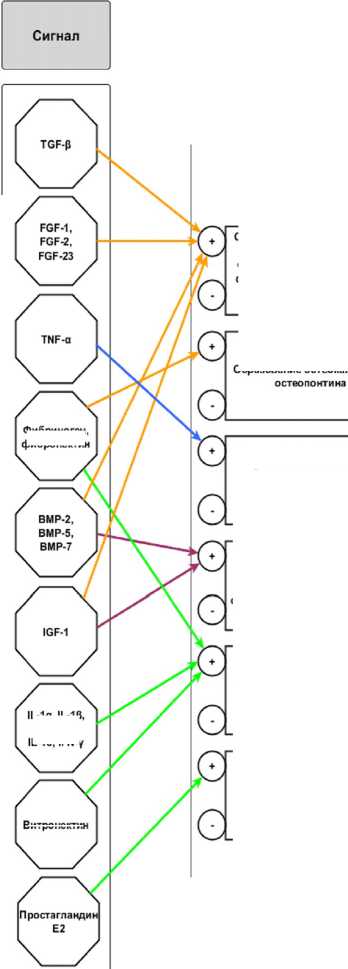
Материалы и методы исследования. Для создания представленной функциональной модели был осуществлен биоинформационный поиск в отечественных и зарубежных источниках литературы, использовались открытые и доступные ресурсы: PubMed, PubMedCentral, PDB, GeneBank, UniProtKB, НЭБ РИНЦ. Проведен сравнительный анализ статей за последние 10 лет, в которых с использованием наиболее точных современных методов было изучено влияние разных белковых сигнальных молекул на остеогенные клетки, обеспечивающие процесс остеоинтеграции. На основе наиболее полных и адекватных источников была составлена функциональная схема с подробным описанием действия каждой сигнальной молекулы в каждом подпроцессе остеоинтеграции.
В данной функциональной модели показаны основные молекулярные участники, которые запускают ответные реакции остеогенных клеток. Так же отражены подпроцессы – составляющие части единого процесса остеоинтеграции:
-
• дифференцировка и пролиферация остеобластов;
-
• дифференцировка и пролиферация остеокластов;
-
• синтез и минерализация экстрацеллюлярного матрикса кости;
-
• резорбция экстрацеллюлярного матрикса кости.
Каждый из этих процессов запускается под действием факторов, которые взаимодействуют с определенными рецепторами на поверхности остеогенных клеток.
Результаты
Все представленные белки регулируют происходящие в кости процессы и составляют общую систему, контроль над которой позволит более эффективно внедрять дентальные имплантаты. В общем, целостность и правильное функционирование кости зависит от баланса между двумя типами клеток, участвующих в процессе ремоделирования кости – остеобластов и остеокластов. Первые формируют кости, вторые – резорбируют. В рамках представленной темы следует подробнее рассмотреть такие основные процессы, как дифференцировка и пролиферация остеобластов и остеокластов, а также синтез, минерализацию и резорбцию экстрацеллюлярного матрикса кости.
В процессе дифференцировки и пролиферации остеобластов участвуют такие белки, как трансформирующий фактор роста (TGF-в), костные морфогенетические белки (BMP-2, ВМР-5, BMP-7), факторы роста фибробластов (FGF-1, FGF-2, FGF-23), инсулиноподобный фактор роста (IGF-1), а также фибриноген и фибронектин (см. рисунок) [1].
Ауто- и паракринная стимуляция белком TGF-в в целом важна для поддержания и размножения мезенхимальных прогениторных клеток, предшествующих остеобластам. Известно, что изоформы TGF- p и их рецепторы (I типа: TGF p RI и ALK5; II типа: TGF p RII и Tgfbr2), играют важную роль в эндохондральном и внутримембранозном окостенении. TGF- р посредством селективных путей MAPK и Smad2/3 и в связке с PTH, Wnt и BMP передает сигнал, чем способствует пролиферации остеопрогениторов и их ранней дифференцировке в остеобласты [2].
BMP – многофункциональные ростовые факторы, принадлежащие к суперсемейству р -трансформирующего фактора роста – действуют на рецепторы клеточной мембраны и играют значительную роль в регулировании роста, дифференцирования и апоптоза различных типов клеток, в том числе и остеобластов. Во организме они поддерживают процесс костеобразования. BMP-2 значительно увеличивает остеокальцин, а его кратковременная экспрессия необходима и достаточна для необратимой индукции формирования кости. BMP2
может высвобождаться стабильно и индуцирует клетки MC3T3-E1 для эффективной дифференцировки в остеобласты. Этот процесс характеризуется значительно повышенной экспрессией отложений кальция, щелочной фос- фатазы, связанного RUNX2, остеопонтина, остеокальцина и коллагена 1 [6]. BMP-7 индуцирует экспрессию маркеров остеобластной дифференцировки, таких как активность ALP и ускоренную минерализацию кальция. Однако, ге-
Образование остеокальцина,
Ответная реакция со стороны клеток костной ткани
Витронектин
Образование со15а1, соИ 1а1; присутствие маркеров остеогенеза: alpl (щелочная фосфатаза), остеокальцина, остеопонтина, костного сиалопротеина
Активация фосфолипазы А
Экспрессия маркеров транскрипции TRAIL, OPG
Образование соИ а1, со11а2, стеокальцина, щелочной фосфатазы, гидроксиаппатита
Синтез металлопротеи-наз (ММР-8, ММР-9), образование Т артрат-резистентной кислой фосфатазы (АСР-5),
Маркеры изменений в системе
Фибриноген, фибронектин
IL-1Q, IL-1 р. IL4, IL-6, IL-10, IFN-v
Количество остеобластов
Количество остеобластов на сетке фибрина
Плотность и количество остеокластов
Плотность и количество костной ткани;
количество остеоцитов;
Толщина остеоинтегративной
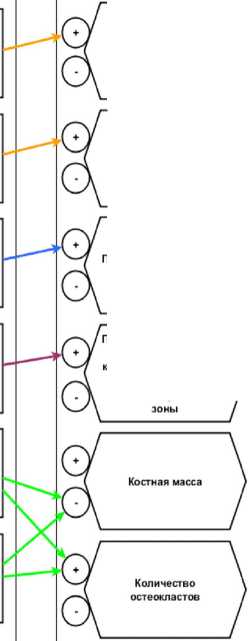
Q Оранжевым цветом отмечены явления, происходщие при дифференцировке и пролиферации остеобластов.
Синим цветом отмечены явления, происходщие при дифференцировке и пролиферации остеокластов.
А Фиолетовым цветом отмечены явления, происходщие при синтезе и минерализации матрикса кости.
Q Зелёным цветом отмечены явления, происходщие при резорбции экстрацеллюлярного матрикса кости.
Функциональная модель, описывающая влияние сигнальных белков на процесс остеоинтеграции
нетические исследования in vivo с использованием модели Prx1-cre показали, что отсутствие локально продуцируемого BMP-7 не влияет на постнатальный рост конечности и поддержание костной массы, указывая на то, что другие представители семейства BMP, присутствующие во взрослой кости, достаточны для компенсации отсутствия BMP-7 [2].
Сигналы семейства FGF, с избыточной передачей сигналов цитокинов меньшим количеством рецепторов, регулируют формирование кости и активно индуцируют дифференцировку остеобластов. FGF обычно связаны с гепарином: две или более молекулы необходимы для активации димерных рецепторов [16]. FGF-2, например, имеет 2 изоформы с высокой (HMWFGF2) и низкой (LMWFGF2) молекулярными массами. LMWFGF2 способствует минерализации костей, действуя локально для увеличения пролиферации и дифференцировки остеобластов. Действию LMWFGF2 противостоит изоформа HMWFGF2, которая функционирует в ядре как активатор транскрипции в комплексе с FGFR1. Основной эффект HMWFGF2 заключается в экспрессии генов ингибиторов минерализации: FGF23 и Sost. LMWFGF2 стимулирует экспрессию BMP2 и может выполнять синергетические функции во время активации линии остеобластных клеток [5].
Инсулиноподобный фактор роста 1 (IGF-1) увеличивает экспрессию коллагена I типа через посттранскрипционный и трансляционнозависимый механизм, включающий передачу сигналов PI3K / Akt / p70S6k. В результате этого увеличивается скорость синтеза коллагена и его внеклеточного накопления. Таким образом, IGF-1 участвует как в дифференцировке и пролиферации остеобластов, так и в синтезе и минерализации экстрацеллюлярного матрикса кости [10].
Фибриноген опосредует значительный потенциал остеоиндукции. Фибриноген связывается с поверхностным интегрином ( α 9 β 1) для экспрессии гена RUNX2 через сигнальный путь SMAD1/5/8. Сигнальная ось фибриноген- α 9 β 1-SMAD1/5/8-RUNX2 может эффективно индуцировать остеогенную дифференцировку. Индуцированные фибриногеном остеогенные клетки сохраняют способность экспрессировать типичные зрелые остеобластные маркеры [7].
Фибронектин обладает двумя изоформами: изоформа, характеризующаяся наличием экстрадомена А, активирует интегрин α 4 β 1 и усиливает дифференцировку остеобластов, а изоформа, содержащая экстрадомен В, усиливает связывание фибронектина через последовательность RGD с β 3-содержащим ин-тегрином, что приводит к увеличению минерализации и дифференциации остеобластов [8].
В процессе дифференцировки и пролиферации остеокластов участвует фактор некроза опухоли (TNF- α ). TNF- α известен как ингибитор дифференцировки остеобластов (хотя при некоторых обстоятельствах он может индуцировать и остеобластогенез) и активатор остеокластогенеза. TNF- α передает сигналы через NF- κ B и митоген-активи-руемые протеинкиназы (MAPK). Активация остеокластов приводит к чрезмерной системной и локальной потере костной массы [15]. TNF- α также вызывает экспрессию маркеров транскрипции TRAIL и OPG. TRAIL (TNF-связанный апоптоз-индуцирующий лиганд) индуцирует апоптоз, связываясь с рецепторами смерти TRAIL-R1 и -R2 [13]. OPG (остеопротегерин) участвует в устойчивости к TRAIL-индуцированному апоптозу в злокачественных клетках.
В процессе синтеза и минерализации экстрацеллюлярного матрикса кости участвуют белки группы BMP и инсулиноподобный фактор роста 1 (IGF-1), роль которых в данном процессе уже была рассмотрена выше.
В процессе резорбции экстрацеллюлярного матрикса кости участвуют белки интерлейкины (1 α , 1 β , 4, 6, 10), интерферон γ (IFN- γ ), фибриноген, фибронектин, витронектин и простагландин Е2.
IL-1 представляет собой мощный цитокин, который может вызывать эрозию кости в местах воспаления посредством активации остеокластов [21]. IL-1 индуцирует остеок-ласт-специфическую экспрессию генов посредством активации MITF, таким образом активируя зрелые остеокласты, тем самым усиливая резорбцию кости. IL-6 усиливает остеоцитарную опосредованную остеокласти-ческую дифференцировку путем активации JAK2 и RANKL [9]. IL-4 и IL-10 ингибируют остеокластогенез, тем самым играя роль в модуляции потери костной массы при воспа- лительных заболеваниях, оказывая взаимное действие на дифференцировку остеокластов и макрофагов от их общего предшественника [18]. Во всех процессах образуется специфические маркеры резорбции: тартрат-рези-стентная кислая фосфатаза (ACP-5), высвобождаемая остеокластами во время резорбции кости [11], матриксная металлопротеиназа 9 (Mmp9), катепсин K (Ctsk) [19].
Действие интерферона γ обладает некой двойственностью. С одной стороны, IFN- γ подавляет остеокластогенез за счет деградации фактора 6, связанного с рецептором фактора некроза опухолевого белка адаптера RANK (TRAF6) и индукции апоптоза взаимодействием лиганда Fas-Fas. С другой, IFN- γ стимулирует антиген-зависимую активацию Т-клеток и продукцию остеокластогенных факторов RANKL и TNF- α . Однако, in vivo суммарный эффект этих двух противоположных качеств IFN- γ смещен в сторону ускорения резорбции кости [17].
Исследования in vitro показали, что иммобилизованный фибриноген может усиливать дифференцировку моноцитов в остеокласты, специализированную воспалительную клетку, которая индуцирует резорбцию кости, опосредованную RANK / RANKL [12].
Фибронектин активирует интегрин α v β 3, необходимый в остеокластах для образования актиновых колец in vitro и раздраженных мембран in vivo. Тем самым фибронектин контролирует правильность резорбции кости, ингибируя ее [8].
Основной производный от витронектина пептид (VnP-16) ингибирует резорбцию кости, ограничивая JNK-c-Fos-NFATc1-индуциро-ванную дифференцировку остеокластов и α v β 3 интегрин-c-Src-PYK2-опосредован-ная резорбтивная функция [4].
Простагландин E2 (PGE2) вырабатывается в кости в основном остеобластами и стимулирует резорбцию кости [14], играя важную роль в развитии TRAP-положительных остеокластов [20].
Заключение. Составленная функциональная модель дает понимание основных молекулярных и клеточных процессов остеоинтеграции, а представленная информация позволяет более глубоко изучить их. На основе собранных здесь данных, при последую- щих исследованиях можно будет прогнозировать и, возможно, улучшать успешность, качество и интенсивность остеоинтеграции.
Список литературы Разработка функциональной модели, описывающей влияние сигнальных белков на процесс остеоинтеграции
- Морфологичесукие особенности остеоинтеграции при использовании титановых имплата-тов с биоактивным покрытием и рекомбинантного костного морфогенетического белка / В. В. Ново-чадов, Н. М. Гайфуллин, А. С. Карягина [и др.] // Морфология. - 2016. - Т. 149, № 1. - С. 77-84.
- Новочадов, В. В. Модели управления в дентальной имплатологии. / В. В. Новочадов, А. О. Зе-кий, А. А. Широкий // Управление развитием крупномасштабных систем. - 2018. - С. 475-478.
- Остеоинтеграция имплантатов с биоактивной поверхностью, модифицированной напылением хитозана в эксперименте у крыс / В. В. Новочадов, Н. М. Гайфуллин, Д. А. Залевский [и др.] // Российский медико-биологический вестник имени академика И.П. Павлова. - 2013. - Т. 1, №2. - С. 30-35. -DOI: https://doi.org/10.17816/PAVL0VJ2013230-35.
- A vitronectin-derived peptide reverses ovariectomy-induced bone loss via regulation of osteoblast and osteoclast differentiation / S. K. Min, H. K. Kang, S. Y. Jung [et al.] // Cell death and differentiation. - 2018. - Vol. 25, № 2. - P. 268-281. -DOI: https://doi.org/10.1038/cdd.2017.153.
- Coffin, J. D. Fibroblast Growth Factor 2 and Its Receptors in Bone Biology and Disease / J. D. Coffin, C. Homer-Bouthiette, M. M. Hurley // Journal of the Endocrine Society. - 2018. - Vol. 7, № 2. -P. 657-671. -DOI: https://doi.org/10.1210/js.2018-00105.
- Fibrin Glue/Fibronectin/Heparin-Based Delivery System of BMP2 Induces Osteogenesis in MC3T3-E1 Cells and Bone Formation in Rat Calvarial Critical-Sized Defects / Q. A. S. Wang, Q. He, H. Ten [et al.] // ACS Appl Mater Interfaces. - 2020. - Vol. 12, № 11. - P. 13400-13410. - DOI: https://doi.org/10.1021/ acsami.0c01371.
- Fibrinogen Induces RUNX2 Activity and Osteogenic Development from Human Pluripotent Stem Cells / F. Kidwai, J. Edwards, L. Zou [et al.] // Stem cells. - 2016. - Vol. 34, № 8. - P. 2079-2089. - DOI: https://doi.org/10.1002/stem.2427.
- Fibronectins containing extradomain A or B enhance osteoblast differentiation via distinct integrins. / C. Sens, K. Huck, S. Pettera [et al.] // The Journal of biological chemistry. - 2017. - Vol. 292, № 19. - P. 77457760. - DOI: https://doi.org/10.1074/jbc.M116.739987.
- IL-6 Enhances Osteocyte-Mediated Osteoclastogenesis by Promoting JAK2 and RANKL Activity In Vitro / Q. Wu, X. Zhou, D. Huang [et al.] // Cellular physiology and biochemistry : international journal of experimental cellular physiology, biochemistry, and pharmacology. - 2017. - Vol. 41, № 4. - P. 1360-1369. - DOI: https://doi.org/10.1159/ 000465455.
- Insulin-like growth factor-1 increases synthesis of collagen type I via induction of the mRNA-binding protein LARP6 expression and binding to the 5' stem-loop of COL1a1 and COL1a2 mRNA / C. D. Blackstock, Y. Higashi, S. Sukhanov [et al.] // The Journal of biological chemistry. - 2014. - Vol. 289, № 11. - P. 7264-7274. - DOI: https://doi.org/10.1074/ jbc.M113.518951.
- Kirstein, B. Secretion oftartrate-resistant acid phosphatase by osteoclasts correlates with resorptive behavior / B. Kirstein, T. J. Chambers, K. Fuller // Journal of cellular biochemistry. - 2006. - Vol. 98, № 5. -P. 1085-1094. - DOI: https://doi.org/10.1002/jcb.20835.
- Luyendyk, J. P. The multifaceted role of fibrinogen in tissue injury and inflammation / J. P. Luyendyk, J. G. Schoenecker, M. J. Flick // Blood. -2019. - Vol.133, № 6. - P. 511-520. - DOI: https:// doi.org/10.1182/blood-2018-07-818211.
- Modulation of tumor necrosis factor related apoptosis-inducing ligand (TRAIL) receptors in a human osteoclast model in vitro / S. McManus, E. Chamoux, M. Bisson [et al.] // Apoptosis. - 2011. -Vol. 17, № 2. - P. 121-131. - DOI: https://doi.org/ 10.1007/s10495-011-0662-5.
- Ohshiba, T. Role of prostaglandin E produced by osteoblasts in osteolysis due to bone metastasis / T. Ohshiba, C. Miyaura, A. Ito // Biochemical and Biophysical Research Communications. - 2003. -Vol. 300, № 4. - P. 957-964. - DOI: https://doi.org/ 10.1016/s0006-291x(02)02937-6.
- Osta, B. Classical and Paradoxical Effects of TNF-a on Bone Homeostasis / B. Osta, G. Benedetti, P. Miossec // Frontiers in immunology. - 2014. - Vol. 5, №48. - P. 1-9. - DOI: https://doi.org/10.3389/ fimmu.2014.00048.
- Osteoblast Differentiation and Bone Matrix Formation In Vivo and In Vitro / H. C. Blair, Q. C. Larrouture, Y. Li [et al.] // Tissue engineering. -2017. - Vol. 2, № 23. - P. 268-280. - DOI: https://doi.org/ 10.1089/ten.TEB.2016.0454.
- Osteoclast-Primed Foxp3+ CD8 T Cells Induce T-bet, Eomesodermin, and IFN-y To Regulate Bone Resorption / E. V. Shashkova, J. Trivedi, A. B. Cline-Smith [et al.] // Journal of immunology. - 2016. -Vol. 197, № 3. - P. 726-735. - DOI: https://doi.org/ 10.4049/jimmunol. 1600253.
- Owens, J. M. IL-10 modulates formation of osteoclasts in murine hemopoietic cultures / J. M. Owens, A. C. Gallagher, T. J. Chambers // Journal of immunology. - 1996. - Vol. 157, № 2. - P. 936-940. - DOI: https://doi.org/10.1155/2013/181849.
- Palmitoleic Acid Inhibits RANKL-Induced Osteoclastogenesis and Bone Resorption by Suppressing NF-kB and MAPK Signalling Pathways. / B. van Heerden, A. Kasonga, M.C. Kruger [et al.] // Nutrients. - 2017. - Vol. 9, №> 5. - P. 441. - DOI: https:// doi.org/10.3390/nu9050441.
- Raisz, L.G. Prostaglandins and bone: physiology and pathophysiology / L.G. Raisz // Osteoarthritis and cartilage. - 1999. - Vol. 7, № 4. -P. 419-421. - DOI: https://doi.org/10.1053/ joca.1998.0230.
- The mechanism of osteoclast differentiation induced by IL-1 / J. H. Kim, H. M. Jin, K. Kim [et al.] // Journal of immunology. -2009. - Vol. 183, №> 3. -P. 18621870. - DOI: https://doi.org/10.4049/jimmunol.0803007.


