Разработка и характеристика трехмерных клеточных моделей солидных опухолей для индивидуализации лечения онкологических больных
Автор: Данилова Анна Борисовн, Нехаева Татьяна Леонидовна, Ефремова Наталья Александровна, Майдин Михаил Александрович, Федорос Елена Ивановна, Балдуева Ирина Александровна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.20, 2021 года.
Бесплатный доступ
Введение. Для решения задач персонализированной медицины в онкологии важным становится этап предклинических исследований, основанный на использовании трехмерных клеточных моделей опухолей in vitro, в том числе сфероидов/тумороидов, которые представляют собой интересный инструмент для генетических, эпигенетических, биомедицинских и фармакологических исследований с целью определения наиболее эффективного индивидуального терапевтического подхода, так как позволяют моделировать динамическую эволюцию опухолевого заболевания от ранних стадий до метастатического распространения через взаимодействие с микроокружением. Цель исследования - провести сравнительные исследования особенностей формирования и пространственной организации сфероидов, полученных из клеток солидных злокачественных новообразований различного гистогенеза: меланом (МК), сарком мягких тканей и остеогенных сарком (СМТ/ОС), эпителиальных опухолей (ЭОп). Материал и методы. Основой для создания 3D-клеточных моделей служили культуры клеток солидных опухолей пациентов, которые проходили лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» в 2015-21 гг. Фрагменты опухолевой ткани были получены интраоперационно: 15 образцов МК, 20 - СМТ/ОС и 9 -ЭОп. Все опухолевые клетки культивировали не менее 10 пассажей. Для изучения сфероидов были использованы методы фазовой контрастной, конфокальной микроскопии, гистологическая техника. С помощью методов ИФА и мультиплексного анализа были изучены супернатанты монослойных клеточных культур и сфероидов на предмет присутствия широкого спектра биологически активных веществ, обеспечивающих процессы иммуносупрессии, инвазии и метастазирования. результаты. Использование низкоадгезивных поверхностей оказалось предпочтительным для получения сфероидов заданной посевной концентрации и интересующего размера. Среднее время культивирования сфероидов составило 4,7 сут, оптимальная посевная концентрация - 10 000 клеток на лунку, при этом диаметр сфероида варьировал от 300 до 1 000 мкм в зависимости от типа злокачественных клеток: самые крупные сфероиды формировали культуры МК. В целом эффективность образования сфероидов составила 88,6 % (39 из 44). Введение в 3D-конструкцию фибробластов приводило к усилению инвазивного потенциала опухолевых клеток, который был ассоциирован с продукцией IL8 (rho=0,636, p=0,035), HGF (rho=0,850, p=0,004), SCF (rho=0,857, p=0,014), FST (rho=0,685, p=0,029), Prolactin (rho=0,810, p=0,015), PECAM1 (rho=0,788, p=0,004). Заключение. Технология низкоадгезивных поверхностей позволяет успешно создавать трехмерные модели опухолевого узла из клеток злокачественных новообразований различного гистогенеза. Заселение трехмерной конструкции фибробластами усиливает биологически агрессивные свойства опухолевых клеток и демонстрирует сложные реципрокные взаимодействия между клеточными элементами стромы опухоли и малигнизированными клетками, что приближает модель к реальной клинической ситуации.
Солидные опухоли, сфероиды, тумороиды, инвазивный потенциал, персонализированная медицина
Короткий адрес: https://sciup.org/140261358
IDR: 140261358 | УДК: 616-006-08:576.385 | DOI: 10.21294/1814-4861-2021-20-5-58-74
Текст научной статьи Разработка и характеристика трехмерных клеточных моделей солидных опухолей для индивидуализации лечения онкологических больных
Методы лечения онкологических заболеваний стремительно развиваются в направлении персонализированной медицины, которая базируется на анализе индивидуальной молекулярной и генетической изменчивости злокачественных новообразований. Новые клеточные модели опухолей in vitro , основанные на культивировании малигнизированных клеток в трехмерном формате, могут быть полезным инструментом для генетических, эпигенетических, биомедицинских и фармакологических исследований с целью определения наиболее эффективного индивидуального терапевтического подхода, так как позволяют моделировать динамическую эволюцию опухолевого заболевания от ранних стадий до метастатического распространения через взаимодействие с микроокружением [1].
Основное преимущество опухолевых 3D-культур состоит в том, что они могут быть созданы как индивидуальные модели солидных опухолей пациентов, которые лишены недостатков традиционных 2D-монослойных культур, потому что имитируют нативную гистологическую архитектуру, процессы клеточной гетерогенности и взаимодействия клеток с внеклеточным матриксом. Считается, что трехмерные культуры более точно отражают фенотипическое поведение исходных опухолей, чем обычные 2D-культуры злокачественных клеток, что позволяет преодолеть разрыв между доклиническими и клиническими исследованиями, предоставив соответствующую модель злокачественных опухолей человека in vitro , которую можно использовать для тестирования лекарств и изучения механизмов опухолевой диссеминации [2].
Идеальная трехмерная модель для изучения биологии злокачественных новообразований должна воспроизводить структуру опухолевой ткани и ее патофизиологическое микроокружение, в котором опухолевые клетки демонстрируют свойства, присущие исходной ткани in vivo , такие как пролиферация, дифференцировка, подвижность, синтетическая активность [3]. Солидные опухоли развиваются в результате взаимодействия между множеством клеточных и неклеточных компонентов, при этом реализуются механизмы, подобные тем, что обнаружены на ранних стадиях эмбриогенеза [4]. В тканях солидных опухолей присутствуют пролиферативные и метаболические градиенты, что приводит к неоднородному ответу на лечение [2, 5]. Опухолевые клетки in vivo окружены другими клетками различных типов (клетками иммунной системы, опухолевой стромы, эндотелиальными клетками) и внеклеточными компонентами, такими как внеклеточный матрикс, внеклеточные везикулы, факторы роста, цитокины и др., которые составляют микроокружение опухоли [4, 6]. Существует несколько методов «сборки» клеточных 3D-моделей in vitro с учетом особенностей организации злокачественных новообразований для имитации субоптимальных условий роста in vivo и для углубленного изучения многогранных особенностей динамического микроокружения опухоли. Одной из таких моделей являются многоклеточные сфероиды или тумороиды, которые представляют собой самособирающиеся модели, возникающие за счет клеточной агрегации и взаимодействия клеток между собой [7]. Трехмерное моделирование в виде сфероидов широко используется при солидных опухолях эпителиального происхождения, таких как рак молочной железы (РМЖ), легких, предстательной железы, толстой кишки [2]. Менее разработаны эти модели для меланомы кожи и сарком мягких тканей [8].
Интерес к трехмерному моделированию для изучения свойств злокачественных новообразований возник достаточно давно, однако все еще необходима более подробная и обширная характеристика и валидация сфероидов как 3D-моделей для изучения различных онкологических заболеваний, чтобы понять, насколько они близки по биологическим свойствам к малигнизированным тканям in vivo , в том числе по структуре, кинетике роста, экспрессии генов, архитектуре сигнальных каскадов и ответу на лекарственную терапию [9, 10]. Кроме того, использование 3D-моделей для определения индивидуальной тактики лечения пациентов позволит учитывать все важные характеристики опухоли. Такой подход будет способствовать изучению индивидуальных биологических особенностей опухолей и пониманию биологии рака в целом.
Цель исследования – провести сравнительные исследования особенностей формирования и пространственной организации сфероидов, по- лученных из клеток солидных злокачественных новообразований различного гистогенеза: меланом (МК), сарком мягких тканей и остеогенных сарком (СМТ/ОС), эпителиальных опухолей (ЭОп).
Материал и методы
Основой для создания 3D-клеточных моделей служили культуры клеток солидных опухолей пациентов, которые проходили лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» в 2015–21 гг. Фрагменты опухолевой ткани были получены интраоперационно: 15 образцов меланомы кожи (МК); 20 – сарком мягких тканей и остеогенных сарком (СМТ/ОС): 7 – остеогенной саркомы, 1 – хондробластической остеосаркомы, 4 – синовиальной саркомы, 3 – миксофибросаркомы, 1 – плеоморфной липосаркомы, 1 – эмбриональной рабдомиосаркомы, 1 – лейомиосаркомы, 1 – альвеолярной саркомы, 1 – шванномы; 9 – эпителиальных опухолей (ЭОп): 3 – колоректального рака, 2 – рака почки, 2 – рака молочной железы, 1 – немелкоклеточного рака легкого, 1 – рака мочевого пузыря (табл. 1). Протокол исследования был одобрен этическим комитетом НМИЦ онкологии им. Н.Н. Петрова, от всех пациентов было получено информированное согласие, а образцы тканей хранили в соответствии с принципами Хельсинкской декларации и использовали в соответствии с Законом о тканях человека от 2004 г.
Монослойные клеточные культуры
После механической дезагрегации тканевых образцов в Медимашине (Dako) клеточную суспензию пропускали последовательно через систему фильтров Filcon 70 и 50 мкм (BD Bioscience, США), после чего помещали в полную питательную среду DMEM/F12, содержащую 20 % сыворотки эмбрионов крупного рогатого скота (СЭКРС), глутамин (365 мг/л), инсулин (5 мкг/мл), трасферрин (5 мкг/мл), селен (5 нг/мл) (Invirtrogen, США), пенициллин (100 eд/мл), стрептомицин (100 мкг/мл) (Sigma, США), и непрерывно культивировали при 5 % CO2, 100 % влажности в пластиковых флаконах (BD Bioscience, США) по методу Freshney [11] с собственными модификациями [12]. После достижения монослоя клетки пересевали, используя раствор, состоящий из равных долей 0,25 % трипсина и 0,02 % версена (Биолот, РФ). Культуры опухолевых клеток были получены во всех случаях, клетки культивировали непрерывно не менее 10 пассажей.
Опухолевые сфероиды
Для получения сфероидов использовали две технологии: 1) метод культивирования на низкоадгезивных поверхностях (Liquid overlay technique) с использованием 96-луночных планшет Ultra-Low Attachment Surface (Corning, США). Клетки помещали в лунки планшета в посевной концентра- таблица 1/table 1 Гистологическая верификация и локализация образцов меланомы кожи, сарком мягких тканей, остеогенных сарком, эпителиальных опухолей, из которых были получены клеточные линии histological verification and localization of skin melanoma, soft tissue sarcoma, osteogenic sarcoma and epithelial tumors from which cell lines were derived
Приготавливали сфероиды двух типов. Для формирования гомосфероидов использовали один тип культуры опухолевых клеток в различных по- севных концентрациях – 1000, 3000, 5000 клеток/ сфероид. Для формирования гетеросфероидов вводили дополнительно клетки культуры фибробластов легкого эмбриона человека FLECH в разных соотношениях: 80 % (опухолевые клетки)/20 % (фибробласты), 70/30 %, 50/50 % в посевной концентрации – 10000 клеток/сфероид.
Наблюдение за формированием и ростом сфероидов вели с помощью инвертированного микроскопа Zeiss Primo Vert (Zeiss, ФРГ). Для визуализации процесса интеграции фибробластов в опухолевые сфероиды последние были окрашены с помощью реагентов Vybrant® CFDA SE Cell Tracer Kit (Invitrogen, США). В этом случае наблюдение вели с использованием флуоресцентного микроскопа ZOE (Bio-Rad, США).
Конфокальная микроскопия
Для изучения структуры сфероидов были использованы методы конфокальной микроскопии. Сфероиды фиксировали с помощью 10 % забуфе-ренного формальдегида и оставляли в холодильнике при температуре 4 ºС на 24 ч. Затем производили окрашивание флуоресцентными красителями Phalloidin–Alexa488/PI в концентрации 2 мкМ и 4 мкМ соответственно [13]. После инкубации c красителями сфероиды отмывали в фосфатно-солевом буфере, заключали в глицерин и получали изображения с помощью конфокального микроскопа Zeiss LSM 710 (Zeiss, ФРГ), при этом осуществляли просмотр по двум каналам + Z-stack на объективе x40 (Plan-Apochromat 40×/1.4). Время экспозиции составляло 100–200 мсек, используемые фильтры Phalloidin-Аlexa 488 – 488 нм, для PI – 546 нм. Полученные изображения анализировали с помощью ZEN Microscope Software 2.1 на Windows7-64-bit (Zeiss, ФРГ).
Гистологическая техника
Cфероиды фиксировали с помощью 10 % забу-ференного раствора формальдегида при температуре 4 °С в течение 24–36 ч. Далее помещали в 4 % агар-агар (Difco, США), обезвоживали абсолютным изопропиловым спиртом и заливали в парафин (Гистомикс, Биовитрум, РФ). Из парафиновых блоков изготавливали серийные срезы толщиной не более 4 мм с помощью микротома SM2000R (Leica, ФРГ). Для детекции объектов каждый десятый срез был окрашен гематоксилином Майера и эозином.
Инвазия опухолевых клеток
Гомо- и гетеросфероиды были исследованы в режиме реального времени для изучения инвазивных свойств опухолевых клеток в трехмерном пространстве с использованием автоматической аналитической системы Cell-IQ® (CM Technologies Oy, Финляндия). В качестве трехмерной матрицы был использован Матригель (Corning, CША). Готовый раствор матригеля в соотношении 1:4 к полной питательной среде переносили в лунки 96-луноч-ного планшета, куда затем помещали сфероиды. Осуществляли контроль за распространением сфероида в матригеле в течение 48 ч с помощью программного обеспечения Cell-IQ® Imagen™ (CM Technologies Oy, Финляндия). Оценивали изменение занимаемой сфероидом площади и его диаметра с помощью программного обеспечения Cell-IQ® Analyser™ (CM Technologies Oy, Финляндия), которое автоматизирует процесс количественного измерения нескольких параметров клеток на основе фазового контраста.
Мультиплексный анализ
Для исследований использовали измерительную систему мультиплексного анализа Bio-Plex® 200 (Bio-Rad, США) с программным обеспечением
Bio-Plex Manager™ v. 6.1 (Bio-Rad, США) и вспомогательные приборы: промывающее устройство Bio-Plex Pro™ II Wash Station (Bio-Rad, США); инкубатор-шейкер Cobas EIA Incubator (Roche, Швейцария). В работе были использованы наборы реагентов Bio-Plex Pro™ Human Cancer Biomarker Panel 2, 18-plex и Bio-Plex Pro™ Human Chemokine Panel, 40-Plex (Bio-Rad, США), позволяющие определять в биологических жидкостях следующие аналиты: растворимый рецептор эпидермального ростового фактора (sEGFR), фактор роста фибробластов (FGF-basic), Follistatin, гранулоцитарный колониестимулирующий фактор (G-CSF), фактор роста гепатоцитов (HGF), Leptin, Osteopontin, тромбоцитарный фактор роста (PDGF-AB/BB), молекулы клеточной адгезии PECAM-1, Prolactin, фактор роста стволовых клеток (SCF), растворимый тирокиназный рецептор sTIE-2, растворимые рецепторы сосудистого эндотелиального фактора роста 1 и 2 (sVEGFR-1, -2), гранулоцитарномакрофагальный колониестимулирующий фактор GM-CSF, фактор некроза опухолей TNF-α, основные цитокины и хемокины: 6Ckine/CCL21, BCA-1/CXCL13, CTACK/CCL27, ENA-78/CXCL5, Eotaxin/CCL11, Eotaxin-2/CCL24, Eotaxin-3/ CCL26, Fractalkine/CX3CL1, GCP-2/CXCL6, Gro-α/ CXCL1, Gro-β/CXCL2, I-309/CCL1, IFN-ϒ, IL-1β, IL-2, IL-4, IL-6, IL-8/CXCL8, IL-10, IL-16, IP-10/ CXCL10, I-TAC/CXCL11, MCP-1/CCL2, MCP-2/ CCL8, MCP-3/CCL7, MCP-4/CCL13, MDC/CCL22, MIF, MIG/CXCL9, MIP-1α/CCL3, MIP-1δ/CCL15, MIP-3α/CCL20, MIP-3β/CCL19, MPIF-1/CCL23, SCYB16/CXCL16, SDF-1α+β/CXCL12, TARC/ CCL17, TECK/CCL25. Производили измерение концентрации исследуемых веществ в надосадочной жидкости культур клеток.
Статистическая обработка
Проводили статистическую обработку данных с использованием W-критерия Уилкоксона для связных выборок. Различия считали статистически значимыми при p<0,05. Хранение, обработку, статистический анализ данных и визуализацию результатов осуществляли с использованием Microsoft Excel 2019 (Microsoft Corporation, США) и с помощью R v. 4.0.1. [14].
Результаты
После дезагрегации опухолевых фрагментов были получены 15 культур МК, 20 культур СМТ/ ОС, 9 культур клеток ЭОп, как описано в разделе «Материал и методы». Большая часть (75 %) образцов имела метастатическое происхождение (33/44), 11,4 % были получены из первичной (5/44), 13,6 % – из рецидивной опухоли (6/44). Морфологически все выделенные опухолевые клетки, культивируемые в виде монослоя, отличались высокой гетерогенностью, в том числе в пределах одного гистологического типа (рис. 1–3).
Для поиска оптимальных условий формирования сфероидов в результате апробации двух технологий: метода «висячей капли» и метода низкоадгезивных поверхностей – было продемонстрировано, что оба метода позволяют получать сфероиды заданной посевной концентрации и интересующего размера (табл. 2). Однако использование низкоадгезивных поверхностей оказалось предпочтительным, так как технология была проще в исполнении и обладала хорошей воспроизводимостью.
За время культивирования наблюдались в основном три стадии формирования тумороидов: 24–48 ч на дне капли или лунки опухолевые клетки образовывали дискообразные структуры, которые на 3-и сут объединялись в нестабильные клеточные агрегаты с неровными краями, разрушающиеся при любом физическом воздействии. На 3–5-е сут агрегаты набирали клеточную массу и формировали более или менее плотный округлый сфероид, часто имеющий ровную, хорошо очерченную краевую поверхность. Время культивирования сфероидов методом «висячей капли» составило в среднем 6,2 (4–9) сут, тогда как время культивирования методом низкоадгезивных поверхностей – 4,7 (3–7) сут. Большинство культур сфероидов после 10-х сут подвергалось распаду. Пределы стартовой посевной концентрации для всех исследованных культур варьировали от 3 000 до 5 000 клеток на каплю и от 3 000 до 40 000 клеток на лунку планшета. В 39 (88,6 %) случаях удалось получить сфероиды, с которыми можно было про-
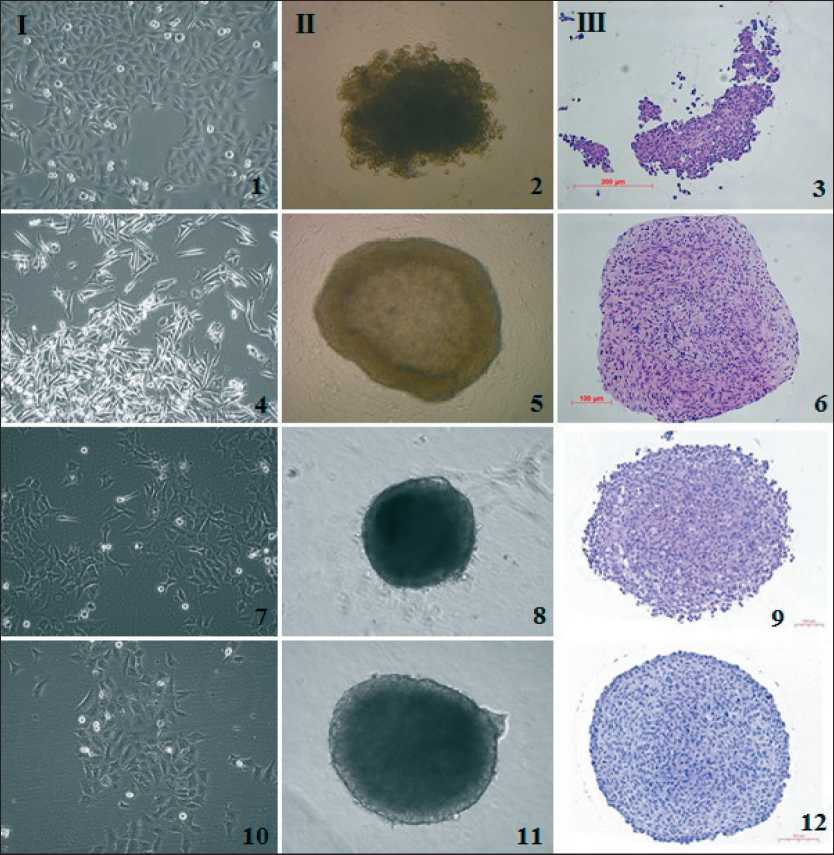
Рис. 1. Создание тумороидов из культивируемых клеток меланомы кожи:
I – монослойные культуры; II – трехмерные культуры; III – гистологические препараты тумороидов, окраска гемалауном Майера и эозином. I, II – прижизненные изображения, инвертированный микроскоп, фазовый контраст; III – световой микроскоп.
1, 2, 3 – культура #311, 36 пассаж; 4, 5, 6 – культура #860, 35 пассаж; 7, 8, 9 – культура #912, 25 пассаж; 10, 11, 12 – культура #929, 51 пассаж
Fig. 1. Tumoroids creation from cultured skin melanoma cells. I – monolayer cultures, II – three-dimensional cultures, III – histological specimens of tumoroids stained with Meyer’s hematoxylin and eosin. I, II – in vivo images, inverted microscope, phase contrast; III – light microscope. 1, 2, 3 – culture #311, 36 passage; 4, 5, 6 – culture #860, 35 passage; 7, 8, 9 – culture #912, 25 passage;
10, 11, 12 – culture #929, 51 passage
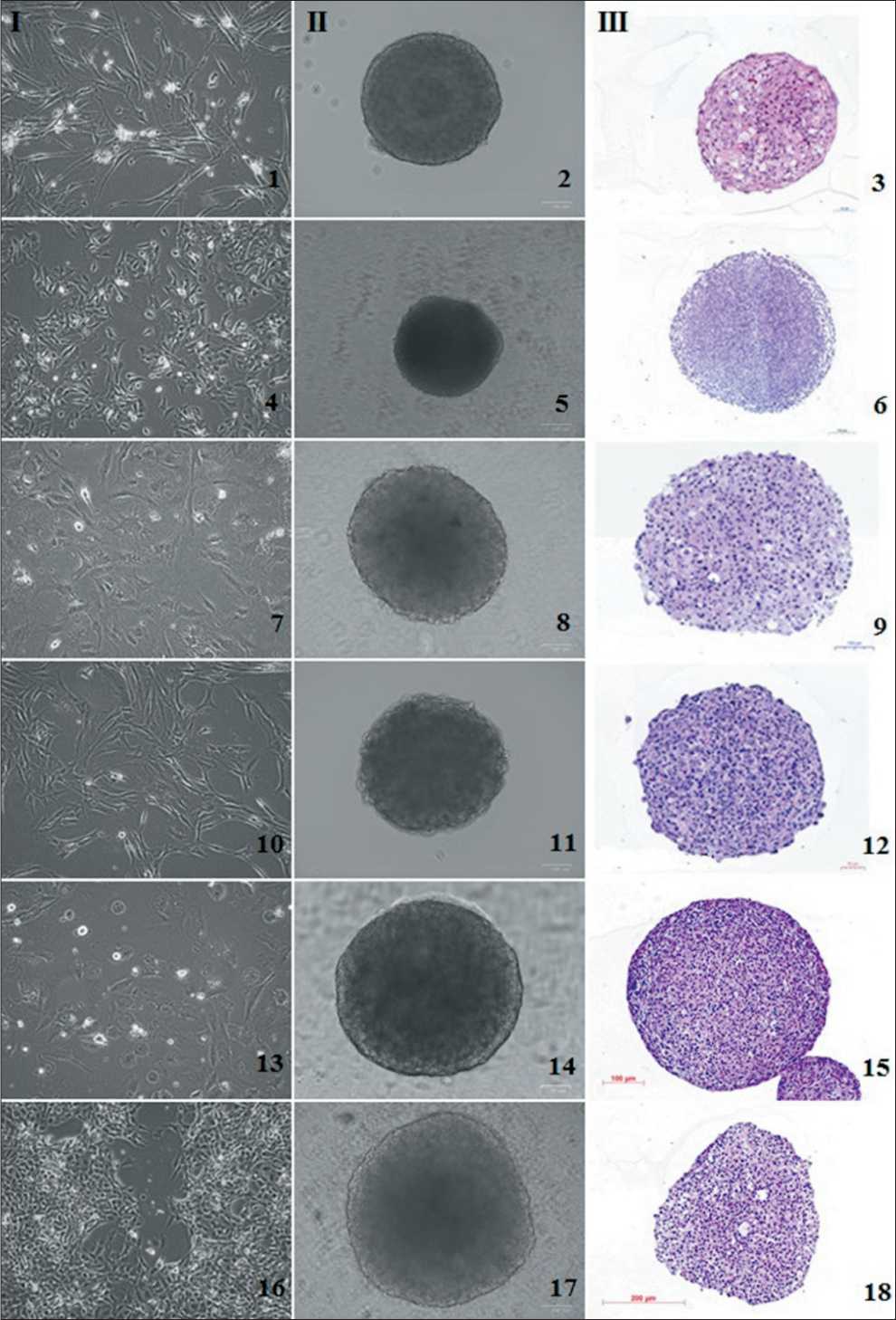
Рис. 2. Создание тумороидов из культивируемых клеток сарком мягких тканей и остеогенных сарком: I – монослойные культуры; II – трехмерные культуры; III – гистологические препараты тумороидов, окраска гемалауном Майера и эозином. I, II – прижизненные изображения, инвертированный микроскоп, фазовый контраст; III – световой микроскоп. 1, 2, 3 – культура лейомиосаркомы #699, 16 пассаж; 4, 5, 6 – культура синовиальной саркомы #716, 25 пассаж; 7, 8, 9 – культура миксофибросаркомы #728, 19 пассаж; 10, 11, 12 – культура рабдомиосаркомы #862, 20 пассаж; 13, 14, 15 – культура остеосаркомы #921, 20 пассаж;
16, 17, 18 – культура альвеолярной саркомы #927, 20 пассаж
Fig. 2. Tumoroids creation from cultured soft tissue and bone sarcoma cells. I – monolayer cultures, II – three-dimensional cultures, III – histological specimens of tumoroids stained with Meyer’s hematoxylin and eosin. I, II – in vivo images, inverted microscope, phase contrast; III – light microscope. 1, 2, 3 – leiomyosarcoma cell culture #699, 16 passage; 4, 5, 6 – synovial sarcoma cell culture #716, 25 passage; 7, 8, 9 – myxofibrosarcoma cell culture #728, 19 passage; 10, 11, 12 – rabdomyosarcoma cell culture #862, 20 passage; 13, 14, 15 – osteosarcoma cell culture #921, 20 passage; 16, 17, 18 – alveolar sarcoma cell culture #927, 20 passage водить дальнейшие манипуляции. Оптимальной для использования низкоадгезивных поверхностей явилась концентрация 10 000 клеток на лунку.
Мы не обнаружили прямой зависимости эффективности формирования тумороидов от гисто-генетического происхождения опухолевых клеток и стадии онкологического процесса, на которой был взят материал для приготовления клеточной культуры (первичная опухоль, рецидив, метастаз). Процесс имел индивидуальный характер и зави- сел от внутренних свойств конкретной культуры малигнизированных клеток. Среди образцов культивируемых клеток МК только в 1 (6,7 %) культуре не наблюдали агрегацию клеток, 5 (33,3 %) культур демонстрировали образование неплотных слабостабильных сфероидов, в некоторых случаях клеточный агрегат имел скорее дискообразную, а не сферическую форму (рис. 1.2, 1.3). Остальные образцы МК (60 %) формировали плотные стабильные сфероиды, часто имеющие хорошо выражен-
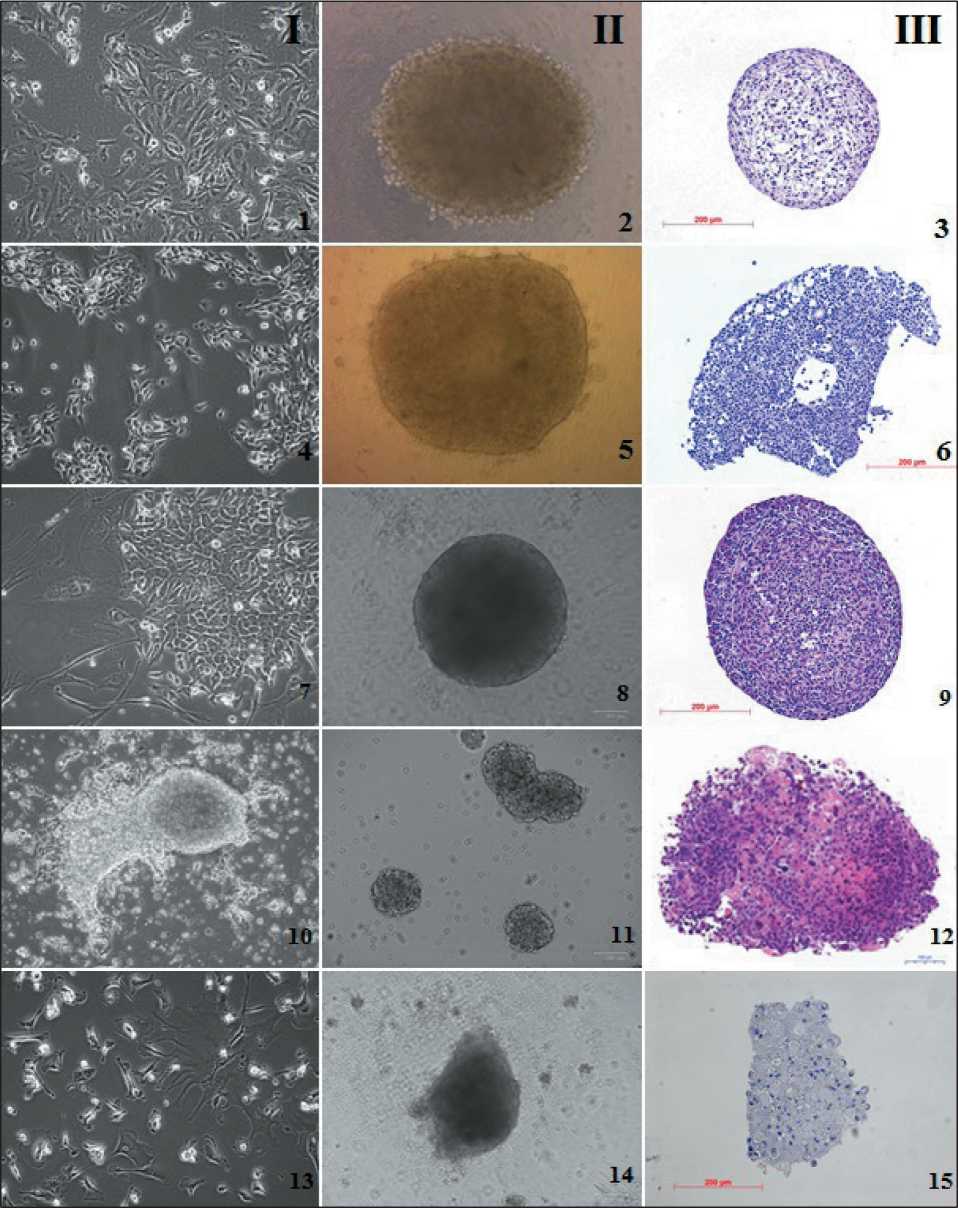
Рис. 3. Создание тумороидов из культивируемых клеток опухолей эпителиального происхождения: I – монослойные культуры; II – трехмерные культуры; III – гистологические препараты тумороидов, окраска гемалауном Майера и эозином. I, II – прижизненные изображения, инвертированный микроскоп, фазовый контраст; III – световой микроскоп. 1, 2, 3 – культура рака почки #291, 40 пассаж; 4, 5, 6 – культура рака мочевого пузыря #875, 32 пассаж; 7, 8, 9 – культура колоректального рака #485, 12 пассаж; 10, 11, 12 – культура рака молочной железы #973, 25 пассаж; 13, 14, 15 – культура рака легкого #1014, 10 пассаж Fig. 3. Tumoroids creation from cutured epithelial tumor cells. I – monolayer cultures, II – three-dimensional cultures, III – histological specimens of tumoroids stained with Meyer’s hematoxylin and eosin. I, II – in vivo images, inverted microscope, phase contrast; III – light microscope. 1, 2, 3 – renal cancer cell culture #291, 40 passage; 4, 5, 6 – bladder cancer cell culture #875, 32 passage;
7, 8, 9 – colorectal cancer cell culture #485, 12 passage; 10, 11, 12 – breast cancer cell culture #973, 25 passage; 13, 14, 15 – lung cancer cell culture #1014, 10 passage
таблица 2/table 2
сравнительная характеристика сфероидов, полученных из клеток солидных опухолей с помощью различных технологий
comparative characteristics of solid tumour cells spheroids derived using different techniques
Технология получения/Production technology
|
№ |
Метод «висячей капли»/Hanging drop method |
Культивирование на низкоадгезивных поверхностях/ Liquid overlay Technique |
|||||||||
|
Агрегация/ Aggregation |
T (сут)/ T (day) |
Кол-во сфероидов в капле (шт.)/ Number of spheroids per drop |
Морфология/ Morphology |
Cs |
D max (мкм) |
Агрегация/ Aggregation |
T (сут)/ T (day) |
Кол-во сфероидов в Морфология/ капле (шт.)/ Number of Morphology spheroids per drop |
Cs |
D max (мкм) |
|
Меланома/Melanoma
Note: • – dense stable spheroid; ○ – loose unstable spheroid; ◌ – single unstable aggregates; Т – spheroid formation time; Cs – starting concentration (number of cells per drop/well on the plate); Dmax – maximum spheroid diameter.
ную краевую зону (табл. 2, рис. 1.5, 1.6, 1.11, 1.12). Клетки СМТ/ОС в основном были отзывчивы на индуцированную агрегацию и быстро формировали плотные стабильные сфероиды (95 %) (рис. 2), за исключением культуры плеоморфной липосаркомы #702, которая росла в капле и на низкоадгезивной поверхности отдельными агрегатами диаметром до 30 мкм, распадающимися при смене среды или переносе сфероида. В группе клеток ЭОп треть культур не формировали тумороиды, среди них – 1 культура рака почки #584 и 2 культуры колоректального рака. Рыхлые нестабильные сфероиды формировали культуры рака почки #291 (рис. 3.2, 3.3) и рака легкого #1014 (рис. 3.14, 3.15). Клетки РМЖ #973 имели полусуспензионный характер роста и были склонны к спонтанной агрегации, то есть существовали в культуре в виде конгломератов, насчитывающих 50–400 клеток (рис. 3.10, 3.11). Для получения тумороидов из клеток этой культуры в заданной стартовой посевной концентрации дезинтегрировали нативные сфероиды, затем полученную клеточную суспензию помещали в каплю или вносили в культуральный планшет. Однако после такого воздействия вновь образованные мелкие агрегаты, которые возникали в течение 24–48 ч, распадались. Объединение нескольких нативных сфероидов в одной капле или лунке планшета приводило к формированию одного большого сфероида (рис. 3.2).
Среди опухолевых сфероидов, полученных из культур МК, #226 и #929 были самыми крупными по диаметру (700–1000 мкм), при этом тумороиды #929 практически не подвергались распаду при длительном культивировании в течение 10–14 дней (рис. 1.11, 1.12). Клетки культуры МК #226 и #929 могли образовывать от 3 до 6 сфероидов в одной лунке, которые затем соединялись и образовывали один крупный сфероид. Иногда наблюдали образование «дочерних» агрегатов из уже сформировавшихся сфероидов.
Среди культур СМТ/ОС самые маленькие сфероиды (до 300 мкм) образовывали клетки рабдомиосаркомы #862, лейомиосаркомы #699, шванномы #976 и остеосарком #938, #1052, культивирование которых занимало от 3 до 6 сут, после чего тумороиды распадались (табл. 2). Диапазон размеров остальных сфероидов колебался от 400 до 700 мкм. Гистологически все стабильные тумо-роиды имели достаточно плотную тканеподобную структуру, в том числе агрегаты дисковидной формы (рис. 1–3).
Изучение пространственной организации сфероидов с помощью конфокальной микроскопии с использованием флюоресцентного окрашивания ядер и актинового цитоскелета позволило уточнить характер взаимодействия опухолевых клеток, их составляющих, и показало, что структурная организация тумороидов различного гистогене-
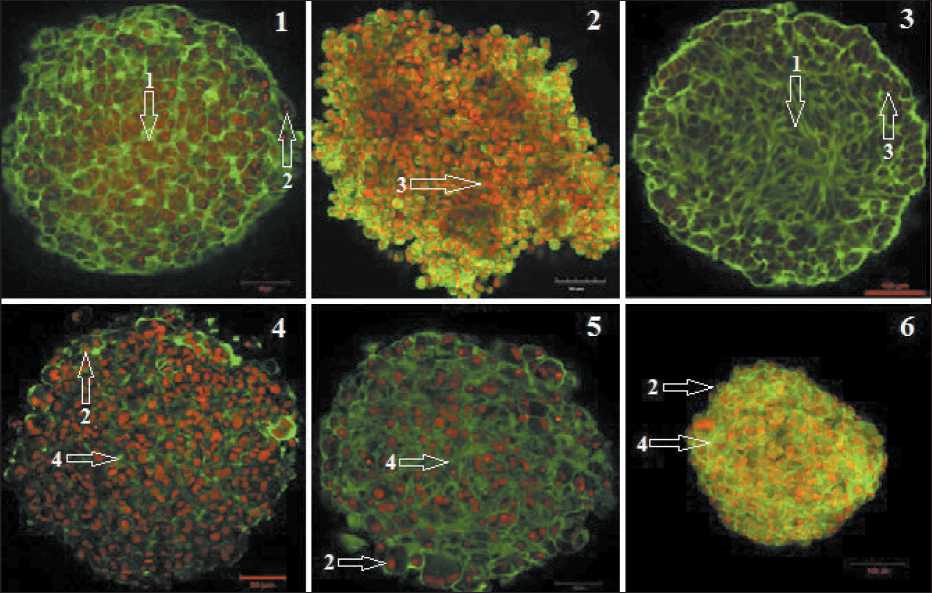
Рис. 4. Анализ структуры тумороидов с помощью конфокальной микроскопии: 1 – сфероид культуры МК #226; 2 – МК #876;
3 – МК #912; 4 – лейомиосаркомы #699; 5 – миксофибросаркомы #728; 6 – рака молочной железы #973. Окрашивание пропи-диумом иодидом (красный, ядра) и Phalloidin-Alexa-488 (зеленый, F-актин). Обозначения: стрелкой 1 показан внутренний слой сфероида; стрелкой 2 –округлые клетки по периферии сфероида; стрелкой 3 – ядра клеток; стрелкой 4 – выросты, содержащие F-актин. Величина масштабной линейки 50 мкм для клеточных культур #699, #728, #226, 100 мкм – для клеточной культуры #876, #912, #973
Fig. 4. Confocal microscopy analysis of tumoroid structure: 1 – spheroid of #226 melanoma cell culture, 2 – #876 melanoma cell culture, 3 – #912 melanoma cell culture, 4 – #699 leiomyosarcoma cell culture, 5 – #728 myxofibrosarcoma cell culture, 6 – #973 breast cancer cell culture. Propidium iodide staining (red, nuclei) and Phalloidin-Alexa-488 staining (green, F-actin). Legend: arrow 1 indicates inner layer of spheroid, arrow 2 shows round cells at periphery of spheroid, arrow 3 shows nuclei of cells, arrow 4 shows outgrowths containing F-actin. The scale bar is 50 µm for cell cultures #699, #728, #226, 100 µm – for cell culture #876, #912, #973
тического происхождения обладала сходными чертами: клетки центральной зоны тумороидов имели типичную мезенхимальную морфологию, характеризующуюся удлиненным клеточным телом и богатую клеточными выростами, содержащими F-актин, которые прослеживались по всей толщине тумороида (рис. 4).
По периферии располагались преимущественно округлые пролиферирующие клетки без отростков. Была обнаружена различная интенсивность экспрессии F-актина в тумороидах, представленных опухолевыми клетками различного происхождения: в сфероидах сарком она была выражена менее всего (рис. 4.4, 4.5). В то же время практически во всех сфероидах наблюдали повышенную экспрессию F-актина в кортикальной зоне, что может указывать на высокую потенцию к инвазии.
Изучение подвижности клеток, составляющих моносфероиды, в трехмерной среде показало, что все типы опухолевых клеток имели способность к инвазии. Наибольшей подвижностью обладали опухолевые клетки эпителиального происхождения и МК (рис. 5.1).
В гетеросфероидах присутствие фибробластов в ряде случаев было ассоциировано со скоростью распространения сфероида в матригеле. В част-
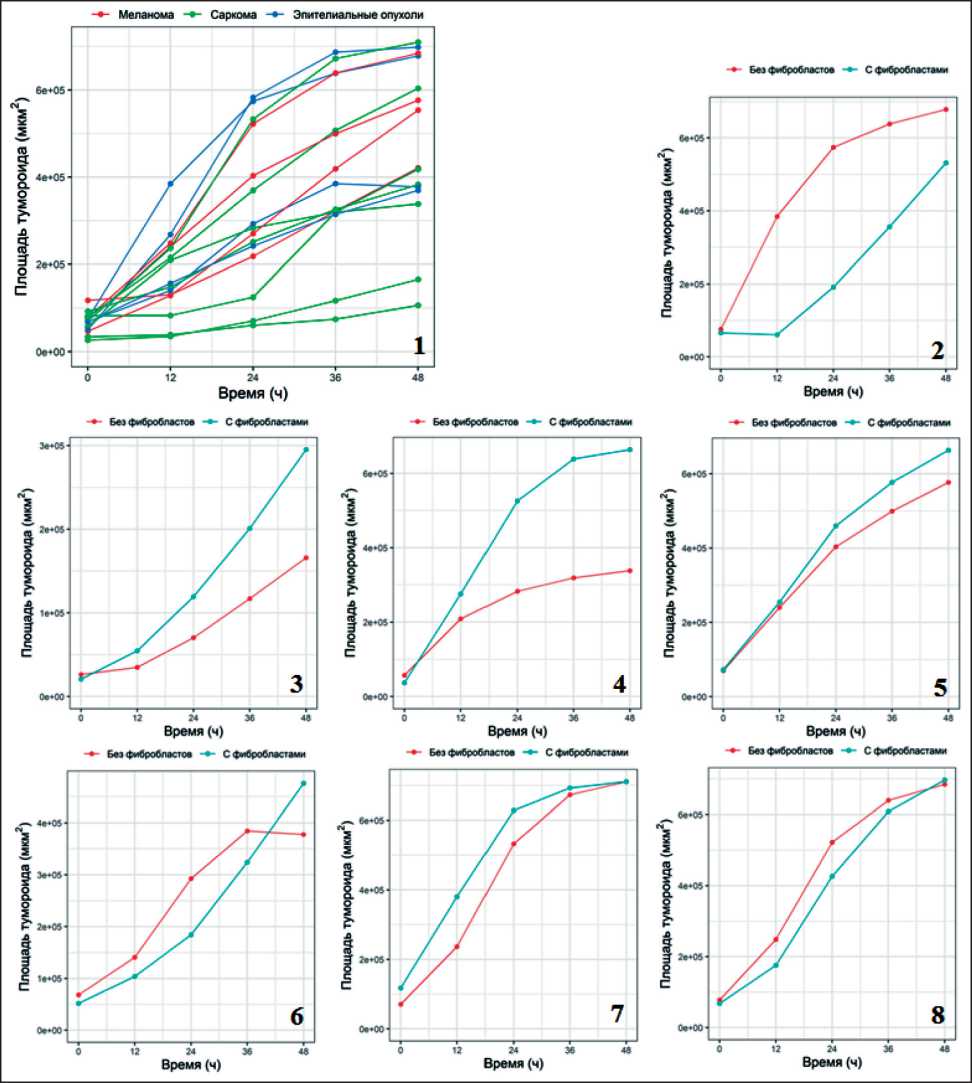
Рис. 5. Графическое изображение индивидуальных различий в динамике распространения в матригеле гомосфероидов, полученных из клеток солидных опухолей различного гистогенеза, и гетеросфероидов, состоящих из опухолевых клеток и фибробластов FLECH: 1 – скорость распространения клеток из сфероидов в матригеле. Красная линия – сфероиды МК, зеленая линия – СМТ/ОС, синяя линия – клеток опухолей эпителиального происхождения; 2 – сопоставление инвазии гомо- и гетеросфероидов культуры колоректального рака #485; 3 – синовиальной саркомы #716; 4 – остеосаркомы #793; 5 – МК #916; 6 – рака легкого #1014; 7 – миксофибросаркомы #982; 8 – МК #519
Fig. 5. Graphical representation of individual differences in the dynamics of spreading in the matrigel of homospheroids derived from solid tumor cells of different histogenesis and heterospheroids consisting of tumor cells and FLECH fibroblasts. 1 – the rate of cell spreading from the spheroids in the matrigel. Red line – melanoma cell spheroids, green line – soft tissue and bone sarcomas, blue line – tumor cells of epithelial origin; 2 - comparison of homo- and heterospheroids invasion of colorectal cancer cell culture #485; 3 – synovial sarcoma cell culture #716; 4 – osteosarcoma cell culture #793; 5 – melanoma cell culture #916; 6 – lung cancer cell culture #1014; 7 – myxofibrosarcoma cell cuture #982; 8 – melanoma cell culture #519
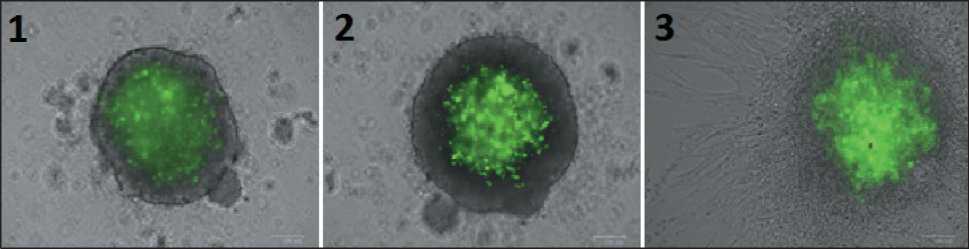
Рис. 6. Формирование гетеросфероида, содержащего клетки остеогенной саркомы #921 и фибробласты FLECH, окрашенные с использованием реагентов Vybrant® CFDA SE Cell Tracer Kit (стартовые концентрации клеток в соотношении 50/50 %): 1 – 1-е сут формирования гетеросфероида на низкоадгезивной поверхности; 2 – 2-е сут формирования гетеросфероида;
3 – распространение гетеросфероида в матригеле (4-е сут). Флуоресцентный инвертированный микроскоп ZOE (Bio-Rad, США). Масштабная линейка 100 мкм
Fig. 6. Formation of heterospheroid containing osteogenic sarcoma cells #921 and FLECH fibroblasts stained using Vybrant® CFDA SE Cell Tracer Kit reagents (starter cell concentrations in a 50/50 % ratio). 1 – 1 day of heterospheroid formation on a low-adhesion surface, 2 – 2 day of heterospheroid formation, 3 – spreading of heterospheroid in matrigel (4 day). ZOE fluorescence inverted microscope (BioRad, USA). Scale bar 100 µm
ности, гетеросфероиды, полученные из клеток колоректального рака #485, были более стабильны, чем гомосфероиды: через 24 ч гомосфероиды #485 увеличивали занимаемую ими площадь в матригеле с 79×103 мкм2 до 580×103 мкм2, тогда как гетеросфероиды увеличивали первоначально занимаемую ими площадь с 79×103 мкм2 до 199×103 мкм2 (рис. 5.2). Такую же тенденцию наблюдали для сфероидов рака почки #291. Введение в клеточную конструкцию фибробластов влияло различным образом на скорость распространения клеток МК в матригеле: для трех культур из пяти скорость практически не менялась (рис. 5.5, 5.8). Усиление инвазивных характеристик гетеросфероидов было продемонстрировано для культур СМТ/ОС: гомосфероиды остеогенной саркомы #793 через 24 ч увеличивали занимаемую ими площадь с 31×103 мкм2 до 289×103 мкм2, а через 48 ч – до 321×103 мкм2 (рис. 5.4). Присутствие фибробластов в гетеросфероиде через 24 ч способствовало увеличению занимаемой площади с 25×103 мкм2 до 521×103 мкм2, а через 48 ч – до 663×103 мкм2. Подобный эффект усиления инвазивных характеристик наблюдали для клеток культуры синовиальной саркомы #716 (рис. 5.3). Через 48 ч от начала культивирования в матригеле наблюдали увеличение площади гомосфероидов с 55×103 мкм2 до 298×103 мкм2, тогда как для гетеросфероидов площадь увеличивалась с 59×103 мкм2 до 160×103 мкм2. В то же время скорость распространения в материгеле гомо- и гетеросфероидов миксофибросаркомы #982 оставалась практически неизменной (рис. 5.7). Визуализация процесса интеграции фибробластов в сфероид продемонстрировала, что фибробласты локализуются в центральной части сфероида, располагаясь диффузно по всей его толще, и в процессе инвазии опухолевых клеток в матригеле остаются в виде «каркаса», стабилизирующего трехмерную структуру (рис. 6).
Скорость распространения гомосфероидов в трехмерной среде коррелировала с продукцией культивируемыми клетками целого спектра биологически активных веществ: наблюдали наличие положительной двухсторонней корреляции высокой силы с присутствием в супернатантах культур опухолевых клеток IL-8 (rho=0,636, p=0,035), HGF (rho=0,850, p=0,004), SCF (rho=0,857, p=0,014), FST (rho=0,685, p=0,029), Prolactin (rho=0,810, p=0,015), PECAM1 (rho=0,788, p=0,004) (табл. 3).
Коэффициент скорости инвазии (KS) опухолевых клеток, представляющий собой соотношение скорости движения опухолевых клеток в гомосфероиде к таковой в гетеросфероиде, выраженное в процентах, также был ассоциирован с присутствием в микроокружении вышеназванных факторов. Мы проанализировали синтетическую активность фибробластов FLECH, которые были использованы для имитации стромы злокачественных новообразований, и обнаружили, что фибробласты продуцируют и экскретируют в микроокружение значительные количества HGF, SCF, IL-8, FST, Prolactin, присутствие которых было ассоциировано со скоростью инвазии (табл. 4).
Обсуждение
В нашем исследовании была поставлена цель апробировать различные подходы к созданию опухолевых сфероидов как модельных систем, оценить их пространственную организацию, подвижность клеток, взаимодействие с элементами стромы опухоли. Для реализации этой цели были получены культуры малигнизированных клеток различного гистогенеза из опухолевого материала пациентов, которые обладали стабильными пролиферативными характеристиками и прошли не менее 10 пассажей. Все полученные культуры опухолевых клеток были использованы для создания сфероидов, однако в ряде случаев стабильные сфероиды получить не удалось. Общая эффективность образования сфероидов составила 88,6 % (39 из 44), которая, на первый взгляд, не зависела от гистогенеза злокачественного новообразования и таблица 3/table 3
корреляционные связи между скоростью инвазии клеток солидных опухолей в трехмерной системе и продукцией факторов, ассоциированных с метастазированием
correlations between the rate of invasion of solid tumour cells in a three-dimensional system and the production of factors associated with metastasis
|
Культура/ Culture |
S gomo х103 мкм2/ч |
KS % |
IL6 |
IL8 |
HGF |
SCF |
MIF |
VEGF пг/мл pg/ml |
FST |
OST |
Leptin |
PECAM1 |
Prolactin |
|
485 |
20,8 |
416,0 |
362,37 |
3727,83 |
575,25 |
68 |
82662,24 |
8256,8 |
8629,23 |
7230,5 |
– |
– |
– |
|
291 |
18,86 |
463,0 |
412,56 |
5328,5 |
238,44 |
72,45 |
– |
1796,98 |
3157,96 |
6311,45 |
68,05 |
128,57 |
80,08 |
|
512 |
6,98 |
54,59 |
2381,5 |
10,452 |
369,43 |
12,92 |
62795,39 |
6548 |
157,56 |
518,82 |
48,36 |
0 |
15,75 |
|
519 |
13,16 |
110,0 |
87,9 |
2934,9 |
147,51 |
13,85 |
5285,021 |
185,74 |
11258,75 |
13818,69 |
66,97 |
104,32 |
40,97 |
|
916 |
13,55 |
110,3 |
274,8 |
3434,9 |
– |
– |
39426,1 |
2887,5 |
28295,73 |
– |
– |
- |
– |
|
226 |
3,76 |
29,54 |
27,734 |
1269,65 |
52,95 |
5,02 |
27654 |
5091 |
0,24 |
15398,56 |
34,17 |
21,33 |
0 |
|
311 |
19,15 |
336,6 |
4,45 |
922,65 |
1357,74 |
64,7 |
– |
418,77 |
3853,18 |
17221,46 |
296,95 |
746,11 |
393,69 |
|
826 |
6,50 |
86,84 |
1,617 |
2177,55 |
118,85 |
1,96 |
14059,45 |
9022,5 |
1403,81 |
21802,48 |
16,64 |
0 |
24,91 |
|
793 |
6,04 |
45,44 |
181,33 |
1162,2 |
– |
– |
43863,75 |
5478,92 |
– |
– |
619,07 |
91,06 |
4,78 |
|
716 |
2,10 |
41,5 |
4,371 |
4,429 |
33,42 |
– |
– |
315,82 |
395,81 |
1076,29 |
62,1 |
60,19 |
19,41 |
|
982 |
12,56 |
90,88 |
379,32 |
2677,5 |
65,38 |
– |
76766,99 |
1653,5 |
219,98 |
1314,89 |
– |
– |
– |
|
rho* |
0,718 |
0,7 |
0,893 |
0,721 |
0,797 |
0,905 |
|||||||
|
p** |
0,013 |
0,036 |
0,003 |
0,019 |
0,003 |
0,002 |
Примечание: Sgomo – скорость распространения гомосфероида в матригеле; KS – коэффициент скорости инвазии; * – критерий Спирмена;
** – точная значимость критерия.
Notes: Sgomo – homospheroid propagation velocity in the matrigel; KS – invasion rate coefficient; * – Spearman’s rank correlation coefficient; ** – p-value.
таблица 4/table 4
Продукция хемокинов и цитокинов фибробластами легкого эмбриона человека Flech chemokine and cytokine production by Flech human embryonic lung fibroblasts
Впервые метод получения сфероидов был описан при изучении эмбрионов амфибий, когда при исследовании самоорганизации эктодермальных, мезодермальных и энтодермальных зародышевых листков относительно друг друга в сферы было обнаружено, что происходит не просто объединение клеток, а их закономерное распределение в пространстве [15]. Сфероид как модель многоклеточной опухоли был впервые разработан R.M. Sutherland et al. в начале 70-х годов, и первые работы по изучению сфероидообразования клетками солидных опухолей показали интересные результаты, указывающие на генетическое детерминирование злокачественных клеток в процессе опухолевой прогрессии [16]. В исследовании J.M. Yugas et al. (1978) из всех изученных клеточных линий РМЖ образовывали сфероиды те опухолевые клетки, которые были выделены из первичных и метастатических солидных очагов, в отличие от клеток из плеврального выпота и асцитической жидкости [17].
В процессе оптимизации протоколов формирования тумороидов с целью быстрого получения большого количества сфероидов за короткий промежуток времени мы сравнили два метода: «висячей капли» и технологию использования низкоадгезивных поверхностей. Предпочтения среди исследователей по применению различных технологий в создании опухолевых сфероидов различны [18]. Сравнительный анализ эффективности образования сфероидов с помощью этих двух методов показал, что использование низкоадгезивных поверхностей сопряжено с более простыми манипуляциями, такими как посев клеток для формирования сфероидов, смена питательной среды в лунках планшета, фиксация или изъятие сфероидов для дальнейших экспериментов. Данный метод позволяет получать большее количество сфероидов в более короткие сроки, при этом клетки в планшете подвергаются наименьшему стрессу по сравнению с методом «висячей капли», так как постоянная смена среды в каплях требует изменения ориентации поверхности, где локализуются капли со сфероидами, в связи с чем капли зачастую принимают неправильную форму, что, в свою очередь, сказывается на процессе формирования туморои-дов. Кроме того, существует риск потери капель, если сила тяжести быстро сформировавшегося и активно набирающего массу сфероида превышает силу натяжения жидкости.
Процесс формирования сфероида состоит как минимум из трех фаз: первоначальная агрегация изолированных клеток, уплотнение сфероида и его рост. Наши наблюдения совпадают с мнением других исследователей [19, 20]. Клетки в сфероидах, как и в опухолях, депонируют компоненты внеклеточного матрикса: коллаген IV, ламинин, фибронектин, протеогликаны, тенасцин и др. [21]. Тесное физическое взаимодействие между опухолевыми клетками и внеклеточным матриксом за счет α5- и β1-интегринов [22] и контакты между опухолевыми клетками за счет E-кадгеринов [23] увеличивают плотность сфероида и создают определенный барьер для проникновения и распределения веществ, поступающих извне [24, 25]. Помимо этого, вклад в образование трехмерных структур также вносят внутриклеточные компоненты, такие как актин и микротрубочки [26, 27]. Наше исследование сфероидов МК, СМТ/ОС и ЭОп с помощью конфокальной микроскопии и на срезах тумороидов продемонстрировало принципиальное сходство структурной организации сфероидов разного гистотипического происхождения, с одной стороны, и индивидуальные различия в строении этих трехмерных образований, с другой стороны. Многие исследователи считают, что кинетика роста тумороидов in vitro сходна с кинетикой роста солидных опухолей. Начальный период роста солидных опухолей называют фазой бессосудистого роста, в этот период объем опухоли увеличивается в геометрической прогрессии, затем наступает состояние покоя, после которого следует фаза образования новых сосудов, вызванная действием ангиогенных факторов, например ангиогенина и сосудистого эндотелиального фактора роста [28, 29]. Под действием матриксных металлопротеиназ (MMP-2, MMP-9) происходит ремоделирование внеклеточного матрикса, и опухолевые клетки приобретают способность к инвазии и метастазированию [30]. В процессе роста тумороидов их объем экспоненциально увеличивается, далее по достижении размера 200–500 мкм в диаметре скорость роста уменьшается и выходит на плато, таким образом, рост сфероидов соответствует начальной фазе роста опухолевого узла [31, 32]. В нашем исследовании самые большие по размеру стабильные сфероиды (700–1000 мкм в диаметре) мы получили из клеток МК, наименьшим диаметром (300–400 мкм) обладали сфероиды из опухолевых клеток ряда сарком, остальные типы клеток формировали ту-мороиды с диаметром около 500–700 мкм.
В сфероиде можно моделировать не только гомотипические, но и гетеротипические взаимодействия. Такие взаимодействия получают путем кокультивирования опухолевых клеток со стромальными фибробластами, эндотелиальными клетками, мезенхимальными стволовыми клетками, с клетками иммунной системы и др. [33–35]. Гетеросфероиды способны воспроизводить тесные и сложные взаимодействия «клетка-клетка» и «клетка-матрикс», которые присутствуют в опухо- лях в естественных условиях [36]. Подобные гетеросистемы возможно использовать для скрининга противоопухолевых препаратов, для оценки их воздействия на опухолевые и нормальные клетки.
Развитие злокачественных клеток запускает патологические процессы в организме, приводящие к формированию опухолевой ткани, которая содержит компоненты нормальных органов [37]. Эти процессы, определяющие сложные гетерогенные взаимоотношения злокачественных клеток с нормальными клетками организма, реализуются в опухолевой строме или опухолевом микроокружении. На сегодняшний день стало очевидно, что развитие злокачественной опухоли и метастазирование опосредованы эффектами опухолевого микроокружения и зависят не только от автономных нарушений клетки [38]. Клетки иммунной системы, ангиогенез, концентрация кислорода, интерстициальное давление, ремоделирование внекеточного матрикса и метаболитов злокачественных клеток, присутствующих в опухолевом микроокружении заслужили особое внимание как важные детерминанты, ассоциированные с прогрессированием заболевания [39]. Основной компонент опухолевой стромы – фибробласты. Исследования последнего времени направлены на изучение роли фибробластов в процессе развития злокачественной опухоли и метастазировании [40]. Поэтому при клеточном моделировании очень важно учитывать и вводить в экспериментальную систему этот стромальный компонент. Мы изучили возможность введения в трехмерную клеточную систему фибробластов легкого эмбриона человека и обнаружили, что в соотношении опухолевые клетки/фибробласты 70/30 % присутствие фибробластов стабилизирует сфероиды, делая их более компактными и плотными. Было также обнаружено, что фибробласты, кокультивированные с опухолевыми культурами в гетеросфероидах, в ряде случаев влияли на подвижность малигнизированных клеток в матригеле, усиливая их инвазивные свойства в случае культур синовиальной саркомы и остеосаркомы и ослабляя инвазивные свойства клеток культуры колоректального рака.
Опухолевые клетки, составляющие гетеросфероиды, которые характеризовались высокими
Список литературы Разработка и характеристика трехмерных клеточных моделей солидных опухолей для индивидуализации лечения онкологических больных
- Colella G., Fazioli F., Gallo M., De Chiara A., Apice G., Ruosi C., Cimmino A., de Nigris F. Sarcoma Spheroids and Organoids-Promising Tools in the Era of Personalized Medicine. Int J Mol Sci. 2018 Feb 21; 19(2): 615. doi: 10.3390/ijms19020615.
- Zanoni M., Cortesi M., Zamagni A., Arienti C., Pignatta S., Tesei A. Modeling neoplastic disease with spheroids and organoids. J Hematol Oncol. 2020 Jul 16; 13(1): 97. doi: 10.1186/s13045-020-00931-0.
- Langhans S.A. Three-Dimensional in Vitro Cell Culture Models in Drug Discovery and Drug Repositioning. Front Pharmacol. 2018 Jan 23; 9: 6. doi: 10.3389/fphar.2018.00006.
- Egeblad M., Nakasone E.S., Werb Z. Tumors as organs: complex tissues that interface with the entire organism. Dev Cell. 2010 Jun 15; 18(6): 884–901. doi: 10.1016/j.devcel.2010.05.012.
- Tabassum D.P., Polyak K. Tumorigenesis: it takes a village. Nat Rev Cancer. 2015 Aug; 15(8): 473–83. doi: 10.1038/nrc3971.
- Bassi G., Grimaudo M.A., Panseri S., Montesi M. Advanced Multi-Dimensional Cellular Models as Emerging Reality to Reproduce In Vitro the Human Body Complexity. Int J Mol Sci. 2021; 22(3): 1195. doi: 10.3390/ijms22031195.
- Sakalem M.E., De Sibio M.T., da Costa F.A.D.S., de Oliveira M. Historical evolution of spheroids and organoids, and possibilities of use in life sciences and medicine. Biotechnol J. 2021 May; 16(5): e2000463. doi: 10.1002/biot.202000463.
- Drost J., Clevers H. Organoids in cancer research. Nat Rev Cancer. 2018 Jul; 18(7): 407–418. doi: 10.1038/s41568-018-0007-6.
- Magin C.M., Alge D.L., Anseth K.S. Bio-inspired 3D microenvironments: a new dimension in tissue engineering. Biomed Mater. 2016 Mar 4; 11(2): 022001. doi: 10.1088/1748-6041/11/2/022001.
- Gilazieva Z., Ponomarev A., Rutland C., Rizvanov A., Solovyeva V. Promising applications of tumor spheroids and organoids for personalized medicine. Cancers. 2020; 12(10): 1–19. doi: 10.3390/cancers12102727.
- Freshney R.I. Culture of animal cells: a manual of basic technique and specialized applications. John Wiley Sons, Inc., Hoboken, New Jersey, USA. 6th ed., 2010. 732 p.
- Danilov A.O., Larin S.S., Danilova A.B., Moiseenko V.M., Baldueva I.A., Kiselev S.L., Turkevich E.A., Barchuk A.S., Anisimov V.V., Gafton G.I., Kochnev V.A., Khanson K.P. An improved procedure for autologous gene-modified cancer vaccine preparation for active specific immunotherapy of disseminated solid tumors. Problem in Oncology. 2004; 50(2): 219–27.
- Geraldo S., Simon A., Vignjevic D.M. Revealing the cytoskeletal organization of invasive cancer cells in 3D. J Vis Exp. 2013; (80): e50763. doi: 10.3791/50763.
- Everitt B.S., Pickles A. Statistical Aspects of the Design and Analysis of Clinical Trials. Imperial College Press. 2004. 340 p.
- Nakatzuji N. Studies on the Gastrulation of Amphibian Embryos: Cell Movement during Gastrulation in Xenopus laevis Embryos. Wilhelm Roux Arch. 1975; 178: 1–14.
- Sutherland R.M., McCredie J.A., Inch W.R. Growth of multicell spheroids in tissue culture as a model of nodular carcinomas. J Natl Cancer Inst. 1971 Jan; 46(1): 113–20.
- Yuhas J.M., Tarleton A.E., Molzen K.B. Multicellular tumor spheroid formation by breast cancer cells isolated from different sites. Cancer Res. 1978 Aug; 38(8): 2486–91.
- Katt M.E., Placone A.L., Wong A.D., Xu Z.S., Searson P.C. In Vitro Tumor Models: Advantages, Disadvantages, Variables, and Selecting the Right Platform. Front Bioeng Biotechnol. 2016 Feb 12; 4: 12. doi: 10.3389/fbioe.2016.00012.
- Weiswald L.B., Bellet D., Dangles-Marie V. Spherical cancer models in tumor biology. Neoplasia. 2015 Jan; 17(1): 1–15. doi: 10.1016/j.neo.2014.12.004.
- Han S.J., Kwon S., Kim K.S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int. 2021 Mar 4; 21(1): 152. doi: 10.1186/s12935-021-01853-8.
- Chan H.F., Zhang Y., Ho Y.P., Chiu Y.L., Jung Y., Leong K.W. Rapid formation of multicellular spheroids in double-emulsion droplets with controllable microenvironment. Sci Rep. 2013 Dec 10; 3: 3462. doi: 10.1038/srep03462.
- Wrenn E., Huang Y., Cheung K. Collective metastasis: coordinating the multicellular voyage. Clin Exp Metastasis. 2021 Aug; 38(4): 373–399. doi: 10.1007/s10585-021-10111-0.
- Smyrek I., Mathew B., Fischer S.C., Lissek S.M., Becker S., Stelzer E.H.K. E-cadherin, actin, microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biol Open. 2019 Jan 24; 8(1): bio037051. doi: 10.1242/bio.037051.
- Tannock I.F., Lee C.M., Tunggal J.K., Cowan D.S., Egorin M.J. Limited penetration of anticancer drugs through tumor tissue: a potential cause of resistance of solid tumors to chemotherapy. Clin Cancer Res. 2002 Mar; 8(3): 878–84.
- Belli C., Trapani D., Viale G., D'Amico P., Duso B.A., DellaVigna P., Orsi F., Curigliano G. Targeting the microenvironment in solid tumors. Cancer Treat Rev. 2018 Apr; 65: 22–32. doi: 10.1016/j.ctrv.2018.02.004.
- Tzanakakis E.S., Hansen L.K., Hu W.S. The role of actin filaments and microtubules in hepatocyte spheroid self-assembly. Cell Motil Cytoskeleton. 2001 Mar; 48(3): 175–89. doi: 10.1002/1097-0169(200103)48:3-175::AID-CM1007-3.0.CO;2-2.
- Yoshii Y., Waki A., Yoshida K., Kakezuka A., Kobayashi M., Namiki H., Kuroda Y., Kiyono Y., Yoshii H., Furukawa T., Asai T., Okazawa H., Gelovani J.G., Fujibayashi Y. The use of nanoimprinted scaffolds as 3D culture models to facilitate spontaneous tumor cell migration and wellregulated spheroid formation. Biomaterials. 2011 Sep; 32(26): 6052–8. doi: 10.1016/j.biomaterials.2011.04.076.
- Raica M., Cimpean A.M., Ribatti D. Angiogenesis in pre-malignant conditions. Eur J Cancer. 2009 Jul; 45(11): 1924–34. doi: 10.1016/j.ejca.2009.04.007.
- Szade A., Grochot-Przeczek A., Florczyk U., Jozkowicz A., Dulak J. Cellular and molecular mechanisms of inflammation-induced angiogenesis. IUBMB Life. 2015 Mar; 67(3): 145–59. doi: 10.1002/iub.1358.
- van Dijk M., Göransson S.A., Strömblad S. Cell to extracellular matrix interactions and their reciprocal nature in cancer. Exp Cell Res. 2013 Jul 1; 319(11): 1663–70. doi: 10.1016/j.yexcr.2013.02.006.
- Byrne H.M. Dissecting cancer through mathematics: from the cell to the animal model. Nat Rev Cancer. 2010 Mar; 10(3): 221–30. doi: 10.1038/nrc2808.
- Costa E.C., Gaspar V.M., Coutinho P., Correia I.J. Optimization of liquid overlay technique to formulate heterogenic 3D co-cultures models. Biotechnol Bioeng. 2014 Aug; 111(8): 1672–85. doi: 10.1002/bit.25210.
- Friedrich J., Seidel C., Ebner R., Kunz-Schughart L.A. Spheroidbased drug screen: considerations and practical approach. Nat Protoc. 2009; 4(3): 309–24. doi: 10.1038/nprot.2008.226.
- Shao H., Moller M., Wang D., Ting A., Boulina M., Liu Z.J. A Novel Stromal Fibroblast-Modulated 3D Tumor Spheroid Model for Studying Tumor-Stroma Interaction and Drug Discovery. J Vis Exp. 2020; (156). doi: 10.3791/60660.
- Weydert Z., Lal-Nag M., Mathews-Greiner L., Thiel C., Cordes H., Küpfer L., Guye P., Kelm J.M., Ferrer M. A 3D Heterotypic Multicellular Tumor Spheroid Assay Platform to Discriminate Drug Effects on Stroma versus Cancer Cells. SLAS Discov. 2020; 25(3): 265–276. doi: 10.1177/2472555219880194.
- Pinto B., Henriques A.C., Silva P.M.A., Bousbaa H. Three-Dimensional Spheroids as In Vitro Preclinical Models for Cancer Research. Pharmaceutics. 2020 Dec 6; 12(12): 1186. doi: 10.3390/pharmaceutics12121186.
- Biffi G., Tuveson D.A. Diversity and Biology of Cancer-Associated Fibroblasts. Physiol Rev. 2021 Jan; 101(1): 147–176. doi: 10.1152/physrev.00048.2019.
- Dzobo K. Taking a Full Snapshot of Cancer Biology: Deciphering the Tumor Microenvironment for Effective Cancer Therapy in the Oncology Clinic. OMICS. 2020 Apr; 24(4): 175–179. doi: 10.1089/omi.2020.0019.
- Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011 Mar 4; 144(5): 646–74. doi: 10.1016/j.cell.2011.02.013.
- Öhlund D., Elyada E., Tuveson D. Fibroblast heterogeneity in the cancer wound. J Exp Med. 2014 Jul; 211(8): 1503–23. doi: 10.1084/jem.20140692.
- Fiori M.E., Di Franco S., Villanova L., Bianca P., Stassi G., De Maria R. Cancer-associated fibroblasts as abettors of tumor progression at the crossroads of EMT and therapy resistance. Mol Cancer. 2019 Mar 30; 18(1): 70. doi: 10.1186/s12943-019-0994-2.
- Denton A.E., Roberts E.W., Fearon D.T. Stromal Cells in the Tumor Microenvironment. Adv Exp Med Biol. 2018; 1060: 99–114. doi: 10.1007/978-3-319-78127-3_6.


