Разработка и изучение in vitro тканеинженерной конструкции на основе политетрафторэтилена и мезенхимальных мультипотентных стромальных клеток (сообщение № 1)
Автор: Розанова Ирина Аркадьевна, Повещенко О.В., Карпенко А.А., Павлова С.В., Сергеевичев Д.С., Лыков А.П., Бондаренко Н.А., Докучаева А.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 4-2 т.19, 2015 года.
Бесплатный доступ
Поиск биоинженерных материалов для создания сосудистых протезов малого диаметра - приоритетная задача. Одним из перспективных направлений разработки тканеинженерных конструкций является создание покрытого аутологичными мезенхимальными мультипотентными стромальными клетками имплантов из политетрафторэтилена. Исследовали in vitro влияние добавления в культуральную среду ростовых факторов и сроков культивирования клеток на экспрессию маркеров эндотелиального и гладкомышечного направлений. Провели тест на способность изучаемых клеток формировать капиллярные структуры в матригеле. Изучали взаимодействие клеточного наполнителя и заплаты, жизнеспособность клеток на заплате и способность вырабатывать компоненты экстрацеллюлярного матрикса. Подтверждена способность мезенхимальных мультипотентных стромальных клеток in vitro к экспрессии эндотелиальных и гладкомышечных маркеров. Выявлено, что клетки на поверхности политетрафторэтилена образуют жизнеспособный монослой, активно нарабатывающий компоненты экстрацеллюлярного матрикса.
Политетрафторэтилен, костномозговые мультипотентные мезенхимальные стромальные клетки, коллаген, фибронектин, адгезия
Короткий адрес: https://sciup.org/142140713
IDR: 142140713
Текст научной статьи Разработка и изучение in vitro тканеинженерной конструкции на основе политетрафторэтилена и мезенхимальных мультипотентных стромальных клеток (сообщение № 1)
Несмотря на значительное число пациентов, нуждающихся в реконструктивных операциях, подходящих кондуитов для замены сосудов малого и среднего диаметра нет. Наилучшим графтом при шунтирующих операциях является аутовена, однако не все пациенты имеют подходящие для реваскуляризации вены. Традиционно используют ксенографты и синтетические протезы из политетрафторэтилена (ПТФЭ) и дакрона. Основная проблема биологических протезов заключается в структурной дегенерации и риске контаминации вирусами [1]. Применение синтетических материалов ограничено высокой тромбогенностью по сравнению с сосудистой стенкой [2]. Исследования показывают, что и биологические, и синтетические кондуиты сенсибилизируют иммунную систему [3].
Попытки повысить биосовместимость и снизить тромбогенность полимерных материалов путем покрытия внутренней поверхности клеточным слоем предпринимаются с 1980-х гг. Установлено, что клеточное покрытие полимерных сосудистых протезов снижает скорость осаждения тромбоцитов на поверхность [4].
Наилучшие результаты проходимости среди синтетических материалов отмечаются у конструкций из политетрафторэтилена [5]. ПТФЭ – инертный материал, не вступающий в химические реакции в условиях организма (водная среда, температура тела), также не описана его цитотоксичность. Из синтетических материа-
лов, используемых в реконструктивной медицине, это наиболее перспективный полимер [6].
Для клеточного заселения исследовательские группы используют различные типы клеток: зрелые эндотелиальные и гладкомышечные клетки; клетки, выделенные из пуповины человека, пунктат костного мозга, полученные из биоптатов жировой ткани; кардиальные экспланты и другие [7].
Аутологичные мультипотентные мезенхимальные стромальные клетки (ММСК) костного мозга (КМ) являются доступным и безопасным материалом. Они подходят для изготовления протезов кровеносных сосудов: данные литературы подтверждают потенциал ММСК к дифференцировке в эндотелиальном и гладкомышечном направлениях in vitro [8, 9].
Мы предложили методику изготовления тканеинженерной конструкции, состоящей из политетрафторэтилена с покрытием внутренней поверхности аутологичными мезенхимальными стромальными клетками.
Научных работ, доказывающих, что покрытие полимерных сосудистых протезов клетками уменьшает их тромбогенность, достаточно, однако сведения о функциональном состоянии клеток in situ , их жизнеспособности и фенотип используемых для заселения клеток недостаточно изучены. Мы оценивали функциональное состояние и жизнеспособность ММСК на ПТФЭ и дифференцировочный потенциал в эндотелиальном и гладкомышечном направлениях.
Цель исследования: разработать технологию изготовления клеточно-заселенного сосудистого протеза на основе политетрафторэтилена и аутологичных мезенхимальных стромальных клеток.
Материал и методы
Протокол изготовления тканеинженерной конструкции на основе политетрафторэтилена и мезенхимальных мультипотентных стромальных клеток включает последовательные этапы (рис. 1).
Первый этап
Выделение мезенхимальных мультипотентных стромальных клеток из костного мозга. Мультипотентные мезенхимальные стромальные клетки из костного мозга лабораторных крыс получали по общепринятой методике [10].
Соответствие полученных мезенхимальных мультипо-тентных стромальных клеток международным критериям. Выделенные клетки тестировали на соответствие общепринятым международным критериям ММСК. В критерии входят адгезия к культуральному пластику, индукция к цитодифференцировке в адипогенном и остеогенном направлениях по стандартной схеме, экспрессия маркеров мезенхимальных клеток, отсутствие маркеров гемопоэтических клеток.
Для исследования экспрессии мезенхимальных и гемопоэтических маркеров проводили фенотипиро-вание полученных ММСК на проточном цитометре FACS CantoII (Becton Dickinson, США) с использованием моноклональных меченых антител anti-CD29-APC (BioLegend), anti-CD34-alexaFluor 555 (BioS), anti-CD45-FITC (BD), anti-CD73 (BD), anti-CD90-FITC (BD), согласно рекомендациям производителей.
Показывали мультипотентность ММСК по индукции к адипогенной и остеогенной дифференцировке по стандартной методике. Для адипогенной дифференцировки ММСК инкубировали в посадочной среде с добавлением 5 х 10–6 М дексаметазона, 10 мг/мл инсулина и 0,5 мМ изобутилметилксантина (Sigma, США). Для остеогенной дифференцировки КМ-ММСК инкубировали с добавлением к посадочной среде 5 х 10–7 М дексаметазона, 10 мМ β -глицерофосфата натрия и 50 мкг/мл аскорбиновой кислоты (Sigma, США). Клетки культивировали 14 дней, замену среды осуществляли каждые 3-4 дня. Использовали красители Oil Red-O для выявления жиров и AgNO3 – для выявления депозитов кальция в костных клетках (Sigma, США).
Оценка способности полученных мезенхимальных мультипотентных стромальных клеток моделировать сосудистую стенку . Для дифференцировки в эндотелиальном направлении использовалась среда с эндотелиальными факторами (ECBM-2 LonzaClonetics). Эндотелиальный потенциал оценивали тестом на образование капилляроподобных структур. Его проводили в слое белков экстраклеточного матирикса Matrigel TM (BD Biosciences) с пониженным содержанием ростовых факторов на 8-м пассаже культуры ММСК. Для дифференцировки в гладкомышечном направлении ММСК культивировали до 16-го пассажа в обычной среде. Результаты оценивали флюорисцентным окрашиванием по стандартной методике.
Препараты клеток фиксировали в 4% пароформаль-дегиде 10 мин, блокировали 2% БСА и далее инкубировали с антителами. Использовали антитела anti-CD31 (ab64543, Abcam), anti-CD90 (MAB1406, Millipor), anti-vWF (A0082, Dako), anti-aSMA (M0851, Dako), anti-VEGF-R2 (ab2349, Abcam), против фибронектина (ab 6328, abcam), против коллагена I типа (ab34710, abcam), Isolectin GS IB4-alexa 594 (Invitrogen). Для выявления связавшихся антител использовали флуорес-
I этап: изучение культуры полученных КМ-ММСК
Выделение ММСК из КМ
Наработка достаточного количества клеток в стандартных условиях до 8-го пассажа

Фенотипирование, изучение функциональных свойств
ММСК in vitro

Полученные ММСК
-
1. Соответветствуют международным критериям
-
2. Способны дифференцироваться в эндотелиальном и гладкомышечном направлениях
-
3. Выделяют фибронектин и коллаген в межклеточную среду
Заселение ММСК заплат из ПТФЭ
II этап: изучение полученных КМ-ММСК in situ ПТФЭ
Инкубация в течение 6 недель
Изучение жизнеспособности, функциональных свойств ММСК,


ММСК на поверхности ПТФЭ
1. Сохраняют жизнеспоспособность
2. Выделяют фибронектин и коллаген в межклеточную среду
3. Монослоя не образуют

III этап: изучение полученных КМ-ММСК in situ ПТФЭ c ЭЦМ
Покрытие ПТФЭ компонентами ЭЦМ для улучшения адгезии ММСК

ПТФЭ
Рис. 1. Схема эксперимента
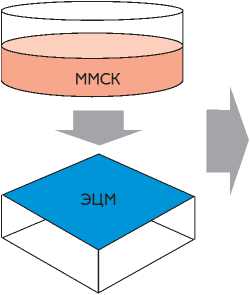
ММСК на предобработанных ЭЦМ заплатах из ПТФЭ образуют монослой
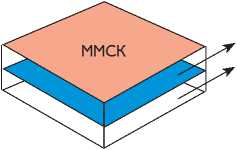
ЭЦМ
ПТФЭ
центно меченные антитела против IgG мыши и кролика (Invitrogen).
Анализ препаратов проводили с помощью флуоресцентного микроскопа Nikon Eclipse Ti-E с использованием программного обеспечения NIS-Elements AR.
Второй этап
Заселение мезенхимальных мультипотентных стромальных клеток на заплаты из политетрафторэтилена. После подтверждения возможности полученных ММСК дифференцироваться в клетки, составляющие нормальную сосудистую стенку, и вырабатывать структурные компонеты для жизнеобеспечения этих клеток, их использовали для модификации заплат из политетрафторэтилена.
Фрагменты материала ПТФЭ, вырезанные из заплат Gore-Tex, заселяли ММСК в дозе 106/см2 (8-й пассаж). Переносили клетки на заплаты пипеткой. Культивирование производили в стандартных условиях 6 недель в чашках Петри.
Оценка функционального состояния мезенхимальных мультипотентных стромальных клеток in situ политетрафторэтилена . Оценивали количество живых ММСК и их функциональное состояние in situ ПТФЭ в течение 1–6 недель на лазерном сканирующем микроскопе LSM 780 NLO (Zeiss, програмное обеспечение ZEN) в Центре коллективного пользования микроскопического анализа биологических объектов ИЦиГ СО РАН.
Для изучения влияния ПТФЭ на жизнеспособность ММСК использовали красители, проникающие только в живые клетки: митохондриальный TMRA TMRM (Sigma) и ядерный Nuc Blue (Molecular Probes TM). Функциональное состояние ММСК анализировали наличием продукции фибронектина и коллагена I типа. Последние выявляли после фиксации препаратов по методике, использующейся для изучения клеток на культуральном пластике.
Третий этап
Изучение влияния предобработки заплат из политетрафторэтилена компонентами экстрацеллюлярного матрикса на адгезию мезенхимальных мультипотентных стромальных клеток . Для оценки влияния компонентов ЭЦМ на адгезию ММСК к политетрафторэтилену обрабатывали лоскуты в течение часа в растворах фибронектина (2 мкг/мл; Sigma, США), коллагенов I или IV типа (20 мкг/мл; Sigma, США) в различных сочетаниях. После чего культивировали ММСК на подложках из ПТФЭ в течение 6 недель и определяли число и площадь клеток. Сравнение проводили с необработанными ЭЦМ заселенными ММСК заплатами политетрафторэтилена.
Степень заселенности фрагментов материала ПТФЭ ММСК оценивалась после фиксации в 10% растворе формалина и последующим окрашиванием гематокси-лин-эозином на световом микроскопе Carl Zeiss (Германия). Для проведения морфометрии использовали программное обеспечение AxioVision 4.8.2 (CarlZeiss, Германия). Подробнее эта часть исследования описана в предыдущей статье [11].
Результаты
Соответствие фенотипа выделенных из костного мозга клеток мезенхимальным мультипотентным стромальным клеткам по международным критерия м. Полученные клетки из КМ соответствовали международным общепринятым критериям, определяющим принадлежность к ММСК. Гетерогенные на ранних сроках культивирования клетки из КМ становились гомогенными, приобретали веретенообразную форму, характерную для клеток мезенхимальной принадлежности, обладали способностью к формированию колониеобразующих единиц, а также цитодифференцировке в адипогенном и остеогенном направлениях после индукции по стандартной методике.
Выделенные клетки экспрессировали поверхностные маркеры мезенхимального ряда CD73, CD90, СD29 и не экспрессировали поверхностные маркеры гемопоэтического ряда CD45, CD34, что подтверждает принадлежность полученных нами клеток к ММСК.
Таким образом, полученные из КМ клетки с высокой долей вероятности являются ММСК и могут использоваться в последующих экспериментах.
Оценка пригодности мезенхимальных мультипотент-ных стромальных клеток для моделирования внутреннего слоя артериальной стенки . Как известно, внутренний слой сосудистой стенки состоит из эндотелиальных и гладкомышечных клеток и внеклеточного вещества, несущего структурную функцию и обеспечивающего обменные процессы клеток. Их взаимосвязь обеспечивает динамическое равновесие свертывающей системы крови. Повреждение в одном из звеньев ведет к системному нарушению гемостаза: нарушения в обмене миоцитов – синдрому Марфана и различным мышечным дисплазиям, повреждение эндотелия – тромбозам либо тромбофилии, диспропорция выработки ЭЦМ – анти-фосфолипидному синдрому. По этой причине изучили цитодифференцирующий потенциал ММСК в эндоте-лиоциты и гладкомышечные клетки и уровень продукции ими компонентов экстрацеллюлярного матрикса.
Эндотелиальную дифференцировку моделировали при инкубировании полученных ММСК в среде с добавлением эндотелиальных ростовых факторов ECBM-2 с 3-го по 8-й пассаж. После чего в культуре ММСК появляется значительное количество клеток, окрашивающихся эндотелиальными маркерами vWF (рис. 2, а ), CD31 (рис. 2, б ), VEGFR-2 и связывающих изолектин. После инкубации в эндотелиальной среде у ММСК появлялась способность образовывать капилляроподоб-
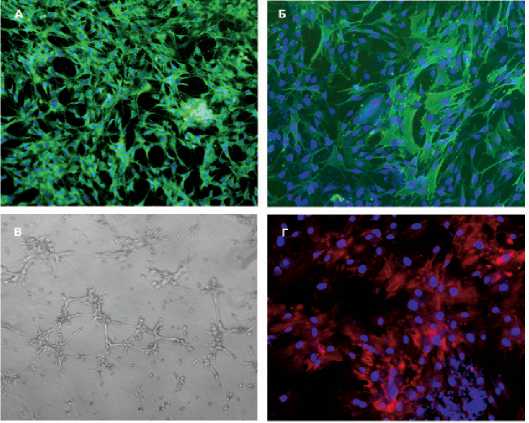
Рис. 2. ММСК (8-й пассаж), культивированные в среде ECBM-2, окрашенные на эндотелиальные маркеры: зеленое свечение – фактор фон Виллебранда, синее свечение – ядра клеток, окрашенные DAPI ( а ); зеленое свечение – CD31, синее свечение – ядра клеток, окрашенные DAPI ( б ); капилляроподобные структуры на матригеле, образованные ММСК ( в ); ММСК (16-й пассаж), культивированные в стандартной среде, красное свечение – aSMA белок, маркер гладкомышечных клеток, синее свечение – ядра клеток, окрашенные DAPI ( г )
ные структуры в матригеле, что характерно для эндотелиальных клеток (рис. 2, г ).
Для индукции ММСК в гладкомышечном направлении выполняли длительное культивирование до 16го пассажа в стандартной среде. Появились островки клеток, положительно окрашивающихся на гладкомышечный маркер aSMA, с характерной исчерченностью (рис. 2, в ). Иммуногистохимия полученных культур ММСК выявила достаточное количество фибронектина и коллагена I типа.
Таким образом, использование ММСК для создания клеточнозаселенного синтетического сосудистого протеза обоснованно. ММСК способны дифференцироваться в эндотелиальном и гладкомышечном направлениях и вырабатывать экстрацеллюлярный матрикс.
Изучение жизнеспособности и функциональных возможностей мезенхимальных мультипотентных стромальных клеток, культивированных на заплате из политетрафторэтилена. При тестировании жизнеспособности и функциональных возможностей ММСК, выращенных на ПТФЭ, выявлено, что большинство клеток до 6 недель культивирования остаются живыми (рис. 3, а). Клетки в достаточном количестве вырабатывают компоненты экстраклеточного матрикса, а именно коллаген I типа и фибронектин (рис. 3, в, г) и гликопротеин, участвующий в регуляции гемостаза фактора фон Виллебранда (рис. 3, б).
Таким образом, не выявили ингибирующее влияние политетрафторэтилена на витальные функции мезенхимальных мультипотентных стромальных клеток. На заплатах клетки остаются живыми в течение инкубирования и вырабатывают экстрацеллюлярный матрикс в достаточном количестве.
Повышение эффективности адгезии мезенхимальных мультипотентных стромальных клеток на политетрафторэтилен путем обработки заплат компонентами экстрацеллюлярного матрикса . При культивировании ММСК in situ ПТФЭ, несмотря на сохранение первоначальной функциональной активности клеток, образования равномерного монослоя, покрывающего большую часть подложки, не происходило даже на 8-й неделе.
Ряд авторов определили влияние ЭЦМ на обменные процессы в клетках и формирование структуры сосудистой стенки [10]. В предыдущем исследовании мы показали положительное влияние компонентов ЭЦМ на адгезию и пролиферацию КМ-ММСК на поверхность ПТФЭ [11]. Поэтому для повышения адгезии
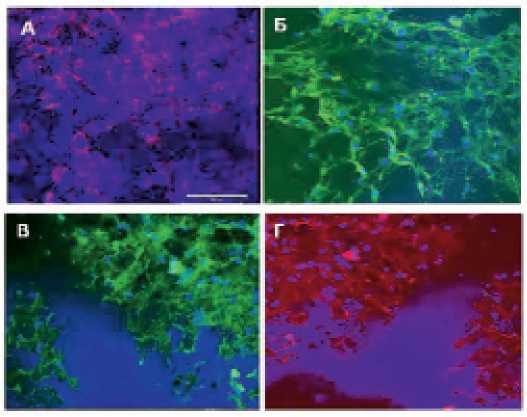
Рис. 3. ММСК in situ ПТФЭ, 6-я неделя инкубации, х 100: красное свечение активных митохондрий красителем TMRA, синее свечение – клеточные ядра, окрашенные Nuc Blue ( а ); зеленое свечение – окрашивание гликопротеина фактора фон Виллебранда, синее свечение – ядра клеток, окрашенные DAPI ( б ); зеленое свечение – окрашивание коллагена, синее свечение – ядра клеток, окрашенные DAPI ( в ); красное свечение – окрашивание фибронектина, синее свечение – ядра клеток, окрашенные DAPI ( г )
ММСК к ПТФЭ заплату дополнительно обрабатывали компонентами ЭЦМ.
Таким образом, получена тканеинженерная конструкция, в составе которой на заплате из ПТФЭ имеется монослой живых и функционально активных клеток, потенциально способных к цитодифференцировке в эндотелиальном и гладкомышечном направлениях и продукции экстрацеллюлярного матрикса.
Обсуждение
На сегодняшний день в мире активно разрабатывают сосудистые протезы, повторяющие архитектонику артериальной стенки [1, 12]. Однако такие конструкции в клиническую практику пока не внедрены. Для этого требуется не только создать конструкцию, по свойствам сопоставимую с настоящими сосудами, но и доказать эффективность и экономическую рентабельность подобных технологий. Мы использовали уже широко изученные и применяемые в клинической практике доступные компоненты, не требующие внедрения и сертификации.
Выбор ПТФЭ как основы очевиден, потому что других полимерных материалов, применяемых для протезирования сосудов малого диаметра, нет.
В литературе представлены работы, в которых в качестве матрицы используют компоненты ЭЦМ, например коллаген или его производное – желатин [13]. Однако механической прочности, достаточной для противостояния артериальному давлению, пока не достигли.
Ранее мы показали, что предобработка ПТФЭ компонентами ЭЦМ приводит к увеличению площади покрытия ММСК и количества клеток по сравнению с необработанными (контроль). Состав компонентов ЭЦМ, используемый для обработки подложки ПТФЭ, принципиально значим: в частности, при культивировании ММСК на подложках, обработанных фибронекти-ном/коллагенами I и IV типа, площадь клеточного слоя достоверно выше, чем в необработанных образцах (p<0,05) [11].
Типы клеток, используемые для создания тканеинженерной конструкции, разнообразны. Цель заключается в том, чтобы повторить строение настоящей сосудистой стенки. Возможны два варианта воссоздания архитектоники артериальной стенки: использование уже зрелых эндотелиальных и гладкомышечных клеток либо стволовых, способных к дифференцировке в эндотелиальном и муральном направлениях. Работа с культурами стволовых клеток, в том числе с ММСК, на практике требует меньше затрат в отличие от зрелых клеток.
Направление дифференцировки стволовых клеток зависит от действия ростовых факторов и микроокружения [10]. В крови циркулируют факторы, обращающие дифференцировку депо стволовых клеток в эндотелиальном и гладкомышечном направлениях, например при повреждении сосуда. Мы предполагаем, что эти факторы таким же образом будут влиять на трансплантированные с заплатой из ПТФЭ клетки.
Использование аутологичного клеточного материала не требует проверки на микроорганизмы и вирусы и не вызывает иммунного ответа. В качестве источника чаще всего используют костный мозг, жировую ткань, отрезок подкожной вены, участок кожи. Мы получали клетки из костного мозга, что позволяет выделить достаточное количество материала малоинвазивной процедурой.
Таким образом, предложен протокол для изготовления тканеинженерного протеза кровеносного сосуда на основе политетрафторэтилена, покрытого компонентами экстрацеллюлярного матрикса и заселенного мезенхимальными мультипотентными стромальными клетками. Проведено подробное изучение взаимодействия компонетов конструкции in vitro .
Мы не выявили ингибирующего влияния политетрафторэтилена на ММСК. В то же время показана способность используемой для заселения культуры к цитодифференцировке в эндотелиальном и гладкомышечном направлениях. Отмечена высокая жизнеспособность клеток на заплате и способность к выработке компонентов ЭЦМ. Полученные результаты согласуются с данными литературы: мезенхимальные мультипотентные стромальные клетки являются полипотентными и обладают рядом важных для клинического применения свойств [10, 12]. При изучении свойств ММСК исследователи обнаружили способность к дифференцировке in vitro в различных направлениях [14]. В работах показана зависимость иммунофенотипа ММСК от источников получения и в условиях культивирования [15]. Мы также выявили зависимость иммунофенотипа ММСК от продолжительности и условий культивирования. Полученные результаты свидетельствуют о перспективности использования данной тканеинженерной конструкции. Следующим этапом планируется изучение проходимости тканеинженерной конструкции in vivo .
Выводы
-
• Полученные мезенхимальные мультипотентные стромальные клетки можно использовать для моделирования сосудистой стенки. Они продуцируют экстрацеллюлярный матрикс и способны дифференцироваться в эндотелиальном и гладкомышечном направлениях.
-
• Разработан протокол модификации внутренней поверхности синтетических сосудистых протезов из политетрафторэтилена аутологичными мультипотен-тными мезенхимальными стромальными клетками и компонентами экстрацеллюлярного матрикса, а именно фибронектином и коллагенами I и IV типов.
-
• Политетрафторэтилен не оказывает ингибирующего действия на мезенхимальные мультипотентные стромальные клетки in situ . Мезенхимальные мультипо-тентные стромальные клетки на поверхности политетрафторэтилена образуют жизнеспособный монослой, активно нарабатывающий внеклеточный матрикс.
Авторы благодарят за помощь в проведении исследования Центр коллективного пользования микроскопического анализа биологических объектов Института цитологии и генетики СО РАН, Байбородина С.И.
Список литературы Разработка и изучение in vitro тканеинженерной конструкции на основе политетрафторэтилена и мезенхимальных мультипотентных стромальных клеток (сообщение № 1)
- Manji R.A., Zhu L.F., Nijjar N.K., Rayner D.C., Korbutt G.S., Churchill T.A., Rajotte R.V., Koshal A., Ross D.B. Glutaraldehyde-Fixed Bioprosthetic Heart Valve Conduits Calcify and Fail From Xenograft Rejection//Circulation. 2006. Vol. 114. P. 318-327.
- Караськов А.М. Дисфункция искусственных клапанов сердца. Новосибирск: Гео, 2008. 251 с.
- Адамян Л.В., Шифман Е.М., Тюлькина Е.Е. и др. Проблемы репродукции. 2014. № 2. С. 21-32.
- Zilla P., Deutsch M., Meinhart J., Puschmann R., Eberl T., Minar E., Dudczak R., Lugmaier H., Schmidt P., Noszian I. Clinical in vitro endothelialization of femoropopliteal bypass grafts: an actuarial follow-up over three years//J. Vasc. Surg. 1994. Vol. 19. P. 540-8.
- Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop Dj., Horwitz E. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement//Cytotherapy. 2006. Vol. 8 № 4. P. 315-7.
- Hodonsky C., Mundada L., Wang S., Witt R., Raff G., Kaushal S., Si M.S.//Ann. Thorac. Surg. 2015. Vol. 99 № 2. P. 605-11.
- Kumara V.A., Cavesa J.M., Hallera C.A., Daia E., Liua L., Graingera S., Chaikof E.L. Acellular vascular grafts generated from collagen and elastin analogs//Acta Biomater. 2013. Vol. 9. № 9. P. 8067-8074.
- Vu Q., Xie K., Eckert M., Zhao W., Cramer S.C. Meta-analysis of preclinical studies of mesenchymal stromal cells for ischemic stroke//Neurology. 2014. Vol. 82. № 14. P. 1277-1286.
- Zappia E., Casazza S., Pedemonte E., Benvenuto F., Bonanni I., Gerdoni E., Giunti D., Ceravolo A., Cazzanti F., Frassoni F., Mancardi G., Uccelli A. Mesenchymal stem cells ameliorate experimental autoimmune encephalomyelitis inducing T-cell anergy//Blood. 2005. Vol. 1065. P. 1755-61.
- Повещенко О.В., Колесников А.П., Ким И.И., Ульянов Е.В., Мозжерина А.Н., Янкайте Е.В., Соловьева Т.В., Гертер А.О., Зонова Е.В., Повещенко А.Ф., Коненков В.И. Способы выделения и условия культивирования мезенхимальных стромальных клеток жировой ткани человека, полученной из различных источников//Бюллетень Сибирского отделения Российской академии медицинских наук. 2008. № 5. С. 90-95.
- Карпенко А.А., Розанова И.А., Повещенко О.В., Лыков А.П., Бондаренко Н.А., Ким И.И., Никонорова Ю.В., Подхватилина Н.А., Сергеевичев Д.С., Попова И.В., Коненков В.И. Влияние компонентов экстрацеллюлярного матрикса на адгезию костномозговых мультипотентных мезенхимальных стромальных клеток к политетрафторэтилену//Ангиология и сосудистая хирургия. 2015. Т. 21. № 4. С. 178-184.
- Богдан В.Г., Зафранская М.М., Гаин Ю.М., Демидчик Ю.Е. Мультипотентные мезенхимные стромальные клетки жировой ткани и фибробласты -выбор клеточной составляющей для биологических трансплантатов//Клеточная трансплантология и тканевая инженерия. 2012. Т. 7. № 4. С. 48-54.
- Wang H., Kwok D.T.K., Xu M., Shi H., Wu Z., Zhang W., Chu P.K. Tailoring of Mesenchymal Stem Cells Behavior on Plasma-Modified Polytetrafluoroethylene//Advanced Materials. 2012. Vol. 24. № 25. P. 3315-3324.
- Шахпазян Н.К., Астрелина Т.А., Яковлева М.В. Мезенхимальные стволовые клетки из различных тканей человека: биологические свойства, оценка качества и безопасности для клинического применения//Клеточная трансплантология и тканевая инженерия. 2012. № 1. Т. 7. С. 23-33.
- Basu J., Genheimer C.W., Guthrie K.I., Sangha N., Quinlan S.F., Bruce A.T., Reavis B., Halberstadt C., Ilagan R.M., Ludlow J.W. Expansion of the human adipose-derived stromal vascular cell fraction yields a population of smooth muscle-like cells with markedly distinct phenotypic and functional properties relative to mesenchymal stem cells//Tissue Eng. Part C. Methods. 2011. Vol. 17. № 8. P. 843-60.


